Работа выполнена в отделе вирусологии им. А. А
| Вид материала | Автореферат |
- -, 260.28kb.
- -, 428.63kb.
- -, 219.49kb.
- Автореферат диссертации на соискание ученой степени, 348.21kb.
- Архитектура стран Закавказья VII в.: формирование и развитие традиции, 671.39kb.
- Восточнославянский мифологический текст: семантика, диалектология, прагматика, 970.28kb.
- Биологические основы создания пробиотиков направленного действия для медицины, сельского, 625.36kb.
- О. А. Панфиленко Общая характеристика работы, 470.75kb.
- Восточноманычская катакомбная культура (анализ погребальных памятников) Исторические, 398.66kb.
- Момент окончания преступления, 253.06kb.
*А>G
Замена триптофана на аргинин в 723 положении белка PB1 Москва/21/17 встречается у большинства проанализированных эпидемических вирусов и, таким образом, не может привносить изменений в сторону холодовой адаптации. Отсутствие отличий в РА белке Москва/21/17 от пассажного варианта подтверждает данные о роли отдельных генов, полученные на модели одногенных реассортантов на основе ХА донора аттенуации А/Ленинград/134/57(H2N2) (Киселева, 2001), когда было показано, что наследование только РА гена от ХА варианта не приводило к аттенуации, если остальные гены происходили от исходного штамма «дикого типа».
Нуклеотидная замена в гене NP является незначащей и прослеживается на электрофореграмме в виде двойного пика с преобладанием А над G у ХА варианта и G над А у его предшественника. Эта мутация не является уникальной, так как встречается также у эпидемического штамма А/Энн Арбор/67. Уникальная мутация в М-гене штамма Москва/21/17 (T-182-A), приводящая к замене в мембранном белке М1, сопровождается изменениями свойств гидрофобности. Ранее при изучении роли отдельных генов в аттенуации штамма А/Ленинград/134/57(H2N2) было показано, что присутствие в геноме вирулентного штамма М-гена от ХА варианта не приводило к проявлению ts- и ca- фенотипа (Киселева, 2001).
Мутация в гене NS приводит к аминокислотной замене в белке NS1 (I-65-V), которая расположена в N-концевом участке α-спирали, состоящем из 73 аминокислот, который является эффекторным доменом взаимодействия с РНК (Qian et al., 1994), а также играет ключевую роль в модулировании таких факторов врожденного иммунитета, как интерферон α/β (Wang et al., 2000). Эта мутация является уникальной, однако, как будет продемонстрировано ниже, оказалось, что замещение NS-гена Москва/21/17 на NS-ген эпидемического вируса не приводило к изменению ts- и ca- фенотипа. Ранее в исследованиях in vitro было показано, что уровни индукции ранних цитокинов ХА реассортантными штаммами A(H1N1) и A(H3N2) на основе донора аттенуации А/Ленинград/134/17/57(H2N2) в основном совпадали с аналогичными показателями для эпидемических вирусов соответствующего серотипа. Индукция интерферона I типа ХА реассортантами оказалась сниженной по сравнению с эпидемическими родителями. Изучение одногенных реассортантов, включающих мутантные гены донора аттенуации А/Ленинград/134/17/57(H2N2), показало, что включение генов РВ2 или РВ1 в состав реассортантов значительно снижало продукцию ранних цитокинов, включая и интерферон I типа, при инфицировании эпителиальных макрофагов человека. В то же время, в отношении реассортантов, включающих мутантный М или NS гены, такого снижения не наблюдалось (Rekstin et al., 2006).
Локализация мутации в гене НА, приводящей к аминокислотной замене в одном из петлеобразных участков глобулярной части тяжелой цепи НА1, свидетельствует, что она могла появиться в процессе адаптации при длительном пассировании в РКЭ (Каверин с соавт., 2000). В гене нейраминидазы различий не выявлено.
Был проведен сравнительный анализ известных последовательностей генов внутренних и неструктурных белков таких доноров аттенуации подтипа H2N2, как А/Ленинград/134/17/57 (Klimov, Cox, 1988), А/Энн Арбор/6/60 (Maassab, 1969) и ХА штамма, полученного пассированием на культуре клеток Vero: А/Сингапур/1/57са (Romanova et al., 2004). Результаты представлены в таблице 2. Общим признаком для всех ХА штаммов является полигенный характер изменений, приводящих к проявлению са- и att- фенотипа при традиционном способе получения ХА штаммов, то есть методом последовательного пассирования при пониженной температуре, даже если это пассирование осуществляется в различных системах (куриные эмбрионы, первичные или перевиваемые культуры). Cопоставление данных о мутациях в различных генах и генных продуктах внутренних и неструктурных белков различных ХА штаммов подтипа A(H2N2) указывает на отсутствие каких-либо универсальных позиций в их геномах, мутации в которых должны приводить к аттенуации. Исключение составляет замена аланина в позиции 86 белка М2 на серин у штамма А/Энн Арбор/6/60 или треонин у штамма А/Ленинград/134/17/57, однако по данным Jin et al. (2003) эта мутация не связана с температурочувствительностью. Еще одним исключением является незначащая нуклеотидная замена в 813 положении гена NS вирусов А/Энн Арбор/6/60 (А→G) и ХА А/Сингапур/1/57са.
Таблица 2
Мутации в генах негликозилированных белков ХА штаммов А(H2N2)
| Ген | Энн Арбор/6/60 | Ленинград/17 | Москва/21/17/65 | Сингапур/1/57 -xa | ||||
| нуклеотид | амино-кислота | нуклеотид | амино-кислота | нуклеотид | амино-кислота | нуклеотид | амино-кислота | |
| PB2 | A-141-G A-821-G T-1933-c | - A-265-S - | G-1459-T | V-478-L | G-633-A G-1267-A G-1273-A A-1740-G | M-202-I V-414-I G-416-S - | A-252-G A-498-G T-581-C G-1046-T | - - I-185-T R-340-I |
| PB1 | A-123-G A-1195-G G-1395-T A-1766-G G-2005-A C-2019-T | - K391-E E-457-D E-581-G A-661-T - | G-360-A G-819-T A-1795-G | - K-265-N V-591-I | T-2191-C | W-723-R | T-1279-A A-1965-C | L-419-I - |
| PA | T-20-C T-2167-C T-2168-C | L-715-P L-715-P | T-222-C T-107-C G-1045-T | - L-28-P V-341-L | - | - | A-707-T T-1425-A A-1537-G G-1819-C | N-228-I - I-505-V E-599-Q |
| NP | A-146-G | G-34-D | - | - | 396 G/A | - | G-210-A | - |
| M1 | - | - | G-68-A | V-15-I | A-567-G | T-182-A | C-55-T T-97-C G-32A-7 G-499-C | - - R-101-K Q-158-H |
| M2 | G-969-T | A-86-S | G-969-A | A-86-T | - | - | - | - |
| NS1 | G-483-A | A-153-W | | | G-193-A | V-65-I | | - |
| NS2 | A-813-G | | G-798-A | M-100-I | | | A-813-G | - |
Данные сравнительного анализа подтвердили, что наибольшим изменениям подвергаются гены полимеразного комплекса холодоадаптированных штаммов. Большинство нуклеотидных замен в этом случае сопровождается аминокислотными замещениями в соответствующих полимеразных субъединицах. Во всех случаях наиболее консервативным является белок NP. Аминокислотные замещения в NP-белке ХА вариантов по сравнению с «дикими» штаммами или отсутствуют (А/Ленинград/134/17/57, А/Сингапур/1/57ха), или существенно не влияют на структурную организацию белка. Во всех случаях множественный характер изменений в геноме ХА штаммов указывает на последовательную сопряженную эволюцию различных белковых субъединиц в процессе серийных пассажей при пониженной температуре. Эти сочетанные изменения в различных генах доноров аттенуации могут обеспечивать генетическую стабильность реассортантов на основе подобных штаммов.
Далее была поставлена задача оценить генетическую стабильность штамма А/Москва/21/17 и потенциальную возможность его применения как нового донора аттенуации. С этой целью были получены полигенные реассортанты с современным эпидемическим вирусом А/Новая Каледония/20/99(H1N1). Один из реассортантов унаследовал от эпидемического вируса гены HA и NA (структура генома 6:2), а другой помимо этого еще NS-ген (структура генома 5:3) (табл. 3). Секвенирование показало сохранность всех мутаций в генах внутренних и неструктурных белков, приобретенных реассортантами от ХА родителя А/Москва/21/17.
Таблица 3
Структура реассортантов на основе штамма А/Москва/21/17/65(H2N2)
| Вирус | Структура генома | |||||||
| А/Москва/21/17/65(H2N2) | PB2 | PB1 | PA | HA | NP | NA | M | NS |
| А/Новая Каледония/20/99(H1N1) | PB2 | PB1 | PA | HA | NP | NA | M | NS |
| Реассортант 6:2 | PB2 | PB1 | PA | HA | NP | NA | M | NS |
| Реассортант 5:3 | PB2 | PB1 | PA | HA | NP | NA | M | NS |
Были изучены ростовые характеристики реассортантов и родительских штаммов при различных температурах инкубации в РКЭ, а также их репродуктивная активность в легких мышей линии СВА (рис. 2). Было показано, что наследование от ХА штамма шести или пяти генов внутренних и неструктурных белков (независимо от источника происхождения NS-гена) приводило к проявлению реассортантами ts и ca- фенотипа (рис. 2, А)
А. В.
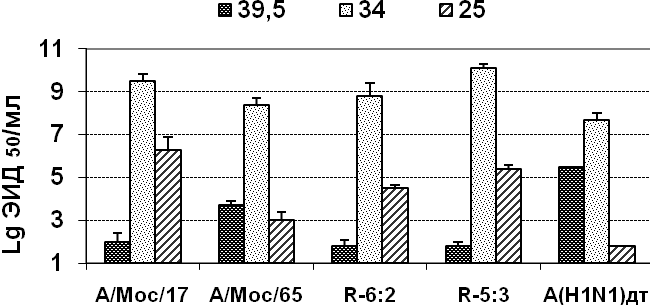
Рис. 2. А – инфекционная активность в куриных эмбрионах при различных температурах инкубации, В – репродукция в дыхательных путях мышей.
Репродукция 6:2 реассортанта в РКЭ при оптимальной температуре оказалась сниженной по сравнению с реассортантом 5:3 и родительским штаммом Москва/17, однако в дыхательных путях мышей такого снижения не наблюдалось (рис. 2, В).
Таким образом, было показано, что мутации, ответственные за холодовую адаптацию штамма А/Москва/21/17/65, локализованы в гене РВ2. Указанные замены расположены в активных доменах субъединицы РВ2 вирусной полимеразы: замена M-202-I локализуется в участке 51-259 аминокислотной последовательности, активном при взаимодействии субъединиц РВ1 и РВ2 вирусной полимеразы, а уникальные близкорасположенные замены V-414-I и G-416-S могут вызывать изменение вторичной структуры белка. Мутация V-65-I в белке NS1 не оказывает влияния на ca- и att-фенотип.
Генетическая стабильность штамма А/Москва/21/17(H2N2), а также сохранение свойств холодовой адаптации и аттенуации реассортантами, полученными на его основе, позволяют его использование в качестве нового донора аттенуации для получения реассортантов, а также в качестве ХА вакцинного штамма в случае возвращения в циркуляцию вирусов А(H2N2).
Молекулярно-генетический анализ и рестриктазное картирование ХА штамма вируса гриппа В/СССР/60/69. Современная реассортантная ЖГВ применяется в виде поливалентного препарата, включающего штаммы всех трех циркулирующих в настоящее время разновидностей вирусов гриппа A(H1N1), A(H3N2) и В. Для подготовки реассортантных вакцинных штаммов вируса гриппа В применяется ХА донор аттенуации В/СССР/60/69. Было проведено определение нуклеотидной последовательности донора аттенуации В/СССР/60/69. На основании данных секвенирования была модифицирована схема ОТ-ПЦР-рестрикционного анализа для изучения состава генома реассортантов на его основе. Ранее метод, основанный на идентификации уникальных нуклеотидных различий между генами ХА доноров аттенуации и эпидемических вирусов, был разработан для идентификации мутаций генов внутренних и неструктурных белков донора аттенуации А/Ленинград/143/17/57(H2N2), который в течение многих лет используется для подготовки ХА реассортантных вакцинных штаммов с современными эпидемическими штаммами вирусов гриппа А подтипов Н1 и Н3 (Klimov, Cox, 1993).
Для получения ДНК-копий участков генов внутренних и неструктурных белков донора аттенуации В/СССР/60/69 применяли следующие праймеры, разработанные А.И. Климовым: PB2-1550 (5’ TGG GGA AGT CAT AAT GG), PB1- 518 (5’ TTT GCC AAG ATA TCA TTG), PA-1061 (5’ AAA TAC AAT AAG TAA TGA GG), NP-1123 (5’ TGG GTA TGA AGC CAT GG), M-8 (5’ GCA CGC ACT TTC TTA AAA TG), NS-6 (5’ AAG CAG AGG ATT TAT TTA G). Комплементарными обратными праймерами были : PB2-r2389 (5' ACA CGA GCA TTT TTC ACT C), PB1-r1399 (5’ CCA TAC ATG TCT CTT CAT C), PA-r2303 (5’ GAA ACA CGT GCA TTT TT), NP - r1838 (5’ GAA ACA ACA GCA TTT TTT AC), M-r1183 (5’ ACA ACG CAC TTT TTC CAG), NS-r 576 (5’ CCC TTT TTA TTG TCA AAC GG). Анализ полученных нуклеотидных последовательностей показал, что гены PB2, PB1, PA, NP и NS ХА донора В/СССР/60/69 имеют нуклеотидные позиции, отсутствующие в геномах современных эпидемических штаммов вируса гриппа В и приводящие к возникновению сайтов рестрикции для Hind III, BspH I, Bcl II, Avr II, Mae I. Анализ нуклеотидной последовательности М гена выявил, что все современные изоляты имеют сайт рестрикции Bgl II, тогда как такой сайт отсутствует в М гене В/СССР/60/69 (табл. 4). Показано, что нуклеотидные замены, обнаруженные в PB1, PA, NP, M и NS генах донора аттенуации В/СССР/60/69, с большой долей вероятности можно считать уникальными, поскольку они не встречались у подавляющего большинства штаммов вируса гриппа В, выделенных в различных регионах мира и принадлежащих к различным генетическим линиям. Хотя нуклеотидная замена в PB2 гене не является уникальной, так как она встречалась у ряда вирусов линии В/Виктория, тем не менее, рестриктаза Hind III может применяться для определения происхождения гена PB2 у реассортантов, полученных на основе ХА донора В/СССР/60/69, поскольку у вирусов гриппа В линии В/Виктория, выделенных после 2002 года, сайт рестрикции для Hind III, характерный для гена PB2 донора В/СССР/60/69, отсутствует.
Таблица 4
Сайты рестрикции, уникальные для донора аттенуации В/СССР/60/69
| Ген | Сегмент | № нуклео-тида | Рестриктаза | В/СССР/60/69 | Современные штаммы |
| PB2 | 1550-2389 | 1939 | Hind III | 5'...AAGCTT...3' * | 5'...AGGCTT...3' |
| PB1 | 518-1399 | 1086 | BspH I | 5'...TCATGA...3' | 5'...TTATGA...3' |
| PA | 1061-2303 | 1796 | Bcl I | 5'...TGATCA...3' | 5'...TGAACA...3' |
| NP | 1123-1838 | 1291 | Avr II | 5'...CCTAGG...3 | 5'...CCTAGA...3' |
| M | 8-1183 | 524 | Bgl II | 5'...AAATCT...3 | 5'...AGATCT...3' |
| NS | 6-576 | 373 | Mae I | 5'...СTAG...3' | 5'...ATAG...3' |
Выявление целого ряда уникальных нуклеотидных замещений в генах внутренних и неструктурных белков донора аттенуации В/СССР/60/69, указывает на единый характер аттенуации вирусов гриппа А и В, полученных последовательным пассированием при пониженной температуре.
ПОДГОТОВКА И ХАРАКТЕРИСТИКА РЕАССОРТАНТНЫХ ХА ВАКЦИННЫХ ШТАММОВ ПАНДЕМИЧЕСКИ ОПАСНЫХ ВИРУСОВ ГРИППА
Характеристика вирусов птичьего гриппа, использованных в качестве источника поверхностных антигенов. В процессе отбора потенциальных кандидатов для подготовки вакцинных штаммов против возможных пандемий будущего были изучены характеристики репродукции в РКЭ при различных температурах следующих апатогенных вирусов гриппа птиц: А/утка/Потсдам/1406-86 (H5N2), А/утка/Вьетнам/342/01 (H5N1), А/дикая утка/Нидерланды/12/00 (H7N3), А/Гонконг/1073/99 (H9N2), А/перепел/Гонконг/6/97 (H9N2), А/курица/Гонконг/G9/97 (H9N2). Показана высокая степень температуроустойчивости всех вышеперечисленных вирусов: показатели роста при 400С не отличались или были выше, чем при 34 и 370С, только при повышении температуры до 410С наблюдалось снижение репродукции на 3-4 lg ЭИД50/мл. Для реассортации классическими методами в куриных эмбрионах были выбраны вирусы А/утка/Потсдам/1406-86(H5N2) [H5N2-дт], А/дикая утка/Нидерланды/12/00 (H7N3) [H7N3-дт], А/перепел/Гонконг/6/97(H9N2) антигенной линии G1 [H9N2-дт]. Молекулярно-генетический анализ НА родительских штаммов «дикого» типа показал, что все они содержат в сайте протеолитического расщепления гемагглютинина один остаток аргинина – признак, характерный для низкопатогенных вирусов. Анализ тяжелой цепи гемагглютинина НА1 вирусов подтипа Н5 показал наличие аминокислотных различий между родительским вирусом, использованным для подготовки реассортантного вакцинного штамма подтипа А(H5N2) - А/утка/Потсдам/1402-6/86 – и вирусами, выделенными в Гонконге в 1997 году (95-96% гомологии), а также вирусом A/Гонконг/213/03(H5N1) (94% гомологии). Количество аминокислотных различий между А/утка/Потсдам/1402-6/86(H5N2) и другими более поздними изолятами A(H5N1) находится в пределах 9-11%. Родительские «дикие» штаммы подтипа A(H9N2) и A(H7N3) были на 98% идентичными изолятам, выделенным от больных в Гонконге в 1999 г. и в Нидерландах в 2003 г.
Ростовые характеристики реассортантов птичьих вирусов при различных температурах инкубации в РКЭ. Для детального исследования были отобраны реассортанты, содержащие все значащие мутации в генах внутренних и неструктурных белков, описанные ранее для ХА донора аттенуации А/Ленинград/134/57(H2N2) [Лен/17]. С помощью ОТ-ПЦР-рестрикционного анализа и секвенирования генов НА и NA было показано, что реассортант А/17/утка/Потсдам/86/92(H5N2) [Лен 17/Н5] унаследовал от «дикого» вируса только ген НА, а остальные 7 генов – от донора аттенуации Лен/17 (формула генома 7:1). Реассортанты подтипов Н7N3 и Н9N2 - А/17/дикая утка/Нидерланды/00/84 (H7N3) [Лен 17/Н7] и А/17/перепел/Гонконг/97/86 (H9N2) [Лен 17/Н9] - имели формулу генома 6:2, так как унаследовали гены НА и NA от «диких» родительских штаммов. Показано, что все реассортанты вирусов гриппа птиц на основе холодоадаптированного донора аттенуации Лен/17 обладают высокой продуктивностью в РКЭ (8,5-9,6 lg ЭИД 50/мл) и устойчиво проявляют ts- и ca- фенотип, то есть свойства, характерные для ХА донора аттенуации (табл.5).
Таблица 5
Репродукция в куриных эмбрионах реассортантов апатогенных вирусов
гриппа птиц
| Вирусы | Инфекцион-ная активность lg ЭИД 50/мл | RCT25 (lg ЭИД50) | RCT40 (lg ЭИД50) | Фенотип |
| Холодоадаптированный донор аттенуации | ||||
| А/Ленинград/134/17/57(H2N2) | 9,5±0,3 | 2,2 | 8,0 | ts, ca |
| Апатогенные вирусы птичьего гриппа | ||||
| А/утка/Потсдам1406-86(H5N2) | 8,5±0,2 | 8,0 | 0 | non-ts, non-ca |
| А/дикая утка/Нидерланды/12/00(H7N3) | 8,7±0,2 | 7,5 | 0 | non-ts, non-ca |
| А/перепел/ Гонконг/6/97(H9N2) | 8,6±0,8 | 8,2 | 0 | non-ts, non-ca |
| Реассортанты апатогенных птичьих вирусов | ||||
| А/17/утка/Потсдам/86/92(H5N2) 7:1 | 9,3±0,3 | 3,1 | 7,7 | ts, ca |
| А/17/дикая утка/Нидерланды/00/84(H7N3) 6:2 | 9,6±0,5 | 4,0 | 8,5 | ts, ca |
| А/17/перепел/Гонконг/97/81(H9N2) 6:2 | 9,8±0,5 | 2,8 | 9,8 | ts, ca |
Оценка безвредности для кур ХА реассортантов, содержащих гены вирусов птичьего гриппа. Данный раздел работы был выполнен совместно с ветеринарной лабораторией, г. Афины, США под руководством Д. Свэйна. Для оценки аттенуации при введении курам использовали реассортанты вирусов птичьего гриппа подтипов А(H5N2) и А(H7N3) на основе Лен/17, а также родительские птичьи вирусы и донор аттенуации Лен/17. Патогенность определяли при внутривенном (в/в) введении стандартного разведения (10-1) вирусного материала (табл.6). «Дикий» вирус подтипа А(H5N2), а также ХА реассортанты подтипов А(H5N2) и А(H7N3) были безвредными и не вызывали развития инфекции. Из всех исследованных вирусов только «дикий» вирус H7N3-дт проявлял токсичность при в/в введении, когда развитие инфекции и смертность на 7-8 сутки наступали в 5 случаях из 8. После интраназального введения птичий вирус H7N3-дт был выделен из ротоглоточных и клоакальных смывов на 3-й день после инфекции в средних титрах 1,1-0,9 lg ЭИД50/мл. ХА реассортант данного подтипа не выделялся и не вызывал сероконверсий по данным радиальной иммунодиффузии в агарозном геле. Реассортант А(H5N2) и родительский вирус этого подтипа H5N2-дт, а также донор аттенуации Лен/17 также не были выделены после интраназального введения и не вызывали сероконверсий.
Таблица 6
Оценка безвредности и инфекционной активности реассортантов при внутривенном (в/в) и интраназальном введении курам
| Вирус | В/в введение (n=8) | Интраназальное введение (n=5) | |||||
| заболевае- мость | леталь- ность | выделение вируса на 3-й день (ЭИД50) | серокон- версии 21-й день | заболевае- мость | леталь- ность | ||
| оральное | клоакальное | ||||||
| Холодоадаптированный донор аттенуации | |||||||
| Лен/17 | 0/8 | 0/8 | 0/5 | 0/5 | 0/5 | 0/5 | 0/5 |
| Апатогенные вирусы птичьего гриппа | |||||||
| H5N2-дт | 0/8 | 0/8 | 0/5 | 0/5 | 3/5 | 0/5 | 0/5 |
| H7N3-дт | 5/8 | 5/8 | 2/5 (10 1.1) | 1/5 (10 0.91) | 5/5 | 0/5 | 0/5 |
| Реассортанты апатогенных птичьих вирусов | |||||||
| Лен17/Н5(H5N2) | 0/8 | 0/8 | 0/5 | 0/5 | 0/5 | 0/5 | 0/5 |
| Лен17/Н7(H7N3) | 0/8 | 0/8 | 0/5 | 0/5 | 0/5 | 0/5 | 0/5 |
Таким образом, было установлено, что приобретение реассортантами «внутренних» генов донора аттенуации А/Ленинград/134/17/57(H2N2) приводило к полной их аттенуации для кур. ХА реассортанты, являясь адаптированными к пониженной температуре репродукции и гиператтенуированными для кур, оказались неспособными ни инфицировать птиц, температура тела у которых значительно выше, чем у человека, ни выделяться от них в окружающую среду.
Безвредность кандидатов в вакцинные штаммы при интраназальном введении мышам. Изучение репродуктивной активности в дыхательных путях мышей показало, что все ХА реассортанты апатогенных птичьих вирусов были аттенуированными для мышей, репродуцируясь более эффективно в носовых ходах, чем в легочной ткани (табл.7).
Таблица 7
Репродуктивная активность реассортантов апатогенных птичьих вирусов и родительских штаммов в дыхательных путях мышей при заражающей дозе
6 lg ЭИД50
| Препарат | Характеристика | Выделение вируса на 3-й день п.и. (lg ЭИД50/мл), n=3 | |
| легкие | носовые ходы | ||
| Лен 17/Н5 | 7:1 ХА реассортант | 2,1±1,0 | 3,5±0,0 |
| Н5N2-дт | «дикий» температуроустойчивый | 6,3±0,3 | 1,6±0,2 |
| Лен 17/Н7 | 6:2 ХА реассортант | ≤1,5 | 3,7±0,3 |
| Н7N3-дт | дикий» температуроустойчивый | 6,4±0,2 | 1,7±0,0 |
| Лен 17/Н9 | 6:2 ХА реассортант | ≤1,5 | 3,7±0,2 |
| Н9N2-дт | «дикий» температуроустойчивый | 4,9±0,5 | 1,8±0,5 |
| Лен/17 | ХА донор аттенуации | 2,3±0,5 | 2,5±0,3 |
| Раствор ФСБ | Контроль | ≤1,5 | ≤0,8 |
Полученные результаты свидетельствуют, что классическими методами в куриных эмбрионах подготовлены высокорепродуктивные реассортанты вирусов гриппа потенциально пандемических подтипов, проявляющие свойства температурочувствительности, холодовой адаптации и аттенуации, необходимые для вакцинных штаммов ЖГВ.
РЕЗУЛЬТАТЫ ДОКЛИНИЧЕСКОГО ИЗУЧЕНИЯ
РЕАССОРТАНТНОГО ШТАММА А/17/УТКА/ПОТСДАМ/86/92(H5N2).
Основные этапы данного раздела работы были выполнены в Центре по контролю и предупреждению заболеваний США (Атланта, Джорджия).
Антигенная специфичность. Проведенное сравнение полных нуклеотидных последовательностей вируса H5N2-дт «дикого» типа и 7:1 реассортанта соответствующего подтипа выявило отсутствие изменений в процессе реассортации и селективных пассажей. Тем не менее, известно, что вирусы гриппа могут антигенно отличаться даже в случае полной идентичности аминокислотного состава НА, в частности, вследствие различных путей гликозилирования при культивировании в различных системах (Katz et al., 1999, Romanova et al., 2003). В таблице 8 представлены данные изучения антигенных свойств реассортантного штамма Лен 17/Н5 в РТГА с набором иммунных сывороток хорьков.
Таблица 8
Данные РТГА с антисыворотками хорьков
| Вирусы | Подтип | Антисыворотки хорьков | |||||
| Гк/156 | Гс/Гк/437 | Вн/113 | Вн/342 | Гк/213 | Лен 17/H5 | ||
| A/Гонконг/156/97 (Гк/156) | H5N1 | 320 | 160 | 640 | 640 | <20 | 160 |
| A/Гусь/Гонконг/437-4/99 (Гс/Гк/437) | H5N1 | 640 | 640 | 5120 | 2560 | 640 | 1280 |
| A/Гусь/Вьетнам/113/01 (Вн/113) | H5N1 | 160 | 40 | 2560 | 320 | 160 | 80 |
| A/Утка/Вьетнам/342/01 (Вн/342) | H5N1 | 320 | 160 | 320 | 2560 | <20 | 640 |
| A/Гонконг/213/03 (Гк/213) | H5N1 | 640 | 160 | 10240 | 2560 | 2560 | 640 |
| Лен17/H5 | H5N2 | 160 | 40 | 1280 | 640 | <20 | 640 |
| H5N2-дт | H5N2 | 160 | 80 | 1280 | 640 | <20 | 640 |
| A/курица/Гонконг/409.1/02 | H5N1 | 160 | 80 | 5120 | 320 | 640 | 320 |
| A/курица/Гонконг/31.4/02 | H5N1 | 320 | 80 | 320 | 640 | <20 | 320 |
| A/Гусь/Гонконг/668.1/01 | H5N1 | 160 | 80 | 640 | 640 | 160 | 160 |
Показано, что вакцинный кандидат Лен 17/Н5 являлся идентичным родительскому штамму А(H5N2), а также проявлял более выраженную степень антигенного родства с ВП вирусами А(H5N1), выделенными в Гонконге в 1997 году, по сравнению с вирусами А(H5N1) 2001-2003 годов выделения. При этом сыворотка, полученная к самому реассортанту Лен 17/Н5, реагировала в пределах всего 1:2 – 1:4 гомологичного титра как с вирусами 1997 года выделения, так и с более поздними изолятами.
Изучение генетической стабильности реассортантного ХА штамма Лен 17/Н5 после пассажа в носовых ходах хорька. В процессе получения иммунной антисыворотки реассортантный вирус вводили в носовые ходы хорька в дозе 6 lg ЭИД50/мл с последующим выделением реизолятов на 3-й и 6-й день после инокуляции. Носовые смывы пассировали трехкратно в РКЭ. Вакцинный вирус, выделенный на 3-й день после инокуляции, сохранил все значащие мутации в генах внутренних и неструктурных белков, характерные для донора аттенуации Лен/17. На 6-й день после инокуляции вирус не был выделен (Desheva et al, 2005).
Иммуногенность реассортантного штамма Лен 17/Н5 при введении белым мышам. На мышах была изучена возможность использования штамма Лен 17/Н5 в качестве как ЖГВ, так и инактивированной вакцины (ИГВ). Было проведено сравнительное изучение иммуногенности ЖГВ в дозе 107 ЭИД50/мл, вводимой интраназально (и/н) и цельновирионной ИГВ, инактивированной формалином, в дозе 10 мкг/100 мл, вводимой внутримышечно (в/м). Результаты представлены в таблице 9. После однократной и/н иммунизации ЖГВ из штамма Лен 17/Н5 сероконверсии антигемагглютинирующих и нейтрализующих антител в сыворотках крови наблюдались только к гомологичному вирусу подтипа А(H5N2). В качестве ИГВ, парентеральное введение Лен 17/Н5 стимулировало образование сывороточных антител как к гомологичному вирусу A(Н5N2), так и вирусам A(H5N1), выделенным в 1997 г. в Гонконге (А/Гонконг/156/97 и А/Гонконг/483/97).
Таблица 9
Иммуногенность ЖГВ и ИГВ из реассортантного штамма Лен 17/Н5 через 6 недель после введения мышам
| Препарат | РТГА (среднегеометрические титры), n=5 | РН (средние титры нейтрализующих антител), n=5 | ||||
| H5N2-дт | Гонконг/483 | Гонконг/213 | H5N2-дт | Гонконг/156 | Гонконг/213 | |
| ЖГВ (и/н) | 8,9 | <10 | <10 | 80 | <20 | <20 |
| ИГВ (в/м) | 10,0 | 7,6 | <10 | 160 | 80 | <20 |
| H5N2-дт (и/н) | 10,0 | <10 | <10 | 160 | 80 | 40 |
| ФСБ(и/н) | <10 | <10 | <10 | <20 | <20 | <20 |
Применение ИФА позволило выявить в ответ на введение ЖГВ или ИГВ развитие сероконверсий вирус-специфических IgG и IgA в сыворотках крови к вирусам H5N1: к цельному вирусу A/Гонконг/213/03 и очищенному НА А/Гонконг/156/97 (рис. 3). В группе мышей, иммунизированных ЖГВ, были выявлены специфические IgG и IgA антитела к вирусам А(H5N1) в легких и верхних дыхательных путях (ВДП). Внутримышечное введение ИГВ не стимулировало выработку IgA в легких и ВДП, локальный иммунный ответ в этом случае был представлен в основном IgG и был выражен значительно слабее, чем при интраназальном введении ЖГВ (р<0,001) (рис.3).
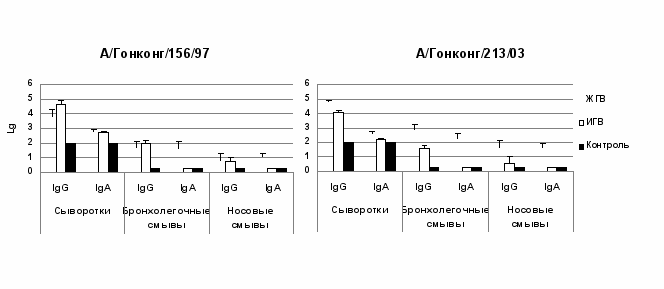
Рис. 3. Системные и секреторные IgG и IgA антитела (ИФА) к вирусам гриппа A(H5N1) после введения мышам реассортантного штамма Лен 17/Н5.
Таким образом, была подтверждена способность штамма Лен 17/Н5 индуцировать антитела не только к гомологичному варианту подтипа H5N2, но также и перекрестно- реагирующие антитела к вирусам А(H5N1) (Desheva et al., 2006).
Сравнительное изучение эффективности ЖГВ и ИГВ из штамма Лен 17/Н5 при реинфекции мышей вирусами A(H5N1). Для заражения животных через 1,5 месяца после однократной иммунизации ЖГВ и ИГВ на основе штамма Лен 17/Н5 использовали вирусы подтипа H5N1 А/Гонконг/483/97 в дозе 50 ЛД50 и А/Гонконг/213 в дозе 100 МИД50 (Desheva et al., 2006). Поскольку вирус А/Гонконг/213/03 не является высокопатогенным для мышей, оценку защитного действия вакцин проводили по показателям выделения этого вируса из легких на 3-й день после контрольного заражения. Результаты представлены в таблице 10.
Показано, что введение мышам ВП штамма А/Гонконг/483 в дозе 50 ЛД50 приводило в контрольной группе к значительной потере веса, начиная с 3-го дня после инфекции и к 100% смертности к 8-му дню, при этом средние титры вируса в легких достигали 5,9 lg ЭИД50/мл. Иммунизация ЖГВ на 100% защищала от летальности, при этом потеря в весе не превышала 5%, а средний титр инфекционного вируса в легких был в 10000 раз ниже, чем в контрольной группе (p<0,001). ИГВ защищала от летальности в 9 случаях из 10 (90%). Несмотря на то, что в группе ИГВ инфекционный вирус ни в одном случае не был выделен из легких, некоторое его количество было выделено из носовых ходов и из головного мозга.
Таблица 10
Эффективность против заражения вирусами А(H5N1),
выделенными в 1997 и 2003 гг.
| Препарат | Заражение 50 LD50 А/Гонконг/483/97 | Заражение 100 МИД50 А/Гонконг/213/2003 | ||||||
| летальность/всего | снижение веса (%) | средние титры (lg ЭИД50/мл), n=5 | выделение вируса из легких | |||||
| легкие | носовые ходы | головной мозг | тимус | выделено/всего | средние титры (lg ЭИД50/мл) | |||
| Лен17/H5(ЖГВ) | 0/8 | 6 | 1,9±0,5 | ≤0,8 | ≤0,8 | ≤0,8 | 1/10 | 1,8±0,9 |
| Лен17/H5(ИГВ) | 1/8 | 7 | ≤1,5 | 1,1±0,3 | 1,0±0,5 | ≤0,8 | 0/5 | ≤1,5 |
| H5N2-дт | 0/8 | 0 | ≤1,5 | ≤0,8 | ≤0,8 | ≤0,8 | 0/10 | ≤1,5 |
| Контроль | 8/8 | 22 | 5,9±1,3 | 4,0±0,7 | 4,3±0,8 | 3,6±1,3 | 10/10 | 5,3±1,4 |
Заражение вирусом А/Гонконг/213, значительно отличающимся по антигенным свойствам, показало, что ЖГВ была на 90% эффективной, когда инфекционный вирус выделялся из легких в 1 случае из 10 в среднем титре 1,8 lg ЭИД50/мл, то есть в 3000 раз меньшем, по сравнению с контролем (p<0,001).
В другом эксперименте была изучена эффективность против реинфекции антигенным вариантом вируса А(H5N1), выделенным во время вспышки во Вьетнаме в 2004 г (в сотрудничестве с Lu et al.). В исследование были добавлены еще две группы мышей, которых иммунизировали в/м цельновирионной неадьювантной ИГВ из штамма Лен 17/Н5 двукратно с интервалом в 4 недели, либо ИГВ с добавлением гидроокиси алюминия - двукратно (табл. 11). Через 3 месяца после первичной иммунизации животные во всех вакцинных группах были полностью защищены от летальной инфекции 200 ЛД50 вируса A/Вьетнам/1203/2004(H5N1). В контрольной группе наблюдалось развитие тяжелой системной инфекции, сопровождающееся снижением среднего веса до 19%, выделением инфекционного вируса из тканей головного мозга в высоких титрах и 100% гибелью животных на 6-9 день инфекции. В группе ЖГВ снижение среднего веса было незначительным (7%), наблюдалось снижение титра заражающего вируса в легких в 10000 раз по сравнению с контролем, при этом инфекционный вирус не был выделен из головного мозга и верхних дыхательных путей.
Таблица 11
Эффективность против заражения антигенным вариантом вируса А(H5N1), выделенным во время вспышки во Вьетнаме в 2004 г.
| Препарат | Кратность введения | Средние титры вируса lg ЭИД50/мл (n=5) | Снижение веса (%) | Летальность /всего | ||
| легкие | носовые ходы | головной мозг | ||||
| ЖГВ | 1 | 1,6±1,2 | ≤0,8 | ≤0,8 | 7,3 | 0/5 |
| ИГВ | 1 | 2,8±1,8 | 1,0±0,4 | 1,1±0,7 | 11,2 | 0/5 |
| ИГВ | 2 | ≤0,8 | ≤0,8 | ≤0,8 | 8,0 | 0/5 |
| ИГВ+адьювант | 2 | ≤0,8 | ≤0,8 | ≤0,8 | 1,8 | 0/5 |
| Контроль | 1 | 6,1±0,7 | 4,7±0,9 | 4,5±0,1 | 19,4 | 5/5 |
Однократное введение ИГВ без адьюванта защищало мышей от летальности, однако заражающий вирус выделялся не только из легких, но также из носовых ходов и головного мозга. Для достижения полной защиты против системного распространения инфекционного вируса и его выделения из ВДП потребовалось две дозы ИГВ.
Таким образом, было показано, что однократная иммунизация ЖГВ из реассортантного штамма Лен 17/Н5 полностью защищала мышей против летальной инфекции высокопатогенными вирусами А(H5N1). При минимальном выделении вируса из легочной ткани зараженных животных, вирус не был выделен из носовых ходов или головного мозга, что коррелировало с наличием вирус-специфических IgA в секретах ВДП. Наблюдаемый защитный эффект реассортантного штамма Лен 17/H5 в отношении вирусов A(H5N1), принадлежащих к различным антигенным линиям в отсутствие достоверного уровня сероконверсий антигемагглютинирующих антител может объясняться как формированием специфических системных и локальных IgA и IgG, выявленных иммуноферментным методом, так и стимуляцией клеточного компонента иммунного ответа, что подтверждается выраженной индукцией интерферона-γ спленоцитами мышей, иммунизированных ЖГВ, в ответ на стимуляцию цельным вирусом А/Гонконг/213/03 или рекомбинантным НА вируса А/Гонконг/156/97(H5N1).
Перекрестная защита против ВП вируса A(H5N1), выделенного в 2005 г. на территории Российской Федерации. Данный раздел работы был выполнен на базе Вирусологического Центра НИИ микробиологии МО РФ (Москва) под руководством начальника отдела, к.б.н. С.А. Мельникова и начальника 1 НИУ, д.м.н., проф. Р.А. Хамитова, за что автор выражает им искреннюю благодарность. С целью изучения перекрестно-реактивной защиты, создаваемой ЖГВ из штамма Лен 17/Н5, было проведено заражение иммунизированных мышей вирусом H5N1 А/курица/Курган/2/05, выделенным специалистами Вирусологического центра в сентябре 2005 г. из легкого павшей курицы птицефабрики «Утятская». Культура штамма прошла один пассаж в легких белых мышей массой 14-16 г. В условиях закрытых лабораторий с повышенным уровнем безопасности на белых мышах линии BALB/с была изучена иммуногенность и эффективность ЖГВ из штамма Лен 17/Н5 по сравнению с субъединичной адьювантной ИГВ, приготовленной ФГУП «Микроген» из реассортантного штамма А(H5N1) NIBRG-14, полученного из Национального Института Биологических Исследований, Великобритания (WHO, 2006). Реассортант NIBRG-14 был подготовлен на основе штамма А/PR/8/34 и содержал модифицированные методами обратной генетики HA и NA от вируса A/Вьетнам/1203/2004(H5N1). В качестве адьюванта использовали иммуномодулятор полиоксидоний (полимер-субъединичная вакцина) или гидроокись алюминия (адсорбированная вакцина). ЖГВ в дозе 106,4/0,05 мл вводили интраназально однократно или двукратно с интервалом в 10 дней, ИГВ в дозе 15 мкг НА по ОРИД – парентерально однократно. Для оценки иммунного ответа у вакцинированных животных были взяты сыворотки крови на 21 день после последней иммунизации. Результаты представлены в таблице 12.
Интраназальное введение ЖГВ как двукратное, так и однократное вызывало образование перекрестно-реагирующих антигемагглютинирующих антител в титрах на уровне протективных (1:80 и 1:40 соответственно). Наиболее высокие титры антител к вирусу А(H5N1) были выявлены при помощи ИФА. В случае применения полимер-субъединичной вакцины, содержащей полиоксидоний, по всем трем тестам были получены наиболее низкие показатели.
Таблица 12
Результаты оценки иммуногенных и протективных свойств вакцинных кандидатов против птичьего гриппа подтипа H5
| Кратность введения | Название препарата, доза | Средние титры антител после иммунизации | Доля выживших животных после инфекции | ||||
| ИФА | РН | РТГА | заражающая доза (ЛД50) | абс./ всего | % | ||
| 1 | Полимер-субъединичная вакцина H5N1, 15 мкг | <1:40 | <1:10 | <1:10 | 25 | 3/15 | 20 |
| Субъединичная адсорбированная H5N1, 15 мкг | 1:80 | 1:10 | <1:10 | 25 | 6/15 | 40 | |
| Интраназальная живая Лен 17/Н5, 6,4 lg ЭИД50 | 1:320 | 1:14 | 1:40 | 27 | 8/14 | 57 | |
| 2 | Полимер-субъединичная вакцина H5N1, 15 мкг | 1:80 | 1:20 | 1:20 | 25 | 7/14 | 50 |
| Субъединичная адсорбированная H5N1, 15 мкг | 1:320 | 1:20 | 1:10 | 25 | 12/15 | 80 | |
| Интраназальная живая Лен 17/Н5, 6,4 lg ЭИД50 | 1:1280 | 1:40 | 1:80 | 27 | 13/15 | 87 | |
| Контроль | Раствор ФСБ | <1:40 | <1:10 | <1:10 | 27 | 0/10 | 0 |
