Низкие температуры, пути достижения. История и современность
| Вид материала | Документы |
- Низкие температуры в природе и технике. Современные аспекты, 17.72kb.
- Землеустройство как комплекс мер по рациональной организации сельского хозяйства, 35.79kb.
- Международная научно-практическая конференция «кооперация: история и современность», 28.8kb.
- Социальная работа на урале: история и современность межвузовский сборник научных трудов, 2331.27kb.
- Экономика, власть, управление в России: история и современность, 11.33kb.
- Русская Православная Церковь. История и современность. Для участия в работе конференции, 52.11kb.
- Тательная деятельность детского оздоровительного лагеря: история и современность сборник, 2465.08kb.
- Рекомендации Научно-практической конференции "Вепсы: история, культура, современность", 18.05kb.
- Лабораторная работа Определение относительной влажности воздуха и температуры насыщенного, 14.75kb.
- Доклад на научно-практической конференции «Народный костюм: история и современность», 84.34kb.
Сжижение простым давлением.
Напомним снова, что газ, находящийся под атмосферным давлением, представляет собой чрезвычайно далекий от состояния насыщения пар, но если при помощи насоса нагнетать все увеличивающиеся количества этого газа в какой-нибудь закрытый сосуд, температура которого поддерживается постоянной, то давление начнет возрастать. При этом может, наступать момент, когда возрастающая таким образом упругость газа станет равной напряжению, которым обладает насыщенный пар при этой температуре, вследствие чего сам газ заключенный в сосуде, превратится в насыщенный пар; я подчеркну, что наступление этого момента только возможно, имея в виду, что упругость насыщения некоторых газов при обыкновенной температуре равна бесконечности.
Но предположим, что с тем газом, который мы взяли для опыта, нам удалось достичь состояния насыщения при помощи простого увеличения давления. Мы знаем, что с этого момента дальнейшее увеличение упругости газа становится невозможным, так как нагнетание нового количества газа в сосуд, поведет к тому, что некоторое количество газа, в точности равное нагнетаемому, перейдет в жидкое состояние. В дальнейшем, по мере подачи в сосуд газа и удаления, теплоты сжижения, конденсация будет совершаться беспрерывно.
Таким именно способом было осуществлено первое известное, науке сжижение, при чем и на этот раз, как это нередко бывает, открытие было сделано случайно. Знаменитый Ван Марум, пользуясь аммиаком, проверял в 1792г. точность закона Марио. Для этого он заключил определенное количество названного газа в градуированную пробирку, в которую с помощью насоса могла подаваться ртуть, чтобы сжимать газ Начало опыта протекало так, как и предполагал экспериментатор, но вдруг, к удивлению ученого, подъем ртути ускорился и газ совершенно неожиданно превратился в несколько капель прозрачной жидкости. При обыкновенной температуре, скажем при 15°С, упругость насыщения аммиака равна 7,2 атм. и так как давление в приборе Ван Марума легко могло дойти до этой величины, то, если бы предусмотрительным экспериментатором не был взят сосуд с достаточно толстыми стенками, мог бы произойти взрыв. Мы уже знаем, что все жидкие тела могут испаряться. Одни жидкости при данной температуре испаряются быстро, другие - медленно. При этом они превращаются в пар, т. е. переходят в газообразное состояние. Естественно поставить вопрос, можно ли газ превратить в жидкость? Каким путем можно этого достигнуть? Если мы имеем ненасыщенный пар воды или эфира и будем сжимать их, то сначала их давление будет увеличиваться, подобно тому как это имеет место для обычных газов. Однако увеличение давления будет происходить только до тех пор, пока давление не достигнет давления насыщенного пара при температуре опыта. После этого оно уже не будет больше расти, а пар начнет конденсироваться в жидкость. Объем, в котором производится сжатие, уже не будет заполнен однородным веществом - газом: появится граница между веществом в двух состояниях - жидком и газообразном.
Еще в начале прошлого столетия английскому физику и химику Майклу Фарадею (1791—1867) и другим исследователям удалось превратить таким образом в жидкость ряд веществ, известных до того только в газообразном состоянии. Они превратили в жидкость хлор и углекислый газ, сжимая их при возможно низкой температуре.
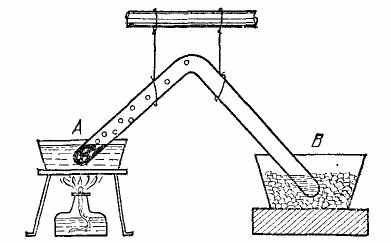 На рисунке показано приспособление Фарадея для сжижения хлора. В колене А запаянной стеклянной трубки помещен сухой гидрат хлора. При нагревании из него выделяется хлор. Конец трубки В помещен в охлаждающую смесь. В нем получается жидкий хлор. Для сжижения таких газов, как хлор или углекислота, их нужно сжать гораздо сильнее, чем пары эфира. Например, чтобы при температуре 20 °С превратить в жидкое состояние хлор, нужно давление 7 атм, а для углекислоты - 60 атм. Это - давления их насыщенного пара при температуре 20 °С.
На рисунке показано приспособление Фарадея для сжижения хлора. В колене А запаянной стеклянной трубки помещен сухой гидрат хлора. При нагревании из него выделяется хлор. Конец трубки В помещен в охлаждающую смесь. В нем получается жидкий хлор. Для сжижения таких газов, как хлор или углекислота, их нужно сжать гораздо сильнее, чем пары эфира. Например, чтобы при температуре 20 °С превратить в жидкое состояние хлор, нужно давление 7 атм, а для углекислоты - 60 атм. Это - давления их насыщенного пара при температуре 20 °С.Однако некоторые из газов (водород, азот, кислород и др.) оказались крайне упорными. Никакое доступное Фарадею охлаждение и давление в несколько тысяч атмосфер не вызывали сжижения этих газов. В чем была причина этих неудач? Решить этот вопрос удалось только после того, как было подробно изучено, каким образом плотности жидкости и ее пара зависят от температуры и давления. Оказалось, что неудача была вызвана не тем, что в то время не умели создавать достаточно большие давления, а тем, что не умели создать достаточное охлаждение. Незначительные шероховатости, неизбежные при научных изысканиях, легко сглаживаются тем огромным удовлетворением, которое дает оправдавший надежды опыт, и Фарадей не был бы тем воодушевленным экспериментатором, каким он известен, если бы ничтожные неудачи ослабили его настойчивость. Уже в течение достопамятного 1823 года, было осуществлено сжижение следующих газов: сернистый водород, полученный от взаимодействия соляной кислоты и сернистого железа, был приведен в жидкое состояние при давлении в 17 атм. и температуре 10°С; сернистая кислота, полученная взаимодействием серной кислоты и ртути- была сжижена под давлением в 3 атмосферы при 7,5°С; даже закись азота получавшаяся нагреванием азотноаммониевой соли, была сжижена под давлением в 50 атм., и, наконец, были сжижены циан - под давлением в 3,7 атм. и углекислота - под давлением в 36 атм. Вот те успехи, которые в первый же год дополнили список побед, одержанных Фарадеем и, понятно, побудили его к дальнейшим работам в этом направлении. Спустя много лет в столь простой открытый Фарадеем метод сжижения газов было введено Мельсенсом чрезвычайно интересное изменение, позволяющее производить очистку обрабатываемых газов. Известно, что древесный уголь обладает способностью жадно поглощать громадные количества различных газов, которые при некотором повышении температуры выделяются снова. Это свойство чрезвычайно возрастает при низких температурах и в дальнейшем будет рассказано об очень интересных применениях этого явления. Вместо того, что бы помещая в трубку Фарадея различные, перечисленные выше реактивы, получать, при их взаимодействии влажные и даже загрязненные различными примесями газы, Мельсенс решил заполнять нагреваемый конец трубки древесным углем, предварительно насытив его тщательно очищенным газом, который желают сделать жидким.
Аппарат Тилорье.
Трубка Фарадея дает возможность производить сжижение газа только в очень незначительных количествах. Для возможности изучения свойств этих необыкновенных тел необходимо получение их в больших количествах. Преследуя эти цели Тилорье внес в аппарат Фарадея некоторые очень остроумные видоизменения и тем самым приспособил его для сжижения некоторых газов и, главным образом, углекислоты в довольно значительных количествах. В настоящее время углекислота является продуктом, имеющим широкое распространение; виноторговцы взяли ее под свое высокое покровительство, что является для будущности этого продукта науки более важным, чем все те услуги, которые он может оказать в лабораториях. В настоящее время в промышленности получают жидкую углекислоту, с большей легкостью, чем это позволял делать вышедший ныне из употребления аппарат Тилорье, но той значительной ролью, которую он сыграл в истории науки, он заслужил хотя - бы краткого описания. Этот аппарат, в сущности говоря, представляет собой ту же трубку Фарадея, но только большой емкости. Прежде его изготовляли из чугуна, но после происшедшего в 1840 году в фармацевтической школе несчастного случая, стоившего жизни сотруднику школы Гервею, он был переконструирован Донни и Мареска и получил следующий вид: два цилиндра из красной меди, скрепленные обручами и выложенные изнутри свинцом играют роль двух колен трубки Фарадея. Один из этих цилиндров, показанный в левой части рисунка, подвешен на цапфах, и в нем содержатся те вещества, которые при взаимодействии дадут нужный газ: пусть это будет, с одной стороны, определенное количество двууглекислой соды и, с другой стороны, серная кислота, налитая в латунное ведрышко. Другой сосуд, предназначен для сжижения полученного газа. Для пуска аппарата в ход, левый цилиндр, после загрузки в него указанных выше веществ плотно закрывается, затем его поворачивают на цапфах до тех пор, пока вся серная кислота не выльется на двууглекислую соду. Происходит реакция, выделяется углекислый газ, который ввиду незначительности имеющегося в сосуде свободного пространства, принужден занять малый объем, т. е. подвергнуться сильному сжатию; но все же он не сжижается сейчас же, так как при поднявшейся вследствие реакции температуре, упругость насыщения становится огромной. Если же теперь соединить оба сосуда с помощью трубки, и если при этом открыть кран газ перейдет в правый сосуд и сжижится под давлением, которое даже при 15°С еще равно 50 атм. Из последнего видно, что давления, возникающие в сосудах, довольно значительны, и поэтому аппарат должен быть сконструирован достаточно прочно. Если теперь открыть кран, имеющийся на цилиндре , то из него начнет с большим напором вырываться образовавшаяся в сосуде жидкость; при этом произойдет обильное испарение, сопровождающееся громадным поглощением тепла, влекущим за собой охлаждение неиспарившейся части ниже ее точки замерзания; вследствие этого она превратится в белый снег, совершенно идентичный с обыкновенным снегом, который, можно собрать (при этом произойдет образование многочисленных электрических искр, получающихся в результате интенсивного трения), направляя выходящую струю в мешочек из какой-либо ткани. Мы уже знаем, что оставленная на открытом воздухе сжиженная углекислота должна дойти до температуры при которой ее упругость равнялась бы одной атмосфере. Эта температура не менее -79°С, а так как температура замерзания только -56°С, то, очевидно, неиспарившаяся часть должна перейти в твердое состояние; следовательно, жидкая углекислота при атмосферном давлении не может существовать и образуемый ею с
 нег отличается от обыкновенного снега тем, что он испаряется не плавясь.
нег отличается от обыкновенного снега тем, что он испаряется не плавясь. Если этот снег заключить в закрытый сосуд, например, в запаянную стеклянную трубку, то под влиянием окружающего тепла испарение будет постепенно увеличивать давление; в определенный момент это давление дойдет до 5 атм., и температура таяния углекислоты -57°С будет достигнута; увеличение давления приостановится, и снег превратится в жидкость, которую можно снова превратить в твердое состояние, на этот раз в виде прозрачного тела, погрузив трубку на несколько мгновений в твердую углекислоту, находящуюся на открытом воздухе. Ввиду того, что при подобных опытах давление возрастает до значительных размеров, они должны сопровождаться соблюдением сугубой осторожности. Твердая углекислота, положенная на руку, не вызывает интенсивного ощущения холода, как это следовало бы ожидать, зная, что ее температура равна -79°С. Это обстоятельство объясняется тем, что между твердой углекислотой и кожей нет достаточно плотного соприкосновения. Доказательством этого служит следующий опыт: если по примеру Тилорье поместить снег углекислоты в эфир, то получится смесь с температурой в -79°; палец, опущенный в эту смесь, будет сильно обожжен. Однако, этот ожог не всегда сейчас же проявит себя резкой болью, так как холод часто вызывает потерю чувствительности. В этом отношении особенно коварной является смесь из спирта и твердой углекислоты. Ощущение холода мало интенсивно, если в эту смесь опустить палец или даже взять ее в рот. Д'Арсонваль проделал любопытный опыт, погружая в спирт и постепенно охлаждая с помощью углекислоты морскую свинку, которая ничем не реагировала на происходящее с ней и продолжала с философским спокойствием грызть свою морковку до того момента, пока она не превратилась в твердый комок и челюсти не отказались ей служить. Испаряя в пустоте эту полужидкую массу согласно уже приведенным объяснениям получают очень низкую температуру, могущую дойти до -110°. Это крупное достижение, полученное с такой относительной легкостью в 1840 году при помощи аппарата Тилорье, позволило Фарадею пойти далеко вперед в изучении проблемы сжижения газов.
Сжижение при помощи одновременного сжатия и охлаждения.
Дальнейшие опыты Фарадея.
Мы уже видели, что при своих первых опытах Фарадей хотел с помощью одного только сжатия привести газ к сжижению. Это странно, так как до Фарадея опыты, производившиеся Монжем, Клуэ, Гюитоном де Морво, так же, как и почти аналогичные опыты Бюсси, произведенные в 1821 году, показали с большой очевидностью, что и для газов холод является могущественным средством воздействия. Когда в 1845 году Фарадей снова принялся за уже высказанную, но недостаточно проработанную Колладоном, а впоследствии и Наттерером, мысль об одновременном применении этих обоих методов, он подошел вплотную к проблемам, над которыми до этого тщетно трудились многие ученые. Мы указали выше на смысл применения этого способа, при чем отметили, что чем ниже та температура, при которой происходит процесс, тем меньше то давление, которое нужно осуществить, чтобы насытить газ, а следовательно, меньше и то давление, которое необходимо для сжижения. Точно также уже было сказано, что влияния только одного холода всегда достаточно для сжижения какого-либо газа. Но в этих случаях иногда приходится доходить до тех чрезвычайно низких температур, при которых давление сжижения обрабатываемого газа снижается до 1 атм. Если же, наоборот, вместе с холодом в процессе примет участие еще и давление, то температуру придется снижать только до того более легко достижимого предела, при котором упругость насыщения соответствует давлению, осуществляемому имеющимися в нашем распоряжении аппаратами. Иначе говоря; вместо необходимости использования либо чрезмерного холода, либо громадного давления мы имеем возможность получить нужный эффект более легким путем, а именно, путем одновременного использования умеренного давления и не слишком интенсивного холода. Вместе с тем, применяя достаточно высокое давление и сильный холод, мы будем владеть тем средством, которое даст нам возможность покорить и самые устойчивые газы. Именно таковым и является метод, осуществленный Фарадеем с помощью такого могучего средства воздействия, как испарение смеси Тилорье под уменьшенным давлением. Уверенность Фарадея в пра
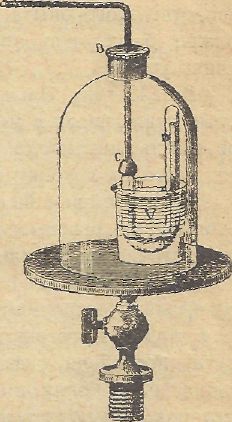 вильности избранного им пути была столь велика, что он не искал других путей и для превращения в жидкость водорода и кислорода, уже в то время получивших известность по тем тщетным усилиям, которые для разрешения этой задачи были затрачены некоторыми физиками. В своем новом аппарате Фарадей не использовал сжатия, получающегося в результате выделения сжижаемых газов, так как газы, которые предполагались к опытной работе и, главным образом, водород, кислород и азот не всегда легко поддавались очистке в его первоначальном примитивном аппарате. В этом аппарате изучаемый газ, предварительно очищенный и осушенный, последовательно проходит через два насоса, которые подымают его давление сначала до 16-20 атм., а затем, по мере надобности, до 50; после этого он попадает в U-образную трубку, в которой находится небольшой манометр со сжатым воздухом, предназначенный для определения давления в каждый данный момент, путем перемещения ртутного столба в капиллярной трубке, заполненную воздухом, И - образная трубка окружена охлаждающей смесью Тилорье, а сам аппарат, в случае надобности, может, быть, как это показано на рисунке, помещен под колокол воздушного насоса. С помощью этого аппарата были получены изумительные результаты. Не только упрямившиеся до сих пор газообразные: соляная, бромистоводородная, иодистоводородная и кремнефтористо-водородная кислоты, мышьяковистый и фосфористый водород, а также и этилен были легко сжижены, но даже большинство газов, подвергнувшихся этим опытам были заморожены: так, сернистый водород принял форму белой кристаллической массы, похожей на камфору; закись азота приняла форму красивого бесцветного кристаллического тела, хлорноватистая кислота - рыхлой, кристаллической массы красного цвета и т. д. А ведь это почти точное и окончательное подтверждение пророческого предвидения Лавуазье.
вильности избранного им пути была столь велика, что он не искал других путей и для превращения в жидкость водорода и кислорода, уже в то время получивших известность по тем тщетным усилиям, которые для разрешения этой задачи были затрачены некоторыми физиками. В своем новом аппарате Фарадей не использовал сжатия, получающегося в результате выделения сжижаемых газов, так как газы, которые предполагались к опытной работе и, главным образом, водород, кислород и азот не всегда легко поддавались очистке в его первоначальном примитивном аппарате. В этом аппарате изучаемый газ, предварительно очищенный и осушенный, последовательно проходит через два насоса, которые подымают его давление сначала до 16-20 атм., а затем, по мере надобности, до 50; после этого он попадает в U-образную трубку, в которой находится небольшой манометр со сжатым воздухом, предназначенный для определения давления в каждый данный момент, путем перемещения ртутного столба в капиллярной трубке, заполненную воздухом, И - образная трубка окружена охлаждающей смесью Тилорье, а сам аппарат, в случае надобности, может, быть, как это показано на рисунке, помещен под колокол воздушного насоса. С помощью этого аппарата были получены изумительные результаты. Не только упрямившиеся до сих пор газообразные: соляная, бромистоводородная, иодистоводородная и кремнефтористо-водородная кислоты, мышьяковистый и фосфористый водород, а также и этилен были легко сжижены, но даже большинство газов, подвергнувшихся этим опытам были заморожены: так, сернистый водород принял форму белой кристаллической массы, похожей на камфору; закись азота приняла форму красивого бесцветного кристаллического тела, хлорноватистая кислота - рыхлой, кристаллической массы красного цвета и т. д. А ведь это почти точное и окончательное подтверждение пророческого предвидения Лавуазье.Однако, несмотря на все усилия, Фарадей оказался не в состоянии сжижить те газы, которые являлись целью его трудов; пять газов: водород, азот, кислород, окись углерода и метан неизменно противостояли его самым настойчивым попыткам.
Критическая точка.
Новые неудачи и их причины.
Неудача Фарадея побудила многих физиков взяться за изучение этого вопроса. В 1838 году Могам сжимал водород и кислород постепенно увеличивающимся давлением, которое получается при самом электролизе воды. Эта остроумная комбинация не привела к каким-либо положительным результатам, при чем автор ее высказал поистине замечательное для его эпохи соображение, что производство этого опыта с применением достаточно низкой температуры должно безусловно привести к положительным результатам и обеспечить успех.
В 1843 году Эме, пользуясь теми громадными давлениями, которые существуют в морских глубинах, не получил лучших результатов, сжимая кислород и водород до 220 атм., при помощи погружения этих газов на глубину свыше 2 километров. В дальнейшем было затрачено много новых усилий, но все они, к сожалению, основывались на преувеличенном значении давления и недостаточно оценивали необходимость понижения температуры. В 1850 году Вертело удалось получить огромные давления в чрезвычайно остроумном и изящном приборе. Он помещал изучаемый газ в трубку простого термометра и нагреванием производил подъем ртути; последняя оказывала на газ все возрастающее давление, доходившее к концу опыта до громадных величин. В таком приборе кислород был подвергнут давлению в 780 атм., и все-таки даже, когда трубка была охлаждена в твердой углекислоте, не было обнаружено ни малейших признаков приближающегося сжижения. В 1854году Наттерер сумел получить колоссальную для давлений величину в 2800 атмосфер; под этими громадными давлениями сокращенные до ничтожной доли своего первоначального объема испытуемые газы героически оставались верными своей природе, становясь более плотными, чем вода, но не сдаваясь! И с этих пор несжижаемые газы стали называться постоянными газами. Наука, не терпящая поспешных заключений, вскоре доказала всю неосмотрительность, которая была проявлена при определении неподдающихся сжижению газов, как газов постоянных. Эти, столь долго сопротивлявшиеся усилиям ученых, желавших превратить их в жидкость, газы суть: водород, азот и кислород (все три - элементы) и два соединения углерода - окись углерода (СО) и (СО2). Муассан в 1866 г. к этому ряду добавил еще фтор, а впоследствии этот список был дополнен еще одним замечательным элементом гелием, который вследствие какой-то необъяснимой странности, наши ученые, достойные последователи астролога Фонте нашли раньше на солнце, прежде чем обнаружили присутствие во вдыхаемом ими воздухе. Сюда можно было бы прибавить еще и вновь открытые элементы: неон, аргон, криптон, и ксенон, обнаруженные уже в последнее время в атмосферном воздухе в компании с гелием. После того, как Фарадеем были произведены опыты, при которых были использованы не только очень низкие температуры, но и достаточно высокие давления, и которые не привели в отношении постоянных газов к положительным результатам, трудно было рассчитывать, думается нам, получить успех, пользуясь только одним давлением или даже применяя одновременно с последним и некоторое охлаждение. Если у кого-нибудь и были основания с некоторой надеждой на успех пытаться производить опыты, применяя высокие давления, то это был Фарадеq. И если он не счел нужным при своих опытах применить давление свыше 50 атм., то это было, не из-за невозможности их создать, а вследствие изумительного ясновидения, благодаря которому он отказался от бесплодных по его мнению усилий.
Работы Каньяр де ля Тура и мнение Фарадея.
Опыты осуществленные в 1821 г. Каньяр де ля Туром прошли почти незамеченными, но не ускользнули от внимания Фарадея и помогли ему разгадать причину постигших его неудач. Нагревая различные жидкости в закрытых, почти целиком заполненных сосудах, Каньярделя Тур наблюдал, что эти жидкости при определенной температуре внезапно превращались в газы. При этом превращении объем их оставался без изменения, в силу чего образующееся при этом давление должно было быть очень высоким. “Очевидно, при этой температуре”, писал Фарадей, никакое увеличение давления, как бы велико оно ни было, не может сжижить образовавшийся газ. Следовательно, возможно, что для кислорода, азота и водорода температура -110°C выше этой нужной, а поэтому нельзя ожидать, чтобы какое бы то ни было давление, (не сопровождаемое большим понижением температуры, чем то, которого достигают) могло заставить эти элементы изменить газообразному состоянию. Вертело после постигших его в этом направлении неудач, держался того же мнения, и известные опыты Эндрьюса вскоре доказали безусловную правоту этой теории: температура, выше которой, согласно Фарадею, невозможно сжижение данного газа, как бы мощно ни было применяемое давление, существует в действительности и называется критической температурой. В период от Фарадея до Эндрьюса, с 1845 до 1863 года следует отметить несколько интересных работ. Дрион, который уже в 1845 году, проверил над сжиженными газами результаты, полученные Каньяр де ля Туром, в 1859 году заметил, что при нагревании жидкостей под давлением, расширение их быстро растет и, когда достигает пределов при которых жидкость внезапно переходит в газообразное состояние, становится подобным расширению газов. В 1861 году Менделеев сделал другое чрезвычайно важное наблюдение: он констатировал, что при тех же обстоятельствах теплота испарения жидкости постепенно уменьшается и доходит до куля при температуре внезапного превращения в газ, которую он назвал точкой абсолютного кипения. Наблюдение Менделеева доказывает, что в этих условиях вещество легко переходит из одного состояния в другое при очень незначительных колебаниях температуры. А это является новым доказательством непрерывности перехода от жидкого к газообразному состоянию.
 Таким образом, мы проследили все этапы развития интересующего нас вопроса и подошли к 1863 году и первым работам Эндрьюса.
Таким образом, мы проследили все этапы развития интересующего нас вопроса и подошли к 1863 году и первым работам Эндрьюса.Опыты Эндрьюса.
Этот великий ученый начал свои исследования постоянных газов, подвергая их одновременному влиянию давления в несколько сот атмосфер и температуры в пределах от -75°С до -110°С.
Подобно Фарадею он потерпел неудачу, несмотря на то, что он внес корректив, подвергая газы высоким давлениям при уже очень низких температурах. Все его попытки не давали положительных результатов. Таким образом, предвидения -его великого предшественника получили новое и веское подтверждение. Тогда, отчаявшись, ученый поступил чрезвычайно благоразумно, обратившись к разрешению более простой задачи - к сжижению углекислого газа, с тем, чтобы уточнить те различные обстоятельства, которые происходят при этом процессе. Разрешая эту задачу, кажущуюся очень несложной, он получил возможность шесть лет спустя создать общую теорию сжижения и развить идеи о последовательности жидкого и газообразного состояния тел. При первых же наблюдениях Эндрьюса, им были отмечены любопытные факты. Этот экспериментатор, при помощи давления, производил частичное сжижение газа, разделяя его на жидкую и газообразную части, которые затем подогревались до 31°С. При этой температуре все признаки существования жидкости и мениск ее исчезали, и пространство оказывалось занятым однородной материей, в которой при малейшем уменьшении давления или температуры появлялись какие-то струйки. Эндрьюс констатировал, что при превышении температуры, при которой состояние жидкости не отличается от газообразного состояния вещества, переход газа в жидкое состояние невозможен, кап бы ни было велико давление, под которым газ находится. Таким образом, при температуре выше 31°С углекислый газ приобретает свойства истинного постоянного газа. А ведь это дает основание предполагать, что и постоянство наших газов зависит от тех же причин и что их сопротивляемость сжижению есть тоже только вопрос температуры. Воодушевленный благоприятным началом, Эндрьюс предпринял более методичное и более полное изучение замеченного феномена и для этой цели сконструировал следующий аппарат. Тщательно откалибрированная трубка Т, вмазана в металлический сосуд А, снабженный винтовой нарезкой, по которой ходит безукоризненно уплотненный сальником винт V. Трубка и часть цилиндра заполнены углекислым газом; часть цилиндра свободная от газа заполнена ртутью, которая при ввинчивании винта V в цилиндр А действует на газ как поршень и перегоняет его мало-по-малу в калибрированную трубку. Вторая система А, Т, V заключает в себе ртуть и воздух и связана с первой посредством трубки С, проходящей ниже уровня ртути. Таким образом, углекислый газ и воздух в каждый данный момент подвержены равным давлениям, и так как воздух, в условиях опыта, достаточно точно подчиняется закону Мариотта, то трубка Т представляет собой ничто иное, как манометр с сжатым воздухом, показывающий в каждый данный момент то давление, которое он испытывает.
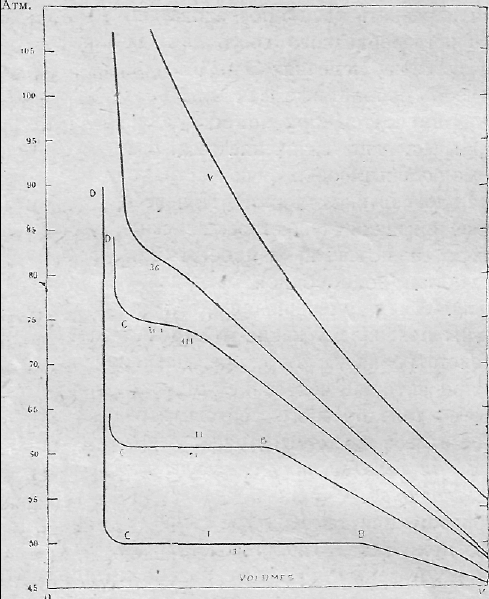
Кривые Эндрьюса для углекислого газа.
Результаты этих опытов изображены "на рисунке, в виде кривых, при чем по оси абсцисс отложены объемы, занимаемые углекислым газом, а по оси ординат -соответствующие давления. Каждая из кривых I, II, III, IV и V относится к ряду опытов, проведенных при одной и той же температуре. Оперируя вначале при довольно низких температурах, Эндрьюс получил те же результаты, что и его предшественники. Так, например, при 13,1°С объем последовательно уменьшается, при увеличении давления - до того момента пока последнее не дои дет до 50 атм. Эта фаза дает отрезок кривой, отмененный буквами АВ. В этот момент появляется первая капля жидкости. При дальнейшем ввинчивании винта V объем продолжает уменьшаться. Количество жидкости постепенно увеличивается, пока не наступит общее сжижение. Эта фаза дает отрезок ВС, который показывает, как это констатировал Эндрьюс, что во все время продолжающегося сжижения давление остается постоянным, а мы хорошо знаем, что так и должно быть, так как для сжижения нужно, чтобы давление только превысило строго определенную и постоянную при данной температуре упругость углекислого газа. Между прочим за время от начала до конца сжижения, происходит небольшое, равное 1,5 атм., увеличение давления, но эта аномалия должна быть отнесена за счет присутствия в углекислом газе следов воздуха, который, как мы это увидим при изучении сжижения газовых смесей должен оказывать именно такого рода влияние.
На кривой I отрезок ВО, соответствующий, как указывалось выше, фазе сжижения, параллелен оси абсцисс, а это наглядно показывает, что во время этого периода происходит уменьшение объема, а давление не увеличивается.
При давлении около 50 атм., все при той же температуре в 13,1°С, весь наш газ сжижится; с этого момента очень значительные увеличения давления смогут только очень немного уменьшить объем, так как жидкость становится при этой температуре очень мало сжимаемой; эту фазу показывает отрезок СП.
При 21°С характер процесса остается тем же. Здесь следует отметить, что отрезок А' В' более развернут, чем АВ, к, что для получения сжижения давление должно быть более повышенным, достигая величины равной, приблизительно, 60 атм. Как и в предыдущем случае сжижение полностью происходит при постоянном давлении, но можно констатировать, что объем при окончании сжижения несколько больше, чем при 13,1°С, что вполне понятно, раз мы имеем дело с более теплой жидкостью.
При 25°С, 30°С наблюдения дают те же результаты: весь газ переходит в жидкое состояние, но приходится по мере повышения температуры применять все большие, и большие давления. Кроме того, горизонтальная часть кривой, представляющая собой значительную величину в кривых, относящихся к 13,1°С и 21°С, все уменьшается и при 30°С становится совсем ничтожной; это показывает, что при этой температуре, в противоположность тому, что наблюдалось, например, при 13°С, почти не происходит сокращения объема в момент сжижения и из этого можно заключить, что к моменту сжижения газ имеет почти ту же плотность, как и образующаяся из него жидкость. Если теперь предпринять новый ряд опытов, но на сей раз при температуре в 31,1°С, то характер- происходящих при этом явлений. в корне изменится, и как бы велико ни было то давление, которому мы подвергнем газ, мы не сумеем получить ни одной капли жидкости. Строя на основании полученных при этих опытах данных кривую III, мы увидим, что вместо резко очерченных углов А1>0, получавшихся при более низких температурах, мы имеем почти плавную кривую. Эта кривая при давлении около 75 атм. становится почти горизонтальной, Происходящее в этой точке уменьшение объема хотя и требует увеличения давления, но это увеличение не является значительным. Таким образом, здесь наблюдается почти сжижение и казалось бы можно заключить, что конденсация неизбежна и что она, безусловно, наступит. Однако, эти надежды напрасны, так как эта сильная сжимаемость быстро проходит, и, как показывает характер кривой С’1>Е, которая с этого момента идет почти параллельно оси давлений, приходится оставить все мечты о сжижении, и дальнейшее увеличение давления будет только бесполезной затратой энергии.
Критическая точка и определяющие ее условия.
Итак, при 30°С наш газ полностью превратился в жидкость; при 31,1°С он с успехом противостоит всем нашим усилиям. Очевидно, между этими двумя пределами заключена точка, которую Эндрьюс так метко назвал критической точкой и которая для углекислого газа равна 30,9°С. Проделаем при помощи прибора Эндрьюса новую серию опытов, на этот раз при температуре 30,9°С. Мы заметим, что с исследуемым нами телом, которое безусловно следует классифицировать как газ, произойдут все те явления, которые в свое время, Каньяр де ля Тур установил для жидкостей: углекислота, находящаяся под сильным сжатием в 70 атм. может при очень незначительных изменениях давления или температуры, сразу, и полностью перейти из жидкого состояния в газообразное. Что касается кривой, изображающей явления, происходящие при 1~ 30,9°С то ее горизонтальная часть BС, которая, как мы уже указывали при 30°С становится очень незначительной, в данном случае представляет собой только точку, являющуюся точкой перегиба и соответствующую критическому объему. Касательная к кривой, проведенная в этой критической точке, горизонтальна и пересекает кривую. Вот все те интересные условия, которые определяют критическую точку углекислоты.
Прежде всего, это температура, выше которой невозможно превратить углекислоту в жидкость только одним давлением, независимо от величины последнего.
Следующее, это то, что при этой температуре материя без изменения объема переходит из газообразного состояния в жидкое или наоборот, и как следствие этого и в жидком, и в газообразном состояниях плотность остается неизменной.
Наконец, этим самым Эндрьюс подтвердил те выводы, которые в свое время сделал Менделеев: неотличимость газообразного от жидкого состояний объясняет, почему теплота испарения, постепенно уменьшающаяся вместе с увеличением температуры, в критической точке доходит до нуля, это показывает постепенное уменьшение, а затем и полное исчезновение силы сцепления частиц жидкости между собой.
Классификация газов по их сжижаемости.
Исключительные по своему значению выводы, полученные Эндрьюсом впредь до более обширного исследования, могли быть отнесены только к одной углекислоте. Сам Эндрьюс задался целью доказать, что эти выводы могут быть приложены и к окиси азота, и к хлористому метилу. После этого, а также и на основании предшествовавших опытов Каньяр де ля Тура, становилась весьма вероятной общность этих выводов для всех газов, согласно предвидения Фарадея; в этом, повидимому, секрет сжижения “постоянных” газов. Последующие события, как мы уже говорили, показали справедливость этого мнения. Из всего сказанного следует, что газы с точки зрения их сжижаемости могут быть разделены на две категории.
1. Газы, критические температуры коих выше нормальной температуры в нашем климате; каковы углекислота, критическая температура которой равна 31°С; ацетилен t = 37°С; хлор t = 140°С; сернистая кислота t = 155°С и т. д. Очевидно, что в обычных условиях эти газы находятся при температуре, которая ниже их критической, и нет ничего удивительного в -том, что при первых же попытках физиков прошлого века, Фарадея, Тилорье и других, им удалось сжижить эти фазы, применяя для этого только одно давление, достаточное для каждого отдельного случая.
2. Газы, критические температуры коих -ниже обычной температуры окружающей нас среды. Эти газы при обыкновенных для нашей планеты температурных условиях, всегда имеют температуру, .которая выше их критической температуры. В силу этого для их приведения в жидкое состояние, действия только одного давления будет всегда недостаточно и для их сжижения необходимо будет прибегнуть к помощи предварительного энергичного охлаждения ниже их критической температуры. Очевидно, газы, которым столь неосмотрительно была дана кличка “постоянных” принадлежат к этой категории. Эти газы характеризуются такими чрезвычайно низкими критическими температурами, о которых еще несколько десятилетий тому назад не имели даже представления.
Было установлено, что для кислорода, критическая температура равна -8°С (вспомним, что Фарадей производил свои опыты при температуре только немного более высокой при -110°С, для окиси углерода -136°С, азота -146°С, водорода -242°С и у гелия критическая температура равна поистине фантастической цифре в -268°С, вблизи от той предельной температуры в -273°С, которую физики на основании научных концепций определили, как крайний предел возможных температур, и которую они вследствие этого назвали абсолютным нулем. Таким образом, с очевидностью выясняется неизбежность участия чрезвычайно интенсивного охлаждения в сжижении перечисленных газов, а также становятся понятными причины неудач опытов тех физиков, которые возлагали свои надежды, главным образом, на безграничное увеличение давления. Следует отметить, что как только достигнуто охлаждение до критической температуры, постоянные газы начинают сжижаться под влиянием, сравнительно, незначительных давлений; так, для азота это давление равно 33 атм., для кислорода - 50 атм., для водорода - 20 атм. и для гелия - 2,75 атм.; если же газы охлаждены ниже критической температуры, то и эти скромные давления будут еще меньше. Таким образом, мы видим, что в деле сжижения газов, как и во всех других случаях надо было только знать, как взяться за дело и все те громадные давления, которые применялись учеными прошлого века при всяком случае, для данного дела были совершенно излишни.
Принадлежность газов к той или другой из двух указанных категорий целиком основана на той средней температуре, которую современные условия солнечной системы создали на нашей планете. Если бы мы жили на какой-нибудь из этих обледенелых планет, которые блуждают в пространствах нашей солнечной системы и на которых господствуют температуры от -200°С до -250°С, нам не пришлось бы классифицировать кислород и азот, как постоянные газы, так как при этих: температурах эти газы текли бы в виде жидкости в наших ручьях или образовали бы, как об этом говорит Лавуазье; “горы и скалы чрезвычайно плотного строения”. И только водород и гелий, и при этих условиях оставаясь в газообразном состоянии, для превращения в жидкость ожидали бы настойчивости своего Эндрьюса и изобретательности своего Кальете.
Классификация Эндрьюса.
Необходимо еще отметить, что Эндрьюс, пораженный чрезвычайным значением критической температуры газов, предложил очень логичное определение для газов и паров. По его определению газами в собственном смысле этого слова, являются вещества, при такой температуре, при которой они не переходят в жидкость под влиянием давления; все эти вещества находятся при температуре, которая выше их критической. Пары же могут переходить в жидкое состояние под влиянием только одного давления: другими словами это вещества, имеющие температуру ниже их критической. Следствием этого-определения является то, что единственными действительными газами являются постоянные газы. Все же остальные газы являются парами. Несмотря на всю логичность этого определения, мы не можем его принять, так как оно заключает в себе то неудобство, что противоречит всем нашим привычным понятиям, классифицируя, как пары большинство тел, которые мы считаем газами, например, углекислоту, сернистый ангидрид и т. п. Поэтому мы сохраним, как тоже очень логичное то определение, которое мы дали выше, и которое заключается в том, что понятия: газ и ненасыщенный пар являются синонимами. Что же касается названия “постоянный газ”, то мы его сохраним, как термин, но, конечно, не в том смысле, который он имел раньше.
