Рыбы открытого океана
| Вид материала | Документы |
- Казимир Малевич, я начало всего, 829.32kb.
- Конспект открытого урока биологии в 7 классе по теме: «класс хрящевые рыбы», 39.29kb.
- Урок-викторина по теме Животные. Класс рыбы, 75.59kb.
- Конспект открытого урока биологии в 7 классе по теме: «класс хрящевые рыбы», 48.22kb.
- Рельеф дна Мирового океана, 52.6kb.
- Урок биологии в 7 классе. Тема: «Внутреннее строение рыб», 112.94kb.
- Процессы и производственные линии замораживания продуктов растительного происхождения, 145.64kb.
- Тема урока Северный Ледовитый океан; особенности природы, хозяйственного использования,, 53.05kb.
- Магистерская специальность «Экономика ресурсов Мирового океана», 26.67kb.
- А. В. Клименко конкурсная документация по проведению открытого конкурс, 1840.42kb.
Особенно большую известность благодаря облигатном комменсализму молоди с плавающими на поверхности сифонофорами физалиями, яд которых опасен даже для человека, получил номей (Nomeus gronovii) (рис. 11), распространенный в теплых водах всех океанов. Пестрые мальки этого вида, имеющие яркие темно-синие пятна на серебристом теле, как правило, не встречаются вдали от сифонофор и получили в связи с этой особенностью поведения название «рыбы-пастушки». Пища физалий состоит из молоди рыб, которую они убивают стрекательными клетками, расположенными на ловчих шупальцах. Но маленькие номей относительно иммунны к токсину физалий, хотя и стараются при этом избегать непосредственного контакта с их щупальцами (известны, впрочем, и отдельные случаи поедания рыбок их опасными «хозяевами»). Несмотря на то что под сифонофорами отмечались лишь мальки и неполовозрелые особи длиной от 1 до 15 см, долгое время считалось, что сожительство номея и физалий имеет постоянный в течение всей жизни характер. Недавно было показано, однако, что взрослые рыбы этого вида живут самостоятельной жизнью, о чем свидетельствуют поимки большим пелагическим тралом экземпляров длиной до 35 см, резко отличающихся от более мелких однотонно-бурой окраской и совсем другими пропорциями тела.
Кубоглавы (род Cubiceps с 10 видами), обладающие очень длинными грудными плавниками, также обычны во всех районах, тропической и субтропической зон. Распространенный в Северо-Восточной Атлантике обыкновенный кубоглав (С. gracilis) в раннем возрасте держится у поверхности и часто ловится под медузами. Половое созревание наступает при достижении длины 20 см, но и после этого рост рыбы продолжается и максимальная длина достигает 1 м. Такие крупные особи живут в подповерхностных слоях. Другие виды кубоглавов значительно мельче: многие из них, например С. pauciradiatus, не превышают 20—25 см.
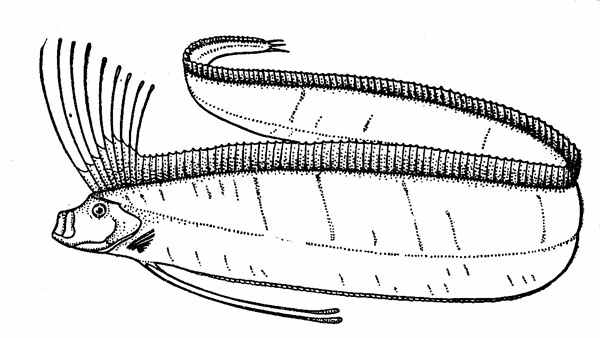
Рис. 12. Сельдяной король.
Некоторые представители рассматриваемого подотряда, например центролоф (Centrolophus niger), живущий в умеренно теплых водах Северной Атлантики и южного полушария, по мере роста существенно меняют глубину обитания. Мальки этого вида держатся у поверхности и, подобно другим строматеевидным, сопровождают крупных медуз. Они быстро растут (в аквариуме рыбка длиной 2 см всего за пять месяцев увеличила размер в 8,5 раз). Взрослые центролофы — однотонные черно-коричневые рыбы, длина которых достигает 1,2 м, — держатся только в нижних горизонтах эпипелагиали.
Для нижней эпипелагиали характерны и другие «полуглубоководные» рыбы, обитающие также в верхней мезопелагиали. В их числе следует упомянуть прежде всего представителей подотряда вогмеровидных (Trachipteroidei), включающего 9 родов (около 15 видов), в том числе сельдяных королей (Regalecus glesne) (рис. 12) и вогмеров (род Trachipterus). Для этих рыб характерен аллометрический рост, т. е. большая онтогенетическая изменчивость формы тела и относительных размеров его частей, и пот этому мальки, молодь и взрослые особи некоторых видов долго носили разные научные названия. Вогмеровидныв рыбы имеют удлиненное и плоское — ремнеобразное — тело, сужающееся к хвосту, и отличаются большой длиной (не менее 1м). Сельдяной король достигает в Северной Атлантике даже длины 5,5 м при массе порядка 250 кг (известны и случаи поимки рыб длиной 7—8 м), а лососевый король (Trachipterus altivelis) из северо-восточной части Тихого океана в возрасте 7—8 лет имеет длину 1,6 м и весит 4 кг. (При сходной в общих чертах форме тела соотношения этих цифр кажутся довольно странными, но они вполне соответствуют представлениям о пропорциональности массы рыб кубу их длины.)
Вогмеровидные — хищники, питающиеся разнообразными рыбами и беспозвоночными. Иногда они встречаются в косяках массовых промысловых видов, в частности сельди и дальневосточных лососей, которых, как считали в давние времена, ведут за собой (отсюда и название «короли», но на деле их связи с «подданными» имеют чисто гастрономический характер). Эти рыбы плавают обычно головой кверху, в положении, близком к вертикальному. При этом они поддерживают от опускания собственное тело, плотность которого больше, чем плотность воды, и поступательно перемещаются с небольшой скоростью за счет одних только ундулирующих движений длинного спинного плавника. Если нужно плыть быстрее, короли передвигаются, волнообразно изгибая свое длинное тело. У всех представителей подотряда тело окрашено в серебристо-белый цвет, на туловище, как правило, разбросаны короткие темные полосы и пятна, плавники у многих ярко-красные. Виды семейства лофотовых (Lophotidae) имеют своеобразный чернильный мешок, открывающийся в клоаку, и способны создавать маскирующую «дымовую завесу» подобно кальмарам и каракатицам.
Вероятно, встречи моряков с гигантскими сельдяными королями, плавающими у поверхности, были причиной многих историй о «морском змее», который в некоторых рассказах описывается как чудовище, имеющее лошадиную голову с развевающейся огненно-рыжей гривой. За такую гриву, видимо, принимали длинные лучи спинного плавника, образующие головной султан этой рыбы.
Еще одно нижнеэпипелагическое (или эпимезопелагическое) семейство — морские лещи (Bramidae) — также приурочено преимущественно к субтропическим и тропическим водам, хотя отдельные виды обитают и в сравнительно холодной зоне. Атлантический лещ (Вгата Ьгата), например, населяет Средиземное море и северную Атлантику и встречается при температуре 10—15°. В южной части области распространения он живет на глубине, а у его северных границ обычен и в поверхностном слое. Эта хищная рыба достигает длины 65—70 см и массы 6 кг и имеет, как и близкородственный северотихоокеанский лещ; (В. japonicus), некоторое промысловое значение. Среди более редких видов можно отметить серебряного морского леща (Pterycombus brama), рыбу с блестящим серебристым телом, желтыми грудными и иссиня-черными спинными а анальными плавниками; при этом оба вертикальных плавника сильно увеличены и имеют парусовидпую форму.
Рассматривая нижнеэпипелагических рыб, нельзя ни упомянуть еще один интересный вид — луваря (Luvarua imperialis), которого выделяют в особое семейство Luvaridae. Это семейство длительное время относили к скумбрие видным рыбам, но недавно было показано, что оно наиболее родственно, как это ни удивительно, прибрежным рыбам-хирургам (семейство Acanthuridae), обитающим главным образом на коралловых рифах. Луварь имеет удлиненное плоское тело и лобастую голову с крохотным ротиком. Он достигает 2 м в длину и весит до 150 кг, очень плодовит (47 млн ооцитов), его личиночные и мальковые стадии очень мало похожи на взрослых луварей. Основной пищей являются медузы и другие студенистые формы планктона, т. е. низкокалорийные объекты, и в связи с этим, как считают Д. Фитч и Р. Лавенберг, он обладает очень длинным кишечником (у метровой рыбы он составлял 92% длины тела). Луварь распространен во всех океанах, но всюду редок, и большинство поимок приходится на субтропическую зону.
Совершенно особую и очень своеобразную группировку в составе эпипелагического ихтиоцена представляют рыбы, ассоциированные с плавучими водорослями саргассами, которые обычно выносятся в океан с прибрежных мелководий, но кое-где (например, в Саргассовом море) существуют в замкнутых круговоротах без всякой связи с берегами. Помимо молоди некоторых океанических рыб (летучки, корифены) и рыб прибрежного происхождения, среди саргассов постоянно обитают два высокоспециализированных вида — морской клоун Histrio histrio (длина до 18 см) и пелагическая рыба-игла Syngnathus pelagicus (длина до 10 см). Внешний вид и окраска этих рыб, никогда не выходящих за пределы водорослевых кустов и скоплений (рис. 13), отлично маскируют их в саргассах, и их нелегко, обнаружить в этом укрытии, даже точно зная, что они скрываются там. Рыба-клоун привлекает добычу специальной приманкой своей «удочки» (первого луча спинного плавника) и заглатывает ее, быстро увеличивая объем ротовой полости при закрытом рте и открывая пасть, когда жертва оказывается прямо перед ней, — весь этот процесс укладывается в тысячные доли секунды.

Рис. 13. Рыбы, ассоциированные с плавучими водорослями.
Почти все рыбы, перечисленные выше, живут в эпипелагиали постоянно — со времени появления на свет до конца своего существования. Таких рыб предложено называть голоэпипелагическими и противопоставлять их видам меропипелагическим, в обязательном порядке проводящим в верхних горизонтах открытого океана лишь определенную часть своего жизненного цикла, и ксеноэпипелагическим, представляющим собой более или менее случайный элемент в поверхностном слое (см. рис. 14) ( «Голос» по-гречески - весь, целый, «мерос» - часть, доля, «ксенос» - чуждый.).

Рис. 14. Основные группировки рыб эпипелагиали.
В 1964 г. директор Института океанологии В. Г. Корт поставил перед сотрудниками задачу обобщить в коллективной монографии все сведения о природе Тихого океана, накопленные к тому времени. Мне было поручено свести воедино то, что было известно об эпипелагических рыбах, которые тогда изучались советскими экспедициями (напомню, что в дальнем океане в те времена фактически работал один «Витязь») в очень узких рамках — в открытых водах проводились только световые станции и сборы ихтиопланктона. В отношении наиболее массовых и соответственно наиболее интересных для промысла видов - тунцов, марлинов и других - пришлось использовать только литературные данные. Эта компилятивная работа приносила мне мало удовлетворения (особенно на ее начальном этапе), но именно она заложила основы моих представлений о сложной структуре «композитного» океанического ихтиоцена. После выхода в свет многотомника «Тихий океан», который получил высокую оценку (группе его авторов была присуждена Государственная премия СССР), я значительно расширил свои главы, дополнил их сведениями по другим океанам и. подготовил монографию «Ихтиофауна океанской эпипелагиали», которая стала моей докторской диссертацией. Ее основные положения вошли в эту книгу но, конечно, в значительно видоизмененном изложении: за 20 лет, прошедших со времени ее опубликования, изучение рыб открытого океана очень сильно продвинулось вперед, да и сам я стал по-иному смотреть на многие вещи. Сейчас, например, я никак не дал бы той книжке ее старого названия (ведь в ней речь идет не столько о «фауне», сколько о «таксоцене»), отказался бы от ненужного, как вижу теперь, придумывания новых, порой труднопроизносимых терминов для обозначения отдельных экологических группировок рыб, внес бы многочисленные коррективы в биологические характеристики отдельных видов. Впрочем, «что написано пером, того не вырубишь топором»...
Итак, по числу видов временные обитатели эпипелагиали не уступают голоэпипелагической группе. Некоторые из них достигают в отдельных районах океана очень высокой численности и биомассы.
Все мероэпипелагические рыбы используют эпипелагиаль посредством замкнутых миграционных циклов. Именно этой особенностью они достаточно четко отличаются от ксеноэпипелагических рыб, не совершающих регулярных и целенаправленных перемещений между эпипелагиалыо ц другими биотопами. Большинство ксеноэпипелагических видов нормально обитают в неритической зоне, но, попав за ее пределы, они способны долго существовать (по-видимому, не размножаясь) и в практически неограниченном удалении от берегов. В качестве примера можно упомянуть хотя бы представителей трех семейств отряда сарганообразных — парусноперую летучую рыбу Parexocoetus brachypterus (семейство Exocoetidae), длинноносого полурыла Euleptoramphus viridis (Hemiramphidae), лентовидного саргана Ablennes hians (Belonidae), которые, являясь по своему существу неритическими, могут быть встречены в любой точке тропического океана. В северной части Тихого океана, в Баренцевом и Черном морях на большом расстоянии от берега можно наблюдать трехиглую колюшку, или колючку (Gasterosteus aculeatus),— обычного обитателя наших рек, озер и прибрежных морских вод. К этой же группе следует отнести и тех прибрежных альгофильных рыб, которые встречаются в тропической эпипелагиали вместе с плавающими водорослями или другими дрейфующими предметами берегового происхождения, например крокодилового саргана (Tylosurus crocodilus), пятнистого спинорога (Canthidermis maculatus), абудефдуфа (Abudef-duf saxatilis), терапона (Therapon theraps), чаба (Kypho-sus cinerascens). Как показал Б. И. Федоряко, эти и некоторые другие рыбы, будучи вынесенными в открытые воды еще на мальковой стадии, прекрасно чувствуют себя и вдали от берегов, там, где преобладающее большинство прибрежных рыб гибнет очень быстро. Способность к долгому выживанию в эпипелагиали, несомненно, содействует широкому расселению ксеноэпипелагических видов, для которых не существует барьеров в виде открытоводных пространств любого протяжения. Многие из них имеют поэтому циркумглобальные ареалы.
Временные обитатели эпипелагиали проникают в нее либо снизу — из глубинных вод, либо «сбоку» — из неритической зоны и с прибрежных мелководий. При этом мероэпипелагические глубоководные рыбы появляются в эпипелагиали лишь ночью (здесь речь идет только о взрослых особях), когда опи поднимаются вверх в ходе регулярных суточных миграций, а перед рассветом вновь уходят на глубины. К этой никтоэпипелагической группе принадлежат уже упоминавшиеся мельком приповерхностные светящиеся анчоусы и змеиные макрели, а также некоторые карликовые акулы и отдельные представители типичных мезопелагических семейств, о которых пойдет речь в следующей главе. Следует отметить, однако, что в отсутствие резкого температурного градиента между приповерхностными и глубинными водами (это характерно для внетропической зоны) обособленность эпи- и мезопелагической группировок рыб выражена значительно слабее, чем в районах с хорошо развитым термоклином, представляющим собой препятствие для вертикальных мигрантов.
Мероэпипелагические рыбы прибрежного происхождения, которые встречаются в открытых водах только в период нагула, по размножаются у берегов или даже в пресных водах, составляют очень характерный элемент населения эпипелагиали. Они нередко образуют значительную биомассу, в некоторых районах соизмеримую с биомассой постоянных обитателей эпипелагиали или даже превышающую ее. Типичными представителями этой группировки являются, в частности, настоящие (род Salmo) и тихоокеанские (Oncorhinchus) лососи. Представители последнего рода — кета, горбуша, нерка, кижуч, чавыча, сима — эндемичны для бассейна северной части Тихого океана и в период нагула являются наиболее массовыми рыбами поверхностного слоя на огромной акватории — от Берингова моря до 40° с. ш. Тихоокеанские лососи образуют многочисленные репродуктивные стада, нерестящиеся в реках дальневосточного побережья Азии (на юг до п-ова Корея и Японии; жилая форма нерки есть даже на о-ве Тайвань) и Северной Америки (до Калифорнии). Ареалы таких стад в открытом океане в значительной степени перекрываются, и между 165° в. д. и 155° з. д. даже азиатские и американские лососи встречаются совместно. Длительность морского периода жизни у разных видов неодинакова — от 1,5 лет у горбуши до 4—7 лет у чавычи, наиболее крупного вида, иногда достигающего 50 кг. Они питаются среднеразмерными и крупными планктонными животными — ракообразными, крылоногими моллюсками, молодью кальмаров и рыб. Границы морских ареалов тихоокеанских лососей претерпевают значительные сезонные изменения, однако даже в зимний период область их распространения не простирается за пределы субарктических вод.
Атлантическо-скандинавская (так называемая океаническая) сельдь (Clupea harengus) размножается в прибрежных водах Норвегии и Исландии, откладывая клейкую икру на водоросли, а в период нагула ведет пелагический образ жизни вдали от берега. В годы хорошего состояния запасов она совершает довольно протяженные миграции в открытую часть Северной Атлантики и достигает Баренцева моря, Шпицбергена, Гренландии (сейчас численность этого вида находится в состоянии депрессии). Примерно в этом же районе в современный период происходит нагул северной путассу (Micromesistius poutassou) — стайной рыбы семейства тресковых (Gadidae), размножение которой также ограничено склонами мелководий в неритической зоне.
Самая большая из хищных рыб Южного океана — антарктический клыкач (Dissostichus mawsoni) размножается у берегов Антарктиды, где держится и подрастающая молодь длиной до 1 м, тогда как более крупные (до 1,8 м) половозрелые рыбы, как было показано В. Л. Юховым, совершают долговременные миграции в пелагиаль, удаляясь па расстояние до 900 миль от материка. Такое распространение клыкачей было установлено по их нахождениям в желудках кашалотов, питающихся преимущественно на глубине 100—1000 м, что дало основание относить эту рыбу к временным обитателям мезопелагиали. Может быть, это действительно так, но, учитывая недостаточность имеющихся данных, нет оснований признавать строго обоснованным тезис об отсутствии клыкача в поверхностных горизонтах.
Другая группа мероэпипелагических видов представлена в эпипелагиали только ранними стадиями развития (вплоть до мальков). Для всех этих видов, живущих во взрослом состоянии в неритической пелагиали или у дна, прохождение эпипелагической стадии в онтогенезе является необходимой и неизбежной фазой жизненного цикла. Будучи хорошо адаптированными к весьма длительному пребыванию в толще воды, такие мальки нередко встречаются в огромном удалении от берегов и сохраняют шансы на благополучное возвращение в прибрежную зону, хотя значительная их часть, конечно, обречена на неизбежную гибель в открытых водах.
Разделение эпипелагических рыб открытого океана между голо-, меро- и ксеноэпипеелагической группировками, как правило, достаточно очевидно, хотя не абсолютно — как обычно, желание разложить природное разнообразие по полочкам вступает в противоречие с практикой жизни. Так, многие виды крупных акул (в частности, кархародон и тигровая), большая барракуда (Sphyrae-na barracuda), ауксиды, полосатый и желтоперый тунцы, ваху, большая корифена, по-видимому, в той или иной степени обычны и в неритической зоне, и в открытых водах (часто их называют нерито-океаническими). Не во всех случаях при современной степени экологической изученности можно четко разграничить мероэпипелагических и ксеноэпипелагических рыб.
Полный перечень отрядов, семейств и родов, представленных в эпипелагиали открытого океана, приводится ниже. Для каждого из родов указаны в скобках число эпипелагических видов и их принадлежность к числу постоянных (Г), временных (М) и случайных (К) обитателей биотопа (виды, представленные в эпипелагиали только молодью, не учтены).
Систематический состав эпипелагического ихтиоцена
Отряд миногообразные (Petromyzontiformes). Сем. миноговые (Petromyzontidae): Geotria (1 К).
Отряд катранообразные (Squaliformes). Сем. катрановые (Squalidae): Euprotomicrus (1 М); к числу мигрирующих ночью из мезопелагиали или живущих на стыке мезо- и эпипелагиали относятся еще 9 видов из 6 родов — Isistius, Squaliolus, Euprotomicroides и др. Отряд воббегонгообразные (Orectolobiformes). Сем. китовые акулы (Rhiniodontidae): Rhmiodon (1 Г).
Отряд ламнообразные (Lamniformes). Сем. ложнопесчаные акулы (Pseudocarchariidae): Pseudocarcharias (1 Г); лисьи акулы (Alopiidae): Alopias (1 Г и 2 К); большеротые акулы (Megachasmidae): Megachasma (1 К); гигантские акулы (Cetorhinidae): Cetorhinus (1 К); сельдевые акулы (Lamnidae): Lamna (2 Г); Isurus (2 Г), Carcharodon (1 К). Отряд кархаринообразные (Carcharhiniformes). Сем. серые акулы (Carcharhinidae): Carcharhinus (2 Г и 5-6 К), Prionace (1 Г), Galoocerdo (IK); молотоголовые акулы (Sphyrnidae): Sphyrna (3 К). Отряд хвостоколообразные (Myliobatiformes). Сем. скаты-хвостоколы (D аsyatidae): Dasyatis (1 Г); мантовые скаты (Моbulidaa): Mania (1 К).
Отряд гнюсообразиые (Torpediniformes). Сем. гнюсовые (Torpedinidae): Torpedo (2-3 К).
Отряд угреобразные (Anguilliformes): Сем. змеехвостые угри (Ophichthyidae): Benthenchelys (1 Г). Отряд сельдеобразные (Clupeiformes). Сем. сельдевые (Clupeidae): Clupea (1 M), Sardinops (1 К); анчоусовые (Еngraulidae); Stolephorus (1 Г), Engraulis (1 К). Отряд лососеобразиые (Salmoniformes). Сем. лососевые (Salmonidae): Oncorhynchus (5 M), Salmo (3 M). Отряд стомиеобразные (Stomiiformes). Сем. фотихтовые (Photichthyidae): Vinciguerria (2 M); астронестовые (Astronesthidae): Astronesthes (1-2 M). Отряд аулопообрэзиые (Aulopiformes). Сем. алепиэавровые (Alepisauridae): Alepisaurus (2 К); кинжалозубовые (Anotopteridae): Anotopterus (1 К), веретенниковые (Paralepididae): Paralepis и др. (3—4 К). Отряд миктофообразные (Myctophi formes). Сем. миктофовые (Myctophidae): Electrona (2 M), Benthosema (1 Г), Hygophum (2 M), Myctophum (13 M), Symbolophorus (около 10 M), Loweina (4 M), Tarletonbeania (1 M), Gonichthys (4 M), Centrobranchus (4 M). Отряд трескообразиые (Gadiformes). Сем. тресковые (Gadidae): Micromesistius (2 МЭн).
Отряд удильщикообразные (Lophiiformes), Сем. рыбы-клоуны (Antennariidae): Histrio (1 Г). Отряд capганообразные (Beloniforraes). Сем. летучие рыбы (Ехосоеtidae): Parexocoetus (1 К), Exocoetus (3 Г), Prognichthys (4 Г и 1 К), Cypselurus (5-6 К), Cheilopogon (5 Г и 10-12 К), Hirundichthys (3 Г и 3 КЭи);полурыловые (Hemiramphidae): Oxyporhamphus (2 Г), Euleptorhamphus (2 К); сарга новые (Belonidae): Platybelone (1 К), Ablennes (1 К), Tylosurus (2 К); макрелещуковые (Scomberesocidae): Scomberesox (1 Г), Cololabis (1 Г), Nanichthys (1 Г), Elassichthys (1 Г). Отряд опахообразные (Lampridiformes). Сем. опаховые (Lampridae): Lampris (2 Г); лофотовые (Lophotidae): Lophotus (1 Г), Eumecichthys (1 Г); радицефаловые (Radiicephalidae): Radiicephalus (1 Г); вогмеровые (Тrасhiptоridae): Trachipterus (5Г), Desmodema (2 Г), Zu (2Г); ремень-рыбы (Regalecidae): Regalecus (1 Г), Agrostichthys (1 Г).
Отряд колюшкообразные (Gasterosteiformes). Сем. колюшковые (Gasterosteidae): Gasterosteus (1 К); рыбы-иглы (Syngnathidae): Syngnathus (1 Г). Отряд екорпенообразмме (Scorpaeniformes). Сем. пипагоровые (Сус1орtегidае): Pelagocyclus (1 Г), Cyclopterus (1 К). Отряд окунеобразные (Pcrciformes). Сем. ставридовые (Carangidae): Elagatis (1 Г), Naucratus (1 Г), Decapterus (2-3 К), Trachurus (2-3 К); рыбы-прилипалы (Есhеnеidае): Phtheiricbthys (1 Г), Remoга (5 Г), Remorina (1 Г); корифеновые (Соrурhaenidae): Coryphaena (2 Г); морские лещи (В га mid а с): Таrасtes (2 Г), Brama (6 Г), Taractichthys (2 Г), Pterycombus (2 Г), Ptoraclis (3 Г); нототениевые (Nototheniidae): Dissostichus (2 M), Pleuragrainma (1 К), Paranotothenia (1 К); и костеевые (Icosteidae): Icosteus (1 Г); лунарепые (Luvari- Jae): Luvarus (1 Г); барракудовые (Sрhуrnidae): Sphyrna (1 К); темнило вые (Gеmруlidae): Lepidocybium (1 К). Ruvettus (1 К), Gempylus (I M); скумбриевые (Sсоmbr idae): Gasterochisma (1 Г), Scomber (2 К), Acanthocybium (1 ГЭв), Allolhunnus (1 Г), Auxis (2 Г), Euthynnus (2 КЭп), Katsuwonus (1 Г), Thunnus (7 Г); меч-рыбы (Xiphiidae): Xiphias (1 Г); парусников ые (Istiophoridae): Istiophorus (1 К), Makaira (3 Г), Tetrapterus (5 Г); центролофовые (Сentrolophidae): Centrolophus (1 Г), Icichthys (1 Г), Pseudoicichthys (1 Г), Tubbia (1 Г), Schedophilus (5 Г); амарсиповыэ (Amar sipida e): Amarsipus (1 Г); номе ев ые (Nоmоidae): Cubiceps (9 Г), Nomeus (1 Г), Psenes (6 Г); алетовые (Tetragonuridae): Tetragonurus (3 Г). Отряд скалозубообразныс (Tetraodontif ormes). Сем. спи пороговые (Balistidae): Canthidermis (1 Г), Balistes (1 К), Xanthichthys (2 К); ска л о зубовые (Tetraodontidae): Lagocephalus (1 Г); ежи-рыбы (Diodontidae): Diodon (1 Г + 2 К); рыбы-луны (Мо1idae): Ranzania (1 Г), Masturus (1 Г), Mola (2 Г).
Следует особо остановиться на периодически происходящих в разных районах и иногда продолжающихся несколько лет подряд массовых выходах в открытую пе-лагиаль стайных неритических рыб. Такие выходы отмечены как в тропической зоне (в тепловодной Атлантике, например, в последние годы резко увеличилась численность серого спиноорога Balistes carolinensis, который стал вполне обычным и в открытом океане), так и в умеренных водах, для которых они особенно характерны. В качестве примеров, кроме уже упомянутых «океанической сельди» и путассу, нужно назвать японского анчоуса (Engraulis japonicus), сардинопсов (подвиды Sardinops sagax, включая иваси) и особенно скумбрию (Scomber japonicus) и ставрид из группы Trachurus picturatus (рис. 15). Все они принадлежат к числу видов, характеризующихся периодическими крупномасштабными изменениями численности (своего рода ритмическими «приливами» и «отливами» волн жизни), в основе которых, как считают В. П. Шунтов и другие исследователи, лежит ритмичность климатических процессов, в свою очередь определяемая космофизическими циклами (в частности, солнечной активностью). Fix выходы в открытый океан всегда связаны с временным увеличением численности неритической популяции (или популяций) в области ее (их) нормального обитания.
Можно полагать, что выселению популяционного «избытка» в океан предшествует увеличение размаха двусторонних (нагульно-нерестовых) миграций, которые имеют некий предел дальности и становятся необратимыми при его превышении. Первоначально происходит, по-видимому, расширение нагульной части ареала во всех возможных направлениях — не только вдоль берегов (так обычно ориентированы нормальные сезонные миграции умеренноводных неритических рыб), но и от них — в открытые воды океана (увеличение площади нерестовой области в большей степени лимитируется консервативными требованиями вида в репродуктивный период). Пока эти миграции сохраняют двусторонний характер, часть популяции, находящаяся за пределами неритической зоны, должна считаться мероэпипелагической, однако у некоторых видов при большом росте численности стайные группы, достаточно далеко удалившиеся от традиционных миграционных путей, оказываются неспособными вернуться обратно. Эта часть популяций переходит тем самым в ксеноэпипелагическую категорию. Постоянно пополняясь за счет новых выселений из неритической зоны, она остается в океане вплоть до естественного вымирания (элиминации), если только не попадет в новые неритические районы или же в такие участки открытого океана, в которых условия среды окажутся благоприятными хотя бы для питания и роста, а в наиболее удачном варианте также для созревания, нереста и выживания на ранних стадиях жизненного цикла. Такие участки (я называю их «псевдонеритическими»), как правило, оказываются приуроченными к биологически продуктивным районам вблизи островов и поднятий или у зон конвергенции и дивергенций течений. В соответствии с возможными различиями условий среды в новых участках могут образовываться три типа популяционных группировок: 1) псевдопопуляции, не способные к нормальному воспроизводству и существующие только за счет пополнения извне; 2) временные зависимые популяции, которые могут существовать при отсутствии пополнения из исходной самовоспроизводящейся популяции лишь до тех пор, пока сохраняется благоприятная обстановка; 3) новые самостоятельные популяции.
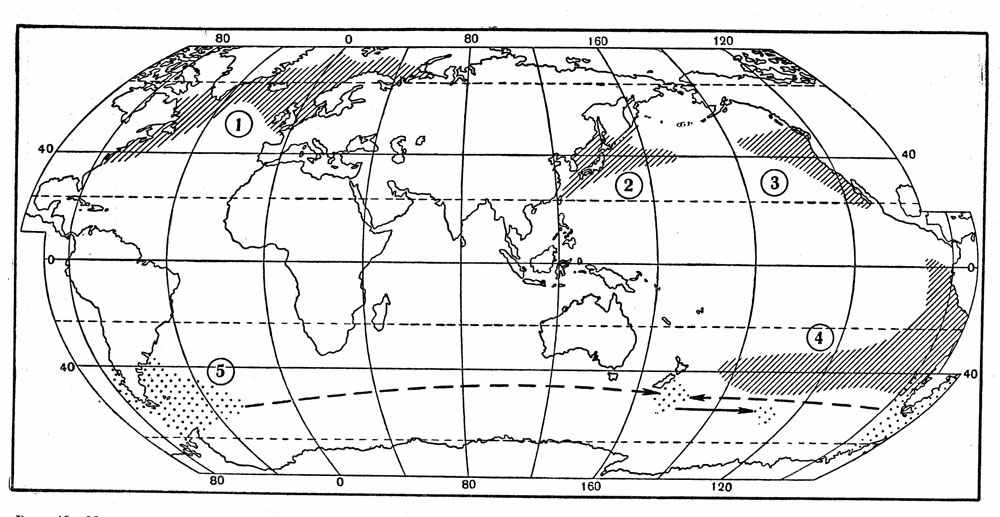 Рис, 15. Максимально расширенные ареалы псевдонеритических рыб — атлантической сельди (1), сардины иваси и дальневосточной скумбрии (2), калифорнийской (3) и перуано-чилийской ставриды (4) и возможные пути расселения южной путассу (3).
Рис, 15. Максимально расширенные ареалы псевдонеритических рыб — атлантической сельди (1), сардины иваси и дальневосточной скумбрии (2), калифорнийской (3) и перуано-чилийской ставриды (4) и возможные пути расселения южной путассу (3).В двух последних случаях вид может рассматриваться как временно или постоянно обосновавшийся в том или ином конкретном участке открытого океана. Примеры, иллюстрирующие сказанное, ограничиваются, к сожалению, данными за самые последние десятилетия, так как имеющиеся ряды наблюдений очень коротки. Большая часть этих примеров относится к Северной Пацифике.
Известно, что в период высокой численности японского анчоуса и японской скумбрии в 50-е годы оба вида были весьма обычными и в открытых водах северо-западной части Тихого океана, в которых предполагалось даже существование их особых «стад» — в действительности, по всей вероятности, псевдопопуляций. В этом же районе в период высокой численности сардины иваси (Sardinops sagax melanosticta) в 30-е годы ее ареал расширялся вплоть до южной части Берингова моря (наблюдения в открытом океане отсутствовали), а современный подъем численности, начавшийся в 70-е годы (за первые 5 лет роста запас возрос не менее чем вдвое), привел к расширению области распространения в восточном направлении вплоть до центральной части океана, где, судя по некоторым сведениям, также образовывались временные псевдопопуляции. У японской скумбрии, как показано В. А. Беляевым, усиление воспроизводства на нерестилищах в прибрежной зоне Японии в середине 70-х годов привело к заселению океанических участков и формированию в районе Северо-Западного подводного хребта (гора Кинмей и прилегающие воды) зависимой популяции псевдонеритического типа: в 1978—1981 гг. скумбрия наблюдалась там на всех фазах жизненного цикла (икра, личинки, мальки, сеголетки).
Интересный материал для размышлений представляют сведения по биологии и распространению двух восточнотихоокеанских видов ставрид из группы Trachurus picturatus. Размножение калифорнийской ставриды (Т. symmetricus simmetricus) было отмечено по нахождениям икры и личинок в зоне 40-х параллелей северного полушария в 1955г. в удалении до 1100 миль, а в 1972 г.— до 600 миль от берегов Северной Америки. Аналогичным образом нерест перуанско-чилийской ставри-ды (Т. s. murphyi) в 40-х широтах южного полушария отмечен в 1985 г. С. А. Евсеенко на огромном расстоянии (около 3000 миль) от побережья Чили. Никаких свидетельств в пользу результативности такого нереста, впрочем, не существует, так как в этих океанических участках — у крайних границ своего распространения на запад — оба вида представлены, судя по имеющимся данным, только очень крупными особями длиной 45—60 см (там нет ни мальков, ни сеголетков, ни созревающих рыб, а созревает ставрида в возрасте 2—3 лет). Таким образом, ати факты могут трактоваться лишь как доказательства существования временных псевдопопуляций (маловероятным представляется даже обособление зависимых популяций), которые не только существуют за счет постоянного пополнения из прибрежного запаса, но и являются фактически его излишком. Выселение перуанской ставриды в океан вполне объяснимо ростом ее численности в неритической зоне. Так, согласно рыбопромысловой статистике ФАО (Продовольственная и сельскохозяйственная организация ООН), уловы этого вида в прибрежных водах Перу и Чили (они, видимо, отражают и истинную численность ставриды) увеличились со 100 тыс. т в 1970 г. и 300—400 тыс. т в 1974—1976 гг. до 1100—1300 тыс. т в 1978—1980 гг., а в открытом океане эта рыба была обнаружена в 1978 г.
Какой же биологический смысл могут иметь безвозвратные уходы прибрежно-пелагических рыб от родных берегов? Какую выгоду получает неритическая популяция, посылая на гибель в открытом океане большие группы «лишних» особей? Такая постановка вопросов представляется не совсем корректной (ибо отнюдь не все в живой природе имеет прямое приспособительное значение), но ответ на них все-таки существует: в результате таких выселений появляется потенциальная возможность расширить видовой ареал, включив в него новые неритические участки, лежащие за «барьером» открытоводных просторов.
То, что я написал здесь, еще два-три года назад показалось бы очень спорным большинству моих коллег-ихтиологов. Обнаружение ставриды в юго-восточной части Тихого океана далеко за пределами перитической зоны, в которой ей, казалось бы, полагалось пребывать, послужило основой для рассуждения об особых океанических популяциях этой рыбы, совершенно самостоятельных и не имеющих никакого отношения к прибрежным группировкам своего вида. Высказывались даже предположения о существовании своего рода «ставридного пояса», сплошным кольцом опоясывающего земной шар в районе «ревущих сороковых» широт южного полушария, и специально посланные суда искали там (да и в других участках открытого океана) «большую рыбу» — обособленные популяции массовых прибрежных видов. Мои представления (а я неоднократно излагал их в докладах на разных ученых собраниях и просто в разговорах с товарищами по профессии) не встречали тогда особой поддержки, хотя не удостаивались и критики. Сейчас, однако, оппонентов этим взглядам практически не осталось, и обо всей этой истории можно было бы и не упоминать, если б не одно важное обстоятельство, на которое хочется обратить специальное внимание: ведь если все так, как здесь написано, то рассчитывать на неограниченно долгое существование той же перуанско-чилийской ставриды в дальнем океане не приходится. Цикличность процесса неизбежно предполагает грядущий спад численности и даже почти полное исчезновение этой рыбы из открытых для международного рыболовства вод. Правда, в те же сроки в каких-то иных участках Мирового океана могут появиться псевдопопуляции других видов. Прогнозировать ход этих пульсационных процессов — одна из важнейших, на мой взгляд, задач прикладной рыбохозяйственной науки.
В целом возникновение новых самостоятельных популяций неритических видов в результате выселения в открытый океан представляется довольно маловероятным событием, но именно этим способом, по-видимому, возникли «баночные» популяции некоторых рыб, в частности ставриды (Т. picturatus) и рыбы-сабли (Lepidopus caudatus), на подводных поднятиях северо-восточной Атлантики в районе Азорских островов. Современный прерванный ареал южной путассу (Micromesistius australis), обитающей сейчас в неритических водах Патагонии и Новой Зеландии (см. рис. 15), также может быть объяснен расселением из Атлантического океана в зоне южных 50-х широт, что могло сопровождаться образованием и исчезновением на пути следования зависимых популяций такого типа, как существующая ныне, по данным В. П. Шпака, в районе подводных гор Южно-Тихоокеанского поднятия на 130° з. д.
Проникновение прибрежно-пелагических видов в открытые воды не может быть причиной того, чтобы подвергать сомнению реальность обособленности неритнческих и океанических ихтиоценов пелагиали. Это явление (как и обратный процесс) наглядно демонстрирует, однако, динамичность биологической структуры эпипелагиали, подверженной сильному влиянию климатических факторов.
Как видно из всего сказанного, эпипелагические рыбы довольно разнообразны по экологии и образу жизни. Их изучение в этих аспектах еще далеко от завершения, но уже сейчас довольно отчетливо просматриваются некоторые общие закономерности, дающие представление об основных экологических характеристиках ихтиоцена и взаимоотношениях слагающих его видов. Эти закономерности представляют немаловажное значение для исследования биологической продуктивности океана, в частности, для изучения проблем, связанных с перераспределением органического вещества.
Размножение. Вполне естественно, что голоэпипелагические рыбы, живущие в полном отрыве от твердого субстрата, имеют пелагические икринки, проходящие развитие в толще воды, но, как уже говорилось, из этого правила есть исключения. Некоторые сарганообразные рыбы, а именно сайры и «четырехкрылые» летучки из родов Cheilopogon и Hirundichthys, подобно многим неритическим представителям своего отряда, откладывают клейкую икру на твердый субстрат, плавающий у поверхности. Икра других сарганообразных (полурыла Охурог-hamphus, «двукрылых» летучих рыб, макрелещуки) развивается в планктоне, однако общей особенностью эмбрионального развития всей этой группы служит его большая продолжительность (одна-две недели). Большая длительность эмбриогенеза отмечена также у сельдяных королей и их родичей. У остальных эпипелагических рыб развитие икринок заканчивается в очень короткий срок, особенно в тропических водах (у большеглазого тунца, например, оно продолжается при температуре воды 28— 29° всего 21 час).
Плодовитость эпипелагических рыб, как правило, очень велика. Только у миктофид (их длина, напомним, редко превышает 10 см), летучих рыб и макрелещуковых она исчисляется тысячами икринок, тогда как крупные рыбы поверхностного слоя продуцируют икру миллионами и десятками миллионов. В качестве примера можно указать, что змеиная макрель и ауксида выметывают до 1 млн икринок, полосатый тунец — до 2 млн, большеглазый тунец и ваху — по 6 млн, синий тунец — 10 млн, меч-рыба — 16 млн, сельдяной король — не менее 20 млн, лу-варь — 47 млн, большой синий марлин — почти 100 млн, рыба-луна — даже 300 млн икринок. Для преобладающего большинства эпипелагических рыб характерна порционность икрометания, приводящая к большой растянутости сроков нереста. В тропических водах в связи с относительным постоянством условий среды размножение может идти даже круглогодично (например, у летучих рыб и тунцов). Высокая плодовитость и ускоренное прохождение ранних стадий индивидуального развития направлены у костистых рыб на компенсацию огромной смертности икры и личинок при полном отсутствии родительской заботы о потомстве. В отличие от них все эпипелагические акулы и скаты (имеется в виду пелагический хвостокол — Dasyatis violacea, принадлежащий к числу постоянных обитателей открытого океана) относятся к яйцеживородящим или живородящим видам и приносят немного (от 2 до 100) крупных детенышей, почти не имеющих врагов.
Рост и возраст. Для эпипелагических рыб очень характерен быстрый рост и, как его следствие, раннее наступление половой зрелости. Аквариальные наблюдения показали, например, что малек сайры длиной 6 см через полгода достиг 20 см, а малек Psenes maculatus (семейство Nomeidae) длиной 7,5 см за три месяца вырос до 28 см (при массе 775 г). Сейчас известно, что самые мелкие из рыб поверхностного слоя —летучки рода Ехоcoetus и сайра — достигают половозрелости уже к концу первого года жизни, а предельная продолжительность их существования не превышает 1,5—2 лет. Быстрым ростом в течение морского периода жизни отличаются лососи. Горбуша, например, возвращающаяся на нерест в двухлетнем возрасте, за полтора года, проведенных в эпипелагиали, увеличивает длину от 3—5 см в момент ската из рек до 42—53 см (при массе 0,9—1,9 кг). Змеиная макрель живет 5 лет, морской лещ — около 8 лет. К особенно быстро растущим рыбам относятся тунцы, меч-рыба и марлины, годовой прирост которых составляет 20— 40 см. Желтоперый тунец впервые мечет икру в возрасте 2—3 лет, большеглазый — в 3 года, длинноперый — в 4—5 лет, меч-рыба — в 5—6 лет, а продолжительность их жизни не превышает 8—10 лет. К числу долгожителей эпипелагиали принадлежат, по-видимому, акулы: наибольший возраст синей акулы достигает по меньшей мере 20 лет, а сельдевой, возможно, и 30 лет.
Питание. В трофическом отношении все эпипелагические рыбы разделяются на две большие группы — мирных планктофагов и хищников (преимущественно ихтиофагов). При этом рыб, питающихся исключительно мелким планктоном, в эпипелагиали открытого океана сравнительно немного. Наибольшей численности среди них достигают голоэпипелагические макрелещуковые и летучие рыбы, а также мероэпипелагические светящиеся анчоусы в выходящие в открытые воды рыбы прибрежного происхождения — лососи, сельдевые, ставриды, скумбрии, тресковые, возможно, нототениевые. К этой группе относятся, естественно, и все планктонные личинки и мальки рыб, которые могут использовать в пищу даже фитопланктон. Почти у всех эпипелагических планктофагов пищевые спектры очень широки, а локальные и сезонные изменения состава их пищи определяются в значительной степени только наличием доступных кормовых объектов. Редкий пример избирательного питания показывают, однако, строматеевидные рыбы (номеи, кубоглавы и др.) и луварь, основным объектом потребления которых служат мягкотелые беспозвоночные — оболочники (сальны и пиросомы) и кишечнополостные (медузы, гребневики, сифонофоры), на 99% состоящие из воды. Для измельчения этого корма у строматеевидных имеется даже специальный орган — снабженные внутри острыми зубами мешковидные выросты с обеих сторон глотки позади жаберных дуг. Возможно, впрочем, непосредственным источником питания рыб служит в этих случаях непереваренная пища их жертв.
Большинство рыб эпипелагиали относится к числу хищников, пищей которых являются рыбы, кальмары и крупные ракообразные. Размеры добычи в значительной степени определяются величиной самого хищника, а состав пищи меняется в зависимости от специфики участка или горизонта, на котором происходит питание. Так, обычной пищей корифен в открытых водах служат летучие рыбы, приповерхностные миктофиды, пелагические осьминоги-аргонавты и кальмары, однако в водах, богатых водорослевым плавником, они поедают преимущественно ставридовых, спинорогов и других рыб, ассоциированных с плавучим субстратом.
Особенно внимательному изучению подвергалось в последние годы питание тунцов, меч-рыб и копьерылов. Полученные данные демонстрируют прежде всего огромную пищевую пластичность этих рыб, потребляющих самые разнообразные кормовые объекты — преимущественно рыб и головоногих моллюсков. В списках компонентов питания полосатого тунца, например, значится более 180 видов жертв, большеглазого тунца — 152 вида, желтоперого тунца — 243 вида, причем основную пищу двух последних видов составляют объекты, обитающие на границе эпи- и мезопелагиали. Как показано О. Д. Бородулиной, «осредненные» рационы этих хищников очень сходны, но желтоперый тунец поедает больше номеевых, летучих рыб и других тунцов, а в желудках большеглазого чаще встречаются более глубоководные виды, и это снижает остроту их конкурентных отношений. Спектры питания тунцов заметно меняются в зависимости от их размеров, что также связано, помимо прочих причин, с различной глубиной охоты особей разных возрастных групп. Так, мелкие особи желтоперого тунца поедают главным образом ракообразных, среднеразмерные — рыб, кальмаров и ракообразных, крупные — рыб и кальмаров. В пище тунцов и других крупных хищников отсутствуют, однако, интерзональные мигранты, поднимающиеся ночью с глубин в те горизонты, где откармливаются тунцы, или пересекающие эти горизонты (это можно объяснить только питанием хищников в светлое время суток).
Таким образом, для эпипелагических рыб типичны слабо выраженная избирательность питания и как ее следствие наличие широких пищевых спектров. Большинство епипелагических рыб питается практически любым доступным кормом, подходящим по размерам и имеющимся в данном месте в достаточном количестве. В схеме трофической структуры океанской пелагиали (рис. 16) рыбы занимают несколько верхних уровней — до пяти в тропических водах, характеризующихся наибольшей сложностью пищевых взаимоотношений.
Распространение. Хорошо известно, что границы ареалов эпипелагических рыб, принадлежащих к нектону (т. е. способных к активным горизонтальным перемещениям) , определяются главным образом температурой воды. Связь распространения с температурными условиями показана для многих рыб — акул, лососей, летучих рыб, тунцов, марлинов и др. Двукрылая летучая рыба Exocoetus volitans, например, встречается при температуре 22—29°, будучи обычной при 24—28°. В результате область распространения этого вида в наиболее теплой западно-экваториальной части Тихого океана была прервана осенью 1961 г. примерно на 15° по широте (т. е. на 900 морских миль), а в центральной части океана, где в области экватора температура несколько понижена благодаря поднятию глубинных вод, не имела такого разрыва. Минимальные значения температуры, отмеченные для разных видов массовых скумбриевидных рыб открытого океана в период нагула, варьируют от 10—12° у длинноперого тунца и меч-рыбы до 18—20° у желтоперого тунца и синего марлина. Температурный диапазон встречаемости в океане лососей рода Oncorhynchus полностью укладывается в пределы 2,3—12°, причем наиболее холодолюбивым видом является нерка, обычная при 2,3—9°, а наиболее теплолюбивым — кижуч, предпочитающий температуру 7—12°, Подобные примеры, количество которых может быть многократно увеличено, вполне убедительно демонстрируют значение температуры воды как главного фактора, лимитирующего географическое распространение нектонных рыб.
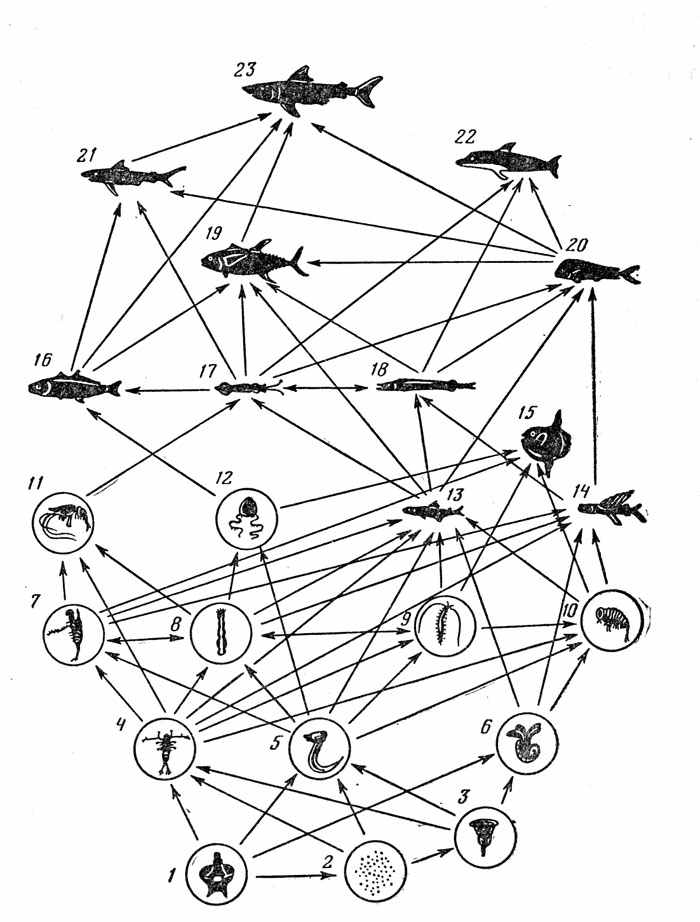
Рис. 16. Схема основных пищевых связей в сообществах тропической зоны.
Этот фактор нельзя, конечно, считать единственным. Ограничивающая роль может принадлежать и другим показателям, найрййер содержанию в воде кислорода (2 мл/л — предельное значение для опускающегося вглубь альбакора), солености воды (35,5%о — минимальная, как полагают, величина для приближающейся к берегам длиннокрылой акулы) или количественному распределению кормовых организмов.
В ареалах нектонных рыб, как уже говорилось, можно различить три структурные части — область размножения, нагульную область и область выселения планктонных стадий раннего развития. Пространственное взаиморасположение репродуктивной и нагульной частей ареала у разных видов может существенно варьировать, В некоторых случаях они полностью совпадают, в других — частично перекрываются, в третьих — нацело разобщены.
Правда, при современной изученности распространения нектонных рыб невозможно выделить структурные части ареалов для большинства эпипелагических видов. Достаточно детальные представления имеются лишь о распространении относительно немногих рыб. Ареал северотихоокеанской сайры, например, состоит из репродуктивной части, занимающей южные районы области распространения (на периферии Северного субтропического круговорота), нагульной части, приходящейся на субарктические воды, и области выселения мальков в заливе Аляска. Полная или частичная пространственная разобщенность нерестовой и нагульной частей ареала имеется также у сельдевой и синей акул, скумбрещуки, субтропической летучей рыбы Hirundichthys rondeletii, длинноперого тунца, полосатого марлина, меч-рыбы и некоторых других видов. При этом основные структурные части ареалов некоторых широко распространенных нектонных рыб эпипелагиали могут располагаться в значительно различающихся условиях среды.
Значительные перемещения многих нектонных рыб в пределах своих ареалов, связанные с периодическими нерестовыми, нагульными и зимовальными миграциями, приводят к существенным изменениям границ распространения отдельных видов в разные сезоны. Особенно сильно меняется распространение в океане у тех рыб, которые обитают в водах, подверженных заметным сезонным изменениям температуры,— у сайры, лососей, некоторых тунцов и акул и т. п.
Число планктонных рыб в эпипелагиали невелико: если исключить из рассмотрения никтоэпипелагических мигрантов, к ним относятся лишь карликрвые виды семейства макрелещуковых, а также пассивные в течение всей жизни гиганты — рыбы-луны (по всей вероятности, сюда следует добавить сельдяных королей, вогмеров, парусных морских лещей рода Pteraclis). Можно думать, что географическое распространение этих рыб определяется, как и распространение других планктонных животных, циркуляцией вод океана, а основы их ареалов более или менее соответствуют крупномасштабным системам замкнутых или полузамкнутых круговоротов.
Миграции. Характерной чертой многих эпипелагических рыб служит их способность к направленным перемещениям в пространстве — вертикальным и горизонтальным миграциям. Оставляя в стороне миграции никтоэпипелагических видов (они будут рассмотрены в гл. III), следует отметить, что наибольшие по размаху вертикальные перемещения совершают тунцы рода Thunnus и особенно меч-рыба. По имеющимся данным, желтоперый тунец может опускаться до глубины 160 м, большеглазый — до 250 м, а длинноперый еще глубже — до 380 и даже 600 м. Меч-рыба также была однажды сфотографирована на глубине, превышающей 600 м.
Активные горизонтальные миграции некоторых эпипелагических рыб, обусловленные пространственным разобщением районов нереста и нагула в соответствии с различиями абиотических (прежде всего температурных) и биотических (в основном кормовых) условий, достигают очень большой протяженности и часто имеют довольно сложный характер. Они еще недостаточно изучены и лишь в немногих случаях подтверждены данными мечения, позволяющими прослеживать их пути. Иногда, впрочем, такие миграции хорошо заметны по перемещениям массовых скоплений и районов промысла. У океанических скумбриевидных рыб они достигают наибольшего размаха: у них отмечены даже сверхдальние трансокеанические миграции.
Особенно значительные перемещения совершают, по-видимому, генеративно тепловодные (т. е. имеющие тропическое происхождение) рыбы, выходящие для нагула за пределы тропических вод. Так, детальное изучение биологии длинноперого тунца (альбакора) в северной части Тихого океана показало, что для этого вида в период, предшествующий наступлению половой зрелости, характерны весьма сложные перемещения.
Опыты по мечению длинноперого тунца начались в 1952 г., а уже на„ следующий год было получено неоспоримое доказательство трансокеанских миграций: рыба, помеченная в районе Калифорнии в августе 1952 г., была обнаружена в японских водах через 323 дня после выпуска. В последующие годы в западной части Тихого океана было поймано еще пять рыб, кроме того, два тунца были возвращены из центральной части океана (район о-ва Мидуэй). Средняя скорость перемещения, по данным мечения, достигает 16—17 миль (около 30 км) в сутки. Мечение длинно-Езрого тунца производилось также в центральной части Тихого океана, восточнее Японии. Рыбы, помеченные в центре океана, ловились впоследствии и у Японии, и у Калифорнии, а тунцы, выпущенные в японских водах, добывались лишь в средней части океана.
Результаты мечения, данные по размерному и возрастному составам уловов, а также сведения о сезонных перемещениях районов промысла позволили представить в общем виде картину миграций неполовозрелого альбакора в северной половине Тихого океана. В промысловых уловах у Японии и Калифорнии длинноперый тунец, как правило, встречается, начиная с двухлетнего возраста, причем в восточной части океана добываются рыбы в возрасте от 2 до 5 лет, а в западной — от 1 до 10 лет. Исходя из возможности одной трансокеанской миграции в год, американские ученые предложили схему миграций этого вида, которая вполне согласуется с имеющимся фактическим материалом. Эта логичная картина, воссозданная в начале 60-х годов, рассматривается теперь лишь как одна из возможных моделей миграционного цикла альбакора.
Способность к дальним активным миграциям представляет собой одно из весьма существенных приспособлений рыб к обитанию в эпипелагиали. Такие миграции делают возможным более полное использование пищевых ресурсов океана, приводя в некоторых случаях даже к полному разобщению репродуктивной и вегетативной частей ареала (особенно характерны в этом отношении миграции, в ходе которых рыбы пересекают границу между тропической и бореальной областями). Именно поиски путей к расширению области нагула — основная причина активных перемещений. Нерестовые и зимовальные миграции служат, как правило, только обратному возвращению мигрантов из районов, в которых происходил их откорм.
Рассматривая миграции эпипелагических рыб, нельзя обойти молчанием вопрос о возможных механизмах их ориентации в открытых водах. Эта проблема активно разрабатывается в последние годы, но все ещё очень далека от разрешения, хотя высокая чувствительность рыб к таким факторам, как температура, соленость, химический состав воды, давно доказана в опытах и не вызывает сомнений. Среди предложенных к настоящему времени гипотез, частично проверенных экспериментально, следует отметить астронавигацию — ориентацию по Солнцу (в том числе по поляризации солнечного света) и другим небесным телам, ориентацию по магнитным полям (у некоторых рыб, в том числе тунцов и марлинов, в черепных костях обнаружен биогенный магнетит), по электрическим полям (восприятие сверхслабых токов может обеспечить ориентацию относительно течений) и даже по гравитационным полям. Все эти гипотезы не дают полного объяснения наблюдаемым в природе процессам, однако твердо установленный факт направленных перемещений некоторых видов рыб требует продолжения научного поиска. Решение вопроса, возможно, будет найдено в результате комплексного подхода.
Итак, подведем некоторые итоги. Эпипелагический ихтиоцен не очень разнообразен в отношении систематического состава, но включает довольно разнородные элементы (табл. 2). Помимо постоянных обитателей поверхностных слоев открытого океана — голоэпипелагпческпх рыб — в его состав входят мероэпипелагические рыбы, проводящие здесь определенную часть жизни, и ксеноэпипелагическне рыбы, нормально живущие в других биотопах. Всего в океанской эпипелагиали представлено не более 300 видов (исключая ранние стадии развития прибрежных и глубинных рыб), принадлежащих, насколько известно, к 53 семействам. Голоэпипелагические виды, число которых не превышает 140, входят в состав 35 семейств, но лишь немногие из этих семейств (всего 16) полностью ограничены в своем распространении эпипелагиально.( Все эти цифры меньше приведенных в моей сводке «Ихтиофауна океанской эпипелагиали» (1968): за прошедшие 20 лет выяснилось, что в состав этой группы включались и но характерные для нее виды. Впрочем, и сейчас «эпипелагиаль» нередко понимается слишком широко.)
Обособленность эпипелагического биотопа лучше всего выражена в тропической зоне — там, где постоянно существующий слой теплых вод («термосфера» А. Брууна), обычная толщина которого составляет 100—200 м, отделен от холодного глубинного слоя главным термоклином, также имеющим постоянный характер. В умеренных и высоких широтах термическая обособленность верхних слоев существует только летом, когда формируется слой скачка, разрушающийся в холодный сезон вертикальной конвекцией в результате охлаждения поверхности воды. Соответственно этому эпипелагический ихтиоцен вполне четко выражен только в тропической зоне, в которой и обитают почти все упоминавшиеся виды. Достаточно сказать, что для перечисления голоэпипелагических рыб, постоянно живущих к северу и югу от 40-х широт, вполне хватило бы пальцев на руках — список «холодолюбивых» видов включает гигантскую акулу, по 2 вида сельдевых акул и морских лещей рода Brama, 2—3 вида строматеевидных рыб, низкотелого опаха, гастерохизму, и даже добавление к этому перечню тех видов, которые заходят в умеренные воды для летнего нагула (сайра, макрелещука, альбакор, меч-рыба) или заносятся течениями (луна-рыба, пятнистый опах) не меняет существа дела. Воды северной части Тихого океана, Северной Атлантики и Субантарктики характеризуются явным преобладанием мероэпипелагических и ксеноэпипелагических рыб, иногда достигающих значительной численности. В Арктике и Антарктике специфическое рыбное население пелагиали крайне бедно (голоэпипелагических рыб нет вообще), но включает очень своеобразный криопелагический ихтиоцен, впервые выделенный А. П. Андрияшевым. Криопелагические виды — антарктические широколобики (род Pagothenia), арктические тресковые рыбы — сайка (Boreogadus saida) и ледовая треска (Arctogadus glacialis) — в массовом количестве живут в непосредственном контакте с припайным и дрейфующим льдом. Эти рыбы потребляют в пищу подледный планктон и сами служат кормом многим хищникам, в том числе ныряющим птицам и морским млекопитающим.
Для эпипелагиали особенно характерны рыбы крупного размера, относящиеся главным образом к нектону, способные к быстрому продолжительному плаванию и ведущие активный образ жизни,— именно здесь обитают рыбы-рекордисты по длине и массе тела (китовая акула — 15,2 м и 14 т), скорости плавания (меч-рыба — 130 км/ч) и его дальности (синий тунец — 5800 миль, т. е. 10 тыс. км). Планктонных рыб в этом биотопе немного, но и среди них имеются настоящие гиганты (луна-рыба «диаметром» 3 м и массой 1,5 т). Почти все обитатели эпипелагиали имеют широкие пищевые спектры, быстро растут, рано достигают половой зрелости, имеют сравнительно непродолжительную жизнь и большую индивидуальную плодовитость при отсутствии заботы о потомстве. По внешнему облику, образу жизни и экологическим характеристикам они резко отличаются от рыб глубоководной пелагиали.
