Удк [544. 77: 577. 112. 824]: 535
| Вид материала | Документы |
СодержаниеМатериалы и методы Результаты и их обсуждение C (одмах), м Список литературы |
- Удк 577. 151 Рудакова наталья леонидовна новая секретируемая металлоэндопептидаза, 478.94kb.
- Удк 616. 992-06: 616. 521]-085: 577, 131.05kb.
- Учебно-методическое пособие минск 2004 удк 577. 3(075., 636.45kb.
- Реферати удк 535. 241. 5 Световозвращение: проблемы и достижения, 116.55kb.
- Удк 112+312. 42 В. В. Зінченко, 285.05kb.
- Освіта. Виховання. Навчання, 274.87kb.
- Освіта. Виховання. Навчання, 317.12kb.
- Освіта. Виховання. Навчання, 134.83kb.
- Методические указания по обследованию специальных металлургических кранов рд 10-112-6-03, 1763.74kb.
- Постановлением Правительства Красноярского края от 20. 11. 2010 №577-п. Цели конкурс, 89.69kb.
УДК [544.77:577.112.824]:535.371
ВЗАИМОДЕЙСТВИЕ БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА
С КАТИОННЫМИ ПОВЕРХНОСТНО-АКТИВНЫМИ ВЕЩЕСТВАМИ
ПО ДАННЫМ ФЛУОРЕСЦЕНЦИИ
А.Н. Кукушкина*1, С.Р. Деркач*, Б.М. Ужинов**, С.М. Левачев**, М.А. Сакварелидзе***
*183010, г. Мурманск, ул. Спортивная, д. 13, Мурманский государственный технический университет, 1anast_kukushkina@mail.ru
**119992, г. Москва, Ленинские горы, 1/3, Московский государственный университет им. Ломоносова
***127427, г. Москва, ул. Академика Королёва, д.21, стр.1, Московский Киновидеоинститут (Филиал С.-Петербургского государственного университета кино и телевидения)
Методом флуоресценции исследовано взаимодействие глобулярного белка бычьего сывороточного альбумина (БСА) с катионными ПАВ цетилтриметиламмоний бромидом (ЦТАБ) и октадекенилдигидроксоэтилметиламмоний хлоридом (ОДМАХ) в водном растворе. В области низких концентраций ПАВ наблюдается статическое тушение флуоресценции БСА с константой тушения Штерна-Фольмера равной (4.7 ± 0.2)103 и (4.3 ± 0.4)103 М-1 в случае ЦТАБ и ОДМАХ соответственно. Тушение флуоресценции БСА в присутствии ПАВ обусловлено образованием комплексов белок-ПАВ переменного состава.
бычий сывороточный альбумин (БСА), глобулярный белок, катионные поверхностно-активные вещества (ПАВ), цетилтриметиламмоний бромид (ЦТАБ), октадекенилдигидроксоэтилметиламмоний хлорид (ОДМАХ), флуоресценция, уравнение Штерна-Фольмера, статическое тушение флуоресценции
ВВЕДЕНИЕ
Сывороточные альбумины обладают уникальной способностью к избирательному связыванию гидрофобных веществ, например, жирных кислот, липидов, билирубина, аминокислот [1]. Процессы ассоциации сывороточного альбумина с ПАВ используются в различных технологиях, в том числе, при разработке продуктов питания и новых лекарственных веществ, а также при селективной экстракции и очистке белка [2].
В многочисленных исследованиях взаимодействия глобулярных белков, особенно бычьего сывороточного альбумина (БСА), с ионными и неионными ПАВ [3] показано, что ПАВ взаимодействуют с БСА с образованием ассоциатов (комплексов) переменного состава. При этом наблюдаются существенные конформационные изменения вторичной структуры белка – доля спиральных -цепей уменьшается [3], а термическая устойчивость вторичной структуры возрастает [4]. При низких концентрациях ПАВ взаимодействие имеет электростатическую природу в результате связывания ионов ПАВ противоположно заряженными группами белка. При высоких концентрациях (в области ККМ и выше) число связанных молекул ПАВ резко возрастает в результате кооперативности процесса, определяющую роль при этом играют гидрофобные взаимодействия [3].
Целью настоящей работы является исследование комплексообразования БСА с катионными ПАВ в водных системах в широком диапазоне концентраций ПАВ и молярного соотношения компонентов ПАВ/БСА, а также определение механизма комплексообразования и констант комплексообразования. В работе использовали флуоресцентный метод, который успешно применяется для исследований белковых систем [5, 6]. БСА, как и многие белки, содержит флуорофоры: два триптофана (Trp135, Trp214). Триптофан весьма чувствителен к полярности окружения, и спектры флуоресценции могут дать существенную информацию о процессе связывания молекул ПАВ и конформационных изменениях белка.
МАТЕРИАЛЫ И МЕТОДЫ
Глобулярный белок бычий сывороточный альбумин (БСА) производства Sigma, содержание белка 97 % , молярная масса 6.7∙104 Da, изоэлектрическая точка 4.9. Катионные ПАВ: октадекенилдигидроксоэтилметиламмоний хлорид (ОДМАХ) (С23Н48О2NCI), KKМ 1.510-4 М, хроматографически чистый; цетилтриметиламмоний бромид (ЦТАБ) (С19Н42NBr), ККМ 810-4 М, производства Sigma использовали без дополнительной очистки.
Для приготовления растворов БСА, ПАВ и их смесей использовали бидистиллят с удельной электрической проводимостью (22 оС) 6.710-6 Ом-1 м-1. рН растворов смесей БСА и ПАВ устанавливали в интервале 5.7 – 6.0.
Концентрацию белка определяли спектрофотометрически по оптической плотности растворов при λ = 280 нм, используя ε280 для БСА 44720 М-1см-1 [6]. Измерения стационарной флуоресценции проводили с использованием спектрофлуориметра Элюмин-2М. Длина волны возбуждения составляла 280 нм. Время жизни флуоресценции определяли из кинетики флуоресценции, измеренной с помощью наносекундного спектрометра SP-70. Температура эксперимента составляла 22 ºС.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
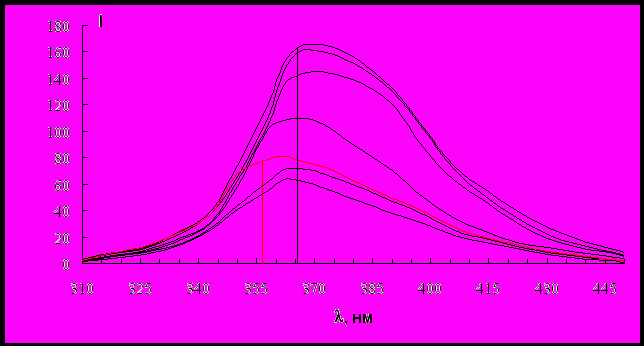
На рисунке представлены зависимости относительной интенсивности флуоресценции БСА I /I0 от концентрации ПАВ при постоянной концентрации белка в растворе CБСА=210-5 М. I0, I – интенсивность флуоресценции в отсутствие и в присутствии тушителя (ПАВ), соответственно. Как видно из рисунка, относительная интенсивность флуоресценции резко уменьшается в определенном диапазоне концентраций ПАВ.
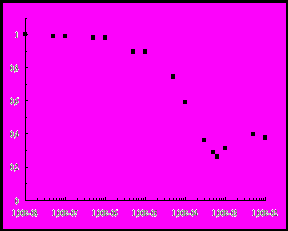
Можно выделить три участка, характерные для обоих катионных ПАВ. Так, в области низких концентраций цетилтриметиламмоний бромида (рисунок, а) интенсивность флуоресценции уменьшается с ростом концентрации ПАВ. При концентрации ЦТАБ равной 610-4 М, что соответствует соотношению 30 молекул ЦТАБ на одну молекулу белка, интенсивность флуоресценции достигает наименьшего значения и составляет 26% от исходного значения интенсивности. Далее с увеличением концентрации ЦТАБ интенсивность флуоресценции до 40% от исходного значения I0, соотношение компонентов при этом равно 250 молекул ПАВ на молекулу белка. При дальнейшем увеличении концентрации ЦТАБ относительная интенсивность флуоресценции не меняется.
Аналогичная зависимость получена и при введении катионного ПАВ октадекенилдигидроксоэтилметиламмоний хлорида (рисунок, б). Наименьшее значение интенсивности флуоресценции достигается при молярном соотношении ПАВ:БСА = 25 и составляет 32% от исходной интенсивности флуоресценции БСА. Затем интенсивность флуоресценции несколько увеличивается, достигая 38% от I0, что соответствует 50 молекулам ОДМАХ на молекулу белка, и далее остается постоянной. Необходимо отметить, что максимальное тушение флуоресценции в обоих случаях при введении ЦТАБ и ОДМАХ наблюдается при концентрациях катионных ПАВ в области ККМ.
 (а) I/I0 C (ЦТАБ), М | 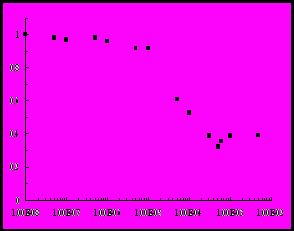 (б) I/I0 C (ОДМАХ), М |
Рис. Зависимость относительной интенсивности флуоресценции БСА
от концентрации добавленного в раствор белка катионного ПАВ: ЦТАБ (а)
и ОДМАХ (б), СБСА = 210-5 М
Тушение флуоресценции может протекать по механизму динамического или статического тушения [7]. В обоих случаях зависимость относительной интенсивности от концентрации тушителя описывается уравнением Штерна-Фольмера:
 ,
,  , (1)
, (1)где I0, I – интенсивность флуоресценции флуорофора в отсутствие и в присутствии тушителя, соответственно; kq – константа скорости реакции тушения; 0 – истинное время жизни флуоресценции (в отсутствие тушителя); [Q] – концентрация тушителя; KSV – константа Штерна-Фольмера (константа тушения).
В работе определено, что истинное время жизни флуоресценции БСА 0 равно 3.910-9 с и не зависит от концентрации ПАВ, что свидетельствует о статическом тушении. Тушение происходит в результате образования в основном состоянии нефлуоресцирующего комплекса белок-ионное ПАВ. Если спектр поглощения такого комплекса близок к спектру поглощения белка, то возбуждающий свет будет поглощаться как свободными, так и связанными в комплекс молекулами БСА, а флуоресцировать будут лишь свободные молекулы БСА. При тушении по статическому механизму константа Штерна-Фольмера представляет собой константу равновесия образования комплекса в основном состоянии, т.е. константу комплексообразования [7].
Полученные экспериментальные данные в области низких концентраций катионных ПАВ (рисунок) проанализированы в рамках уравнения Штерна-Фольмера. Линейный характер зависимости интенсивности флуоресценции БСА от концентрации ПАВ свидетельствует об образовании комплекса БСА-катионное ПАВ. Константы комплексообразования, вычисленные по уравнению (1), для обоих ПАВ близки по своим значениям и равны (4.70.2)103 М-1 для ЦТАБ и (4.30.4)103 М-1 для ОДМАХ.
ВЫВОДЫ
Флуоресценция бычьего сывороточного альбумина тушится катионными ПАВ ЦТАБ и ОДМАХ в водном растворе. Константа тушения, представляющая собой константу равновесия связывания молекул ПАВ белком и рассчитанная по уравнению Штерна-Фольмера, равна (4.7 ± 0.2) 103 и (4.3 ± 0.4)103 М-1 для ЦТАБ и ОДМАХ соответственно. Тушение происходит преимущественно по статическому механизму. Тушение флуоресценции БСА обусловлено взаимодействием макромолекул белка с молекулами ПАВ, сопровождающимся образованием комплексов БСА-катионное ПАВ.
СПИСОК ЛИТЕРАТУРЫ
1. Peters T. Serum Albumin / T. Peters // Advances in Protein Chemistry. - 1985. - V. 37. - P. 161-245.
2. Zhang W., Liu H., Chen J. Forward and backward extraction of BSA using mixed reverse micellar system of CTAB and alkyl halides / W. Zhang, H. Liu, J. Chen // Biochemical Engineering J. - 2002. - V. 2. - № 1. - P. 1-5.
3. Santos S.F., Zanette D., Fischer H., Itri R. A systematic study of bovine serum albumin (BSA) and sodium dodecyl sulfate (SDS) interactions by surface tension and small angle X-ray scattering / S.F. Santos, D. Janette, H. Fischer, R. Itri // J. Colloid Interface Science. - 2003. - V. 262. - P. 400-408.
4. Yamasaki M., Yamashita T., Yano H., Tatsumi K., Aoki K. Differencial scanning calorimetric studies on bovine serum albumin. VI. Effect of anionic surfactants with various lengths of hydrocarbon chains / M. Yamasaki, T. Yamashita, H. Yano, K. Tatsumi, K. Aoki // J. Biological Macromolecules.-1996.-V. 19. - P. 241-246.
5. Gelamo E.L., Silva C.H.T.P., Imasato H., Tabak M. Interaction of bovine (BSA) and human (HSA) serum albumins with ionic surfactants: spectroscopy and modelling / E.L. Gelamo, C.H.T.P. Silva, H. Imasato, M. Tabak // Biochimica Biophysica Acta. - 2002. - V. 1594. - P.84-99.
6. Carter D., Ho J.X. Structure of Serum Albumin / D. Carter, J.X. Ho // Advances in Protein Chemistry. - 1994. - V. 45. - P. 153-203.
7. Лакович Д. Основы флуоресцентной спектроскопии / Д. Лакович. - М., 1986.
INVESTIGATION OF BOVINE SERUM ALBUMIN INTERACTIONS WITH CATIONIC SURFACTANTS BY FLUORESCENCE PROBE METHOD
A.N. Kukushkina, S.R. Derkatch, B.M. Uzhinov, S.M. Levachev, M.A. Sakvarelidze
Protein-surfactant interactions were studied using bovine serum albumin (BSA) and cationic surfactants cetyltrimethylammonium bromide (CTAB) or octadecenildehydrocsoetylmethylammonium chloride (ODMAC). The interactions were followed fluorimetrically using intrinsic tryptophan (Trp 135, Trp 214) fluorescence. The quenching takes place with a Stern-Volmer constant of (4.7 ± 0.2)103 и (4.3 ± 0.4)103 М-1 in the case of CTAB and ODMAC respectively. These results are explained in terms of static quenching between the adsorbed surfactant and the excited Trp groups.