Е. М. Овсянникова Кафедра педиатрии рмапо, Москва
| Вид материала | Документы |
СодержаниеПоказания к антибактериальной терапии Первоначально выбор антибактериальной терапии Сделаны следующие выводы |
- Экзаменационные вопросы по педиатрии для лечебного факультета V курс, кафедра педиатрии, 81.29kb.
- Календарно-тематический план практических занятий по предмету педиатрия для студентов, 54.07kb.
- Основы мастерства профессионализм и клиническая психотерапия, 167.15kb.
- Рабочая программа по поликлинической педиатрии для студентов педиатрического факультета, 1219.82kb.
- Нормальный вакцинальный процесс у детей: особенности течения и методы коррекции, 80.26kb.
- Волгоградский государственный медицинский университет кафедра педиатрии и неонатологии, 60.4kb.
- Календарно-тематический план лекций по педиатрии для студентов 4 курса лечебного факультета, 29.41kb.
- План практического занятия, 66.22kb.
- План практического занятия, 116.22kb.
- Типовая программа дополнительного профессионального образования врачей клиническая, 6412.19kb.
Бронхообструктивный синдром инфекционного генеза у детей

Е.М. Овсянникова
Кафедра педиатрии РМАПО, Москва

Бронхообструктивный синдром (БОС) – собирательное понятие, характеризующееся определенными клиническими параметрами и нарушением проходимости дыхательных путей. БОС может быть следствием аллергического воспаления трахеобронхиального дерева, обтурационной непроходимости или гемодинамических нарушений, но в большинстве случаев БОС имеет вирусную или вирусно-бактериальную этиологию, т.е. является следствием инфекционного воспаления. БОС инфекционного генеза имеет наибольшую частоту в детском возрасте [1, 2]. У детей первых 3 лет жизни чаще, чем в других возрастных группах, на фоне острой респираторной вирусной инфекции (ОРВИ) развивается БОС [2]. Это в определенной степени объясняется анатомо-функциональными особенностями бронхолегочной системы у детей раннего возраста [3, 4].
Респираторный тракт имеет систему защиты, которая препятствует фиксации микроорганизмов на слизистых оболочках, их размножению и повреждению эпителия дыхательных путей. Верхние дыхательные пути имеют мукоцилиарную и иммунную системы защиты.
Мукоцилиарная защита осуществляется благодаря движению ресничек респираторного эпителия, которое обеспечивает удаление секрета вместе с микроорганизмами, проникшими в дыхательные пути. В состав секрета, кроме того, входят вещества, препятствующие адгезии бактерий и вирусов [5, 6]. Если микроорганизмам удается преодолеть мукоцилиарный барьер и закрепиться на слизистой оболочке дыхательных путей, в процесс защиты включаются иммунные механизмы. Главными иммунными факторами защиты являются фагоцитирующие нейтрофилы и Ig AS [5]. Инфекционный процесс в легких развивается, с одной стороны, в результате несостоятельности защитной системы, с другой – в силу тропности ряда возбудителей к эпителию респираторного тракта [7, 8].
Таким образом, патогенное воздействие возбудителей и недостаточная система защиты респираторного тракта приводят к развитию воспалительного процесса в трахеобронхиальном дереве.
По данным литературы, ведущая роль в этиологии бронхитов принадлежит РС-вирусу, вирусам парагриппа, аденовирусам. Реже встречаются риновирусы, вирусы гриппа, энтеровирусы, цитомегаловирусы и др. Вирусные бронхиты регистрируются у детей в 20% случаев [8–10].
В возрасте от 6 мес до 1 года ведущая роль в этиологии принадлежит РС-вирусам [1, 8]. Что касается бактериальной этиологии бронхитов, то на долю Haemophilus influenzae приходится от 45,9 до 48,7%, Streptococcus pneumoniae – от 16,5 до 25,5%, Moraxella catarralis – от 13,4 до 14,2% [11–13].
По данным исследования, проведенного на базе инфекционного отделения ТДГБ г. Москвы, в этиологии БОС у детей первого года жизни на первый план выступает сочетание РС и аденовируса (17%), на втором месте – аденовирус (14%) и только на третьем – РС (6%).
У детей старше года первое место в этиологии БОС занимает РС (29%), на втором – аденовирусы (16%), на третьем – сочетание РС и аденовирусов.
Независимо от возраста детей с одинаковой частотой в этиологии БОС встречается грипп (3%) и парагрипп (3%).
В основе обструкции бронхов инфекционного генеза лежит воспаление респираторного тракта [7, 14]. Основными медиаторами воспаления являются гистамин, фактор некроза опухоли, цитокины, простагландины и лейкотриены, которые приводят к гиперпродукции слизи, отеку слизистой бронхов и повреждению реснитчатого эпителия, в результате чего образуются слизистые пробки и нарушается мукоцилиарный клиренс [15, 16]. Усугублять клиническую картину обструктивного синдрома может спазм гладкой мускулатуры бронхов, который может быть связан с нарушением равновесия вегетативной нервной системы, дисбалансом между возбуждающими и тормозящими путями адренергической (снижению - и возрастанию -адренергической активности) и холинергической иннерваций.
Показано, что под действием вирусов может снижаться активность нейтральной пептидазы, это приводит к усилению бронхоконстриктивного действия нейропептидов (субстанция Р, тахикинин, кальциеподобный пептид и др.), образующихся в эндокринно-активных клетках дыхательных путей [17].
Мы провели анализ особенностей клинической картины БОС у детей первого года жизни. Под нашим наблюдением находились 154 ребенка в возрасте 6 до 12 мес. Эпизод обструкции был первым в 95% случаев, вторым у 5% детей.
Во всех случаях БОС предшествовала ОРВИ с характерной клинической картиной вирусной инфекции (лихорадка, ринит, фарингит). Обструкция дыхательных путей развивалась на 3–4-е сутки ОРВИ при первом эпизоде и на 2–3-и – при повторных.
Рис. 1. Динамика одышки.
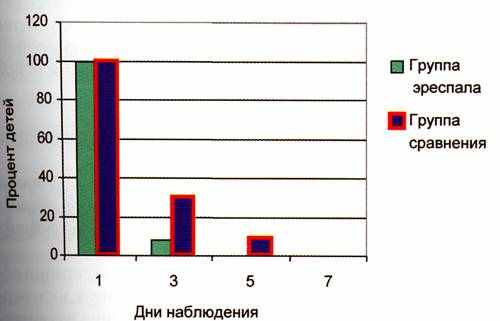
Рис. 2. Динамика интоксикации.
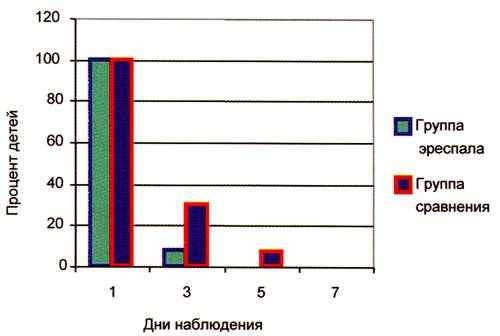
Рис. 3. Динамика влажных хрипов.
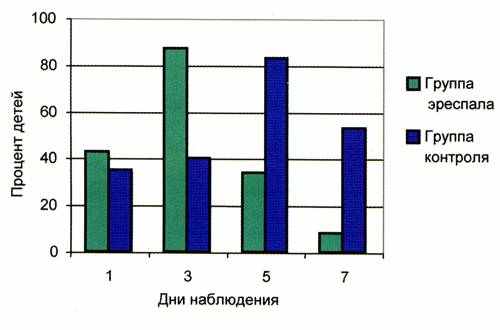
Основной жалобой при поступлении было затрудненное дыхание.
При обструктивном синдроме инфекционного генеза у детей первого года жизни с одинаковой частотой (48%) встречалась одышка как экспираторного характера, так и смешанная.
У большинства (94%) детей отмечена бледность и выраженный цианоз носогубного треугольника. Заболевание обычно начиналось с сухого кашля (у 57%). Следует отметить, что БОС развивался значительно чаще (74%) у детей с увеличенной вилочковой железой.
Аускультативно сухие хрипы преобладали над единичными влажными у 57%, влажные с единичными сухими выслушивались у 43% детей.
В основном состояние дыхательной недостаточности (ДН) расценивалось как ДН I–II степени, что соответствовало среднетяжелому течению заболевания, реже (31%) ДН была II–III степени.
У всех отмечена тахикардия. Неадекватное увеличение частоты сердечных сокращений наблюдали у 25%.
При рентгенологическом обследовании отмечено общее вздутие легких у 55%, усиление сосудистого рисунка у 44%, ателектаз верхней правой доли у 1% детей.
Анализируя результаты клинического анализа крови, нами были выявлены следующие особенности: лейкоцитоз до 15 тыс. с нейтрофилезом отмечен у 51%, СОЭ была в пределах возрастной нормы, обращала на себя внимание тенденция к моноцитозу и эозинофилии.
При обструктивном бронхите инфекционного генеза все дети получали традиционное лечение, которое включало бронхолитические, противовоспалительные, муколитические препараты.
Восстановлению адекватной оксигенации способствовало назначение увлажненного 40% кислорода через воронку.
С целью бронходилатации первоначально всем назначали 2-агонисты короткого действия, их эффективность оценивали через 20–25 мин после ингаляции через небулайзер. Проведенные нами наблюдения доказали их эффективность при обструктивном бронхите даже у детей первого года жизни. Использование 2-агонистов короткого действия сокращает длительность заболевания и пребывание детей в стационаре (r=-0,56).
Отсутствие эффекта при применении 2-агонистов короткого действия чаще связано с неправильной техникой ингаляций. В условиях стационара они вводятся через спейсер или небулайзер. Длительность назначения определяется продолжительностью бронхоспазма.
У детей грудного возраста при тяжелом обструктивном бронхите оральная регидратация, как правило, затруднена. Поэтому приходится прибегать к назначению инфузионной терапии для восполнения физиологических потребностей, с учетом патологических потерь. Инфузионная терапия представлена глюкозо-солевыми растворами. Рассчитывается суточная потребность ребенка в жидкости и разовый объем инфузионной терапии, которая составляет не более 1/4 от суточной потребности.
Недостаточная эффективность 2-агонистов короткого действия у ряда детей послужила поводом для назначения кортикостероидов. У 73% детей раннего возраста возникла необходимость в инфузионной терапии, в объем которой вводили метилксантины и кортикостероиды.
При тяжелых обструктивных бронхитах и бронхиолитах возможно развитие микроциркуляторных нарушений и гиперкоагуляции. В этих случаях рекомендуется использование гепарина из расчета 100 ЕД/кг в сутки.
Вопрос об антибактериальной терапии решали индивидуально и только по показаниям [12].
Показания к антибактериальной терапии:
• стойкая лихорадка более 3 сут,
• респираторный микоплазмоз, хламидиоз,
• возраст до 2 мес,
• наличие других очагов бактериальной инфекции,
• лейкоцитоз более 15 тыс.
Первоначально выбор антибактериальной терапии осуществляют эмпирически, т.е. ориентируясь на предполагаемого возбудителя. Чаще причиной бронхита являются гемофильная палочка, пневмококк и моракселла. Учитывая значительную частоту -лактамазопродуцирующих штаммов среди этих возбудителей, в качестве стартовой терапии целесообразно использовать "защищенные" пенициллины, цефалоспорины II поколения [8, 11–13].
Отсутствие терапевтического эффекта от применения стартовой антибактериальной терапии в течение 2–3 дней может быть обусловлено атипичными возбудителями (хламидии и микоплазмы). При этом препаратами выбора следует считать макролиды [8, 11–13].
У 74% детей при бронхиальной обструкции возникла необходимость назначения антибактериальной терапии.
Поскольку в основе бронхиальной обструкции при острых респираторных заболеваниях является воспаление в респираторном тракте, логично использование противовоспалительной терапии [9, 18–20]. В настоящее время в арсенале врачей имеется новый препарат противовоспалительного действия "Эреспал" (фенспирид). Препарат обладает тропностью к респираторному тракту, поэтому оказывает воздействие на процессы воспаления только в респираторном тракте.
Фенспирид влияет на метаболизм арахидоновой кислоты, уменьшает поступление ионов кальция внутрь клетки, уменьшает синтез простагландинов и лейкотриенов, что определяет противовоспалительное действие эреспала.
Кроме того, фенспирид оказывает ингибирующее действие на гистамин и фактор некроза опухоли. За счет этого уменьшается образование факторов хемотаксиса и тем самым снижается миграция клеток воспаления и выработка медиаторов, в том числе гистамина [15, 16].
Воздействуя на Н1-рецепторы респираторного тракта, препарат уменьшает экссудацию и отек в респираторном тракте [1, 14].
Фенспирид блокирует 1-адренорецепторы, стимуляция которых приводит к гиперпродукции секрета [21].
Совокупность перечисленных свойств определяет противовоспалительное и бронхолитическое действие фенспирида.
Нами в открытом рандомизированном сравнительном исследовании, проведенном в стационарных условиях, оценивалась клиническая эффективность эреспала в комплексном лечении БОС у 154 детей первого года.
Наблюдаемые больные были разделены на 2 группы (по 77 детей в каждой). Клинически группы были сопоставимы, в обеих пациенты получали 2-агонисты короткого действия, метилксантины на период бронхоспазма, антибактериальный препарат пенициллинового ряда. В основной группе пациенты получали фенспирид с момента поступления в стационар, в группе сравнения при уменьшении бронхоспазма назначали муколитик (группа без фенспирида).
Наблюдения показали, что у 92% детей уже на 3-й день терапии бронхолитиками и фенспиридом отмечен хороший клинический эффект, который проявлялся в уменьшении бронхоспазма и интоксикации. На 3-и сутки от начала терапии только у 8% детей сохранялись минимальные признаки бронхоспазма и интоксикации (рис. 1, 2), на 4-е сутки явлений бронхоспазма и интоксикации не было отмечено ни у одного пациента.
У пациентов, не получавших фенспирид, положительная динамика оцениваемых симптомов была более медленной. На 3-и сутки от начала терапии у 30% детей сохранялись признаки бронхоспазма и интоксикации (см. рис. 1, 2). На 5-е сутки от начала терапии у 9% сохранялись явления бронхоспазма, у 7% – интоксикация.
Оценивая динамику кашля и аускультативной картины в легких, было отмечено, что на 3-и сутки от начала терапии в группе пациентов, получавших фенспирид, у 87% появление влажного кашля сопровождалось отхождением мокроты и на фоне жесткого дыхания выслушивались немногочисленные мелкопузырчатые влажные хрипы. У 11% кашель сохранялся сухим и непродуктивным.
На 5-е сутки от начала терапии у 34% детей сохранялся только редкий влажный кашель. На 7-е сутки от начала терапии только у 8% детей сохранялся редкий влажный кашель (рис.3).
Динамика кашля и аускультативной картины в легких у пациентов, не получавших фенспирид, была более медленной (см. рис. 3).
На 3-и сутки от начала терапии у большей части пациентов (60%) кашель был сухим, в легких выслушивались сухие хрипы и аускультативно у 40% пациентов на фоне жесткого дыхания выслушивались влажные хрипы.
На 5-е сутки от начала терапии у 17% сохранялся сухой кашель и у 83% кашель стал влажным, у них же на фоне жесткого дыхания выслушивалось небольшое количество влажных мелкопузырчатых хрипов. На 7-е сутки от начала терапии у 53,3% детей сохранялся влажный кашель, который сопровождался отхождением густой, вязкой мокроты.
Таким образом, у детей, получавших фенспирид, признаки интоксикации и одышка исчезали быстрее, сухой кашель сохранялся 1–2 дня, а влажный – до 5-х суток от начала заболевания. Аускультативная картина имела также быструю положительную динамику. Как правило, к 7-м суткам от начала терапии кашель и хрипы исчезали практически у всех детей.
В группе сравнения одышка и признаки интоксикации сохранялись дольше. Динамика кашля была иной. Длительно сохранялся сухой кашель и трансформация его во влажный была замедлена и происходила на 4–5-е сутки от начала заболевания. Переносимость терапии фенспиридом была отмечена как хорошая и отличная в 98,4%.
Проведенное исследование показало, что применение фенспирида в комплексной терапии БОС инфекционного генеза сокращает сроки заболевания и длительность пребывания ребенка в стационаре.
Сделаны следующие выводы:
1. У детей первого года жизни обструктивный бронхит чаще вызывается сочетанием аденовируса и РС.
2. Обструктивный бронхит у детей первого года жизни имеет особенности клинического течения, лабораторных и рентгенологических показателей, соответствующих этиологии.
3. Применение фенспирида в комплексной терапии обструктивного бронхита инфекционного генеза достоверно снижает длительность течения заболевания и соответственно сокращает сроки пребывания ребенка в стационаре.
4. Фенспирид рекомендуется включать в комплексную терапию острых воспалительных заболеваний респираторного тракта (в том числе обструктивного синдрома инфекционного генеза) с первых суток заболевания.
Литература
1. Рачинский С.В., Таточенко В.К.Болезни органов дыхания у детей. М., 1988; 186–95.
2. Чебуркин А.В. Бронхообструктивный синдром у детей раннего возраста. Лекция. М., 1998; 2, 5–7.
3. Воронцов И.М. Пропедевтика детских болезней. М., 1985; С. 104–5.
4. Климанская Е.В. Хронические обструктивные заболевания легких у детей. Consilium Mеdicum. 1999; 1 (6).
5. Olivery F, Del Donno M. Efficacy of fenspirid on mucociliary transport. Bull Euro Physiopatol Respir 1987; 348: 297–304.
6. Morgenroht K. Morphologie der bronchialen clearence. Fortschr Мed 1984; 102: 971–6.
7. Майкл А. Гриппи. Патофизиология легких. М.: Бином. 1997; 85–95.
8. Самсыгина Г.А. Антибиотики в лечении острых бронхитов у детей. Лечащий врач. 2001; 1: 12–5.
9. Сафонова А.Н., Геппе Н.А. Современные подходы к терапии бронхитов у детей. Мед. помощь. 2000; 6: 1–2.
10. Таточенко В.К. Антибиотики при бактериальных заболеваниях дыхательных путей у детей. Респираторные заболевания. 2002; 1: 1–2.
11. Балясинская Г.Л., Коровина Н.А., Таточенко В.К.Антибактериальная терапия острых респираторных заболеваний у детей. Пособие для врачей. 2002; 4–5, 9–10.
12. Коровина Н.А., Захарова И.Н.,. Заплатников А.Л.Антибактериальная терапия респираторных заболеваний в амбулаторной практике врача-педиатра. Руководство для врачей. 2000; 13–20.
13. Страчунский Л.С., Белоусов Ю.Б., Козлов О.Н. Антибактериальная терапия. Практическое руководство. М., 2000.
14. Овчаренко С.И. Противовоспалительная терапия хронического бронхита. РМЖ. 2001; 9 (5): 203–4.
15. Perry M, Whyte A. Immunology of the tonsils. Immunol Today1998; 19: 414–21.
16. Campbell AM, Chanez P et al. Modulashion of eicosanoid and histamine from human dispersed lung cells by terfenadine. Allergy 48: 125–9.
17. Чучалин А.Г., Балкарова Е.О. Бронхиальная астма и респираторная вирусная инфекция. РМЖ. 1998; 6 (17): 1095–7.
18. Середа Е.В. Современная терапия при бронхитах у детей. Детск. доктор. 1999; 2: 30–2.
19. Середа Е.В. Хронический бронхит у детей. Новые возможности терапии. Респиратор. забол. 2002; 5: 6–7.
20. Середа Е.В. Современные принципы противовоспалительной терапии при хронических воспалительных заболеваниях у детей. Вопр. совр. педиатрии. 2002; 1 (2): 35–6.
21. Рязанцев С.В. Противовоспалительное лечение инфекций верхних дыхательных путей. IX Российский национальный конгресс "Человек и лекарство". Рациональная антибактериальная терапия инфекций верхних дыхательных путей. М., 2002; 9–11.
Источник: www.consilium-medicum.com
