Химическая связь
| Вид материала | Документы |
СодержаниеЭлектронное облако. Шестерной блок |
- В. И. Ермолаева 1 семестр 2005/06 уч г. График лабораторных занятий по химии для всех, 82.76kb.
- Атом. Ион. Ионная химическая связь, 174.24kb.
- Программа Государственного экзамена по подготовке магистра по направлению «Физика полупроводников., 53.9kb.
- Урока. Тема: «Металлическая химическая связь», 113.33kb.
- Рабочая программа по дисциплине «Основы научных и инженерных исследований» Направление, 83.71kb.
- Тема: Химическая связь и кристаллические решетки, 51.64kb.
- Отчет о результатах самообследования основной образовательной программы по специальностям:, 1627.98kb.
- Рабочая программа по дисциплине "Химическая технология неорганических веществ " Направление:, 112.47kb.
- Химическая и радиационная физика мемориал О. И. Лейпунского, 152.71kb.
- Рабочая программа по дисциплине «Математическое моделирование в химической технологии», 77.52kb.
29 января 2007 г.
ХИМИЧЕСКАЯ СВЯЗЬ
Стивен К. Риттер (Stephen K.Ritter), «Новости химии и инжиниринга» (C&EN), Вашингтон
«Химики упорно ищут новые принципы образования химических связей - будь то шестерные связи, или связи без поделённых электронов»
 | Разнообразные ракурсы На увеличенном изображении двухмерного кластера бора B9 мы видим три небольших фигуры, являющих собой локализованные ơ-орбитали (слева) и делокализованные ơ-орбитали (вверху справа) и π-орбитали (внизу справа). |
«Иногда мне кажется, что связь между двумя атомами стала столь реальной, столь ощутимой, столь родной, что я почти могу видеть её. Но затем я просыпаюсь в легком шоке, ведь химическая связь не является чем-то материальным. Её не существует. Никто никогда её не видел. Никто даже не сможет её увидеть. Это плод нашего воображения» Эти слова принадлежат Чарльзу А. Коулсону(Charles.A.Coulson), выдающемуся химику-теоретику из Оксфордского университета, исследования которого оказали влияние на целое поколение энтузиастов, изучающих химические связи в период с 40-х до начала 70-х годов XX века. Лауреат Нобелевской премии в области химии Роальд Хоффман(Roald Hoffmann) (Корнельский университет) любит цитировать комментарии Коулсона начала 50-х годов на своих лекциях по образованию химической связи.
Хоффман хорошо разбирается в химическом связывании, ведь он посвятил большую часть своей карьеры детальному изучению молекулярных орбиталей. В 60-е годы совместно с Робертом Б. Вудвордом (Гарвардский университет) он разработал знаменитые правила Вудворда-Хоффмана, которые предсказывают стереохимическое направление определенных органических реакций.
«Нет ничего более важного для химии, чем химическая связь, - утверждает Хоффман. – Но это непростая концепция». На научных заседаниях, прошедших за пару лет, он пытался объяснить свою позицию по этому вопросу в ходе дискуссий на тему «Всевозможные способы образования связи».
Хоффман рекомендует химикам «довести концепцию связи до предельных условий и признать, что при таких условиях связь будет являться связью лишь по некоторым критериям, но не по всем». Он также советует обратить внимание на изучение именно многообразия способов образований химических связей, поскольку эта тема до сих пор не обозначена чётко.
И это именно то, чем в настоящее время занимается международное сообщество специалистов в области математической химии. Насчет общепринятых концепций связи постоянно возникают новые точки зрения. Тем временем, продолжают выявляться новые способы образования химических связей.
Некоторые примеры включают связи, в которых нет общих электронов между атомами или, наоборот, рассматривают молекулу с шестерной связью. Другие привлекают внимание молекулярными взаимодействиями, которые обуславливают реакционную способность металлоферментов; ароматичность в металлических и неметаллических кластерах; образование связей в таких новых материалах, как наночастицы, молекулярные магниты и квантовые точки.
Согласно исследованиям Гернота Френкина(Gernot Frenking) из Университета Филиппса в Марбурге (Германия) и Симона Шайка(Sason Shaik) из Еврейского университета в Иерусалиме (Израиль), тема образования химических связей переживает второе рождение. Эти ведущие специалисты в области вычислительной химии недавно объединились, чтобы написать специальный выпуск журнала «Вычислительная химия»(Journal of Computational Chemistry, JCC), посвященный теме образования химических связей. Он был опубликован 15 января. Выпуск также посвящен покойному Гилберту Н. Льюису из Калифорнийского университета (Беркли), который считается отцом концепции образования химических связей. В специальный выпуск объемом примерно пятьсот страниц входят многочисленные эссе и статьи об истории исследований химического связывания, а также о последних новостях в этой теме. Он доступен в интернете по адресу www3.interscience.wiley.com/cgi-bin/jissue/113493174.
В одном из эссе Шайк указывает, что «революция электронной структуры», приведшая к современным описаниям образования химических связей, началась 90 лет назад, когда Льюис опубликовал судьбоносную работу под названием «Атом и молекула» («Журнал Американского химического общества», [American Chemical Society] 1916, 38, 762). В ней Льюис предложил общую теорию образования химических связей, основанную на обобществлении электронных пар между атомами. Идеи Льюиса, вместе с появлением квантовой механики в 1920-е годы, привели к теориям валентной связи и молекулярных орбиталей, которые по сей день являются основой большинства современных теорий связи и вычислительной химии.
В предисловии к специальному выпуску «Журнала американского химического общества» Френкин и Шайк замечают, что, несмотря на то, что…существует большое количество материала для работы историков в области изучения истоков и развития моделей образования химических связей, эта «тема изобилует нерешенными вопросами». Комплекс эссе и работ демонстрирует, что «мы всё ещё далеки от понимания природы химической связи».
В одном исследовании в области химического связывания Хоффман и бывший постдокторант Дин Тантилло(Dean J. Tantillo) (в настоящее время – сотрудник Калифорнийского университета в Дэвисе) рассмотрели новую возможность сигматропных реакций с помощью конструирования «сигматропно перегруппировывающихся соединений» («Отчёты о химических исследованиях», 2006, 39, 477). Сигматропные реакции – это вид перегруппировок, которые могут произойти в углеводородах, содержащих двойные связи. Результирующий эффект заключается в том, что ơ-связи и π-связи меняются местами, и это позволяет атому водорода (или двойной связи) перейти к другой части молекулы. «Перегруппировывающиеся соединения представляются полимерами, в которых ơ-связи и π-связи перегруппировываются туда и обратно по каркасу углеводорода, обеспечивая необычные способы транспортировки электронов на дальние расстояния», говорит Тантилло.
Хоффманн и Тантилло начали свои исследования с полиацетилена - проводящего полимера, в котором проводимость электронов или «дырок» (отсутствующие электроны, или положительно заряженные носители) возникает вследствие дефектов в структуре оксидированного сопряженного полимера. Ученые задались вопросом, могут ли они произвести аналоги проводящих полимеров с помощью создания молекул, в которых оперативно происходят последовательные сигматропные сдвиги. Они достигли своей цели с помощью двух изображений, которые они назвали «змеи» и «лестницы».
«Змеи» представляют собой линейные сопряженные углеводородные цепи, которые сворачиваются в спираль; при этом сигматропные сдвиги могут возникнуть в каждой секции цепи, где спираль заворачивает назад. «Лестницы» - это лестничные полимеры, пара параллельных углеводородных цепей, поперечно связанных С-С связями и снабженных двойными связями, которые способны участвовать в сигматропных сдвигах. Данные сдвиги позволили бы двойным связям перемещаться вверх и вниз по параллельным цепям. Сейчас исследователи ожидают мнения специалистов в области синтетической химии, чтобы выяснить, правы ли они.
Над еще одной попыткой исследовать тему новых способов образования химических связей работает профессор химии Кендалл Хоук(Kendall N. Houk) (Калифорнийский университет, Лос-Анджелес). Он стремится достичь понимания того, каким образом ферменты работают над ускорением реакций, которые трудно запустить. Изучив связующую способность взаимодействий протеина и лиганда в переходных состояниях, группа специалистов под его руководством доказала, что ферменты, ускоряющие реакции со скоростью более, чем 1011, должны иметь сильное ковалентное или частично ковалентное взаимодействие с реагирующими носителями, наряду с любыми нековалентными взаимодействиями («Новости химии и инжиниринга», 16 мая 2005 г., С. 35). По словам Хоука, это спорное предположение противоречит общепринятому мнению, заключающемуся в том, что переходные взаимодействия активного участка ферментов возникают при посредстве нековалентных электростатических взаимодействий, углеводородной связи и гидрофобных взаимодействий. (это нам не интересно)
Группа специалистов под руководством Френкина, занятых детальным изучением ковалентной связи, недавно пришла к новой точке зрения на возможные валентные состояния углерода в органических соединениях. Синтетическая органическая химия в основном охватывает четырехвалентные углеродные соединения, в которые все четыре валентных электрона участвуют в образовании связи. Также хорошо известны устойчивые двухвалентные углеродные соединения, такие как синглетные карбены, имеющие неподеленные пары электронов в углероде, а также два заместителя. Важным примером являются N-гетероциклические карбены, которые стали полезными лигандами в комплексах переходных металлов и как органические катализаторы.
В настоящее время Френкин и его коллеги представили теоретические и экспериментальные свидетельства того, что формально нульвалентный углерод может существовать в соединениях, в которых валентные электроны остаются в виде двух неподелённых пар, не участвующих в связи («Прикладная химия. Международное издание», [Angew.Chem.Int.Ed]2006, 45, 8038). Для этого исследования ученые изучили такие карбодифосфораны, как C(PPh3)2, где фосфин Ph обозначает фенильную группу. В действительности, атом углерода является двухвалентным (как в карбене), и донорами для электронных пар в углеродно-фосфорных связях служат исключительно атомы фосфора. Эта «щедрость» приводит к тому, что углерод остается с двумя неподеленными парами, и атом углерода формально имеет нулевое валентное состояние. Френкин и его коллеги сообщают, что такая картина образования химической связи подтверждается исследованной структурой и высоким протонным сродством к карбодифосфоранам, а также расчетами связи, произведенными группой в ходе исследования.
Для многих специалистов в области неорганической и органометаллической химии многократные связи в более тяжелых элементах основной группы стали темой №1 для изучения. Но такая ситуация сложилась далеко не сразу. До середины 60-х годов химики в основном считали, что максимально допустимой разновидностью кратных связей была тройная связь. Однако в 1964 г. Альберт Коттон(F.Albert Cotton) и его коллеги из Техасского университета агрокультуры и машиностроения поразили сообщество химиков доказательством того, что анион [Re2Cl8]2 содержит четверную связь между двумя атомами металла, - явление, которое никогда не встречали ранее. С тех пор химики изучили множество соединений переходных металлов с четверными связями.
Так прошло 40 лет, но в 2005 году Филипп Пауэр [Philip Power] (Калифорнийский университет в Дэвисе) совместно с коллегами открыл новые горизонты в сфере кратных связей, представив первую пятерную связь в дихромовом комплексе RCrCrR, в котором R означает объемный терфенильный лиганд («Новости химии и инжиниринга», 26 сентября 2005 г., С. 9). Исследователи высказали предположение, что два атома хрома (I), обладающие электронной конфигурацией 3d5, имеют совместные пять электронных пар на пяти связывающих молекулярных орбиталях. При этом Пауэр продемонстрировал крайне осторожную позицию при использовании термина «пятерная» для описания новейшего вида связи, открытого им совместно с коллегами. Он предпочитает называть это явление «пятикратным связыванием», поскольку два металл-лиганда находятся в «транс-изогнутом» положении в большей степени, нежели в линейном, типичном для традиционного многократно связанного соединения, которое ведет к фактической кратности связи менее чем 5.0.
После того, как было представлено понятие пятерной связи, Пауэр и его коллега из Калифорнийского университета в Дэвисе Марчин Бринда (Marcin Brynda), совместно с Бьёрном Роосом(Bjorn O. Roos) и Олофом Видмарком (Per-Olof Widmark) из Лундского (Швеция), а также с Лаурой Гальярди (Laura Gagliardi) из Женевского университета (Швейцария) провели более подробный численный анализ дихромового соединения («Прикладная химия. Международное издание», 2006, 45, 3804). Данное исследование, при котором использовалась простая модель PhCrCrPh, подтверждает идею пятерной связи в дихромовом соединении, а также длины его связи. Впоследствии, Кларк Лэндис(Clark R.Landis) и Фрэнк Вейнхолд (Frank Weinhold) [Висконсинский университет, Мэдисон] представили теоретическое исследование, которое свидетельствует о том, что транс-изогнутая геометрия возникает из положения s- и d-орбиталей. Данная работа также объясняет, как данная геометрия приводит к сильнейшему возможному связыванию («Журнал Американского химического общества», 2006, 128, 7335).
В настоящее время Роос и Гальярди совместно с Антонио Борином (Antonio C.Borin) [Университет Сан-Паулу, Бразилия] представляют результаты еще более широкомасштабного математического исследования, стремясь доказать, что максимальная кратность ковалентной химической связи между двумя элементами составляет шесть, а также то, что именно вольфрамовый димер (W2), вероятно, отличается самой сильной шестерной связью («Прикладная химия. Международное издание», ЦИО: 10.1002/anie.200603600). Некоторые химики уже признали, что в переходных металлах s- и d-орбитали могут объединяться, чтобы способствовать образованию шестерной связи в «голой» двухатомной молекуле – соединении, в котором нет лигандов, чтобы привязать связывающую орбиталь. Несколько соединений с шестерными связями и с весьма короткой длиной связи, например, хром Cr2, были удержаны в газообразной фазе при низкой температуре и исследованы с помощью лазеро-индуцированной флуоресцентной спектроскопии.
Оказывается, число доступных валентных электронов и доступных орбиталей приводит к максимальной кратности связи 6.0 только в нескольких элементах – группы шести переходных металлов (хром, молибден и вольфрам), а также урана. Среди димеров с шестерной связью, состоящих из перечисленных элементов, MO2 и W2 имеют максимально высокую рассчитанную фактическую кратность связи 5.2. Димер W2 претендует на максимально высокую энергию связи вычисленных шестерных связей. Исследователи приписывают более высокую энергию уменьшенному электронному отталкиванию в 5d-орбиталях вольфрама, которые более диффузны, чем 3d- и 4d-орбитали хрома и молибдена.
По словам исследователей, достижение более высокой кратной химической связи должно было бы задействовать дополнительные оболочки атомных орбиталей, такие, как f-орбитали. Однако их расчеты показывают, что формирование дополнительных кратных связей вследствие характера f-орбиталей является маловероятным. Например, шестерная связь в уране U2, которую вычисления определяют как вполне возможную, имеет более низкую энергию связи вследствие участия 5f-орбиталей.
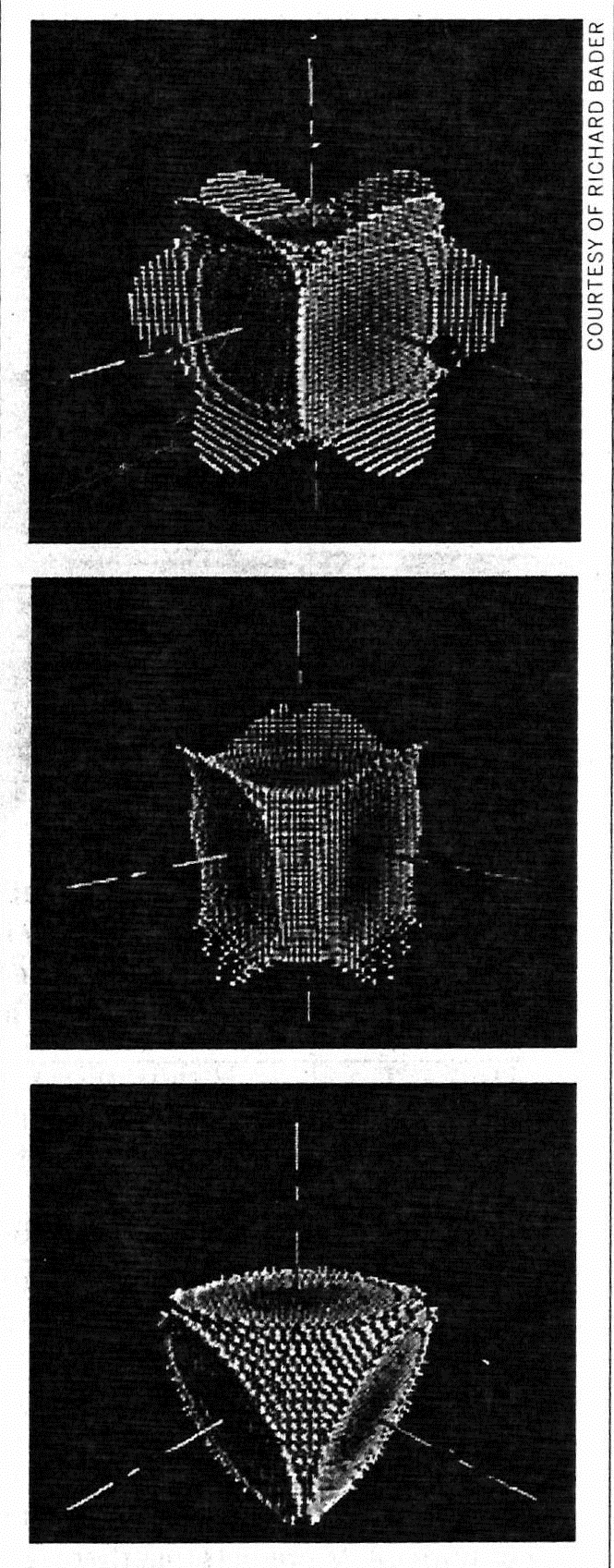 | Электронное облако. Замкнутые участки электронной плотности, вычисленные с помощью теории «атомов-в-молекулах», являются частью связывающих взаимодействий, скрепляющих вместе (сверху вниз) карбонил хрома Cr(Co)6, карбонил железа Fe(CO)5 и карбонил никеля Ni(CO)4. Плотность электронов (белого цвета), связанная с металлическими центрами (на рисунке не видны), может быть отделена от плотностей электронов (не показано) атомов углерода (серого цвета) и атомов кислорода (большие красные сферы). Маленькие красные сферы указывают расположение максимальной плотности электронов для каждого связывающего взаимодействия. |
В то время как некоторые исследователи укрепляют доверие к таким новейшим концепциям образования химической связи, как связывание более высокого порядка, другие в этой сфере развивают нестандартные идеи, которым ещё предстоит утвердиться. Например, группа Шайка в сотрудничестве с группой Филиппа Хиберти (Philippe C. Hiberty) [Парижский университет] занимается определением класса связей, возникающих за счет электронной пары и названных «связями с переносом заряда» («Химия. Европейский журнал», 2005, 11, 6358).
По словам Хиберти, связь с переносом заряда не является результатом традиционной ковалентной или ионной связи, а скорее происходит в результате резонанса между ними. К примеру, когда связь гомоядерная (как в случае с двумя атомами фтора в F2), разделение ковалентных электронов является отталкивающим, и ионная компонента в целом является неполярной (нейтральной). Вместо этого есть большая стабилизирующая энергия резонанса, сгенерированная колебаниями в плотности электронов между двумя атомами. Данная энергия резонанса превосходит отталкивающую ковалентность и обеспечивает незначительную энергию связи, за счет которой атомы держатся вместе.
Как предполагают исследователи, помимо возникновения в гомонуклеарных двухатомных молекулах (таких, как фтор F2, кислород O2 и азот N2), связи с переносом заряда должны проявляться и в полярных C-F связях и в связях таких соединений благородных газов, как фторид ксенона XeF2. Это явление также характерно для двойной и тройной связи и для большинства комплексов, содержащих металл переходной валентности.
Как утверждает Шайк, связь с переносом заряда, по-видимому, представляет собой распространенное явление. Однако по его словам, принятие данной идеи «означает пересмотр концепции ковалентной связи». До того, как общество химиков совершит исключительный поступок (принять эту идею), добавляет Шайк, это сделает независимыми теоретические выводы по теме связи с переносом заряда и, что ещё более важно, экспериментальные исследования, выполненные другими группами специалистов. Шайк, Хиберти и их коллеги, а также Вей Ву из Сямыньского университета (Китай) верят в то, что они определили первый потенциально поддающийся измерению пример резонансной энергии- связи со сдвигом заряда в параллельных водородной и галогенной обменных реакциях, включая фтористый водород («Журнал Американского химического общества», 2006, 128, 2836).
Шайк также принимал участие в разработке модели, необходимой для объяснения ситуации образования связи в симметричных клеткообразных металлических кластерах, в которых атомы металла прочно скреплены вместе даже несмотря на то, что они не имеют общих электронных пар («Журнал физической химии», [J.Phis.Chem.]2006, 110, 8510). Данные «связи без электронных пар» имеют формальную кратность, равную нулю, и возникают, когда каждый атом имеет одиночный валентный электрон с одним и тем же спином. Примеры подобных кластеров со связью без электронных пар (такие, как литий Lin и медь Cun) были исследованы путем расчетов группой Шайка и другими учёными.
Неспаренные электроны со одинаковами спинами неспособны сформировать связывающую пару, поскольку их спиновые состояния должны быть противоположными друг другу. Тем не менее, атомы кластера все равно незначительно скреплены вместе тем, что Шайк называет «ферромагнитной связью», которая, по его словам, основана на ковалентно-ионном резонансном взаимодействии спаренных электронов в двух атомах (электронная пара с тройным состоянием).
Стабилизирующий эффект ферромагнетической связи делокализован и рассеян по ближайшим соседним атомам в кластере. Фактически, данная электронная структура представляет собой резонансный гибрид всех перекрывающих ферромагнетических связей, и достаточно сильна, чтобы стабилизировать кластер по энергии разобщенных (несвязанных) атомов. Поскольку кластер становится больше, то и больше неспаренных электронов участвуют, энергия связи возрастает.
По словам Шайка, данный тип связи демонстрирует, как слабое взаимодействие может стать «необычайно сильной связующей силой, даже без обобщения электронных пар».
Шайк совместно с коллегой из Еврейского университета Дэвидом Дановичем
(David Danovich) и постдокторантами Сэмом де Виссером (Sam P. Visser) и Девешом Кумаром (Devesh Kurmar) вычислили порядок образования химических связей для таких крупных кластеров, как литий Li12 и медь Cu14. Ферромагнетическая связывающая энергия достигла значения примерно 19 ккал/моль для атома Cu10 и выше. По словам Шайка, при таких энергиях связи «ясно, что мы имеем дело не со слабым ван-дер-ваальсовским взаимодействием». Ученый утверждает, что признаки непарной связи были спектроскопически изучены в щелочно-металлических димерах, и данные связи должны быть возможными для других металлов с одиночными неспаренными электронами в валентной оболочке.
Теоретический и вычислительный арсенал средств для исследования и анализа новых моделей связи только продолжает расти. Одним из наиболее значимых методов является теория «атомов в молекулах» (АВМ-теория) - подход, базирующийся на понятии «электронная плотность», который разработал Ричард Бадер (Richard F.W. Bader) из Университета Макмастера (Онтарио).
АВМ-теория представляет предмет исследования в виде точечного ядра, заключенного в концентрированное облако электронов. Молекулярная природа такой системы базируется на пространственной топологии всей электронной плотности и поляризации этой электронной плотности электростатическими силами, возникающими между ядром и электронами. Поскольку отдельные атомы и функциональные группы вносят вклад в общие свойства молекулы, которую они формируют, можно деконструировать молекулу и осуществить удобные вычисления «по кусочкам» с помощью АВМ-теории. Затем можно собрать показатели «кусочков» вместе и воссоздать молекулу.
Как утверждает Бадер, АВМ-теория не определяет понятие «связь», поскольку связей не существует. Вместо этого данная теория обозначает то, что «два атома связаны, именно с помощью глагола, но не существительного». По словам Бадера, связанные атомы обозначены линией, называемой «дорожкой связи». Она нарисована между двумя атомами там, где электронная плотность является максимальной.
Бадер считает, что с помощью АВМ-теории ученые-химики могут рассчитывать любые значительные параметры молекулы, например, заряд атома, дипольный момент и энергии связи. Присутствие «дорожки связи» в любой структуре «однозначно определяет атомы, как связанные друг с другом, независимо от любого допускаемого механизма образования связи». Будучи по образованию специалистом в области физико-органической химии, Бадер утверждает, что полного понимания связи можно достигнуть только с помощью этой надежной физической концепции.
Некоторые химики считают АВМ-теорию одной из самых важных среди новых теорий связи последних десятилетий. Данная теория все больше применяется при изучении множества химических систем, включая полупроводниковые материалы и биомолекулы. «АВМ-теория предлагает объяснения для реальных проблем, так как имеет дело с физикой», - говорит Бадер.
Однако прозаичный подход Бадера не принимается всеми специалистами в области вычислительной химии. Несколько исследователей предъявили к теории замечания, поскольку она может привести к интерпретациям, дающим маловероятные результаты.
К примеру, АВМ-теория предполагает, что между двумя ближайшими атомами гелия есть «дорожка связи» для формирования молекулы гелия He2, схожей с молекулой водорода H2. По словам Френкина, химики принимают то, что связующее взаимодействие в H2 образовывает связь. Но что касается молекулы He2, несмотря на то, что она была спектроскопически исследована при очень низких температурах, притяжение He-He столь незначительно, что не может считаться химической связью. Ученые-химики проводят различие между молекулами He2 и H2, добавляет Френкинг, в то время как согласно АВМ-теории они рассматриваются на равном основании.
Френкин говорит, что благодарен Бадеру за его позицию в химии, поскольку Бадер «доказывает, что нельзя забывать физические законы при использовании моделей химической связи». АВМ-теория является важным вкладом, считает Френкин, «однако к данной теории можно подходить с химическим восприятием, а не только с физическим. Что действительно имеет значение – это то, как именно теоретические методы и модели связи помогают понять устройство материального мира на молекулярном уровне».
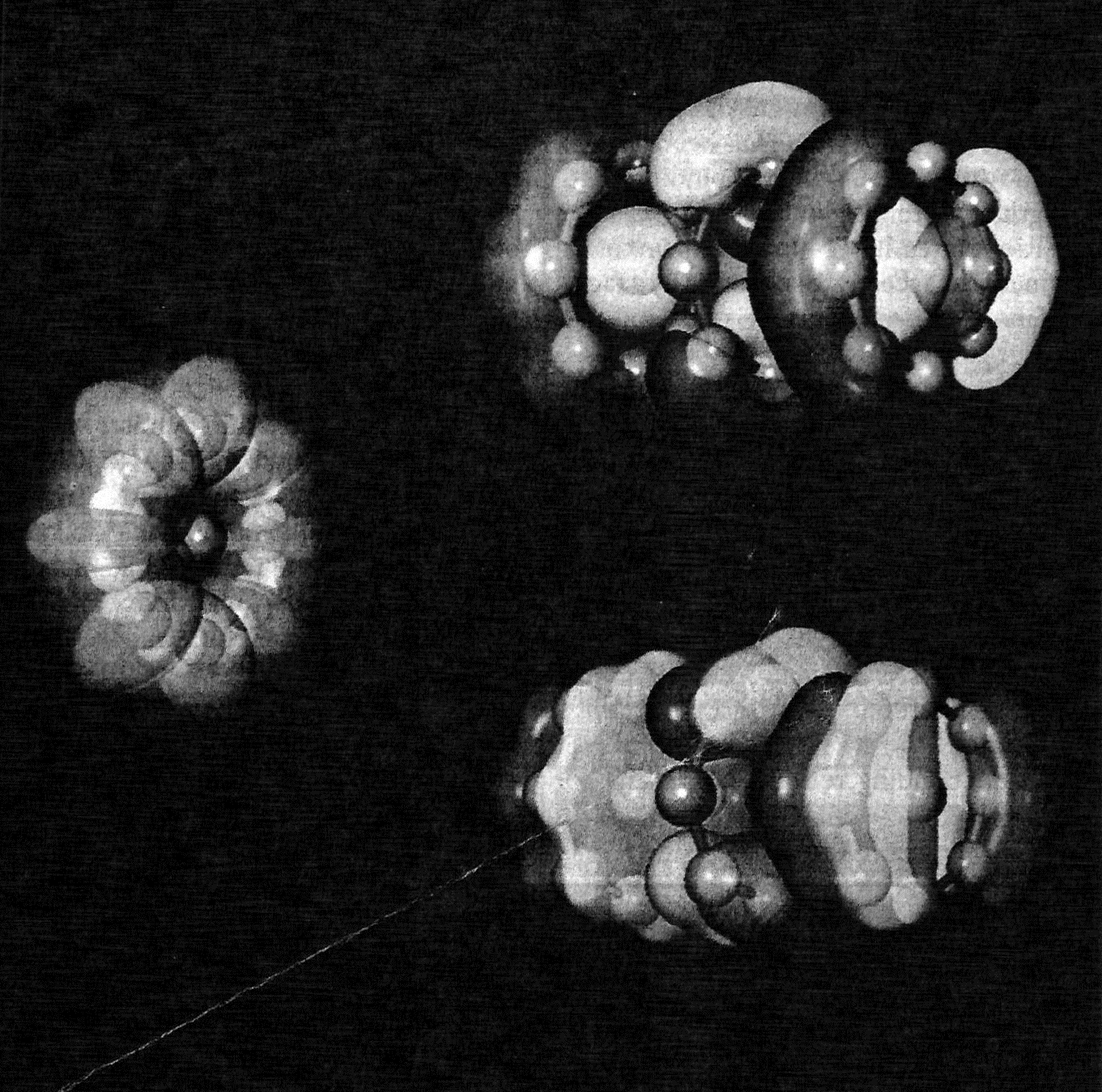
 | Шестерной блок Предполагается, что молекула дивольфрама W2 скреплена вместе шестерной связью (молекулярные орбитали показаны на рисунке), которая теоретически представляет максимальное число связей, возможных между двумя атомами. Подготовленная, она может превзойти пятерную связь молекулы хрома Cr2, экспериментально исследованную в 2005 году. |
Частично выводы Френкина происходят из его работы, проведенной с целью выяснить, может ли быть связывающее взаимодействие между атомами благородного газа, как это предполагает АВМ-теория. Группа под его руководством изучила пары атомов благородных газов, помещенные внутрь клетки фуллерена, например, Xe2@C60. Расчеты указывают на то, что соединение Xe2@C60 является энергетически выгодным и имеет короткую связь Xe-Xe, говорит Френкин читателям журнала «Новости химии и инжиниринга». «Но связь ли это?» - вопрошает он.
По словам ученого, согласно определению понятия «химическая связь», установленным Международным союзом теоретической и прикладной химии, это действительно связь. Согласно ЮПАК (Union of Pure & Applied Chemistry), связь существует между двумя атомами или группами атомов, когда силы, действующие между ними, приводят к объединению с устойчивостью, достаточной, чтобы молекулярные соединения считались независимыми. Френкин считает, что «Xe2@C60, по существу, является поддающимся экспериментальной оценке соединением, которое должно быть долговечным, поскольку активационный барьер для его разрыва достаточно высокий». «Если данное соединение не имеет этой химической связи, тогда чем является Xe2@C60? Это определенно молекула».
В журнале «Вычислительная химия» Френкин и Шайк пишут: «Химическая общественность согласна с тем, что в настоящее время понятие химической связи может быть правильно определено только в рамках квантовой механики». Ученые поддерживают «полифоническую культуру» вычислительной химии, которая включает множество различных моделей образования связи, и они не стали бы предлагать сократить эту культуру до монолита с одной-единственной доминирующей теорией. «Это бы разрушило интеллектуальное наследие химии и её творческую природу», - считает Шайк.
«С расстояния в 90 лет мы понимаем, что некоторые выводы, сделанные Льюисом, были неверными», пишут Френкин и Шайк в специальном выпуске журнала «Вычислительная химия». «Но, несмотря на все незначительные отклонения и неточности, работа Льюиса оказала колоссальное влияние на эволюцию химии, в которой концепция ковалентной связи остается ведущей темой».
