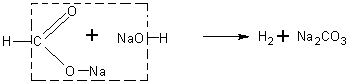Методика и техника пособие для учителей издание пятое, переработанное и дополненное Под общей редакцией Е. И. Оржековской
| Вид материала | Документы |
СодержаниеМуравьиная кислота Окисление муравьиной кислоты Получение муравьиной кислоты Взаимодействие формиата натрия с натронной известью |
- Учебник издание пятое, переработанное и дополненное проспект москва 2001 Том 3 удк, 11433.24kb.
- Учебник издание пятое, переработанное и дополненное проспект москва 2001 Том 3 удк, 11230.01kb.
- Курс экономической теории учебник Издание 4-е, дополненное и переработанное Под общей, 13419.12kb.
- Открытое общество и его враги. Том I. Чары Платона, 8727.87kb.
- Учебник 3-е издание, переработанное и дополненное, 10138.23kb.
- Учебник. 3-е издание, переработанное и дополненное, 10586.44kb.
- Жёлтышева анжела владимировна, 2426.67kb.
- П. И. Пидкасистого третье издание, дополненное и переработанное Учебное пособие, 11008.18kb.
- Рабочая программа учебного курса «Литература», 449.21kb.
- Учебное пособие для технических вузов Серия «Современное высшее образование», 19249.92kb.
МУРАВЬИНАЯ КИСЛОТА
При изучении муравьиной кислоты необходимо поставить опыты, показывающие особенности ее строения и химических свойств.
Разложение муравьиной кислоты на оксид углерода (II) и воду. После того как учащиеся ознакомятся с физическими свойствами муравьиной кислоты (агрегатное состояние, запах, цвет) и вспомнят ее структурную формулу по реакциям окисления формальдегида, целесообразно поставить вопрос о том, как может быть подтверждена ее структурная формула. Учащиеся обращают внимание на то, что молекула муравьиной кислоты построена как бы из молекулы воды и молекулы оксида углерода (II):
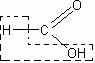
Естественно встает вопрос, нельзя ли получить кислоту реакцией оксида углерода (II) с водой. Учитель сообщает, что эта реак-
ция не идет так просто, как кажется: угарный газ не вступает в реакцию с водой. Но можно провести обратную реакцию: разложить кислоту на оксид углерода (II) и воду. В качестве водоотнимающего средства можно воспользоваться часто применяемой для этой цели серной кислотой. Оксид углерода (II) нетрудно будет обнаружить по его характерному пламени при горении.
В небольшую колбочку (или пробирку) с отводной трубкой наливают 1 мл муравьиной кислоты и 3-4 мл концентрированной серной кислоты. Колбу закрывают пробкой и нагревают в пламени горелки. Образующийся газ собирают в два цилиндра над водой. Во втором цилиндре газ поджигают (в первом — смесь газа с воздухом может дать взрыв). По синей окраске пламени учащиеся узнают оксид углерода (II). После этого поджигают оксид углерода (II) у отводной трубки. Опыт ведут до полного разложения муравьиной кислоты или останавливают его, прекращая нагревание. При проведении опыта необходимо следить, чтобы ядовитый газ не проникал в помещение. Опыт подтверждает формулу муравьиной кислоты.
Окисление муравьиной кислоты. Учащиеся легко устанавливают, что муравьиная кислота одновременно является альдегидом, так как имеет группировку атомов
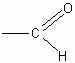
Это дает возможность предположить, что муравьиная кислота должна окисляться легче уксусной, и в частности давать реакцию серебряного зеркала.
До проведения опыта можно высказать предположение и о том, какие вещества будут получаться в результате реакции. Учащиеся составляют уравнение реакции, аналогичное уравнению для альдегидов, и замечают, что образуется угольная кислота:
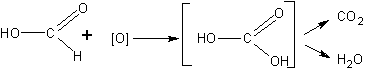
Поскольку угольная кислота, как известно, распадается с образованием углекислого газа, то для большей убедительности опыт, следовательно, надо поставить так, чтобы попытаться обнаружить углекислый газ.
а) Окисление перманганатом калия. В колбочке или пробирке с отводной трубкой к 1 мл муравьиной кислоты приливают 10 мл разбавленного раствора перманганата калия и немного серной кис-
лоты. Нагревают колбу через асбестовую сетку. Отводную трубку опускают в известковую воду. Перманганат калия при реакции обесцвечивается, содержимое колбы пенится от образующегося газа, и известковая вода мутится. Уксусная кислота, как известно, не обесцвечивает перманганат калия.
б). Окисление аммиачным раствором гидроксида серебра. Реакцию проводят как обычно, однако восстанавливающееся серебро при этом чаще всего выделяется не в виде зеркала, а в виде черного
осадка.
Получение муравьиной кислоты. Получение муравьиной кислоты из спирта и альдегида после всего изученного не представляет особого интереса. Значительно важнее было бы показать учащимся получение кислоты синтезом формиата натрия из оксида углерода(II) и едкого натра, что соответствует промышленному способу. Однако необходимость обращения со значительными количествами оксида углерода (II), даже при всей тщательности работы, делает опыт неприемлемым для школы.
При отсутствии в лаборатории муравьиной кислоты она может быть приготовлена нагреванием щавелевой кислоты с глицерином. Щавелевая кислота в этих условиях разлагается, образуя углекислый газ и муравьиную кислоту:
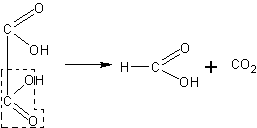
В колбу емкостью 200—250 мл с отводной трубкой помещают 30 г безводного глицерина и 30 г безводной щавелевой кислоты (кислоту обезвоживают осторожным нагреванием в сушильном шкафу при 95 - 100°С). Закрывают колбу пробкой с термометром, шарик которого погружают в смесь веществ. К колбе присоединяют нисходящий холодильник и приемник для дистиллята. Нагревают колбу через асбестированную сетку так, чтобы термометр показывал 110 — 115°С. Около 100°С начинается обильное выделение углекислого газа. При этом начинает отгоняться муравьиная кислота. Когда выделение углекислого газа станет слабым, добавляют вторую порцию (30 г) щавелевой кислоты и снова продолжают перегонку. При необходимости добавляют третью такую же порцию кислоты. После повторной дистилляции удается получить довольно крепкую муравьиную кислоту (темп. кип. кислоты 100°С).
Если почему-либо не удалось приготовить безводную щавелевую кислоту, можно воспользоваться кристаллической кислотой, беря ее всякий раз несколько большее количество. В этом случае будет получаться менее концентрированная кислота, так как одновременно перегоняется значительное количество воды.
Взаимодействие формиата натрия с натронной известью. Учащимся известно, что при нагревании солей карбоновых кислот с натронной известью (или едким натром) образуются соответствующие углеводороды.
Будет очень интересно предложить учащимся решить вопрос о том, какие продукты получатся при нагревании формиата натрия с натронной известью, а затем поставить соответствующий опыт и определить образующиеся вещества.
При реакции получаются водород и карбонат натрия: