Методика и техника пособие для учителей издание пятое, переработанное и дополненное Под общей редакцией Е. И. Оржековской
| Вид материала | Документы |
СодержаниеВзаимодействие метанола с хлороводородом Получение метанола при сухой перегонке дерева Сравнение свойств одноатомных спиртов |
- Учебник издание пятое, переработанное и дополненное проспект москва 2001 Том 3 удк, 11433.24kb.
- Учебник издание пятое, переработанное и дополненное проспект москва 2001 Том 3 удк, 11230.01kb.
- Курс экономической теории учебник Издание 4-е, дополненное и переработанное Под общей, 13419.12kb.
- Открытое общество и его враги. Том I. Чары Платона, 8727.87kb.
- Учебник 3-е издание, переработанное и дополненное, 10138.23kb.
- Учебник. 3-е издание, переработанное и дополненное, 10586.44kb.
- Жёлтышева анжела владимировна, 2426.67kb.
- П. И. Пидкасистого третье издание, дополненное и переработанное Учебное пособие, 11008.18kb.
- Рабочая программа учебного курса «Литература», 449.21kb.
- Учебное пособие для технических вузов Серия «Современное высшее образование», 19249.92kb.
МЕТАНОЛ
Ряд опытов с метанолом может быть поставлен по аналогии с вышеописанным, при этом нет необходимости воспроизводить опыты в том объеме, как они ставятся при изучении этанола.
Поэтому здесь описываются опыты, характеризующие лишь некоторые особенности самого метанола.
Взаимодействие метанола с хлороводородом. Очень ле1 ко и быстро можно получить хлорметан по реакции:
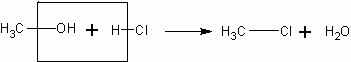
Демонстрация этого опыта подтверждает наличие гидроксильной группы в молекуле метанола. Хлорметан представляет собой газ и может быть обнаружен по цвету пламени.
1. В маленькую колбочку или пробирку с отводной трубкой наливают по 1-2 мл метанола, концентрированной соляной кислоты и концентрированной серной кислоты. При несильном нагревании смеси образуется газ, который после вытеснения воздуха собирают в цилиндр или пробирку над водой и поджигают. Хлорметан горит характерным зеленым пламенем, газ можно также поджечь у отводной трубки. Хлорметан не следует выпускать в лабораторию, так как он ядовит.
2
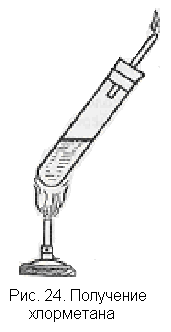 . В пробирку (рис. 24) наливают по 1 мл метанола и концентрированной серной кислоты и добавляют немного (на кончике ножа) прокаленной поваренной соли. Колбочку закрывают пробкой со стеклянной трубкой. При слабом нагревании образуется Хлорметан, который поджигают у отводной трубочки. При внесении в пламя стеклянного или фарфорового предмета образуется копоть, что свидетельствует о горении органического вещества.
. В пробирку (рис. 24) наливают по 1 мл метанола и концентрированной серной кислоты и добавляют немного (на кончике ножа) прокаленной поваренной соли. Колбочку закрывают пробкой со стеклянной трубкой. При слабом нагревании образуется Хлорметан, который поджигают у отводной трубочки. При внесении в пламя стеклянного или фарфорового предмета образуется копоть, что свидетельствует о горении органического вещества.По аналогии с образованием бромэтана уравнение реакции для простоты можно представить в следующем виде:
NaCI + H2SO4 NaHSO4 + НСI
СН3ОН + НСI СН3СI + H2O
На самом деле реакция идет через образование метилсерной кислоты СН3 — О — SO2OH, которая затем реагирует с хлоридом натрия, образуя Хлорметан и гидросульфат натрия:
CH3OSO2OH + NaCI СН3СI + NaHSO4
Получение метанола при сухой перегонке дерева. Получение спирта по этому способу состоит из двух частей:
а) сухой перегонки дерева с целью получения дегтярной воды (наряду с углем, дегтем и газом) и б) выделения метанола из дегтярной воды.
Сухую перегонку дерева проводят в круглодонной термостойкой колбе с отводом (рис. 25). В колбу помещают сухие опилки и
стружку и нагревают сначала осторожно, а потом все сильнее и сильнее до тех пор, пока наблюдается обугливание дерева и образование жидких и газообразных продуктов. Приемник для дегтя и дегтярной воды ставят о ледяную воду, а выделяющиеся газы собирают путем вытеснения воды из пробирки.
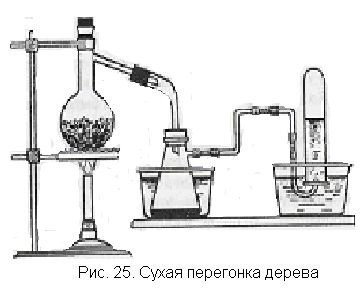
Когда будет получено достаточное для демонстрации количество жидкости, опыт прекращают. При этом обращают внимание учащихся на расслоение жидкости (внизу — водный слой, сверху — деготь). С помощью делительной воронки отделяют водный слой и лакмусовой бумажкой обнаруживают присутствие кислоты.
Газообразные продукты сухой перегонки дерева собирают в два сосуда (цилиндры или пробирки). Затем в одном из них поджигают газ, который горит синеватым пламенем, а в другой приливают известковую воду для обнаружения углекислого газа в продуктах перегонки.
Для доказательства присутствия метанола в дегтярной воде уксусную кислоту нейтрализуют избытком гидроксида кальция (лакмус!) и, когда кислота будет связана, нагревают жидкость до кипения в пробирке с отводной трубкой. При поджигании пары метанола горят голубоватым пламенем.
Уксусную кислоту превращают в соль с той целью, чтобы она не улетучивалась с метанолом и не мешала распознаванию его по характеру пламени. Эта операция не усложняет понимания учащимися опыта, так как понятие о нейтрализации кислот они имеют. Присутствием ацетона в дегтярной воде при этом опыте можно пренебречь.
Для извлечения метанола берут по возможности большое количество дегтярной воды (например, 100 мл), нейтрализуют ее неболь-
шими порциями мела или известковым молоком, как было указано в предыдущем опыте, и фильтруют. Фильтрат помещают в перегонную колбу, закрывают колбу пробкой с термометром, присоединяют прямой водяной холодильник и отгоняют на водяной бане фракцию до 70—75'С. Метанол получается при этом с примесью воды и ацетона. Ацетон неизбежно летит со спиртом, так как точки кипения их близки (у метанола 65°С, у ацетона 56°С).
Сравнение свойств одноатомных спиртов. Обладая сходными химическими свойствами и составляя один гомологический ряд, предельные одноатомные спирты различаются по физическим свойствам и характеру горения. Это может быть легко показано на опытах.
а) В одинаковые цилиндры или демонстрационные пробирки наливают по 50 мл воды, подкрашенной перманганатом или бихроматом калия и добавляют по 10 мл спиртов, имеющихся в лаборатории, например, метанол, этанол, пропанол-1, пропанол-2, 2-метилпропанш1-2, бутанол, изобутанол и т.д. Энергично встряхивают содержимое цилиндров и дают жидкостям отстояться. Наблюдают, что первые гомологи растворились в воде полностью, бутанол растворяется частично, а другие не растворяются.
б) В небольшие тигли или фарфоровые чашечки наливают спирты в той же последовательности и поджигают. Наблюдают, что с увеличением молекулярного веса и содержания углерода в спиртах светимость пламени возрастает; высшие спирты горят коптящим пламенем. Тушат пламя, покрывая тигли крышками или стеклянными пластинками.
в) В пробирки или химические стаканчики наливают одинаковые количества различных спиртов и помещают небольшие кусочки металлического натрия. Сравнивают скорость выделения водорода в этих случаях.
