Теоретические основы создания и оптимизации свойств хладоносителей для систем косвенного охлаждения
| Вид материала | Автореферат |
- Исследование и разработка моделей и методов оптимизации структур телекоммуникационных, 179.52kb.
- Система охлаждения двигателя автомобиля, 231.89kb.
- Календарно тематический план занятий Предмет: информационные системы в экономике для, 38.5kb.
- Аннотация программы дисциплины «Теоретические основы систем мобильной связи», 680.62kb.
- 1. Теоретические основы создания и функционирования систем внутреннего контроля, 77.22kb.
- Теоретические основы информационных процессов и систем [Текст] : учебник для студентов, 144.33kb.
- Рабочая программа По дисциплине «Сетевые технологии» По специальности 230102. 65 Автоматизированные, 210.65kb.
- Рабочая программа по дисциплине Теоретические основы электротехники Рекомендуется для, 705.4kb.
- Научно-технические основы создания систем питания высоковольтных устройств пыле-, 491.12kb.
- Рабочая программа дисциплины «Физика низкоразмерных структур», 49.43kb.
Для описания вязкости растворов существуют различные теоретические подходы. Согласно Джонсу-Долу, зависимость относительной динамической вязкости раствора электролита от его концентрации выражается формулой:
| μ / μ0 = 1 + Ас1/2 + Вс, | (12) |
где μ и μ0 – динамическая вязкость раствора и растворителя; А – коэффициент, учитывающий межионные взаимодействия, может быть рассчитан на основании теории Дебая-Хюккеля и всегда положителен; В – коэффициент вязкости, характеризующий взаимодействие ионов с растворителем. В может принимать как положительные, так и отрицательные значения.
Из уравнения следует:
- если μ / μ0 < 1, то В < 0 (так называемая отрицательная вязкость);
- если μ / μ0 > 1, то знак коэффициента вязкости зависит от абсолютной величины произведения Ас1/2, при этом чаще он имеет положительное значение (так называемая положительная вязкость).
Физический смысл коэффициента вязкости следует соотносить с так называемой положительной и отрицательной гидратацией (сольватацией). Один из подходов к теории гидратации предполагает, что ионы по своей способности связывать молекулы воды ближнего окружения делятся на две группы.
К первой группе относятся однозарядные одно- и многоатомные ионы с большим радиусом (К+, Сs+, Br-, J-, MnO4-, Cl4- и др.). В этом случае ближайшие к ионам молекулы воды более подвижны, чем в чистой воде, т.е. имеет место эффект разупорядочения структуры воды (изменение энтропии воды в процессе гидратации ΔSгидр > 0). Это ионы с отрицательной гидратацией.
Вторую группу образуют небольшие по размеру однозарядные ионы (Li+, F-), а также многозарядные ионы (Mg2+, Al3+, SO42-, PO43- и др.). В присутствии этих ионов ближайшие молекулы воды менее подвижны, чем в чистой воде, т.е. происходит эффект упорядочения структуры воды (ΔSгидр < 0). Эти ионы называются ионами с положительной гидратацией.
На рис. 3 приведены зависимости типа гидратации однозарядных ионов от их размеров.
Из рисунка видно, что положительно гидратированные ионы располагаются над осью абцисс, ионы с отрицательной гидратацией – ниже оси абцисс. Ионы Ag+, Na+, Cl- находятся вблизи границы перемены знака ΔSгидр.
Применительно к смешанным растворителям, в частности, водно-пропиленгликолевым, следует говорить о положительной и отрицательной сольватации ионов и электролитов. В обоих случаях катионы образуют координационные связи с электронодонорными атомами кислорода растворителя, а анионы взаимодействуют с молекулами растворителя посредством водородных связей. Не случайно для большинства ионов стандартная энергия переноса из воды в другой растворитель составляет, как правило, не более 6-10% от энергии гидратации, а в смешанный водно-органический – не более 3-4%. Поэтому для выявления характера изменения относительной вязкости водно-пропиленгликолевых электролитных растворов от природы электролитов можно использовать их значениями энергии гидратации или энергии сольватации.


а) б)
Рис. 3. Зависимость ΔSгидр от радиуса: а) – одноатомных катионов;
б) – одноатомных анионов
Пусть μ — динамическая вязкость раствора электролита в ВПГ растворителе, μ0 - вязкость водно-пропиленгликолевого раствора в отсутствие электролита, т.е водно-пропиленгликолевого растворителя. Величина μ/μ0, называемая относительной вязкостью, характеризует влияние электролита на вязкость раствора. В присутствии различных электролитов величины μ/μ0 могут иметь разные значения. Для того, чтобы вязкость раствора электролита в ВПГ-растворителе была меньше вязкости водно-пропиленгликолевого растворителя, т.е. чтобы соблюдалось условие μ/μ0 < 1, необходимо ввести такой электролит, ион (ионы) которого имеет (имеют) отрицательное значение В-коэффициента. Знак В-коэффициента зависит от принадлежности иона к одно- или многоатомным, от знака и величины заряда иона, а также его радиуса.
На рис. 4 показан характер изменения величины μ/μ0 растворов электролитов, в состав которых входят сравнимые по свойствам ионы, от их концентрации.
Из двух электролитов NaCl и NaJ, отличающихся анионом, первый содержит анион Cl-, находящийся на границе положительной и отрицательной гидратации (коэффициент В незначительно больше нуля). В состав электролита NaJ входит анион J- с отрицательной гидратацией (В < 0). Поэтому в соответствии с уравнением Джонса-Дола при увеличении концентрации с значение μ/μ0 для раствора NaCl увеличивается, для раствора NaJ – уменьшается.
Из двух электролитов NaJ и КJ, отличающихся катионом, второй содержит катион K+, отрицательный коэффициент В которого по абсолютной величине больше, чем у катиона Na+, входящего в электролит NaJ. В результате при увеличении концентрации электролита наиболее резко уменьшается относительная вязкость раствора KJ.
Теоретические и экспериментальные исследования показали, что при выборе из нескольких электролитов, способных уменьшить вязкость водно-пропиленгликолевого раствора, целесообразно руководствоваться значениями энтальпий сольватации ΔНс этих электролитов в растворителе с соответствующей массовой долей ПГ. При этом величины ΔНс могут быть найдены из теплот растворения при бесконечном разбавлении и энергий кристаллических решеток электролитов.

Рис. 4. Зависимость относительной вязкости μ/μ0 растворов электролитов NaCl, NaJ, КJ в ВПГ - растворителе от их концентрации с (ξпг = 30%)
Нами изучена зависимость относительной вязкости растворов галогенидов калия и хлоридов натрия, калия, цезия и аммония в водно-пропиленгликолевом растворителе (массовая доля ПГ 26%) при 20° С от природы катионов и анионов, точнее, от энергии гидратации этих ионов. Экспериментальные данные для галогенидов калия при концентрации электролитов 2,0 моль/кг показаны на рис. 5.
Из рис. 5 следует, что отношение μ/μ0 для всех электролитов при выбранных фиксированных значениях ξпг и сm является линейной функцией от их энтальпии гидратации. Причем с увеличением ΔHгидр относительная вязкость раствора возрастает, а с уменьшением – наоборот. Этот факт можно объяснить следующим образом.
При больших значениях энтальпии гидратации электролита увеличение вязкости раствора за счет образования сольватокомплексов преобладает над уменьшением вязкости за счет разрыва водородных связей между молекулами растворителя в присутствии ионов электролитов. В результате относительная вязкость раствора электролита с высоким значением энтальпии гидратации оказывается выше, чем у электролита с меньшим значением энтальпии гидратации. При невысоких значениях ΔHгидр картина обратная.

Рис. 5. Зависимость относительной динамической вязкости растворов галогенидов калия в водно-пропиленгликолевом растворителе от энтальпии гидратации галогенидов (ξпг = 26%; сm = 2,0 моль/кг)
Проведенные исследования позволили научно обосновать и экспериментально подтвердить связь между характером изменения вязкости ВПГЭ растворов и природой электролитов. В частности, установлено, что определяющим фактором является тип гидратации ионов электролитов, который количественно выражается посредством В-коэффициентов, принимающих положительные или отрицательные значения. Впервые дана интерпретация относительной динамической вязкости ВПГ электролитных растворов через величину, всесторонне характеризующую взаимодействие между ионами и молекулами электролита – энтальпию сольватации. Это открывает большие возможности для выбора электролита с прогнозируемым эффективным действием по снижению вязкости ВПГ растворов.
Исследование большого числа (более 20) электролитных систем показало, что наиболее эффективными по снижению вязкости ВПГ-растворителя являются электролиты KBr и KJ. В частности применение ВПГЭ растворов на основе йодида калия с концентрацией 1,2-2,0 моль/кг и массовой доле ПГ 30-40% позволяет уменьшить вязкость на 33 - 46 %.
Оптимизация состава хладоносителя методом планирования эксперимента.
Одним из главных факторов, определяющим свойства ХН, является природа электролита. Значимыми факторами являются массовая доля пропиленгликоля в смешанном растворителе, концентрация электролита и температура хладоносителя.
С одной стороны, опытные данные подтвердили теоретические предпосылки о возможности целенаправленного изменения некоторых свойств хладоносителя в лучшую сторону (уменьшение вязкости, снижение температуры замерзания, уменьшение коррозионного воздействия на металлы) посредствам введения электролита в ВПГ растворитель. С другой стороны, в силу недостаточного развития теории сильных электролитов, вообще, и в смешанных растворителях, в частности, всесторонний учет влияния факторов на физико-химические свойства ХН трудно поддается детерминированному описанию с помощью термодинамических и критериальных уравнений. Поэтому представляется целесообразным осуществить математико-статистический подход к исследованию водно-органических электролитных систем, т.е. перейти к изучению формальной связи между параметрами трехкомпонентного раствора.
Для исследования влияния концентрации электролита (использовался электролит KJ), массовой доли ПГ в водно-пропиленгликолевом растворителе и температуры (х1–х3 - факторы оптимизации) на физико-химические (у1-у5) свойства ХН (параметры оптимизации) использовали метод планирования эксперимента. Введем обозначения: массовая доля пропиленгликоля ξ, % - х3; концентрация электролита Cm, моль/кг- х1; температура проведения эксперимента t, °C - х2; температура замерзания хладоносителя t3, °С – у1; плотность хладоносителя р, кг/м3 - у2; теплоемкость хладоносителя Ср,Дж/кг·К - у3; теплопроводность хладоносителя λ, Вт/(м·К) - у4; динамическая вязкость хладоносителя μ, мПа·с - у5.
Факторы х1, х2, х3 являются входными параметрами, а (у1-у5) – выходными параметрами или функциями отклика. С математической точки зрения задачей исследования является построение адекватной математической модели в виде уравнения регрессии, описывающей взаимосвязь между функциями отклика yi и входными параметрами:
| уi = f (х1, х2, х3) | (13) |
Наиболее распространенной моделью в задачах исследования является полином. В большинстве задач оказывается достаточным использование полинома второй степени:
| yi = bo+b1x1+b2х2+ + b12x1х2+ b13 x1х2 +…+ b11x12+b22x22+… | (14) |
Коэффициенты уравнения (14), как правило, определяются с помощью компьютерных программ, реализующих метод наименьших квадратов.
Адекватность уравнения регрессии определяется мерой рассеяния экспериментальных значений функций отклика уi относительно сглаженной кривой уравнения, характеризуемой, как правило, остаточной дисперсией
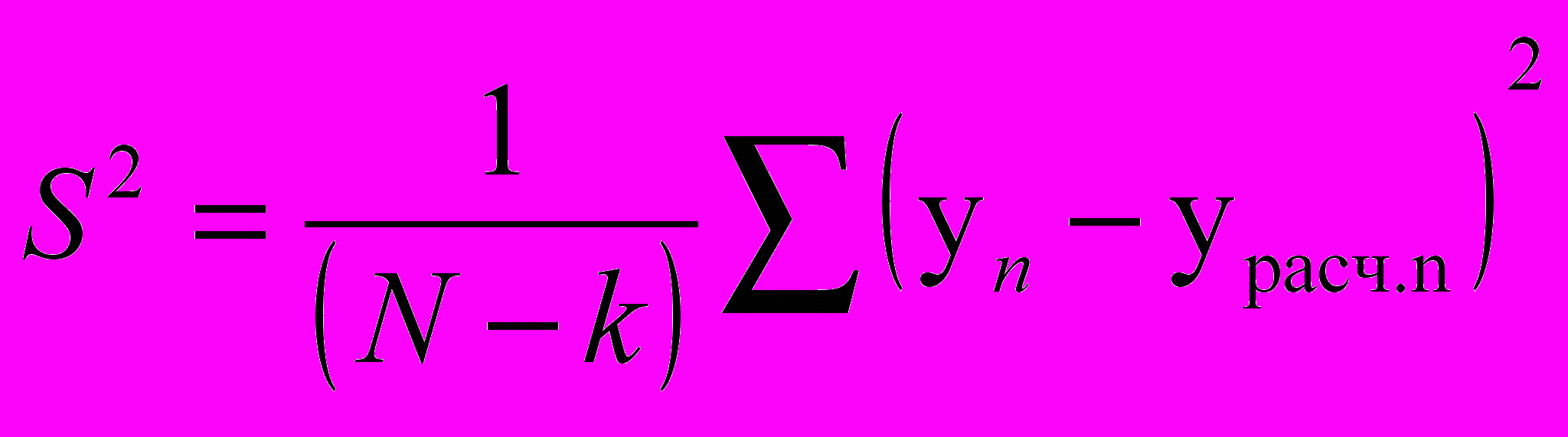 или или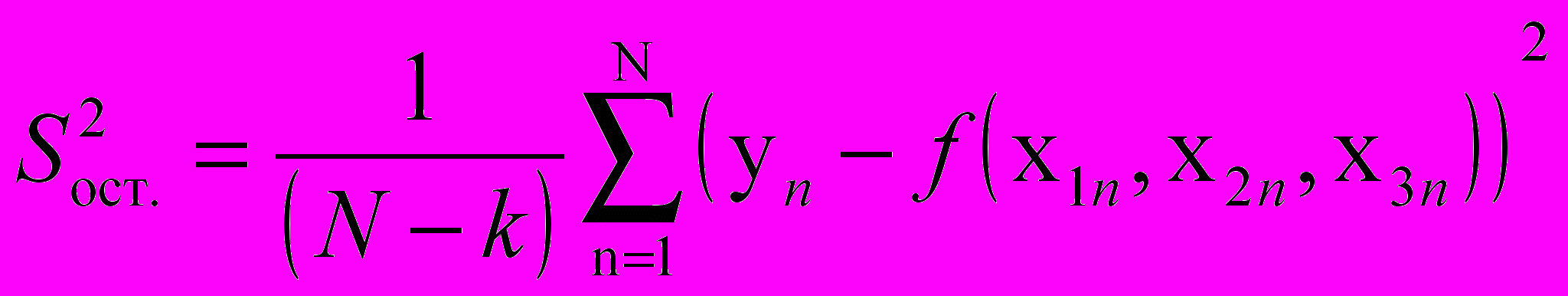 | (15) |
где N - число экспериментальных точек, k - число оцениваемых коэффициентов регрессии, n - текущая точка, урасч.n - текущее значение функции отклика, рассчитанное по уравнению регрессии в n-й точке.
Метод позволяет определить значения входных параметров эксперимента для получения адекватной математической модели, позволяющей, с одной стороны, оценить направление и степень влияния каждой входной переменной на выходной параметр, а с другой - использовать построение уравнений регрессии при решении задачи оптимизации. Кроме того, при минимальном числе опытов может быть осуществлено крутое восхождение к области с экстремальными значениями функций.
Для этого на первом этапе был выбран ортогональный полный факторный двухуровневый эксперимент (ПФЭ) типа 23. При таком планировании каждый анализируемый фактор заменяется своим кодированным значением:
| Хi = (хi - х0i)/Δ хi | (16) |
где x0i- основной уровень варьирования; Δxi - шаг варьирования.
После проведения замены переменных каждый входной параметр принимает только два значения «-1» и «+1», т.е. варьирует на двух уровнях - верхнем и нижнем.
Основной, верхний и нижний уровни, а также шаг варьирования переменных ΔXi определялись исходя из априорных теоретических предпосылок, согласно которым выходные параметры раствора чувствительны к содержанию его компонентов, в частности, электролита. Кроме того, прогнозируемые значения функций отклика, например по вязкости, могут быть обеспечены только в том случае, когда достигнута определенная (часто максимальная) концентрация растворенного вещества в ВПГ растворителе при той или иной температуре. Совокупность этих обстоятельств, а также отсутствие необходимости понижать вязкость растворов с ξ ПГ меньше 25%, обусловили выбор рациональной области варьирования: 0,5<х1<2,5; 25<х3<45.
Для построения модели более высокого порядка, включающей коэффициенты при квадратичных членах bii полный факторный эксперимент ПФЭ 23 был дополнен до многоуровневого плана, который был обработан с использованием стандартных компьютерных программ, реализующих методы регрессионного анализа. При этом необходимость одновременного удовлетворения комплекса свойств в заданной области изменения входных параметров требует рассмотрения задачи оптимизации состава раствора как задачи отыскания условного экстремума функции при ограничениях, накладываемых другими выходными параметрами.
Параметры оптимизации при заданных ограничениях рассчитывают по уравнению (14), коэффициенты которого определены методом шаговой регрессии. Полученные с помощью компьютерной программы полиномиальные уравнения регрессии для температуры замерзания, вязкости, теплоемкости, плотности и теплопроводности имеют вид:
| t3 = 21,453-10,160x1-1,092х3+0,203х1х3-0,420х12 | (17) |
| μ = –9,202+0,299х2+0,507х3+0,086х1х2-0,048х1х3 - 0,022x2·x3+0,0072x22 | (18) |
| ср = 4483-776,6х1+3,400х2-12,96х3+74,35х12 | (19) |
| ρ = 995,8+140,1х1-1,936х2+0,902х3-0,592х1х2+0,039х2х3-6,670х12+0,0135х22 | (20) |
| λ = 0,591-0,076х1+0,0020х2-0,0054х3+0,00052х1х3-0,000015х2х3+0,0100х12 | (21) |
С помощью этих уравнений можно выбрать оптимальный состав ХН, который при определенной температуре, зависящей от температуры замерзания, обеспечивает физико-химические свойства, количественные показатели которых укладываются в область указанных ограничений.
Аппроксимация целевых функций для оптимизации параметров
и разработки ВПГЭ хладоносителя, содержащего NaCl.
Среди требований, предъявляемых к ХН, в том числе, и к пропиленгликолевым – невысокая вязкость и низкая температура замерзания. Лучшим электролитом по эффективности воздействия на μ и tз может считаться тот, который снижает и температуру замерзания, и вязкость по сравнению с ВПГ раствором, не содержащим электролит.
В предыдущем разделе описан поиск оптимального состава ВПГЭ хладоносителя с йодидом калия, основная роль которого заключалась в снижении вязкости, а комплекс оптимальных свойств по всем другим параметрам, в том числе и по температуре замерзания (до –28 °С), обеспечивала высокая массовая доля пропиленгликоля (25-45%).
Оптимальный состав хладоносителя может быть достигнут и при использовании другого электролита, основное назначение которого будет заключаться в снижении температуры замерзания; при этом массовая доля ПГ в смешанном растворителе может быть уменьшена до 12%-30%. Как указывалось выше, достижению более низкой температуры замерзания может способствовать электролит с невысоким значением константы ионной ассоциации КА и большими сольватационными числами ns (формулы 4 и 5). Расчеты по приведенным формулам, использование литературных данных показали, что электролитом, способным активно влиять на понижения температуры замерзания, может быть хлорид натрия. Кроме благоприятных физико-химических характеристик с точки зрения их влияния на tз растворов, хлорид натрия обладает и потребительскими достоинствами – он доступен и недорогой.
Из сказанного вытекает необходимость оптимизации температуры замерзания и вязкости электролитного водно-пропиленгликолевого хладоносителя, содержащего хлорид натрия.
Температуру замерзания tз можно представить в виде функции двух переменных: x1 (масс. доля ПГ) и x2 (концентрация NaCl).
Эта функция аппроксимируется полиномом 2-й степени (6 неизвестных коэффициентов) по 20-ти табличным значениям методом наименьших квадратов:
| tзi = a1x1i + a2 x2i + a3 x 1i x 2i + a4 x1i2 + a5 x2i2 + a6, | (22) |
где i = 1,...,20 для каждой пары значений x1, x2.
Значения коэффициентов a1,..., a6 вычислены с использованием пакета MATLAB. В итоге получен аппроксимирующий полином:
| tз =0,35x1+10,18x2-0,115x1x2+0,015x12-0,588x22 - 7,078. | (23) |
Вязкость раствора является функцией 3-х аргументов: μ(x1, x2 , x3 ) , где x3 - температура раствора. Экспериментально получены значения вязкости растворов при температуре –15о С и –10° С от аргументов x1,x2 и аппроксимированы полиномами второй степени (уравнения соотвественно 24 и 25).
| μ = -0,48x1 – 0,44x2+0,117x1x2+0,018x12-0.079x22+5,7 | (24) | |
| μ = -0,198x1 – 0,287x2+0,068x1x2 – 0,01x12 – 0,013x22+3,576. | (25) | |
Желательно получить низкую температуру замерзания при небольшом значении вязкости. Эти характеристики находятся в обратной зависимости, поэтому оптимальное сочетание значений аргументов находится в локальной области т.е. при достаточно низкой концентрации ПГ и достаточно высокой концентрации NaCl (рис. 6 и 7). Теперь, аппроксимируя tз и μ только по концентрациям NaCl 3,6-2,4 моль/кг и по массовым долям ПГ 11,7-20,9% мы получим более точное приближение искомых функций в областях, обведенных на рис. 6 и рис. 7:

Cm, моль/кг
ξпг,%
Рис. 6. Линии уровня температуры замерзания для локальной области:
Cm = 2,4-3,6 моль/кг; ξпг = 11,7-20,8%.
| tз = 0,97x1+4,238x2 – 0,144x1x2 + 0,0026x12 + 0,46x22 – 3,87; | (26) |
| μ(-15 о) = 0,013x1 – 1,567x2 + 0,0044x1x2 + 0,0099x12 + 0,34x22 + 4,72; | (27) |
| μ(-10 о) = -0,093x1 – 1,705x2 + 0,0219x1x2 + 0,00935x12 + 0,324x22 + 5,28. | (28) |
Эта аппроксимация дает сильно искаженную картину поведения искомых функций вне обведенного прямоугольника, зато внутри интересующей нас области получается значительно более точное приближение. Ввиду монотонности поведения функции μ при движении по линии уровня функции y можно сделать вывод, что оптимальное сочетание параметров x1 и x2 достигается на границе области. Используя результаты аппроксимации, это сочетание можно получить аналитически, задав конкретную температуру замерзания t и x2=x2max= c.

Cm, моль/кг
ξпг,%
Рис.7. Линии уровня функции вязкости при -150С для локальной области:
Cm = 2,4-3,6 моль/кг; ξпг = 11,7-20,6%.
Тогда получаем уравнение для x1:
| a1x1 + a2c + a3cx1 + a4x12 + a5c2 + a6 = t, | (29) |
которое приводится к стандартному квадратному уравнению:
| a4x12 + (a1 + a3c)x1 + (a2c + a5c2+a6 - t) = 0. | (30) |
Его решение дает оптимальную пару параметров x1,c.
Пусть, например, при условии температуры замерзания не выше –27о С требуется определить такую пару аргументов x1 и x2, которая обеспечивает минимальную вязкость раствора при температуре -15о С. Из рис. 11 видно, что «изотерма» –27о С пересекает верхнюю границу обведенной области, поэтому концентрация NaCl x2 = c =3,6 моль/кг. Подставляя это значение в квадратное уравнение при t = 27o С, имеем:
| 0,0026x12 + 0,4516x1 – 9,6516 = 0. | (31) |
Это уравнение имеет два решения:
x11= 19,2 ; x12= –193.
Второе решение не входит в допустимую область, а первое имеет определенный физический смысл.
Итак, для раствора с t3 = –270 С оптимальными параметрами для обеспечения минимальной вязкости при t = –150 С будет концентрация ПГ 19,2% и концентрация NaCI 3,6 моль/кг.
Таким образом, впервые для задачи оптимизации свойств электролитного хладоносителя, содержащего хлорид натрия, использован метод наименьших квадратов для многочлена II степени от нескольких переменных; с помощью линий уровней вязкости и температуры замерзания изыскана возможность выбора хладоносителей с низкой температурой замерзания и невысокой вязкостью; введение электролита в ВПГ (растворитель с массовым содержанием пропиленгликоля 17,4-30 %) позволяет снизить температуру кристаллизации на 14…18 оС и при этом обеспечить вязкость ХН на уровне 8…30 мПа∙с за счет невысокого содержания ПГ.
Исследование коррозии сталей в водных и водно-пропиленгликолевых растворах солей
Для защиты металлов, находящихся в среде солевых хладоносителей, в качестве ингибиторов коррозии используются полифосфаты, карбонаты, сахараты, гидроксид калия, нитраты, нитриты, а также соли неорганических кислот, анион которых может быть выражен формулой МО4n- (М - катион металла, n - заряд аниона). В частности нашли применение хромат калия К2СrО4, молибдат калия К2МоО4, дигидрофосфат натрия NaH2PO4, перманганат калия КМnО4.
Были изучены коррозионные (по отношению к углеродистой стали Ст.3) и свойства растворов хлорида кальция с добавлением перманганата в качестве ингибитора. Выбор раствора хлорида кальция был продиктован следующими обстоятельствами. Водные растворы СаСl2 и NaCl оказывают сильное коррозионное воздействие на стальные трубопроводы, поэтому их использование в качестве хладоносителей возможно только в присутствии ингибиторов. Разработанные диссертантом водно-пропиленгликолевые растворы электролитов, в частности, NaCl в меньшей степени вызывают коррозию сталей, чем водные растворы солей. Использование же СаСl2 в качестве электролита в водно-пропиленгликолевых растворах невозможно, поскольку ионы Са+ обладают положительной сольватацией и их присутствие приведет к заметному увеличению вязкости. Поэтому поиск новых ингибиторов коррозии сталей, находящихся в среде водного раствора СаСl2, представляется оправданным.
Коррозионная среда - главным образом 13%-ный, а также 30%-ный (по массе) растворы хлорида кальция. Содержание КМnО4 и Na2HPO4 изменяли от 0,5 до 5,0 % и от 0,05 до 0,5 % соответственно по отношению к массе СаС12. Принимая по внимание, что KMnO4 – энергичный окислитель и устойчивость водных растворов перманганата калия в значительной степени определяется характером среды, в исследуемые растворы вводили гидроксид калия в количествах, необходимых для создания среды с рН 10, 12 и 14. В качестве контрольного раствора использовали 13%-ный раствор СаС12 без ингибитора. Эффективность действия коррозионных добавок выражали с помощью защитного коэффициента, который вычисляли по формуле:
 , , | (32) |
где v и v׳ - скорости коррозии без ингибитора и в присутствии ингибитора соответственно.
Экспериментальные данные показывают, что введение перманганата калия в растворы СаCl2, используемые в качестве промежуточного хладоносителя, приводит к снижению скорости коррозии углеродистой стали Ст3.
Ингибирующее действие перманганата зависит от его концентрации, щелочности среды, а также от массовой доли СаС12 в растворе: в наибольшей степени (τ = 3,5) оно проявляется при концентрации КМnО4 0,5 % и рН, равном 14. С учетом использования КМnО4 в качестве ингибитора коррозии нами был предложен способ его получения из МnО2.
Коррозионные испытания трехкомпонентных хладоносителей проводили на двух видах стали Ст20 и 09Г2С по методике основанной на определении потери массы образцов. Для выявления роли органического компонента и природы электролита на скорость коррозии были изучены водные, водно – пропиленгликолевые растворы электролитов NaCl, KBr, KJ, CsCl.
В табл. 1 приведены результаты коррозионных испытаний сталей в растворах электролитов NaCl, KBr, KJ, CsCl. В водно-пропиленгликолевых растворах массовая доля ПГ составляет 30%.
Таблица 1
Скорость коррозии (мм/год) образцов сталей в водных и в водно-пропиленгликолевых растворах электролитов при температуре 20 °С. Время испытаний – 720 часов.
| Марка стали | Электролит | |||
| NaCl, конц. 3,0 моль/кг | KBr, конц. 1,9 моль/кг | |||
| Водный раствор | ВПГ раствор | Водный раствор | ВПГ раствор | |
| 09Г2С | 0,0160 | 0,0073 | 0,0124 | 0,0038 |
| Ст20 | 0,0202 | 0,0093 | 0,0149 | 0,0086 |
| | CsCl, конц. 2,0 моль/кг | KJ, конц. 1,9 моль/кг | ||
| | Водный раствор | ВПГ раствор | Водный раствор | ВПГ раствор |
| 09Г2С | 0,0100 | 0,0027 | 0,0084 | 0,0062 |
| Ст20 | 0,0110 | 0,0040 | 0,0101 | 0,0037 |

Коррозия сталей в водно – пропиленгликолевых растворах электролитов протекает с меньшей скоростью по сравнению с водными растворами (в отсутствие органического компонента). Так, скорость коррозии стали Ст20 в ВПГ растворе электролита NaCl в 2 раза меньше чем в водном растворе этого же электролита. Коррозионная активность раствора зависит от концентрации ионов, которая определяется степенью диссациации электролита в растворе. Выбранные электролиты в водных растворах ионизируют практически нацело (α близка к единице), в смешанном водно – органическом растворителе степень ионизации электролитов значительно меньше. Уменьшение величины α обусловлено меньшей диэлектрической проницаемостью ε ВПГ растворителя по сравнению с водой. Кроме того, равновесие ионизации [K(S)n A(S)m]0 ↔ [K(S)n]+ + [A(S)m]- в большей степени смещено влево, если S – молекула смешанного растворителя по сравнению с равновесием ионизации в водном растворе.
Снижение скорости коррозии в ВПГ растворах примерно одинаково для обеих марок сталей и зависит от природы электролита (при одинаковых концентрациях электролита и массовых долях пропиленгликоля в смешанном растворителе).
Проведенные исследования показали следующее. Впервые показано, что введение перманганата в растворы хлорида кальция, используемого в качестве хладоносителя, снижает скорость коррозии в 3,5 раза. Скорость коррозии сталей Ст20, 09Г2С в водно – пропиленгликолевых средах в 1,7-3,3 раза меньше по сравнению со скоростью коррозии в водных растворах. Уменьшение скорости коррозии связано с меньшей ионизирующей способностью ВПГ растворителя по сравнению с водой.
Невысокая скорость коррозии сталей (<0,01 мм/год) в электролит – содержащих ВПГ растворах соответствует категории металла «весьма стойкий» и позволяет использовать эти растворы в качестве хладоносителей без добавления ингибиторов.
В этом проявляется достоинство хладоносителей, в которых каждый из трех компонентов имеет определенное назначение и свойства которых (теплофизические, физико-химические, эксплуатационные) можно изменять в нужном направлении можно более эффективно по сравнению с двухкомпонентными хладоносителями состава вода - неорганическая соль или вода – пропиленгликоль.
В частности, разработаны трехкомпонентные хладоносители с невысокой коррозионной активностью: ВПГЭ (KJ) с tз –27,9 °С и вязкостью, равной 18,4 мПа·с; ВПГЭ (NaCl) с tз –31,2 °С и вязкостью, равной 26,2 мПа·с.
Энергетическая и технико-экономическая эффективность применения электролит-содержащих воднопропиленгликолевых хладоносителей.
В системе хладоснабжения с промежуточным ХН добавляются дополнительные энергетические затраты, в том числе и на перемещение промежуточного хладоносителя. При прочих равных условиях теплофизические и физико-химические свойства ХН влияют на характеристики холодильной машины, определяют ее эффективность. В частности, свойства хладоносителя оказывают влияние на коэффициент теплопередачи в испарителе, на размер потерь от внешней необратимости, зависящих от разности между температурой хладоносителя и температурой кипения хладагента в испарителе. За счет возрастания температуры кипения в режиме совместной работы испарителя и компрессора возрастает холодопролизводительность и холодильный коэффициент компрессорно – испарительного агрегата.
Оценку энергетической эффективности того или иного ХН для паровой компрессорной холодильной машины (ПКХМ) можно осуществить, используя численные значения следующих величин: коэффициента теплоотдачи α от потока хладоносителя в прямом гладком канале при ws = idem и dэ = idem, который пропорционален комплексу Кα; комплекса Кθ = ρ · ср, который оказывает влияние на перепад температур между средней температурой хладоносителя и кипящим холодильным агентом (с увеличением Кθ уменьшается указанный перепад температур, а следовательно, уменьшаются внешненеобратимые потери энергии от несовершенства процесса теплопередачи в испарителе); мощности привода N циркуляционного насоса, которая при прочих равных условиях пропорциональна комплексу KN = ρ0,75 ·μ0,25.
С учетом того, что значимость комплексов Кα и Кθ проявляется в одинаковом направлении, произведение Кα·Кθ может характеризовать достоинство хладоносителя с точки зрения его влияния на эффективность ХМ.
Теплоотдача при движении внутри труб и каналов в значительной степени зависит от режима движения хладоносителя. При скоростях хладоносителя, принятых в настоящее время, и сравнительно небольших диаметрах труб (dвн≤20 мм) течение водных растворов СаСl2, NaСl, пропиленгликоля и других жидкостей происходит почти целиком в области ламинарного и переходного режимов. На рис. 8 показана зависимость чисел Рейнольдса (Re) от скорости движения исследуемых растворов при температуре ts2 = –10ºС. Из рис. 8 видно, что присутствие электролитов в ВПГ растворах резко повышает значения чисел Re и в рабочей области скоростей хладоносителя переводит режим их движения из ламинарного в переходный. Это в свою очередь, обеспечивает более высокие значения коэффициента теплоотдачи от хладоносителя к стенке трубы.



Рис. 8. Значение чисел Re в зависимости от скорости хладоносителя в трубе диаметром 20 мм при температуре –10 °С
Для ориентировочной оценки коэффициента теплоотдачи при сравнении малоисследованных хладоносителей, можно применить комплекс Кα.
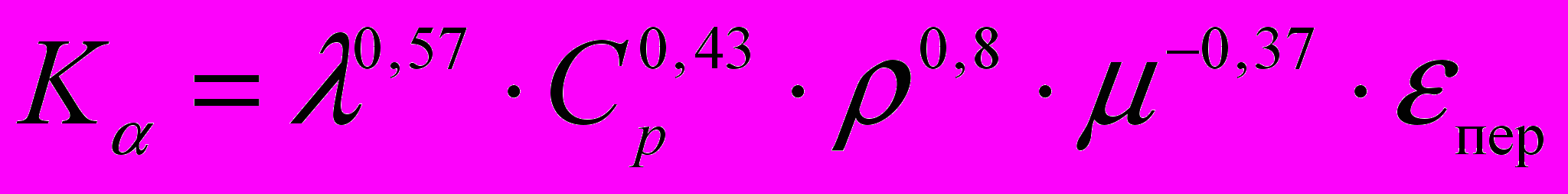 . . | (33) |
где εпер – поправочный коэффициент на переходный режим, зависит от Re.
В таблице 2 приведены свойства электролитных ВПГ хладоносителей и водно-пропиленгликолевого ХН, не содержащего электролит, при -10 °С. Численные значения физико-химических и теплофизических свойств и комплексов Кα, Кθ, KN дают возможность оценить и сравнить энергетическую эффективность использования каждого из хладоносителей. Расчеты выполнены для внутреннего диаметра трубы 20 мм и скорости ХН 1,1 м/с.
Таблица 2
Свойства хладоносителей, влияющие на энергетическую эффективность ПКХМ
| Хладоно-ситель | Режим движения | ρ, кг/м3 | с, кДж/(кг·К) | λ, Вт/(м·К) | μ·103, Па·с | Кα·10-3 | Кθ·10-6 | Кα Кθ·10-9 | КN |
| ВПГ-40 | Ламинар-ный | 1050 | 3,61 | 0,383 | 19,7 | 7,82 | 3,80 | 29,7 | 68,5 |
| ВПГЭ-30 (NaCl) | Переход-ный | 1135 | 3,41 | 0,352 | 11,3 | 11,84 | 3,91 | 46,4 | 61,7 |
| ВПГЭ-40 (KJ) | Переход-ный | 1276 | 2,78 | 0,291 | 9,53 | 14,61 | 3,56 | 52,0 | 65,8 |
Из табл. 2 видно, что в условиях одной и той же холодильной машины электролитные растворы обладают большими (в 1,5-1,9 раза) значениями Кα по сравнению с ВПГ-40, причем комплекс Кα хладоносителя ВПГЭ-40 (KJ) на 18,9% превышает значение Кα ХН, содержащего хлорид натрия. Это означает, что раствор ВПГЭ-40 (KJ) обеспечивает максимальные значения коэффициента теплоотдачи, температуры кипения и, следовательно, холодильного коэффициента ε = Q0/NE. По затрачиваемой мощности привода циркуляционного насоса преимущества также имеют ХН, содержащие электролит. Наименьшей мощности следует ожидать при использовании хладоносителя ВПГЭ-30 (NaCl).
Для более детального анализа эффективности применения рассматриваемых хладоносителей была использована математическая модель, позволяющая рассчитать технико-эксплуатационные характеристики аммиачной ПКХМ (θ0, θm, ε, эксергетический КПД испарителя ηэкс) в зависимости от температур хладоносителя и окружающей среды
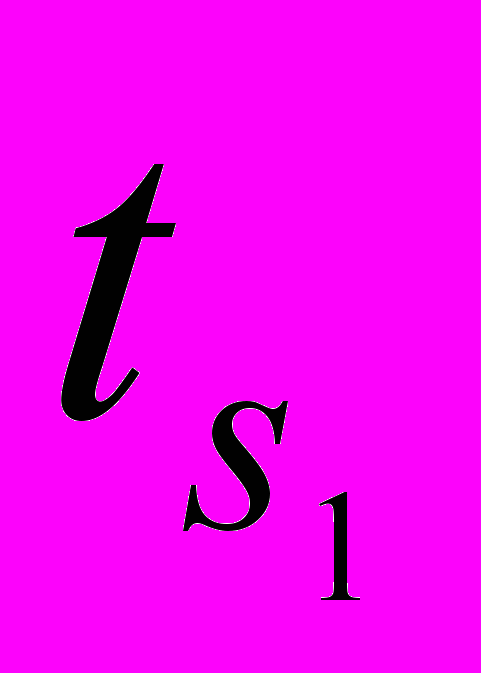 и
и 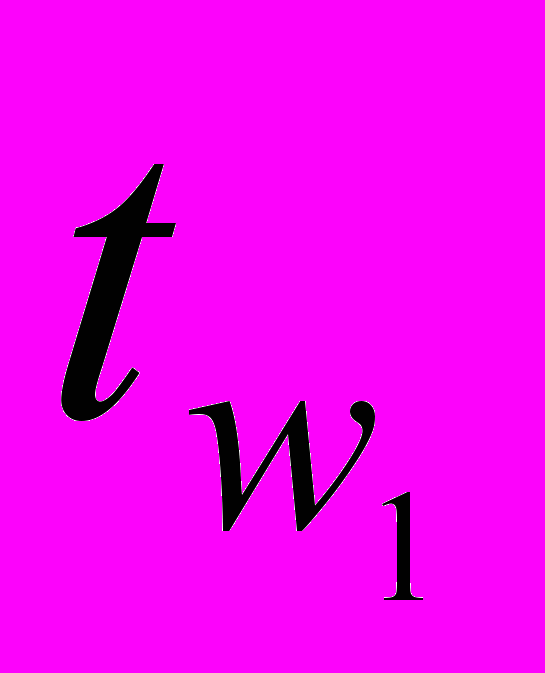 , а также от конструктивных параметров компрессора, конденсатора и испарителя.
, а также от конструктивных параметров компрессора, конденсатора и испарителя.Установлено, что электролитные ХН имеют преимущества по сравнению с хладоносителем ВПГ-40 по всем указанным характеристикам. В частности, θ0 увеличивается на 7-20% в интервале температур
 = 0…-15° С, ηэкс возрастает на 10-12% (
= 0…-15° С, ηэкс возрастает на 10-12% ( = -15° С).
= -15° С).Учет закономерностей взаимодействия частиц в растворах ХН, содержащих водно-органический растворитель и электролит, совместно с математико-статистическим методом изучения формальной связи между компонентами раствора дали возможность оптимизировать свойства хладоносителей в широком интервале концентраций и температур. Выяснилось, что среди большого числа электролитных растворов (изучено влияние 27 электролитов) системы, содержащие KI, KBr, NaCl обладают преимуществом по сравнению с безэлектролитными водно-пропиленгликолевыми растворами по вязкости, температуре кристаллизации, коррозионной активности.
Поэтому именно эти растворы, в частности, KJ и NaCl были испытаны в условиях, приближенных к холодильной практике с целью последующего их внедрения в промышленность. В табл. 3 приводятся свойства испытуемых ХН.
Таблица 3
Теплофизические и физико-химические свойства хладоносителей, прошедшие испытания на экспериментальном стенде
| Состав ХН | t, °С | ρ, г/см3 | Ср, кДж/(кг·К) | λ, Вт/(м·К) | μ·103, Па·с |
| ВПГЭ-40 (KJ) минимальная температура ХН – 34 °С | 0 | 1,267 | 2,81 | 0,303 | 6,43 |
| -10 | 1,276 | 2,78 | 0,291 | 5,53 | |
| -20 | 1,285 | 2,74 | 0,283 | 14,7 | |
| ВПГЭ-30 (NaCl) минимальная температура ХН – 30 °С | 0 | 1,120 | 3,45 | 0,339 | 6,70 |
| -10 | 1,135 | 3,41 | 0,352 | 11,3 | |
| -20 | 1,148 | 3,36 | 0,343 | 20,7 | |
| ВПГ-40 минимальная температура ХН – 14 °С | 0 | 1,044 | 3,64 | 0,392 | 12,0 |
| -10 | 1,050 | 3,61 | 0,383 | 19,7 | |
| -20 | - | - | - | - |
Испытания новых хладоносителей и оценка технико-экономической эффективности их применения
Цель проведения испытаний – исследование влияния свойств новых хладоносителей на энергетические показатели одноступенчатой холодильной машины. В качестве испытуемых хладоносителей были взяты растворы ВПГЭ – 30 (NaCl) и ВПГЭ – 40 (KJ): для сравнения был исследован раствор ВПГ – 40, не содержащий электролит.
Для реализации цели были поставлены задачи по определению следующих характеристик холодильной машины при работе ее на трех хладоносителях: холодопроизводительности холодильной машины Qo; холодильного коэффициента д; электрической мощности компрессора N.
Исследование хладоносителей ВПГЭ-30 (NaСl), ВПГЭ-40 (KJ) и ВПГ-40 проводились на экспериментальном стенде одноступенчатой холодильной машины ХМ2ФВБС6, оборудованном приборами для замера температур и давлений в узловых точках цикла, расхода хладоносителя и воды через испаритель и конденсатор, соответственно, а также, электрической мощности компрессора и насоса. На рисунке 9 дана принципиальная схема экспериментального стенда.
Испытания проводились при установившемся режиме работы холодильной машины. Установившимся режимом считался режим, при котором давление и температура рабочего вещества в измеряемых точках оставались постоянными в течение всего времени испытаний, с допуском ± 0,5 С. Для обработки принимались режимы, в которых Gaи и Gaк различались не более, чем на 3%.

Рис. 9. Принципиальная схема холодильной машины
I – компрессор ФВБС-6, II – кожухотрубный затопленный конденсатор, III – регенеративный теплообменник, IV – дроссельный вентиль; V- испаритель; VI – циркуляционный насос хладоносителя; VII – бак хладоносителя. Арабскими цифрами на рис. 9 обозначены температуры рабочего вещества: 1 и 2 – при входе и при выходе из компрессора; 1' – перед всасывающим клапаном; 3 и 4 – при входе из конденсатора; 5 и 6 – перед и после дроссельного вентиля (t6 равна температуре кипения to); 7 – на выходе из испарителя.
Показания контрольно-измерительных приборов записывались в протокол через каждые 1015 мин, не менее трех раз. Результаты эксперимента и расчетов при
 = –10°C представлены в табл. 4.
= –10°C представлены в табл. 4.Таблица 4
Опытные технико-эксплуатационные параметры хладоносителей.
| Хладоноситель | Q0, кВт | N, кВт | ε | ηобр |
| ВПГ-40 | 4,04 | 2,26 | 1,79 | 0,28 |
| ВПГЭ-30 (NaCl) | 4, 47 | 2,32 | 1,96 | 0,29 |
| ВПГЭ-40 (КJ) | 4,54 | 2,31 | 1,99 | 0,29 |
Полученные данные свидетельствуют о том, что при использовании электролит-содержащих растворов холодопроизводительность машины, одна из важнейших ее режимных характеристик, возросла на 10,8-12,4%, холодильный коэффициент увеличился на 9,5-11,2% - в зависимости от природы электролита. Соответственно изменениям этих параметров увеличился и коэффициент обратимости.
Важным представляется и тот факт, что характер изменения опытных технико-эксплуатационных параметров в сторону их улучшения находится в полном соответствии с данными, полученными расчетным путем. Таким образом, можно констатировать, что электролит-содержащие ВПГ хладоносители по совокупности физико-химических и теплофизических свойств, а также по технико-эксплуатационным показателям превосходят водно-пропиленгликолевые хладоносители, в состав которых не входит электролит.
Большая эффективность электролитных хладоносителей предопределена не только их качественным составом, который выбирался с учетом взаимодействия в растворах на микроуровне, но и тем обстоятельством, что свойства трехкомпонентной системы удобнее изменять в нужном направлении по сравнению с двухкомпонентной. В этом отношении трехкомпонентный электролитный хладоноситель более совершенен, чем ХН, содержащий только пропиленгликоль и воду.
Для оценки технико-экономической эффективности работы холодильной машины при использовании ВПГЭ хладоносителей будем считать, что годовые затраты будут зависеть только от того, какой хладоноситель используется – 40%-ный водно-пропиленгликолевый или разработанные электролитные на ВПГ основе.
Для сравнения годовых затрат на работу холодильной машины при использовании электролитных ХН и ВПГ хладоносителей, не содержащих электролит, следует учитывать, главным образом, расходы на электроэнергию Экнас для компрессора и насоса и стоимость хладоносителей кхн с учетом амортизационных затрат на дозаправку, составляющих 15% от стоимости. Другие составляющие общих затрат не зависят от холодопроизводительности и холодильного коэффициента – тех технико-эксплуатационных показателей, которые характеризуют эффективность холодильной машины.
В табл. 5 приведена часть годовых затрат на работу аммиачной холодильной машины ХМ-АУУ90/А1 (холодопроизводительность 107 кВт при
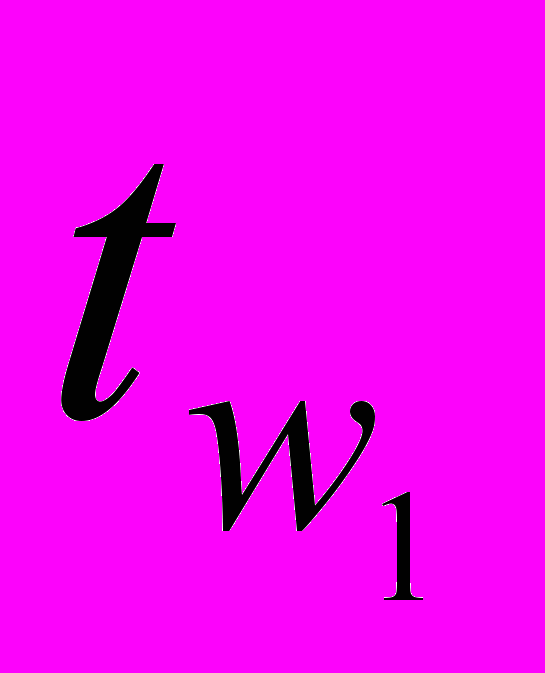 28 °С,
28 °С,  –10 °С; мощность электродвигателя компрессора 55 кВт, число часов работы в году – 5000) при использовании водно-пропиленгликолевых хладоносителей.
–10 °С; мощность электродвигателя компрессора 55 кВт, число часов работы в году – 5000) при использовании водно-пропиленгликолевых хладоносителей.Таблица 5
Годовые затраты на электроэнергию для компрессора и насоса и расход хладоносителя на его стоимость.
| Хладоноситель | Затраты, руб./год | ||
| Эк,нас | кхн | Всего | |
| ВПГ-40 | 665280 | 129122 | 794402 |
| ВПГЭ – 30(NaCl) | 467925 | 98877 | 566802 |
| ВПГЭ – 40(КJ) | 401755 | 261250 | 662955 |
Из табл. 5 следует, что уменьшение затрат при использовании электролитных хладоносителей составляет:
- для ВПГЭ – 30(NaCl) 227600 руб./год или 28,7%;
- ВПГЭ – 40(КJ) 131447 руб./год или 16,5%.
Таким образом, использование электролитных водно-пропиленгликолевых хладоносителей экономически целесообразно.
Рекомендации по применению ВПГЭ хладоносителей в системах косвенного охлаждения и при замораживании пищевых продуктов
Разработанные ВПГЭ ХН на основе водно-пропиленгликолевых растворов электролитов могут быть использованы для охлаждения пищевых продуктов и других объектов различного назначения. В зависимости от природы электролита, его концентрации, массовой доли пропиленгликоля рабочая температура ХН может достигать -40° С. В частности, опытным путем и с помощью полиноминальных уравнений регрессии установлено, что ВПГЭ раствор с массовой долей пропиленгликоля 45%, содержащий KJ с концентрацией 2,5 моль/кг имеет tз - 43ºC. Вязкость такого раствора почти в 6 раз ниже, чем у безэлектролитного ВПГ раствора с той же температурой замерзания.
Охлаждение до -40ºС может обеспечить и ВПГЭ-40, содержащий NaCl, концентрация которого составляет 2,4 моль/кг. Электролитные ВПГ хладоносители соединяют в себе хорошие теплофизические и физико-химические характеристики, что в сочетании с высоким уровнем безопасности открывает широкие возможности для их использования.
Роль ингибитора коррозии в большинстве случаев выполняет водно-пропиленгликолевый растворитель. При использовании в качестве электролита йодида калия (сm = 2,2 моль/кг, ξ = 30%) может быть использован ингибитор.
Сравнительно низкая температура электролитного ВПГ хладоносителя
 = –28… –30ºС. может быть использована в системах холодоснабжения с современным оборудованием для снижения количество аммиака в системе и, следовательно повышения химической безопасности холодильной установки.
= –28… –30ºС. может быть использована в системах холодоснабжения с современным оборудованием для снижения количество аммиака в системе и, следовательно повышения химической безопасности холодильной установки. Хорошие технико-эксплуатационные свойства ВПГЭ хладоносителей при температурах -10…-14ºС позволяют их использовать в холодильных машинах для создания искусственного льда, в помещениях для хранения пищевых продуктов. Выявлена возможность применения хладоносителя, содержащего NaCl, для контактного и бесконтактного замораживания пищевых продуктов.
Для бесконтактного охлаждения и замораживания в герметичной упаковке рекомендуется применять раствор NaCl в водно-пропиленгликолевом растворителе с массовой долей ПГ 26-30%. Для контактного охлаждения и замораживания ягод с плотной кожицей, плодов и овощей можно использовать 35%-ный водный раствор ПГ, содержащий 1,5-2,5% NaCl, 1% СaCl2 и лимонную кислоту. Возможно замораживание до температуры -20…-25ºС с помощью ХН, содержащего пропиленгликоль, воду и йодид калия, обладающего низкой динамической вязкостью при низких температурах.
Важно отметить, что при быстром замораживании растительной продукции в ВПГ электролитных хладоносителях снижается скорость гидролиза ди- и полисахаридов, максимально сохраняются биологически активные вещества.
