Носов Владимир Павлович
| Вид материала | Автореферат |
СодержаниеОбщие сонные артерии Наружные сонные артерии Внутренние сонные артерии Уточнить клинический вариант течения АГ |
- Владимир Павлович Максаковский Географическая картина мира книга, 143.3kb.
- Новозеландско-китайские отношения в последней четверти ХХ начале ХХI века, 457.06kb.
- Беспалько Владимир Павлович, 3378.64kb.
- Аудиодокументы по внеклассному чтению для учащихся начальных классов проза, поэзия,, 43.31kb.
- Географические открытия. Детская энциклопедия-М., «Махаон»,2007, 33.48kb.
- Быков Владимир Павлович лекция, 48.35kb.
- В. П. Култыгин тенденции в европейской социологической теории начала XXI века, 383.16kb.
- 23 ноября 1908 года родился Николай Николаевич Носов, 97.02kb.
- Степанец Владимир Яковлевич доцент Кожич Павел Павлович Минск 2008 г. Оглавление Оглавление, 228.35kb.
- Николай Николаевич Носов автор многих интересных рассказ, 153.82kb.
Примечание. *-p<0,05, ** - p <0,01, *** - p <0,001 (сравнение с контрольной группой); # - p<0,05, ## - p <0,01, ### - p <0,001 (различия между подгруппами больных с СД и ИС АГ)
Также обнаружены различия параметров СМАД в условиях разных клинических вариантов течения АГ у лиц пожилого и старческого возраста. Смешанный вариант характеризуется большими значениями САД и ПАД в ночные часы (147,09±3,09 и 68,53±2,28 мм рт. ст., p < 0,05), а также среднесуточного ПАД (75,79±1,59 мм рт. ст., p < 0,05), увеличением ВУП ДАД (29,44±2,58 мм рт. ст., p < 0,05), коронароишемический – повышенными значениями ВУП ДАД (32,53±4,39 мм рт. ст., p < 0,05), а гемодинамический – вариабельности ДАД в ночные часы (13,35±0,61 мм рт. ст., p < 0,05). Таким образом, смешанный и коронароишемический варианты АГ входят в группу риска развития сосудистых катастроф в ранние утренние часы, что требует адекватного контроля ночной гипертензии и параллельной коррекции прочих факторов риска атеротромбоза. Выявленные различия служат основанием к целесообразности проведения амбулаторного и стационарного СМАД как для диагностики АГ, так и для оценки эффективности и переносимости антигипертензивной терапии у больных пожилого и старческого возраста.
Нужно сказать, что хроническая гемодинамическая перегрузка как повышенным среднесуточным и среднедневным САД, а так и его ИВ в указанные промежутки времени (r = 0,435, p < 0,001 и r = 0,389, p < 0,01 соответственно для САД; r = 0,279 и r = 0,331, p < 0,05 соответственно для ИВ САД) вносит свой вклад в усиление возраст-зависимого структурно-функционального ремоделирования артериальных сосудов, сопровождающегося нарастанием индекса артериальной жесткости (ПАД/УИ) (на 117,09%, p<0,001) - независимого предиктора смертности от ИБС больных АГ мужчин в возрасте 70 лет и старше (L.Lind et al., 2004)жно сказать, что , чтовными лицамити от зличных классов. При этом СД и ИС АГ у лиц старших возрастных групп, вне зависимости от клинического варианта её течения, сопровождается гипер- и дислипидемией [IIб (54%), IIа (31%) и реже IV (12%) фенотипы по ВОЗ], более выраженной у женщин и прогрессирующей параллельно АГ. При этом следует акцентировать внимание на то, что в сравнении с нормотензивным контролем, значимо преобладала частота гиперхолестеринемии ≥5,0 ммоль/л (88% против 67%, χ2 = 4,35, p < 0,05).
Все вышеперечисленное лежит в основе того, что АГ в пожилом и старческом возрасте, вне зависимости от варианта повышения АД, сопровождается гемодинамически незначимыми стенозами (66%), преимущественно наружных и общих сонных артерий (37%, χ2 = 8,10, p < 0,01 и 33%, χ2 = 5,2, p < 0,05 соответственно), за счет формирования атеросклеротических бляшек III, IV и V типов. Это формирует асимметрию кровотока в общих сонных артериях (в 1,75 раза, p < 0,001), прогрессирующее нарушение каротидной гемодинамики по типу затрудненной перфузии (нарастание возраст-зависимого снижения скоростных показателей кровотока - Vs, Vd и Vm при повышении индексов периферического сопротивления - PI и ISD), более выраженных в условиях СД АГ (большее снижение Vs и Vm в правых общей и наружной сонных артериях (p < 0,05)) (таблица 3), что отражает прогрессирующее снижение эластико-тонических свойств сосудистой стенки, нарастание ригидности и извитости каротид со снижением способности уменьшать амплитуду пульсовых колебаний, и, что, в конце концов, формирует хроническую ишемию ГМ в условиях сочетания АГ и атеросклеротического поражения в рассматриваемой возрастной группе. Это может быть обоснованием повышенного риска развития церебральных гипоперфузионных осложнений вследствие возможного избыточного снижения АД на фоне антигипертензивной терапии (З.А.Суслина и соавт., 2004, В.И.Шмырев и соавт., 2002).
Следует заметить, что цереброишемический и гемодинамический клинические варианты течения АГ характеризуются более высокими значениями ISD в наружных сонных артериях (5,72±0,11 усл. ед. и 5,85±0,01 усл. ед. соответственно, p < 0,05).
Действительно, акселерирующую роль в структурно-функциональных возраст-зависимых изменениях каротид, с формированием в них гемодинамически незначимых стенозов и нарушением каротидной гемодинамики, играют липидные и гемодинамические факторы. Так повышение ОХС, ХС ЛПНП и Ка с одной стороны, и ИВ САД и ДАД в ночные часы – с другой, сопровождаются увеличением PI и ISD в бассейне наружных сонных артерий (ОХС: r = 0,263 для всех случаев; ХС ЛПНП: r = 0,250 и r = 0,251 соответственно; Ка: r = 0,260 и r = 0,262 соответственно; ИВ САД в ночные часы: r = 0,398 и r = 0,404 соответственно; ИВ ДАД в ночные часы: r = 0,386 и r = 0,389 соответственно, p < 0,05 во всех случаях). Это свидетельствует о независимой роли липидных факторов в формировании атеросклеротического поражения каротид у лиц старших возрастных групп, страдающих АГ (С.В.Моисеев и соавт, 2005, M.Mosso et al., 2000, P.Ye et al., 2001) Кроме того, рост среднесуточного и среднедневного ПАД сопровождается нарастанием асимметричности кровотока в бассейне наружных сонных артерий (r = 0,306 и r = 0,342, p < 0,05). Количество пораженных экстракраниальных артерий позитивно коррелирует как с уровнем Ка (r = 0,265, p < 0,05), так и исходно повышенной вариабельностью САД в дневные часы (r = 0,260, p < 0,05). Таким образом, повышение АД, вне зависимости от его вида, является аддитивным фактором развития атеросклеротического поражения наружных и общих сонных артерий у лиц 65 лет и старше. Комбинация АГ и гиперлипидемии усугубляет их негативное влияние на артериальную стенку у больных АГ пожилого и старческого возраста. Следует подчеркнуть, что наличие данного патологического процесса, являющегося одной из основных детерминант мультифокального атеросклероза, – маркер негативного сердечно-сосудистого прогноза, высокой вероятности вовлечения в процесс коронарных и почечных артерий и повышенного риска развития ишемического инсульта и транзиторных ишемических атак у пожилых больных с АГ (S.Kuroda et al., 2000, T.Ogata et al., 2005).
Таблица 3.
Сравнительная характеристика параметров каротидной УЗДГ в основной и в контрольной группах, а также в подгруппах СД и ИС АГ
| Показатель | Основная группа, n = 95 человек | Контрольная группа, n = 30 человек | ||
| Группа в целом, n = 95 человек | Больные СД АГ, n = 56 человек | Больные ИС АГ, n = 39 человек | ||
| Общие сонные артерии | ||||
| Vs, см/с | 45,271,10(d)*** 48,771,33(s)* | 43,411,31(d)*** 46,211,46(s)** | 48,071,83(d)*# 52,622,40(s) | 52,731,50(d) 53,732,08(s) |
| Vd, см/с | 8,420,22(d)*** 9,210,27(s)* | 8,120,27(d)*** 8,700,30(s)** | 8,900,36(d)** 9,970,47(s) | 10,470,33(d) 10,370,98(s) |
| Vm, см/с | 20,701,51(d)*** 22,400,62(s)* | 19,880,62(d)*** 21,200,69(s)** | 21,950,85(d)*# 24,191,11(s) | 24,560,71(d) 24,821,01(s) |
| PI, усл. ед. | 1,780,01(d)*** 1,770,01(s) | 1,770,01(d)*** 1,770,01(s) | 1,790,01(d)*** 1,770,01(s) | 1,720,01(d) 1,750,01(s) |
| ISD, усл. ед. | 5,410,03(d)*** 5,320,02(s) | 5,380,04(d)*** 5,350,03(s)* | 5,440,06(d)** 5,300,03(s) | 5,060,05(d) 5,220,04(s) |
| КА, % | 16,051,75** | 14,031,70* | 19,183,52*** | 9,171,76 |
| Наружные сонные артерии | ||||
| Vs, см/с | 59,312,08(d) 55,421,90(s) | 58,752,78(d) 54,292,40(s) | 60,183,24(d)# 57,363,15(s) | 62,932,64(d) 58,371,88(s) |
| Vd, см/с | 11,210,43(d)*** 9,710,33(s)* | 11,110,60(d)** 9,530,42(s) | 11,380,65(d)** 10,020,54(s) | 13,170,51(d) 10,270,37(s) |
| Vm, см/с | 22,400,62(d)* 24,950,85(s) | 26,991,31(d) 24,451,07(s) | 27,651,50(d)# 25,801,41(s) | 29,711,21(d) 26,280,88(s) |
| PI, усл. ед. | 1,770,01(d)*** 1,830,01(s) | 1,770,01(d)*** 1,830,01(s) | 1,770,01(d)*** 1,840,01(s) | 1,670,75(d) 1,830,01(s) |
| ISD, усл. ед. | 5,340,04(d)*** 5,730,04(s) | 5,360,06(d)*** 5,730,06(s) | 5,310,06(d)*** 5,740,06(s) | 4,770,04(d) 5,750,09(s) |
| КА, % | 23,532,33 | 27,333,41 | 17,922,84 | 21,104,93 |
| Внутренние сонные артерии | ||||
| Vs, см/с | 62,682,30(d) 58,551,48(s) | 60,372,99(d) 56,201,92(s) | 65,503,70(d) 61,322,26(s) | 62,204,06(d) 58,803,00(s) |
| Vd, см/с | 14,580,60(d)** 13,390,34(s)*** | 14,010,77(d)** 12,880,44(s)* | 15,320,99(d) 13,990,53(s)** | 17,541,04(d) 16,670,76(s) |
| Vm, см/с | 30,621,17(d) 28,440,71(s) | 29,461,50(d) 27,320,92(s) | 32,041,89(d) 29,761,08(s) | 32,432,04(d) 30,711,49(s) |
| PI, усл. ед. | 1,580,01(d)*** 1,590,01(s)*** | 1,580,01(d)*** 1,580,01(s)*** | 1,580,01(d)*** 1,590,02(s)*** | 1,370,02(d) 1,360,02(s) |
| ISD, усл. ед. | 4,370,04(d)*** 4,410,05(s)*** | 4,380,06(d)*** 4,390,07(s)*** | 4,360,07(d)*** 4,430,10(s)*** | 3,520,06(d) 3,520,06(s) |
| КА, % | 19,402,66 | 18,023,46 | 21,854,24 | 20,375,07 |
Примечание. *-p<0,05, ** - p <0,01, *** - p <0,001 (сравнение с контрольной группой); # - p<0,05 (различия между подгруппами больных с СД и ИС АГ)
Присутствие гипер- и дислипидемии, с характерной для больных как СД, так и ИС АГ пожилого и старческого возраста гиперхолестеринемией (≥5,0 ммоль/л) (88% пациентов) и с сопутствующими ИБС: стенокардией напряжения II функционального класса (24% человек), и ее клиническими эквивалентами - симптомным каротидным атеросклерозом (66%), атеросклерозом магистральных артерий нижних конечностей с хронической артериальной недостаточностью I степени по классификации R.Fontaine в модификации А.В.Покровского (2%), является основанием к активной профилактике атеротромботических осложнений, включая воздействие на липидные и гемодинамические факторы сердечно-сосудистого риска (Российские рекомендации «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза», 2004, European guidelines on cardiovascular disease prevention in clinical practice, 2003). Указанные данные служат основанием к заострению внимания на необходимость выявления и коррекции липидных факторов риска у больных пожилого и старческого возраста с АГ, включения липидограммы в обязательный комплекс обследования данных пациентов. Таким образом, диагностика и контроль показателей липидного обмена, своевременная адекватная немедикаментозная и медикаментозная, как гиполипидемическая, так и антигипертензивная и церебровазоактивная терапия должны играть важную роль в профилактике усугубления поражения органов – «мишеней» и атеросклеротических осложнений АГ у лиц старших возрастных групп.
АГ у больных пожилого и старческого возраста характеризуется наличием вегетативной дисфункции (нарушение нормальной геометрической структуры ритма с максимумами рейтинга в виде фигур, состоящих из 2 или 3 точек (61%), χ2 = 8,43, p < 0,01) (таблица 4) по типу относительной парасимпатикотонии (уменьшение ВПР на 47,05% и увеличение SDNN на 118,89% (p < 0,05)) (таблица 5).
Таблица 4.
Сравнительная характеристика показателей нелинейной хаотической динамики ритма сердца в основной и в контрольной группах, а также в подгруппах больных СД и ИС АГ
| Показатель | Основная группа, n = 75 человек | Контрольная группа, n = 30 человек | ||
| Группа в целом, n= 75 человек | Больные СД АГ n = 40 человек | Больные ИС АГ, n = 35 человек | ||
| Максимум рейтинга с точками 4, 5 и 6, человек | 29 (38,67%)** | 22 (55,00%)## | 7 (20,00%)* | 21 (70,00%) |
| Максимум рейтинга с точками 2 и 3, человек | 46 (61,33%)** | 18 (45,00%) | 28 (80,00%)*## | 9 (30,00%) |
| N1, усл. ед. | 1,098 ± 0,143*** | 1,405± 0,206 *## | 0,683 ± 0,141*** | 3,348 ± 0,765 |
| N2, % | 42,70 ± 2,80*** | 49,10 ± 3,40## | 34,20 ± 3,80*** | 58,60 ± 3,40 |
| N3, усл. ед. | 0,953 ± 0,122*** | 1,203 ± 0,181 *# | 0,615 ± 0,107** | 1,816 ± 0,206 |
Примечание. *-p<0,05, ** - p <0,01, *** - p <0,001 (сравнение с контрольной группой); # - p<0,05, ## - p <0,01 (различия между подгруппами больных с СД и ИС АГ)
Таблица 5.
Сравнительная характеристика показателей ВСР в основной и в контрольной группах, а также в подгруппах больных СД и ИС АГ
| Показатель | Основная группа, n = 75 человек | Контрольная группа, n = 30 человек | ||
| Группа в целом, n = 75 человек | Больные СД АГ n = 40 человек | Больные ИС АГ, n = 35 человек | ||
| ВПР, усл. ед. | 6,83 ± 0,61* | 6,78 ± 0,72 | 6,26 ± 1,07 | 12,90 ± 2,16 |
| ПАПР, усл. ед. | 51,18 ± 3,18 | 53,62 ± 3,83 | 45,72 ± 5,33 | 52,24 ± 6,39 |
| RRmin, мс | 780,93 ± 22,89 | 790,28 ± 29,15## | 772,37 ± 35,13 | 788,01 ± 23,09 |
| RRNN, мс | 962,70 ± 18,89 | 923,65 ± 27,46# | 999,53 ± 24,79 | 906,72 ± 34,11 |
| SDNN, мс | 34,42 ± 4,84* | 28,59 ± 5,34 | 39,91 ± 7,91* | 28,95 ± 4,24 |
| HRVti, усл. ед. | 6,67 ± 0,41 | 6,40 ± 0,52 | 7,04 ± 0,69 | 7,89 ± 0,65 |
| pNN50, % | 3,56 ± 3,01 | 3,44 ± 2,31## | 7,83 ± 6,61 | 3,05 ± 0,82 |
| rMSSD, мс | 47,94 ± 8,48 | 28,53 ± 7,78## | 74,22 ± 14,99** | 24,97 ± 3,62 |
| W, мс | 367,66 ± 59,09 | 247,86 ± 54,76# | 529,75 ± 107,66* | 262,62 ± 38,13 |
| WN1, мс | 182,82 ± 24,11 | 130,71 ± 19,07# | 253,31 ± 46,02* | 135,22 ± 16,70 |
| WAM5, мс | 145,24 ± 18,40 | 116,51 ± 17,51# | 184,10 ± 34,76 | 162,62 ± 31,85 |
| WAM10, мс | 119,07 ± 15,90 | 104,62 ± 13,35 | 138,61 ± 32,81 | 131,37 ± 15,15 |
| TP, мс2 | 2672,36 ± 840,75 | 1534,45 ± 738,04# | 4109,71 ± 1627,23* | 824,18 ± 151,94 |
| VLF, мс2 | 671,15 ± 155,76 | 478,75 ± 137,18 | 914,18 ± 303,09 | 421,95 ± 76,32 |
| LF, мс2 | 546,47 ± 226,48 | 309,71 ± 136,38 | 845,54 ± 481,59 | 191,12 ± 42,61 |
| HF, мс2 | 924,13 ± 359,04 | 347,62 ± 138,51## | 1652,36 ± 772,65* | 211,03 ± 44,15 |
| VLF%, % | 45,61 ± 3,48 | 53,59 ± 3,84## | 35,95 ± 5,19** | 56,08 ± 2,33 |
| LF%, % | 20,11 ± 1,16 | 21,76 ± 1,48 | 18,12 ± 1,79 | 21,28 ± 1,03 |
| HF%, % | 31,06 ± 3,58 | 22,27 ± 3,74## | 41,69 ± 5,69** | 22,63 ± 2,33 |
| LFnorm, норм. ед. | 46,43 ± 3,48 | 55,40 ± 4,55### | 34,28 ± 3,88** | 50,96 ± 2,62 |
| HFnorm, норм. ед. | 53,57 ± 3,48 | 44,60 ± 4,55### | 65,72 ± 3,88** | 49,04 ± 2,62 |
| LF/HF, усл. ед. | 1,38 ± 0,23 | 1,96 ± 0,36 *# | 0,63 ± 0,10 | 1,17 ± 0,10 |
| IC, усл. ед. | 4,99 ± 0,94 | 7,21 ± 1,53 ## | 2,30 ± 0,45** | 4,53 ± 0,48 |
Примечание. *-p<0,05, ** - p <0,01 (сравнение с контрольной группой); # - p<0,05, ## - p <0,01, ### - p <0,001 (различия между подгруппами больных с СД и ИС АГ)
При этом ИС АГ сопровождается абсолютной парасимпатикотонией (большая продолжительность rMSSD, pNN50, RRNN (на 260,15% и 227,62%, p < 0,01, на 108,22%, p < 0,05 соответственно); увеличение W, WN1, WAM5 (на 213,73%, 193,80% и 158,01% соответственно, p < 0,05); сонаправленное повышение HF (на 475,34%, p < 0,01), HF% (на 186,37%, p < 0,01), HFnorm (на 147,35%, p < 0,001) и ТР (на 267,83%, p < 0,05)) (таблица 5). Следует отметить, что в максимальной степени парасимпатикотония выражена в условиях цереброишемического варианта течения АГ (значимо большие значения WAM10, HRVti и HF - 194,54±66,37 мс, 8,22±1,31 усл. ед. и 2287,77±1781,56 мс2 соответственно, p < 0,05). СД АГ проявляется относительной симпатикотонией (увеличение LFnorm и LF/HF (на 161,61%, p < 0,001 и 311,11%, p < 0,05 соответственно)) с участием центральных эрготропных (надсегментарных) и гуморально-метаболических механизмов (повышение VLF% и IC - на 149,07% и в 3,13 раза, p < 0,01) (таблица 5). При этом максимальное значение ПАПР было достоверно выше в условиях коронароишемического варианта течения заболевания (78,00±0,60 усл. ед., p < 0,05).
Выявленные различия позволяют рекомендовать комплексную оценку ВСР, включая исследование нелинейной хаотической динамики сердечного ритма, в программу обследования пациентов старших возрастных групп с целью индивидуализации медикаментозной терапии АГ.
Нами выявлено, что атеросклеротические гемодинамически незначимые стенозы сонных артерий с поражением барорецепторных зон каротидных синусов, формирующие асимметрию кровотока и паттерн затрудненной перфузии в общих сонных артериях у больных данной возрастной группы, сопровождаются снижением чувствительности барорефлекса и повышением вариабельности как САД за сутки и дневные часы (КА: r = 0,391, p < 0,05 и r = 0,432, p < 0,01 соответственно), так и ДАД за сутки (PI: r = 0,364; ISD: r = 0,358, p < 0,05 для всех случаев), с развитием вегетативной дисфункции (асимметрия кровотока в бассейне общих сонных артерий коррелирует с уменьшением параметров N1, N2 и N3 (r = -0,539, r = -0,462 и r = -0,462 соответственно, p < 0,05)). При этом в условиях СД АГ на фоне поражения наружных и внутренних сонных артерий развивается симпатикотония (снижение HF (PI: r = -0,449 и ISD: r = -0,435 соответственно, p < 0,05) и повышение LF (PI: r = 0,435 и ISD: r = 0,435 соответственно, p < 0,05)) с повышением роли надсегментарных центральных эрготропных влияний (количество пораженных экстракраниальных сосудов позитивно коррелировало с VLF (r = 0,433, p < 0,05)).
Длительно повышенные среднесуточное и среднедневное САД (ОПСС: r = 0,426, p < 0,001 и r = 0,306, p < 0,01 соответственно; Е/A: r = -0,232 и r = -0,354 соответственно, p<0,01), ПАД в дневные часы (ОПСС: r = 0,242; ТЗСЛЖ: r = 0,223; ОТС ЛЖ: r = 0,207; Е/A: r = -0,313; Еi/Ai: r = -0,327, для всех p<0,05), вариабельность САД за сутки и ночные часы (ТЗСЛЖ: r = 0,313, p<0,01 и r = 0,258, p<0,05 соответственно; ТМЖП: r = 0,290 и r = 0,310 соответственно, p<0,05; ОТС ЛЖ: r = 0,370 и r = 0,390 соответственно, p<0,05; Еi/Ai: r = -0,298 и r = -0,287 соответственно, p<0,05), ВУП САД (ТЗСЛЖ: r = 0,231, p < 0,05), а также увеличение среднесуточного ДАД (ОПСС: r = 0,348, p < 0,001; Е/A: r = -0,241, p<0,01) и его ИВ (Еi: r = -0,315, p<0,05) лежали в основе роста ОПСС и хронической гемодинамической перегрузки миокарда ЛЖ, формирования его ремоделирования, преимущественно по прогностически самому неблагоприятному его типу - концентрической гипертрофии (53%, χ2 = 12,75, p < 0,001), с увеличением ТМЖП, ТЗСЛЖ, ОТС ЛЖ, ММЛЖ и ИММЛЖ (на 117,91%, 124,44%, 109,76%, 169,59% и на 161,75% соответственно, p < 0,001), и стимуляцией возраст-зависимого увеличения содержания коллагена в миокарде ЛЖ, что проявляется нарушением его диастолической функции, большей частью, по нерестриктивному типу (85%, χ2 = 7,72, p < 0,01) (с уменьшением Е/А (на 14,85%, p<0,001) и Еn (на 14,67%, p<0,01), ростом А и Аi (на 139,13%, p<0,01 и 148,94%, p<0,05 соответственно), DT (на 128,57%, p<0,01)) в условиях АГ у больных в возрасте 65 лет и старше (таблица 6). Это процессы лежат в основе нарастания КДР ЛП (на 17,91%, p<0,001), что может рассматриваться как фактор риска развития мерцательной аритмии и хронической сердечной недостаточности в данной группе пациентов (C.Pitsavos et al., 2000). Следовательно, процесс ремоделирования при АГ в условиях старения, охватывая миокард ЛЖ и ЛП, может рассматриваться как проявление гипертонического сердца.
Таблица 6.
Сравнительная характеристика параметров ЭхоДКГ в основной и в контрольной группах, а также в подгруппах больных СД и ИС АГ
| Показатель | Основная группа n = 201 человек | Контрольная группа, n = 30 человек | ||
| Группа в целом, n= 201 человек | Больные СД АГ, n = 137 человек | Больные ИС АГ, n = 62 человека | ||
| КДР ЛП, см | 3,95 0,04*** | 3,95 0,04*** | 3,96 0,08*** | 3,35 0,07 |
| ТМЖП, см | 1,24 0,01*** | 1,23 0,02*** | 1,26 0,02*** | 0,94 0,03 |
| ТЗСЛЖ, см | 1,12 0,01*** | 1,12 0,01*** | 1,14 0,02*** | 0,90 0,03 |
| ОТС ЛЖ, усл. ед. | 0,48 0,01*** | 0,48 0,01*** | 0,49 0,01*** | 0,41 0,01 |
| ФВ, % | 62,41 0,59 | 62,51 0,72 | 63,39 1,07 | 63,87 1,48 |
| ФС, % | 34,28 0,41 | 34,20 0,49 | 34,60 0,77 | 34,83 1,12 |
| ММЛЖ, г | 274,39 5,73*** | 272,71 6,55*** | 278,73 11,38*** | 161,80 9,71 |
| ИММЛЖ, г/м2 | 150,23 3,91*** | 151,89 4,64*** | 147,94 7,32*** | 92,88 5,47 |
| Е, м/с | 0,51 0,02 | 0,50 0,02 | 0,52 0,03 | 0,51 0,02 |
| A, м/с | 0,64 0,03** | 0,65 0,03** | 0,62 0,04** | 0,46 0,03 |
| E/A, усл. ед. | 0,86 0,03*** | 0,85 0,03*** | 0,87 0,03*** | 1,01 0,08 |
| Ei, м/с | 0,082 0,007 | 0,085 0,010 | 0,077 0,008 | 0,056 0,003 |
| Ai, м/с | 0,070 0,007* | 0,074 0,009* | 0,062 0,004 | 0,047 0,003 |
| Ei/Ai, усл. ед. | 1,26 0,05 | 1,25 0,07 | 1,23 0,07 | 1,46 0,18 |
| Еn, м/с | 4,42 0,18** | 4,50 0,23 | 4,12 0,26** | 5,18 0,31 |
| ВИР, с | 0,110 0,013 | 0,096 0,009 | 0,148 0,040 | 0,078 0,003 |
| DT, с | 0,18 0,01** | 0,17 0,01* | 0,19 0,01* | 0,14 0,01 |
| ОПСС, дин×с×см-5 | 2309,27107,49*** | 2405,09 138,12*** | 2113,38 161,55* | 1445,75 109,99 |
| ПАД/УИ, мм. рт. ст./мл/м2 | 2,54 0,17*** | 2,60 0,23*** | 2,46 0,26*** | 1,17 0,10 |
Примечание.*-p<0,05, ** - p <0,01, *** - p <0,001 (сравнение с контрольной группой); ### - p <0,001 (различия между подгруппами больных с СД и ИС АГ)
Формирование ремоделирования ЛЖ и связанного с этим нарушения его диастолической функции, вне зависимости от варианта повышения АД, происходило на фоне увеличенных ОПСС и ПАД/УИ (на 59,73% и 117,09% соответственно, p<0,001).
Цереброишемический клинический вариант течения АГ характеризуется значимо большим ВИР (0,100±0,080 с, p < 0,05).
Не выявлено нарушения систолической функции ЛЖ у пациентов с СД и ИС АГ в данной возрастной группе. Не показано достоверных различий в паттернах центральной гемодинамики у больных старших возрастных групп с АГ, вне зависимости от варианта повышения АД.
В рассматриваемой возрастной группе пациентов с АГ выявлены независимые факторы формирования гипертрофии ЛЖ (ИММЛЖ) (увеличение САД в дневные часы (β = 0,833, p = 0,006) и LFnorm (β = 0,609, p = 0,023)). Указанные данные сужают круг независимых предикторов формирования ремоделирования ЛЖ, полученных в ходе исследования LIFE (V.Papademetriou et al., 2001), сохраняя только среднедневное САД, и впервые включают LFnorm. Симпатикотония с повышением роли надсегментарных центральных эрготропных и гуморально-метаболических влияний вносит свой вклад в прогрессирование ремоделирования ЛЖ и нарушение его диастолической функции: отрицательная связь между Е и LF/HF (r= -0,394, p<0,05), Еi, а также En, и VLF (r= -0,391 и r= -0,427 соответственно, p<0,01), что связано с симпато-усилением напряжения стенок ЛЖ. Тесная взаимосвязь симпатоадреналовой и ренин-ангиотензин-альдостероновой систем в условиях АГ у лиц пожилого и старческого возраста способствует акселерации возраст-зависимых изменений в миокарде ЛЖ, что результирует развитием ремоделирования сердца и интерстициального миокардиофиброза (Е.В.Шляхто и соавт., 2003). В то же время сама гипертрофия ЛЖ сопровождается снижением чувствительности синусового узла к вегетативным влияниям и снижением общей мощности спектра нейрогуморальной модуляции (ММЛЖ: r = -0,498, p<0,001; ИММЛЖ: r = -0,379, p<0,05), нарастанием «вегетативного десинхроноза» (Е.Д.Голованова и соавт., 2005). Следует подчеркнуть, что по данным ряда популяционных исследований (The Framingham Heart Study, ARIC) снижение ВСР сопровождается более высокой частотой развития сердечно-сосудистых осложнений и смертности от них, в том числе у лиц старших возрастных групп (J.M.Dekker et al., 2000, H.Tsuji et al., 1996).
Независимыми предикторами развития нарушения диастолической функции ЛЖ, описываемого снижением Ei/Ai, являются отсутствие адекватного снижения ДАД в ночные часы (СНС ДАД (β = 1,804, p = 0,017)) и повышение ХС-ЛПНП (β = - 0,904, p = 0,034)).
АГ у пациентов 65 лет и старше, вне зависимости от клинического варианта ее течения, сопровождается повышением агрегационной способности тромбоцитов (52%) и содержания фактора фон Виллебранда (на 132,07%, p < 0,05). Это доказывается наличием спонтанной агрегации (23%, p < 0,001), необратимой агрегации (отсутствие дезагрегации – 44%), совпадения по времени первой и второй волн агрегации за счет ускорения реакции высвобождения (24%), увеличения LT тромбоцитов в ответ на «средние» и «сильные» индукторы (АДФ 2×10-6 М и 5×10-6 М, а также ристомицин) на 97,77%, p < 0,05; 59,05%, p < 0,001 и 60,28%, p < 0,05 соответственно (таблица 7). Статистически значимое увеличение содержания фактора фон Виллебранда у больных АГ в возрасте 65 лет и старше, по-видимому, отражает значимость прогрессирующего повреждения эндотелиальных клеток и повышенной активации эндотелиоцитов в стимуляции агрегационной способности тромбоцитов (А.И.Мартынов и соавт., 2005). Указанные нарушения, могут являться факторами риска развития тромботических окклюзий мозговых и коронарных артерий. При этом СД АГ характеризуется более выраженной гиперфункцией тромбоцитов в сравнении с ИС АГ. Об этом свидетельствуют наличие спонтанной агрегации тромбоцитов - независимого фактора риска развития атеротромбоза (М.Ю.Жук и соавт., 2003, H.K.Breddin et al., 1999), более высокие показатели LT тромбоцитов в ответ на АДФ 2×10-6 М и 5×10-6 М (на 82,22% и 7,48% соответственно, p<0,05), а также SL тромбоцитов с АДФ 0,5×10-6 М (на 115,90%, p<0,05) в сравнении с подгруппой лиц с ИС АГ и обследуемыми без АГ (таблица 7).
Таблица 7.
Сравнительная характеристика показателей сосудисто-тромбоцитарного гемостаза в основной и в контрольной группах, а также в подгруппах больных СД и ИС АГ
| Показатель | Основная группа, n = 71 человек | Контрольная группа, n = 30 человек | ||
| Группа в целом, n = 71 человек | Больные СД АГ, n = 40 человек | Больные ИС АГ, n = 31 человек | ||
| Спонтанная агрегация, ПА, отн. ед. | 2,10 0,95*** | 3,10 1,59*** | 0,77 0,54 | 0 |
| АДФ, 0,5 мкМ агрегация, LT, % | 12,94 2,98 | 16,62 4,37 | 6,52 1,28 | 9,65 1,26 |
| АДФ, 0,5 мкМ агрегация, SL, %/мин. | 10,60 1,79 | 13,17 2,49# | 6,10 1,37 | 9,88 1,16 |
| АДФ, 2 мкМ агрегация, LT, % | 40,72 5,13* | 50,33 6,99**# | 27,62 5,69 | 20,59 2,49 |
| АДФ, 2 мкМ агрегация, SL, %/мин. | 27,70 2,75 | 31,63 4,21 | 22,33 2,45 | 26,07 2,87 |
| АДФ, 5 мкМ агрегация, LT, % | 59,55 4,18*** | 53,71 5,01***# | 49,97 4,33 | 37,44 2,39 |
| АДФ, 5 мкМ агрегация, SL, %/мин. | 48,94 3,65 | 48,94 3,65 | 42,44 4,83 | 46,13 0,77 |
| Ристомицин, 0,8 мг/мл агрегация, LT, % | 57,70 6,71* | 61,21 8,71 | 50,20 10,06 | 36,00 1,75 |
| Ристомицин, 0,8 мг/мл агрегация, SL, %/мин. | 65,73 5,36 | 67,64 6,94 | 59,97 5,53 | 63,30 4,36 |
| Фактор фон Виллебранда, % | 90,69 12,51* | 92,88 18,64 | 87,20 15,58 | 68,67 1,15 |
Примечание.*-p<0,05, ** - p <0,01, *** - p <0,001 (сравнение с контрольной группой); # - p <0,05 (различия между подгруппами больных с СД и ИС АГ)
Корреляционный анализ показал значимую роль АД в повышении агрегационной активности тромбоцитов. Это подтверждает положительная связь между повышенным ДАД в течение суток и LT тромбоцитов с АДФ 2×10-6 М (r = 0,462 и 0,448 соответственно, p < 0,05), а также между показателями «нагрузки давлением» (ИВ ДАД и САД в вышеназванный промежуток времени) и SL тромбоцитов с АДФ 5×10-6 М и 2×10-6 М соответственно (r = 0,661 и 0,636 соответственно, p < 0,05). Увеличение ПАД в дневной и ночной периоды времени сопровождалось ростом LT тромбоцитов с ристомицином (r = 0,586, p < 0,05 и r =0,686, p < 0,001 соответственно).
Спонтанная агрегация тромбоцитов у больных АГ старших возрастных групп наблюдалась на фоне нарастания ИММЛЖ (ПА: r = 0,540, p < 0,01). Увеличение активности индуцированной агрегации происходило по мере прогрессирования как нарушения диастолической функции ЛЖ (E/A: r = -0,451, p < 0,05 в случае LT тромбоцитов с АДФ 5×10-6 М и r = -0,638, p < 0,01 - с ристомицином; А: r = 0,555, p < 0,05 в случае LT тромбоцитов с ристомицином; Аi: r = 0,521, p < 0,05 в случае SL тромбоцитов с АДФ 5×10-6 М и r = 0,559, p < 0,05 - LT тромбоцитов с АДФ 2×10-6 М), так и атеросклеротического поражения каротид на экстракраниальном уровне (увеличение PI и ISD в общих сонных артериях сопровождалось ростом SL тромбоцитов с АДФ 0,5×10-6 М (r = 0,638 во всех случаях, p < 0,05), а во внутренних сонных артериях – LT тромбоцитов с АДФ 0,5×10-6 М (r = 0,673 во всех случаях, p < 0,05), тогда как снижение Vs в последних – увеличением LT тромбоцитов с АДФ 5×10-6 М (r = -0,448, p < 0,05)). Это указывает на роль атеросклеротического поражения артерий в формировании повышенной агрегационной способности тромбоцитов, что связано с дисфункционирующим эндотелием бляшек и нарушениями ламинарного потока крови.
Рост индуцированной АДФ 2×10-6 М агрегации тромбоцитов протекал на фоне симпатикотонии (RRNN: r = -0,762, p < 0,05 в случае SL) с участием центральных эрготропных и гуморально-метаболических механизмов (VLF: r = 0,657, p < 0,05 в случае LT). Симпатикотония также сопровождала увеличение SL тромбоцитов с ристомицином (LF: r = 0,600, p < 0,05). Полученные данные показывают повышенную чувствительность тромбоцитов в условиях АГ у лиц пожилого и старческого возраста к локальным катехоламиновым воздействиям, в частности из симпатических окончаний сердца, что может являться следствием увеличения плотности α2-адренорецепторов тромбоцитов, и играет роль триггерного механизма к преходящим изменениям коронарного кровотока, в особенности у больных с гипертрофией ЛЖ (А.И.Мартынов, 2002, A.D.Blann et al., 2003, G.Y.H.Lip et al., 2000). Таким образом, активация симпатической нервной, а также ренин-ангиотензиновой систем, наряду с прогрессированием АГ и атеросклеротического поражения каротид сопровождается повышением агрегационного потенциала тромбоцитов, преимущественно в условиях комбинированной АГнноймущественно . Следует рекомендовать лабораторное тестирование сосудисто-тромбоцитарного гемостаза у больных АГ старших возрастных групп для оценки необходимости и адекватности дезагрегантной терапии, играющей важную роль в профилактике атеротромботических осложнений.
Нами проведена оценка эффективности антигипертензивной терапии больных АГ пожилого и старческого возраста препаратами различных групп: амлодипин (5-10 мг/сутки), бетаксолол (10-20 мг/сутки), индапамид-ретард (1,5 мг/сутки), периндоприл (4-8 мг/сутки, n = 68 человек). К 12 месяцу терапии снижение среднесуточного АД не различалось между группами: амлодипин (-19,78% / -14,50%, p<0,01), бетаксолол (-24,69% / -20,39%, p<0,001), индапамид-ретард (-12,01% / -23,77%, p<0,01 в случае ДАД), периндоприл (-11,76%/-17,97%, p<0,05 в случае САД и p<0,01 - ДАД), но при этом большая частота полной антигипертензивной эффективности на протяжении 1 года имела место в случае бетаксолола (89%, χ2 = 7,83, p < 0,01) и амлодипина (67%, χ2 = 7,39, p < 0,01) против периндоприла (59%), в случае использования которого наблюдалось «ускользание» нормализующего эффекта на САД и ПАД за сутки и дневные часы (∆САД: +7,55% и +7,14%, ∆ПАД: +24,34% и +25,23% соответственно, p<0,05), наблюдавшегося на 3 месяце лечения. Комбинированная терапия чаще наблюдалась при использовании периндоприла и индапамида-ретарда (76% и 65% соответственно) против амлодипина и бетаксолола (50% и 60% соответственно). По частоте развития побочных эффектов у пациентов пожилого и старческого возраста с АГ к 12 месяцу терапии лидирует периндоприл (38%), достоверно опережая амлодипин (29%), бетаксолол (26%) и индапамид-ретард (25%) (χ2 = 3,99, p < 0,05). В течение 1 года наблюдения у больных, продолжавших прием вышеназванных препаратов, не выявлено осложнений АГ. Наблюдение в течение 3 последующих лет выявило в подгруппе периндоприла – 6 (8,82%) летальных случаев вследствие ОНМК и ИМ (по 3 соответственно (4,41%)), в подгруппе амлодипина - 5 (8,93%) летальных случаев вследствие ОНМК и в подгруппе бетаксолола – 4 (7,02%) вследствие ИМ, без какого-либо различия между подгруппами.
У больных АГ пожилого и старческого возраста, вне зависимости от варианта повышения АД, терапия амлодипином обеспечивала преходящее нарастание преимущественно функциональной вегетативной дисфункции с тенденцией к нормализации к 12 месяцу терапии, проявлявшейся первоначально нараставшей, а затем уменьшавшейся вариабельностью ритма сердца (рисунок 1) и парасимпатикотонией (от выраженной абсолютной до умеренной относительной) (рисунок 2) с проградиентным снижением активности как центрального контура регуляции (церебральных эрготропных и гуморально-метаболических влияний), так и модулирующих афферентных симпатических влияний вследствие барорецепторной активности (рисунок 4). Использование бетаксолола сопровождалось повторным появлением исчезнувшей к 3 месяцу органической вегетативной дисфункции, что проявилось рецидивным повышением уменьшившейся к 3 месяцу общей вариабельности ритма сердца (рисунок 1) и сохранением умеренной абсолютной парасимпатикотонии (рисунок 2), более выраженной в условиях ИС АГ в ходе трехмесячной терапии. индапамид-ретард, вне зависимости от варианта АГ, вызывал уменьшение вегетативной дисфункции с транзиторным повышением вариабельности ритма сердца (рисунок 1), а также развитие абсолютной парасимпатикотонии, уменьшавшейся в процессе терапии с преимущественно выраженных до умеренных значений. Лечение периндоприлом характеризовалось транзиторной эйтонией к 3 месяцу терапии с последующим «ускользанием» гармонизирующего вегетотропного действия: нарастание вегетативной дисфункции за счет прогрессирующего повышения вариабельности ритма сердца (рисунок 1) со снижением симпатических (рисунок 3) и увеличением парасимпатических влияний до степени абсолютной парасимпатикотонии (рисунок 2), более выраженных в условиях ИС АГ в ходе трехмесячной терапии.
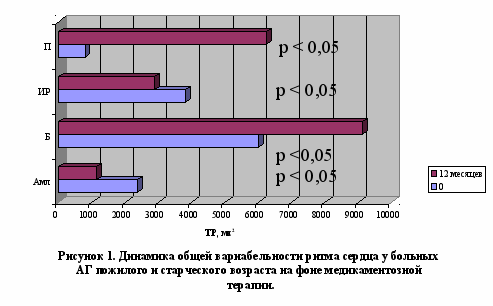
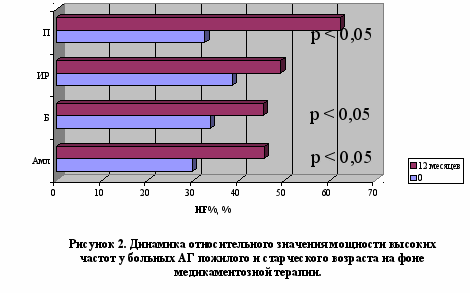
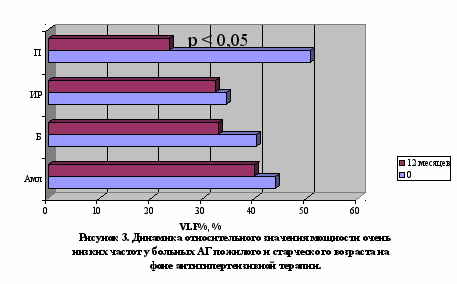
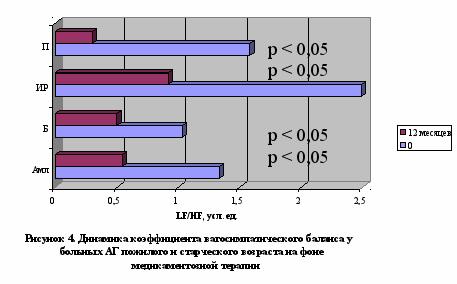
Следовательно, использование оценки ВСР позволяет индивидуализировать назначение антигипертензивной терапии (при повышении общей вариабельности ритма сердца и преобладании парасимпатикотонии, преимущественно в условиях ИС АГ, показаны амлодипин и индапамид-ретард. При относительном увеличении симпатического тонуса и активности центрального контура регуляции, в основном при СД АГ, показано применение бетаксолола, амлодипина, периндоприла и индапамида-ретарда).
Амлодипин и периндоприл обладали максимальной регрессивной эффективностью на гипертрофию ЛЖ у больных пожилого и старческого возраста с АГ (∆ММЛЖ = -33,13%, p<0,001 и -28,50%, p<0,01 соответственно). Амлодипин снижал частоту концентрического и ликвидировал эксцентрический паттерны гипертрофии ЛЖ [с 64% до 25% (χ2 = 4,18) и с 18% до 0% (χ2 = 4,46) соответственно, p < 0,05] за счет уменьшения ТМЖП (-14,06%, p<0,001), ТЗСЛЖ (-19,68%, p<0,001) и ОТС ЛЖ (-10,00%, p<0,01) вне зависимости от варианта повышения АД и клинического течения АГ. 12-месячная терапия периндоприлом сопровождалась редукцией исходно увеличенной ТЗСЛЖ (-21,43%, p<0,001), максимально выраженной в условиях смешанного клинического варианта СД АГ (при ТМЖП < 1,16 см). Индапамид-ретард обеспечивал в ходе длительной терапии уменьшение полости ЛЖ (∆КДР ЛЖ = - 10,75%, p<0,05 и ∆КДО ЛЖ = - 28,26%, p<0,01) вне зависимости от вариантов повышения АД и клинического течения заболевания. Бетаксолол вызывал ликвидацию эксцентрической гипертрофии ЛЖ [c 21% до 0% (χ2 = 5,80, p < 0,05)], преимущественно в условиях коронароишемического клинического варианта течения СД АГ у больных в возрасте 65 лет и старше.
Амлодипин в ходе 12-месячной терапии показал максимальную нормализующую эффективность на нарушенную диастолическую функцию ЛЖ I типа (χ2 = 5,82, p < 0,05) (за счет снижения А и Аi – на 44,62%, p < 0,001 и на 60,00%, p < 0,01 соответственно, и увеличения Е/А и En - на 53,41%, p < 0,01 и на 55,50%, p < 0,001 соответственно) вне зависимости от вариантов повышения АД и клинического течения АГ. Периндоприл обладал нормализующим влиянием на исходно повышенные значения А (-42,11%, p < 0,01), преимущественно при смешанном и коронароишемическом клинических вариантах АГ вне зависимости от варианта повышения АД в данной возрастной группе.
Годичное применение амлодипина, вне зависимости от вариантов повышения АД и клинического течения АГ у лиц пожилого и старческого возраста, оправдано при исходно повышенном ОПСС (-33,37%, p < 0,05), тогда как использование бетаксолола и индапамида-ретарда целесообразно в случае гиперкинетического типа центральной гемодинамики (УИ более 45 мл/м2) (χ2 = 5,23 и 4,87 соответственно, p < 0,05). Индапамид-ретард также уменьшал повышенную жесткость системного артериального русла (∆ПАД/УИ = - 32,17%, p < 0,05), показав свою максимальную антигипертензивную эффективность при ПАД/УИ < 1,76 усл. ед.
Исследуемые антигипертензивные препараты не влияли на погранично повышенные атерогенных фракций липопротеинов крови, за исключением амлодипина и индапамида-ретарда, нормализовавших выраженность погранично повышенной гипертриглицеридемии на фоне 3- (-13,54%, p < 0,05 - в случае амлодипина) и 12 месячной терапии (-18,68%, p < 0,05 - в случае индапамида-ретарда).
Все это требует дополнительного назначения статинов в условиях мультифокального, симптомного атеросклеротического поражения у пациентов пожилого и старческого возраста с АГ, вне зависимости как от вариантов её клинического течения, так и повышения АД.
Амлодипин обладал свойствами опосредованного ингибитора агрегации тромбоцитов, нормализуя спонтанную (p < 0,05) и исходно повышенную, индуцированную только АДФ 5х10-6 М (∆LT = -39,38%, p < 0,05), их агрегационную способность. Бетаксолол показал свою эффективность только в случае спонтанной агрегации тромбоцитов (p < 0,05), а индапамид-ретард – индуцированной АДФ 5х10-6 М (∆SL = -45,30%, p < 0,05). Не отмечено влияния всех исследуемых антигипертензивных препаратов на исходно повышенное содержание фактора фон Виллебранда в условиях АГ у лиц старших возрастных групп. Это обосновывает целесообразность дополнительного подключения к эффективной антигипертензивной терапии контролированного лечения дезагрегатами с целью первичной профилактики тромботических осложнений у больных АГ пожилого и старческого возраста высокого и очень высокого стратификационного риска.
Нами выявлены предикторы эффективности терапии представителями различных классов антигипертензивных препаратов:
- амлодипин
А) смешанный и цереброишемический варианты СД АГ:
- ИВ САД за сутки < 79,70% (p=0,030);
- САД в дневные часы < 153,00 мм рт. ст. (p=0,034);
- вариабельность САД в ночные часы < 15,59 мм рт. ст. (p=0,033);
- СНС ДАД < 11,27% (p=0,026);
Б) коронароишемический и смешанный варианты ИС АГ:
- RRmin <1052,63 мс (p=0,032);
- бетаксолол (СД АГ):
- ПАПР > 36,72 усл. ед. (p=0,013);
- индапамид-ретард (смешанный вариант СД АГ):
- вариабельность САД за сутки = 14,40-22,27 мм рт. ст. (p=0,023);
- СНС ДАД < 9,88 % (p=0,023);
- ПАПР>40,91 усл. ед. (p=0,038);
- ПАД/УИ < 1,76 усл. ед. (p=0,028);
- периндоприл (смешанный и цереброишемический варианты СД АГ):
- СНС ДАД > 4,74% (p=0,034);
- VLF% > 54,59% (p=0,024);
- ТМЖП < 1,16 см (p=0,027).
Нами разработан алгоритм комплексного лечения АГ у больных старших возрастных групп с включением гиполипидемической и дезагрегантной терапии (таблица 8).
Таблица 8.
Алгоритм комплексной терапии АГ у лиц старших возрастных групп (65+)
| Вариант повышения АД | Антигипертензивная терапия | Гиполипидемическая терапия (статины) | Дезагрегантная терапия (ацетилсалициловая кислота) | |
| Уточнить клинический вариант течения АГ | Провести анализ ВСР | Объективизировать наличие мультифокального атеросклеротического поражения в условиях ОХС ≥ 5,0 ммоль/л | Оценить наличие активации сосудисто-тромбоцитарного гемостаза:
| |
| СД АГ |
|
| +++ | +++ |
| ИС АГ |
| +++ | + | |
