Гусаева ханум замрутдиновна современные аспекты патогенеза, диагностики и лечения сочетанных доброкачественных заболеваний матки
| Вид материала | Автореферат |
СодержаниеРезультаты исследования и их обсуждение Практические рекомендации |
- Информационное письмо №1 Уважаемые коллеги!, 50.08kb.
- Информационное письмо №1 Уважаемые коллеги!, 47.13kb.
- Запорожан В. Н., Голант М. Б., Хаит, 62.84kb.
- Тематическая выставка, 439.17kb.
- Эндост Мотор Апекс доклад, 94.79kb.
- «Актуальные аспекты экстракорпорального очищения крови в ит», 292.88kb.
- Н. А. Нечипоренко и д м. н., профессор, 2241.71kb.
- Заболевания шейки матки при беременности (современные аспекты диагностики и тактика, 505.53kb.
- «Современные методы диагностики и лечения в реаниматологии», 25.71kb.
- Заболевания шейки матки при беременности (современные аспекты диагностики и тактика, 509.81kb.
Из 1602 больных репродуктивного возраста, которые были оперированы в отделении оперативной гинекологии Центра (руководитель – академик Л.В. Адамян) по поводу патологии матки у 664 (41,5%) женщин выявлены сочетанные доброкачественная заболевания эндо- и миометрия. Согласно данным гистологического исследования тканей, которые были удалены в ходе различных оперативных вмешательств на матке, миома обнаружена у 89,7% пациенток, аденомиоз у 76,6%, гиперпластические процессы эндометрия у 46,8%. Из них в I группе были выявлены: множественная миома матки у 208 (58,9%), в том числе субмукозное расположение узлов - у 15 (7,2%); очаговый аденомиоз - у 52 (14,7%); узловая форма аденомиоза - у 13 (3,7%); диффузный аденомиоз II-III степени - у 261 (73,9%) больной. Во II группе множественную миому матки диагностировали у 83 (53,5%), субмукозное расположение узлов у 25 (16,1%); простую гиперплазию эндометрия - у 31 (20%); полипы эндометрия - у 93 (60%), из них аденоматозный - у 6 (3,8%), железисто-фиброзный - у 30 (33,3%), железистый - у 18 (20%) больных. У женщин III группы очаговый аденомиоз был в 17 (25%) случаях, диффузный аденомиоз II-III степени - у 51 (75%); полипы эндометрия - у 39 (57,3%); атипическая гиперплазия эндометрия - у 5 (7,3%); простая гиперплазия эндометрия - у 24 (35,2%). В IV группе множественная миома матки выявлена у 59 (67%), один миоматозный узел у 29 (32,9%), субмукозное расположение узла – у 17 (19,3%) очаговый аденомиоз - у 24 (27,2%), диффузный аденомиоз II-III степени - у 39 (44,3%), диффузно-узловой аденомиоз - у 25 (28,4%); полипы эндометрия - у 43 (48,8%), атипическая гиперплазия эндометрия - у 2 (2,2%), простая гиперплазия эндометрия - у 43 (48,8%) больных.
Средний возраст больных с сочетанными заболеваниями матки был 40,2 года (I группа - 41,6±8,3; II группа - 38,9±4,1; III группа - 36,7±4,5; IV группа 37,3±7,3). Все больные были репродуктивного возраста.
В клинической картине заболевания каждая вторая пациентка указывала на различные нарушения менструального цикла, которые стали беспокоить в течение 1-9 лет. Из них у подавляющего большинства женщин характер нарушений менструального цикла стал усугубляться в течение последних 1-2 лет. Ведущими жалобами в I, II и IV группах были: мено-метроррагия различной степени выраженности - 87,8%, 76,7% и 78,4%; слабость - 54,9%, 32,9%, 45,4%; анемия – 32%, 29%, 40,9% соответственно по группам. Основными жалобами больных III группы были альгодисменорея и приступообразные боли во время менструации (69,1%).
Изучение семейного анамнеза выявило у ближайших родственников 139 (21%) пациенток от общего числа больных миому матки, из них у 63 (17,8%) в I группе, у 38 (24,5%) во II группе, у 10 (14,7%) и 28 (31,8%) в III и IV группах соответственно. Отягощенная онкологическая наследственность отмечена у 224 (33,7%) женщин. При этом опухоли половых органов и/или молочных желез наблюдали приблизительно с одинаковой частотой во всех группах: 54 (15,2%); 25 (16,1%); 10 (14,7%) и 15 (17%) в I, II, III и IV соответственно. Опухоли экстрагенитальной локализации преимущественно отмечены у 19 (21,5%) больных в группе с сочетанием всех трех патологических состояний (миомы матки, аденомиоза и гиперпластические процессы эндометрия).
Изучение преморбидного фона с обращением особого внимания на заболеваемость в детстве, перенесенные в прошлом и сопутствующие в настоящее время заболевания, позволило выявить, что индекс здоровья обследованных больных был довольно низким. В среднем на 1 больную с сочетанными доброкачественными процессами матки приходится 2,6 экстрагенитальных заболеваний (по группам: I - 2,6, II - 2,4, III - 2,2 и IV- 2,7).
Среди перенесенных экстрагенитальных заболеваний преобладали болезни желудочно-кишечного тракта (хронический гастрит, гастродуоденит, панкреатит, холецистит, желчекаменная болезнь, дискинезия желчных путей) (55,7%), анемия (48,2%), варикозное расширение вен (34,4%), заболевания сердечно-сосудистой системы (33,2%), мочевыделительной системы (21,2%), поливалентная аллергия (29,2%), метаболические нарушения (11,5%), патология молочных желез (9,4%).
265 (40%) обследуемых больных ранее перенесли оперативные вмешательства - чаще других производилась аппендэктомия - 152 (22,8%) больным, тонзиллэктомия – 131 (19,7%) пациентам. Секторальная резекция молочной железы была выполнена 11 (1,6%) женщинам.
При анализе менструальной функции у обследованных больных было выявлено, что у 70% больных первая менструация наступила в возрасте 13-15 лет (средний возраст - 13,2 года): у 244 (69,1%) в I группе, у 113 (72,9%) во II группе, у 46 (67,6) и 63 (71,5%) в III и IV соответственно. Менархе до 11 лет чаще отмечалось в IV группе – у 11 (12,5%) женщин. У подавляющего большинства пациенток менструальный цикл установился сразу: 271 (76,6%), 100 (64,5%), 41 (60,2%) и 44 (50%) соответственно в I, II, III и IV группах. Продолжительность менструального цикла у большинства больных была в пределах 26-30 дней.
Сравнительный анализ репродуктивной функции у больных с сочетанными доброкачественными заболеваниями матки выявил, что 23,6% женщин репродуктивного возраста имели в анамнезе бесплодие: первичное – 8,7% и вторичное - 14,9%. Наибольшее количество беременностей отмечено у больных IV группы: у 51,2% было более 4 беременностей, у 7,9% - 14 и более беременностей, у 27% - беременность закончилась самопроизвольными выкидышами, 3 и более искусственных прерывания беременности - у 45,4% пациенток.
Из перенесенных гинекологических заболеваний обращает на себя внимание наличие в анамнезе у каждой второй больной (57,8%) хронических воспалительных процессов матки и придатков, по поводу которых большинство пациенток получали длительное консервативное лечение и терапию физическими факторами в стационаре и амбулаторно. Деструкция (крио-, лазер- и диатермокоагуляция) эпителия влагалищной части шейки матки по поводу доброкачественной патологии имела место в 43,9% наблюдений. Миомэктомия была в анамнезе у 63 (9,4%) обследованных пациенток. Оперативные вмешательства на придатках матки (резекция или удаление яичника по поводу эндометриоидной кисты, апоплексии или перекрута ножки кисты, сальпингэктомия и т.д.) произведены у 60 (9%) больных. Обращает на себя внимание, что 462 (69,5%) пациентки в прошлом перенесли неоднократные лечебно-диагностические выскабливания слизистой оболочки тела матки и цервикального канала по поводу дисфункциональных маточных кровотечений; их наибольшая частота отмечена в I группе - у 285 (80,7%) больных.
Длительность наблюдения за больными с появления первых жалоб и до операции у 55,5% не превышала 3-х лет. Свыше 5 лет находились под наблюдением 14 % женщин, из них основной контингент составили пациентки I и II группы (15,7% и 16,1%). На проведенную ранее гормональную терапию (норэтистерон, дидрогестерон, даназол, гестринон, бусерелин, золадекс и др.) указывала каждая вторая пациентка. Прием препаратов продолжался от 3 мес до 3 лет прерывистыми курсами.
Размеры матки соответствовали таковым при 5-7 недельной беременности у 21,5% всех больных, что преимущественно характерно для больных II группы. Увеличение размеров матки до 8-10 недельной беременности обнаружено у 47,1%, 42%, 51,5% и 48,8% больных соответственно в I, II, III и IV группах. Увеличение размеров матки более 12 недельной беременности наблюдалось у 11%, 6% и 8% соответственно в I, II, IV группах.
Таким образом, представленный анализ клинической картины больных с сочетанными доброкачественными заболеваниями матки выявил большой процент перенесенных и сопутствующих гинекологических и экстрагенитальных заболеваний, что характерно для всех клинических групп, которые отягощали их общее состояние, снижая качество жизни и нарушая функцию всех звеньев репродуктивной системы.
Информативность эхографии изучалась у 156 женщин с морфологически подтвержденным диагнозом заболеваний эндо- и миометрия. При сочетании миомы матки и аденомиоза у 3-х пациенток имело место несоответствие эхографического и гистологического диагнозов. Ложноположительный результат был у 1 больной с множественной миомой матки; ложноотрицательный - у 2 больных (в обоих случаях сопутствующим заболеванием был аденомиоз диффузно-узловой формы, у одной больной в сочетании с эндометриоидной полостью в миометрии). При сочетании миомы матки и гиперпластического процесса эндометрия ложноотрицательный результат получен у одной больной (при множественной миоме матки не был обнаружен мелкий аденоматозный полип эндометрия), ложноположительный - также у одной пациентки (за полип эндометрия принят мелкий субмукозный узел). У пациенток с сочетанием миомы матки, аденомиоза и гиперпластического процесса эндометрия ложноотрицательный результат у одной больной (полип эндометрия был расценен как субмукозный узел), ложноположительный - у 2-х больных (за полипы эндометрия были приняты миоматозные узлы субмукозной локализации). Специфичность УЗИ при сочетанных доброкачественных заболеваниях матки составила 87,7%, чувствительность - 82,5%, точность - 73,2%. На определенные сложности в диагностике сочетанных заболеваний эндо- и миометрия указывают также К.И. Малевич (1994), А.И. Гус (1996), Демидов В.Н. (1997). Вероятно, взаимное наслаивание акустических картин миомы матки, аденомиоза и гиперпластического процесса эндометрия усложняет диагностику.
Магнитно-резонансная томография проведена у 51 пациентки, каждой из которых предварительно было проведено ультразвуковое исследование органов малого таза и не уточнен диагноз. Основными показаниями к проведению МРТ были: а) сложности в точной диагностике после проведения всего комплекса традиционных клинико-диагностических исследований, включая данные УЗИ; б) существенные различия клинической картины заболевания и данных УЗИ; в) необходимости выбора объема операции при заинтерсованности в сохранении репродуктивной функции. Для более точной дифференциальной диагностики 9 пациенткам была проведена повторная МР-томография органов малого таза во второй фазе. Специфичность МРТ при сочетанных доброкачественных заболеваниях матки составила 83,3%, чувствительность - 92%, точность - 93,4%. Несоответствие МРТ и гистологического диагноза отмечено у 4 больных. Ложноотрицательный результат был у 3 больных, когда за миоматозные узлы были приняты узлы аденомиоза. Ложноположительное заключение МРТ имело место у 1 пациентки - за полип эндометрия была принята миома матки. Учитывая то, что сочетание миомы матки, аденомиоза и гиперпластического процесса эндометрия часто является причиной ошибок и снижения точности диагноза, мы обобщили признаки, полученные при МР-исследовании, характерные для заболеваний эндо- и миометрия (табл. 1.)
Таблица 1
Дифференциальная МРТ-диагностика сочетанной доброкачественной патологии эндо- и миометрия
-
МРТ – признак
ММ
АМ
ГПЭ
Увеличение матки, асимметрия стенки
+
+
+
Изменения переходно–соединительной зоны
Появление кистозных полостей
_
+
_
Утолщение более 0, 7см
_
+
_
Изменения миометрия
Появление в миометрии зон пониженного гетерогенного сигнала
+
+
_
Появление кистозных полостей, иногда с геморрагическим компонентом
_
+
_
Изменения функционального эндометрия
Утолщение
_
_
+
Выраженное изменение структуры, с участками некрозов и кровоизлияниями
_
_
+
Образование в полости матки
Гетерогенное с кистозным компонентом
_
+
_
Изоинтенсивное эндометрию
_
_
+
С выраженным понижением МР сигнала
+
_
_
Расширение полости матки
_
_
+
Снижение дифференциации маточной стенки
_
+
_
«+» - признак наблюдается; «-» - признак не наблюдается.
Согласно результатам проведенного исследования, МРТ обладает большими возможностями в четкости определения локализации, степени и глубины распространения процесса. Скрининговым методом следует считать УЗИ, так как этот метод выявляет большинство изменений в матке. В сложных случаях, особенно после ранее перенесенных операций, прибегали к более дорогостоящим методам для оптимизации диагностического процесса. Наибольшую значимость точная оценка диагноза имеет для женщин репродуктивного возраста, когда определяется дифференцированный подход к выбору тактики ведения, объема операции и восстановительного лечения, направленных на сохранение репродуктивного потенциала.
Для исследования особенностей состояния иммунного статуса у обследованного контингента больных был использован экспресс-метод витальной компьютерной морфометрии. Для характеристики некоторых иммуноморфологических признаков сочетанных доброкачественных заболеваний матки у 38 больных проведено исследование периферической (ПК) и перитонеальной жидкости (ПЖ) с помощью прижизненной компьютерной фазометрии цитообъектов. Группы сравнения составили 8 больных миомой матки (ММ) и 12 практически здоровых женщин репродуктивного возраста.
На начальном этапе исследований проанализировали морфометрические параметры мононуклеарных клеток периферической крови и перитонеальной жидкости в сравниваемых группах. Установлено, что у пациенток I группы средние морфометрические показатели мононуклеаров периферической крови отличались достоверно меньшими значениями среднего диаметра, периметра и площади (91,8%, 88,4%, 83,4% от нормативных величин, р<0,05) при сниженных фазовых высоте и объеме (95,4% и 93,5%, соответственно, р>0,05). В популяции мононуклеаров перитонеальной жидкости этих больных были значительно увеличены средние величины диаметра, периметра, площади и объема (110,6%, 107,2%, 121,2% и 144,2%, соответственно, р<0,05), фазовая высота клеток соответствовала значениям нормы. У больных II группы все размерные показатели мононуклеаров периферической крови оставались в диапазоне нормальных значений, отмечалось только снижение фазовой высоты клеток (90,9%, р<0,05). В перитонеальной жидкости, напротив, средние D, P, S и V превышали нормативные величины на 9,4%, 5,2%, 114,8% и 118,1%, соответственно. Высота снижалась на 4,6% (р>0,05). Для III группы оказалось характерным снижение морфометрических показателей мононуклеаров периферической крови: D, P, Н, S и V клеток составили 92,9%, 90,0%, 90,9%, 87,5% и 88,3% от нормы, соответственно (р<0,05). В перитонеальной жидкости при практически неизмененных значениях диаметра и периметра были увеличены площадь и объем (109,0% и 124,4%, соответственно, р<0,05), но уменьшена средняя высота клеток (95,4%, р<0,05). В IV группе все морфометрические показатели мононуклеаров периферической крови оказались ниже нормативных величин: средние D, P, Н, S и V клеток составили 88,2%, 85,6%, 86,4%, 78,0% и 70,8%, соответственно (р<0,05). Мононуклеары перитонеальной жидкости, напротив, отличались увеличенными значениями D, P, S и V – 107,0%, 104,4%, 115,2% и 128,0%, соответственно. Фазовая высота оставалась в пределах нормы. У мононуклеаров периферической крови больных миомой матки также было зарегистрировано снижение всех размерных параметров: 91,8%, 91,2%, 95,4%, 85,7% и 82,4% для D, P, Н, S и V клеток, соответственно (р<0,05). В перитонеальной жидкости основные показатели клеточной популяции оставались в диапазоне нормальных значений, отмечалось только недостоверное снижение фазовой высоты (95,4%, р>0,05), увеличение площади (105,3%, р>0,05) и объема (112,3%, р>0,05).
Также нами исследовано морфофункциональное состояние Т- и В-лимфоцитов периферической крови у обследованных пациенток. Установлено, что у больных I группы величины средних значений в популяции диаметра и периметра Т-лимфоцитов оставались в пределах нормальных значений. Фазовые высота и объем снижались на 8,7% и 11,7%, соответственно (р<0,05). Во II группе D, P и S Т-клеток превышали показатели нормы на 11,1%, 9,1% и 16,2%, соответственно (р<0,05), при достоверном снижении величин фазовой высоты и объема на 21,7% и 12,0%, соответственно (р<0,05).
У пациенток III, IV и в группе с миомой матки все размерные показатели Т-лимфоцитов оказались ниже нормальных значений. Причем у больных III группы, а также у женщин с миомой матки все эти изменения были достоверны (р<0,05). Изменение морфофункционального состояния В-клеток у пациентов I, II, III и IV групп было практически равнозначным: все морфометрические показатели В-лимфоцитов были в той или иной степени снижены. Только у пациентов с миомой матки все размерные параметры В-клеток соответствовали нормативным значениям.
В В-популяции доля малых лимфоцитов (диаметр 8,5 мкм) составляют 35,3% клеток, средних (8,5 – 10,5 мкм) – 36,4%, больших ( 10,5 мкм) – 29,3%. В популяции Т-лимфоцитов у пациенток I группы наблюдались изменение содержания малых и средних Т-клеток и тенденция к увеличению числа больших лимфоцитов. Во II группе зарегистрировано увеличение содержания малых и больших Т-клеток до 35% и 41%, соответственно (против 28% и 15% в контроле). При этом количество лимфоцитов со средним диаметром (6,5 – 8,5 мкм) уменьшалось практически в 2 раза (24%). У пациентов III и IV групп изменение состава Т-клеточной популяции имело сходный характер: увеличивалось число малых лимфоцитов (55% и 45%, соответственно), снижалось количество больших – 11% и 10%.
Анализ морфометрических показателей В-лимфоцитов не выявил морфометрических признаков активации. Напротив, у пациенток I, II, III и IV групп оказалось сниженным содержание больших В-клеток – продуцентов иммуноглобулинов, а количество малых В-лимфоцитов было увеличенным до 48%, 49%, 44% и 57%, соответственно. В группе контроля (миома матки) нарушений в составе В-лимфоцитов не было обнаружено.
Поскольку известно, что фазовая высота лимфоцита отражает состояние хроматина в ядре и уровень его метаболизма в клетке, то увеличение этого показателя может свидетельствовать о снижении пролиферативной активности, а уменьшение, напротив, о повышенной способности к пролиферации. В связи с этим был проведен сравнительный анализ распределения лимфоцитов по их фазовой высоте: до 1,5 мкм, от 1,5 до 3,0 мкм и выше 3,0 мкм. Следует отметить, что во всех обследуемых группах был снижен процент Т-клеток с фазовой высотой выше 3,0 мкм, а в III группе такие лимфоциты просто не были обнаружены. Полученные результаты свидетельствуют о повышении пролиферативной активности интерфазного хроматина ядер Т-лимфоцитов, более выраженной у пациенток II и III групп. В популяции В-лимфоцитов незначительное подавление пролиферативной активности наблюдалось у пациенток I группы, однако в целом значимых структурных и функциональных изменений хроматина в ядрах В-клеток нами не было зарегистрировано: во всех группах содержание В-лимфоцитов с фазовой высотой менее 1,5 мкм и от 1,5 до 3,0 мкм оставалось в пределах 98% – 99% от состава популяции.
Представленные результаты компьютерной фазометрии клеток иммунной системы позволяют утверждать, что у больных с сочетанием миомы матки и аденомиоза имеют место изменения морфофункционального состояния клеточного звена иммунитета, как на локальном, так и на системном уровнях. Выявлено, что состав клеточной фракции перитонеальной жидкости формируется за счет появления клеток с увеличенными размерными показателями, и отражает, по-видимому, преобладание макрофагов.
При сочетании миомы матки и гиперпластических процессов эндометрия нарушения иммунологической регуляции также выявлены на всех уровнях. Значимых нарушений клеточного звена гуморального иммунитета у обследованных пациенток не установлено, определенные изменения морфофункционального состояния В-лимфоцитов имели стертый и разноплановый характер.
В III, а также IV группах показатели иммунореактивности оказались практически равнозначными. Мононуклеары перитонеальной жидкости имели увеличенные размеры, что предполагало наличие макрофагов и активированных лейкоцитов. В периферической крови имели место дисрегуляторные взаимоотношения между иммунокомпетентными клетками: иммунодефицит по Т-клеточному типу, более выраженный у пациенток III группы. В популяции В-лимфоцитов содержание больших клеток определялось на нижней границе нормы, в то же время у некоторых пациенток (преимущественно IV группы) обнаруживались признаки незначительной активации циркулирующих В-лимфоцитов.
У больных контрольной группы (миома матки) значимых изменений морфофункционального состояния мононуклеарных клеток на локальном уровне не выявлено. Показатели системного иммунитета продемонстрировали перестройку Т-звена, связанную, скорее всего, с процессами дифференцировки Т-лимфоцитов и незначительным повышением цитотоксического потенциала за счет цитотоксических лимфоцитов и натуральных киллеров. Все показатели В-звена иммунитета соответствовали нормальным значениям.
Цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию защитных реакций. Исследован уровень ряда цитокинов (IL-6, IL-8, TNF-α, INF-γ) в периферической крови и перитонеальной жидкости у 38 больных анализируемых нами групп. Больные миомой матки (n=8) составили контрольную группу.
Установлено, что во всех группах уровень фактора некроза опухоли в крови превышал нормативные значения (2,5 пк/мл): 3,8, 6,1, 6,4, 6,7 и 4,5 пк/мл в I, II, III, IV, и контрольной группах соответственно. Максимальное содержание TNF-α в перитонеальной жидкости было отмечено в группе больных миомой матки и аденомиозом (12,1 пг/мл против 3,3 пг/мл у соматически здоровых женщин). Во II, III и IV группах в перитонеальной жидкости содержание TNF-α было снижено, оставаясь практически на одном уровне: 8,0, 8,5 и 8,3 пг/мл, соответственно. Наиболее низкие значения цитокина оказались в контрольной группе – 4,8 пг/мл. Значительное повышение TNF-α характеризует цитотоксический потенциал мононуклеарных клеток крови, высокие уровни этого фактора в ПЖ свидетельствуют о функциональной активности фагоцитарных моноцитов.
Минимальное значение INF-γ в крови зарегистрировано в контрольной группе – 374,8 пк/мл, максимальное - во II группе, 567 пк/мл. У больных III и IV группы значительной разницы между уровнем INF-γ не выявлено – 511,3 и 527,2 пк/мл. В ПЖ, напротив, максимальный уровень INF-γ был обнаружен у больных III группы (864,1 пк/мл). В других группах содержание данного цитокина составило 503,0, 453,8, 766,3 и 647,3 пг/мл в I, II, IV и контрольной группах, соответственно.
При анализе IL-6 установлено, что в периферической крови у пациентов I, II, III и IV групп его концентрация изменялась недостоверно: 311,4, 233,1, 217, 1 и 259,3 пк/мл. Содержание IL-6 в перитонеальной жидкости у больных I, II, III и IV групп - 931,4, 767,7, 813,1 и 715, 4 пг/мл, соответственно. Самый низкий уровень IL-6 зарегистрирован в перитонеальной жидкости больных контрольной группы. Мы не обнаружили в периферической крови достаточную для определения концентрацию IL-8 у больных I группы. В перитонеальной жидкости также уровень этого цитокина находился на минимальных значениях – 16,1 пк/мл. У пациенток II группы и в периферической крови, и в перитонеальной жидкости было зарегистрировано максимальное содержание IL-8: 48,3 и 68,2 пг/мл, соответственно. Высокий уровень цитокина в периферической крови отмечался и у пациенток III, IV и контрольной групп: 23,8, 24,9 и 27,3 пг/мл, соответственно. В перитонеальной жидкости, напротив, большая концентрация была зарегистрирована у пациенток III группы – 56,9 пг/мл, а в IV и контрольной группах уровень IL-8 оказался практически равнозначным – 47,3 и 44,9 пг/мл.
Таким образом, результаты настоящего исследования указывают на важную роль иммунной системы в патогенезе доброкачественных заболеваний матки. Изучение цитокинового профиля позволило в определенной степени конкретизировать механизмы иммунологических нарушений на системном и локальном уровнях при конкретном патологическом процессе, а также оценить значение и роль каждого из них в манифестации клинических проявлений при сочетанных заболеваниях.
Учитывая данные литературы о возможности развития онкологического процесса в матке на фоне миомы матки, аденомиоза и гиперпластических процессов эндометрия (Железнов Б.И., Стрижаков А.Н., 1985; Kothapalli R., 1997; Баскаков В.П. и др., 2002), а также необходимость до операции принимать решение о тактике ведения больной в случае заинтересованности в сохранении репродуктивной функции, в своем исследовании мы уделили этому вопросу большое внимание.
Теломераза - фермент, компенсирующий укорочение эукариотических хромосом достраиванием утраченных в ходе репликации теломерных повторов. Активность теломеразы находится под гормональным контролем в таких эстрогензависимых тканях, как эндометрий, предстательная железа, и эпителиальных клетках с высокой регенерирующей способностью в регулируемых эстрогенами тканях (Williams C.D. et al., 2001; Witek A. et al., 2001; Bardin A. et al., 2004). В. В. Резван с соавт. (2001) указала на высокую степень корреляции между наличием рака и активностью теломеразы, которая поддерживает длину теломер на постоянном уровне.
Предметом исследования служили ткани эндо- и миометрия у 26 больных с различными формами сочетания доброкачественных заболеваний матки. Во всех случаях фаза менструального цикла соответствовала секреторной. Контролем служили ткани, полученные миомы матки и рака эндометрия. Положительными контролями ОТ-ПЦР служили теломеразопозитивные клеточные линии человека LNCaP (рак предстательной железы) и HeLa (рак шейки матки). Активность теломеразы (гена hTERT) определяли методом неколичественной ОТ-ПЦР. Экспрессия гена 2-микроглобулина отмечена во всех исследуемых образцах. Положительный результат ОТ-ПЦР на мРНК 2-микроглобулина подтверждает успешное проведение реакции ОТ и отсутствие неспецифических ингибиторов ПЦР.
Таким образом, в исследованных группах экспрессия гена hTERT не обнаружена: а) в тканях эндо- и миометрия при различных сочетаниях миомы матки, аденомиоза и гиперпластических процессов эндометрия (при простой и атипической гиперплазии); б) в тканях матки при изолированной миоме матки. Нет различий в экспрессии гена hTERT при сочетанных доброкачественных заболеваниях эндо- и миометрия и при монозаболевании. Для интерпретации полученных результатов была исследована экспрессия гена hTERT при раке эндометрия: наблюдалось присутствие как полноразмерного варианта транскрипта гена hTERT, так и транскрипта с β-делецией.
С аналогичной целью проводили определение экспрессии гена PRAME (Preferentially expressed antigen of melanoma) в периферической крови и тканях эндо- и миометрия и яичника у 28 больных репродуктивного возраста с сочетанными доброкачественными заболеваниями матки. Ткань яичника нами исследована по той причине, что транскрипция гена PRAME в норме присуща, главным образом, клеткам семенников, эндометрия и яичников (Kirkin A. F. et al., 1998; Ikeda H. et al., 1999; Steinbach D. et al., 2002))25)317 , 430)ому 5р ( клеток ( эндометрический потенциал.
В ходе исследования экспрессия гена PRAME не обнаружена ни в одном образце крови. В то же время, наибольшая активность гена обнаруживается в тканях матки при гиперплазии эндометрия, как при сочетании с миомой матки и аденомиозом, так и при изолированной форме. Мы предположили, что активация PRAME при доброкачественных заболеваниях эндо- и миометрия может быть обусловлена патогенезом этих заболеваний и отражает их некоторые биологические особенности. Таким образом, в исследуемых образцах тканей при сочетанных доброкачественных заболеваниях эндо- и миометрия установлено: а) «высокая» экспрессия при гиперплазии эндометрия; б) «умеренная» - при аденомиозе, миоме матки и нормальной ткани яичника; в) «низкая» в образце капсулы эндометриоидной кисты и ткани миометрия. Можно предположить, что появление экспрессии гена PRAME при доброкачественных заболеваниях матки отражает не количественные, а качественные характеристики. В пользу данного предположения свидетельствует и обнаруженная у больной корреляция между присутствием мРНК PRAME и высокой активностью СА-125 (в 10 раз!). Установлено, что активация гена PRAME при заболеваниях эндо- и миометрия ассоциирована с гиперплазией эндометрия. «Высокий» уровень гена PRAME в гиперплазированном эндометрии требует дальнейших исследований, что, вероятно, внесет ясность в понимание данных результатов исследования.
Таким образом, предварительные результаты по изучению гена PRAME у больных с заболеваниями эндо- и миометрия свидетельствуют о том, наиболее выраженная экспрессия обнаруживается при гиперпластических процессах эндометрия, как в сочетании с миомой и аденомиозом (в одном случае коррелирует с выраженной экспрессией СА-125), так и в изолированной форме. Мы считаем целесообразным проведение дальнейших исследований по определению точного порога чувствительности гена PRAME и возможности его использования как фактора оценки прогноза заболевания.
Хирургическое лечение проведено 664 больным. С использованием лапароскопического доступа были прооперированы 331 (49,8%) больных, лапаротомического - 211 (31,7%), влагалищного - 26 (3,9%) и 95 (14,3%) женщины - комбинированным (лапароскопический с влагалищным) доступами.
Проведен сравнительный анализ применения различных оперативных доступов у женщин репродуктивного возраста с сочетанными доброкачественными заболеваниями матки находившихся в отделении оперативной гинекологии Центра с 1996 по 2006г. Из проведенных оперативных вмешательств на матке у женщин репродуктивного возраста в 1996 г. наиболее часто использовали лапаротомный доступ - 87,8%, а в 2006 г. на его долю пришлось 13,8%. Количество операций, которые проводили, используя лапароскопический доступ, увеличилось за 11 лет с 6% (1996 г.) до 55,8% (2006 г.). За этот период времени увеличилось также, и количество комбинированных доступов (лапароскопия + влагалищный доступ) с 6,6 до 29,2%. Как видим, лапароскопический доступ в нашем исследовании был приоритетным. Его бесспорными преимуществами являются минимальная операционная травма, снижение интенсивности послеоперационных болей, минимизация образования спаек, быстрое восстановление послеоперационной активности и трудоспособности, косметический и экономический эффекты.
Все операции выполнялись под эндотрахеальным наркозом. Радикальное оперативное вмешательство (гистерэктомия) выполнено у 403 (60,7%) больных: в I группе – 268 (75,9%), во II – 21 (13,5%), III – 51 (75%), IV - 63 (71,5%). Основными показаниями к операции у этих больных были менометроррагии, сопровождающиеся выраженной анемией, постоянные боли в нижних отделах живота во время и вне менструального цикла, нарушение функции соседних органов и отсутствие эффекта от проведенных ранее оперативных и консеравтивных методов лечения. Реконструктивно-пластические операции (миомэктомия, миометрэктомия) выполнены у 261(39,3%) больной. У 57 больных с подслизистой локализацией миоматозного узла выполнена гистерорезектоскопия (в том числе у 37 в сочетании с лапароскопией). У 176(26,5%) больных под контролем гистероскопа произведено раздельное выскабливание эндоцервикса и эндометрия. Из них у 112(63,6%) женщин с целью уточнения состояния эндометрия и определения основного объема вмешательства, раздельное диагностическое выскабливание слизистой стенок полости матки и эндоцервикса произведено до основного этапа операции.
Большинство операций проводили в несколько этапов, комбинируя различные доступы. При выборе хирургического доступа, мы руководствовались его адекватностью для выполнения достаточного объема операции, рациональностью минимальной травматичности для обеспечения целостности сосудисто-нервного пучка в важной для сохранения репродуктивной функции анатомической зоне. С этой точки зрения, эндоскопический доступ (при отсутствии противопоказаний к нему) является «золотым стандартом», так как позволяет создать хороший обзор операционного поля, широкий угол подхода для удобной работы на оперируемом органе. Ранняя активация больных (в течение 1-2 сут), даже после радикального объема лапароскопических операций, способствовала благоприятному течению раннего послеоперационного периода, который протекал без осложнений, тогда как после лапаротомии у 9(4,2%) больных осложнился частичным расхождением послеоперационного шва. Все больные во время операции и в раннем послеоперационном периоде получали антибиотики широкого спектра действия, а также восстановительную физиотерапию.
После чревосечения больные в течение 4-6 дней предъявляли жалобы на боли в нижних отделах живота, диспепсию, слабость. В отличие от них у больных после лапароскопических операций наблюдали раннюю активацию (в течение 2 сут) даже после радикальных операций. Срок нормализации температуры у больных, оперированных лапаротомным доступом, составил 5,9±0,7 дня; после лапароскопических операций - 2,9±0,7; после гистерорезектоскопических операций - 1,6±0,6 дня; после комбинаций лапароскопического и вагинального доступа - 5,2±0,8 дня (р1,2<0,01; р 1,3<0,001). Объем интраоперационной кровопотери существенно отличался в зависимости от вида хирургического доступа и составлял, в среднем, после лапаротомического доступа - 412,5±132 мл; после лапароскопического - 135,8±90,3 мл, после гистероскопического доступа - 37,2±24,3 мл; после влагалищного доступа - 240,1±56,2 мл; после комбинированного лапаро-вагинального - 225,5±47,6 мл (р1,3<0,01). Частота гемотрансфузий и инфузий плазмы во время лапароскопических операций была меньшей 15(4,5%), чем во время лапаротомических 24(11,3%) (р<0,05).
Все больные во время операции и в раннем послеоперационном периоде получали антибиотики широкого спектра действия (цефалоспоринового ряда), а также физиотерапию, систематически обрабатывали области послеоперационных швов. Ранний послеоперационный период после лапароскопии протекал без осложнений, тогда как после лапаротомии у 7 (4,1%) больных осложнился частичным расхождением послеоперационного шва.
При адекватной, индивидуально подобранной предоперационной подготовке больных с сочетанными доброкачественными заболеваниями матки объем операции, при необходимости с применением нескольких доступов, не оказывает значительного влияния на величину койко-дня и на течение раннего послеоперационного периода. С 1996 по 2006 г. произошло уменьшение среднего койко-дня по группам: 14,3±1,8; 15,4±1,4; 16,9±2,1; 17,3±2,9 дней в 1996 г., то в 2006г. 12±1,1; 9,2±1,7; 10,5±0,7; 12±1,8 дней соответственно по группам в I, II, III и IV. В настоящее время имеются значительные резервы для дальнейшего снижения койко-дня при обеспечении преемственности стационара и амбулаторного звена, что имеет огромное экономическое значение.
Отдаленные результаты проведенного оперативного лечения прослежены у 205 больных: 110 - после реконструктивно-пластических операций (36 (32,7%), 33(30%), 29 (26,3%) и 12 (11%) соответственно из I, II, III и IV группы) и 95 после радикального объема операции (47(49,5%), 11 (11,6%), 15(15,7%) и 22(23,2%) соответственно из I, II, III и IV группы).
С целью профилактики рецидивов заболевания 77 (29,5%) женщин после органосохраняющих операций, получали гормональную терапию агонистами гонадотропин-релизинг гормонов в течение 4-6 месяцев (золадекс, диферелин). На фоне указанных препаратов у всех больных возникла аменорея. Менструальный цикл восстановился в среднем через 25-26 дней после прекращения приема перечисленных препаратов. Отмечено сокращение длительности менструаций до 5 дней, значительное уменьшение объема менструальной кровопотери (что определялось количеством используемых прокладок), частоты и тяжести дисменореи. Рецидив заболевания выявлен у 23 (20,9%): у 5 женщины после комбинированного (хирургическое+гормональное) лечения и у 18 пациенток, не получавших гормональные препараты.
Диагностированы рецидивы заболевания: узловая форма аденомиоза у 5 пациенток (4,5%), миома матки у 10 (9,1%) (в двух случаях подслизистые узлы диаметром 15-20 мм), гиперплазия эндометрия - у 5 (4,5%), миома матки и полип эндометрия - у 3 (2,3%). Рецидив после удаления узла аденомиоза можно расценивать как неполное удаление очага узлового аденомиоза. Всем больным произведены повторные оперативные вмешательства в адекватном объеме. У 31 (28,1%) пациенток в течение 9-18 месяцев после операции наступила маточная беременность. Все пациентки ранее были оперированы с использованием лапароскопического доступа. В 15 наблюдениях было выполнено кесарево сечение при доношенном сроке, у 4 - кесарево сечение в 36-37 недель беременности, у 7 пациенток - самопроизвольными неосложненными родами. В 5 наблюдениях беременность прервана в сроке 6-9 недель по желанию женщин. Трубная беременность диагностирована у двух больных из III группы и у одной из IV. В течение беременности и в родах ни у одной из оперированных и наблюдаемых нами женщин не было несостоятельности рубца на матке после миомэктомии и миометрэктомии, что можно объяснить тактикой хирургического лечения с обязательным послойным зашиванием стенки матки независимо от доступа и адекватной послеоперационной реабилитацией
6 (6,3%) пациенткам после гистерэктомии (от 3 до 5 лет ) произведено оперативное лечение по поводу опущения стенок влагалища и несостоятельности мышц тазового дна. Тщательное изучение анамнеза и данных операции до обследования показало, что у этих пациенток до гистерэктомии были выявлены симптомы опущения стенок влагалища, различной степени выраженности, но на тот период оперативное лечение не планировалось. После гистерэктомии, при отсутствии противопоказаний, больным была рекомендована заместительная гормональная терапия. Выбор препарата проводился с учетом результатов гистологического заключения и определения онкомаркеров, УЗИ органов малого таза, маммография, гемостазиограмма, консультация терапевта.
Чрезвычайно важны и актуальны поиск и внедрение методов лечения миомы матки и часто сочетающихся с ней доброкачественных заболеваний эндо- и миометрия, позволяющих сохранить матку без оперативного вмешательства у женщин репродуктивного возраста. Это особенно важно при противопоказаниях к оперативному лечению. Одним из таких методов лечения является ЭМА, которая проведена нами 37 больным.
В результате обследования пациентки разделены на две подгруппы. В I подгруппу включены 15 пациенток с сочетанными доброкачественными заболеваниями матки: у 7 (46,6%) пациенток миома матки сочеталась с аденомиозом, у 4 (26,6%) - с гиперплазией эндометрия, у 4 (26,6%) - с аденомиозом и гиперплазией эндометрия; во II подгруппу вошли 22 больные миомой матки. Из 37 пациенток, подлежащих эмболизации маточных артерий, у 34 удалось выполнить двухстороннюю окклюзию артерий, в том числе у 30 операция выполнена одноэтапно, у 4 - двухэтапно. У 3 женщин выполнена односторонняя эмболизация маточной артерии, что было связано с техническими трудностями (невозможность катетеризации вследствие извитости маточной артерии и небольшого диметра сосуда). ЭМА проводили по методике Сельдингера. В качестве эмболизирующего материала в нашем исследовании мы применяли микроспирали, частицы PVA (TRUFILL), гидрогель. Средняя продолжительность операции составила 70±10,5 мин (25-115 мин). Все больные перенесли процедуру удовлетворительно. При анализе раннего послеоперационного периода у всех пациенток отмечен постэмболизационный синдром (болевая реакция, повышение температуры тела, диспепсические расстройства) различной степени интенсивности, который купировался назначением ненаркотических и наркотических (по показаниям) анальгетиков, дезинтоксикационной терапии, противовоспалительных препаратов.
Сроки наблюдения за пациентками колебались от 3 мес. до 2 лет. В предполагаемый срок 1-ая менструация наступила у 25 (67,5%) женщин. Болезненность при 1-й менструации после эмболизации отмечали 17 (45,9%) женщин, чего не было при последующих циклах. Уменьшение болезненности к 12-му месяцу отметили 70% находящихся под наблюдением женщин. Объём менструальной кровопотери после ЭМА был достоверно меньше по сравнению с первоначальным, что подтверждало количество используемых прокладок. У всех 37 больных отмечено уменьшение менструального кровотечения сразу в первые циклы после ЭМА, уменьшение боли и давления на соседние органы параллельно с сокращением образования. Ни у одной женщины мы не выявили длительной аменореи, вероятно, это было связано с относительно молодым возрастом пациенток (средний возраст 36,3±4,4 года).
Динамическое наблюдение за изменениями в матке и доминантном миоматозном узле осуществляли с помощью УЗИ с ЦДК и СКТ. Через 6 мес. наблюдали сокращение объема матки, по данным УЗИ, на 33,1% (n=14) в I подгруппе и на 34,6% (р>0,05) у пациенток II подгруппы; через 1 год, соответственно, - на 45% (n=13) и 51% (n=19) (р>0,05) (рис. 1). Ко 2-ому году наблюдения регресс матки, в среднем, достиг 46% и 50,1% (р<0,05) от первоначальных размеров в I (n=7) и II (n=10) подгруппах соответственно. Через 3-6 мес. после ЭМА в миоматозных узлах появлялись некротические изменения, которые визуализировались при УЗИ как эхонегативные зоны, представляющие собой участки кистозной дегенерации. Через 6-12 мес. большая часть плотных тканей узла подвергалась лизису и замещалась жидкостью. Тенденции к росту миоматозных узлов за этот период времени не зафиксировано. Результаты ЦДК через 2 года после ЭМА выявили признаки перинодулярного кровотока в миоматозных узлах у 64,7% женщин: у 5 (71,4%) в I подгруппе (n=7), у 6 (60%) во II подгруппе (n=10). Интранодулярный кровоток отмечен в 21,6% (n=7) случаев в I подгруппе и 2 (20%) (n=10) во II подгруппе (n=10). Более раннее восстановление кровотока нами отмечено в миоматозных узлах при сочетанных доброкачественных заболеваниях матки.
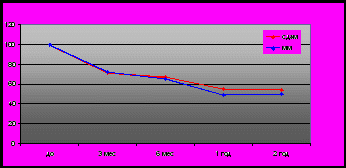
Рис. 1
Динамика регрессии
матки с узлами в исследуемых
подгруппах после ЭМА
Уменьшение размеров доминантных миоматозных узлов, а также наличие в них вторичных изменений и кровотока было подтверждено наиболее точным методом исследования - СКТ органов малого таза. Через 12 мес. в результате процессов дегидратации и склерозирования миоматозные узлы имели повышенную плотность (60 HU и более) и отмечены у 25% пациенток. Через 24 мес. была повышена плотность узла у 2 (42,8%) пациенток I подгруппы (n=7) и у 6 (60%) II подгруппы (n=10).
В отдаленные сроки после ЭМА были выполнены оперативные вмешательства у 6 (16,2%) пациенток: у 5 (33,3%) из I подгруппы и у 1 (4,5%) из II подгруппы. У 2(5,4%) больных из I подгруппы больных хирургическое лечение было выполнено из-за отсутствия эффекта от ЭМА и восстановления симптоматики заболевания: в одном случае была произведена гистерэктомия (женщина из I подгруппы), в другом - миомэктомия лапаротомическим доступом из-за категорического отказа женщины (II подгруппа) от радикальной операции. По поводу дисфункционального маточного кровотечения 4 пациенткам из I подгруппы было осуществлено раздельное диагностическое выскабливание слизистой стенок полости матки. В результатах гистологического исследования биоптатов эндометрия у 2 (13,3%) больных (через 7 и 12 мес. после ЭМА) была выявлена атипическая гиперплазия эндометрия. У 1 из них при УЗИ обнаружена сопутствующая цистаденома правого яичника. По поводу данной патологии пациенткам была осуществлена гистерэктомия с придатками. У 2 (13,3%) других пациенток была железисто-кистозная гиперплазия эндометрия. У 2 больных (через 6 месяцев после ЭМА) из I подгруппы и у 1 (через 9 месяцев после ЭМА) из II подгруппы произошла миграция миоматозного узла в полость матки. В дальнейшем узлы из полости матки были удалены гистерорезектоскопом. Результат гистологического исследования: бесструктурные некротические массы, что расценивалось как естественная миграция части миоматозного узла в полость матки за счет ишемии тканей и сокращения. Вероятно, на фоне сокращения матки происходит «выталкивание» миоматозных узлов в полость матки.
В нашем исследовании беременность наступила у одной пациентки из первой группы через 4 месяца после ЭМА. В сроке 8 недель была диагностирована неразвивающаяся беременность, по поводу которой произвели инструментальное удаление плодного яйца из полости матки. Во второй группе беременность наступила у одной пациентки через год после ЭМА, которая завершилась кесаревым сечением при доношенном сроке.
Таким образом, ЭМА у больных с миомой матки обеспечивает небольшую травматичность вмешательства при хорошем клиническом эффекте и уменьшение размеров матки, а также позволяет сохранить матку, что особенно актуально у женщин с нереализованной детородной функцией, при противопоказаниях к хирургическому лечению и категорическом отказе от него. При сочетанной доброкачественной патологии матки процент осложнений в позднем послеоперационном периоде высокий. При наличии у пациентки одновременно заболеваний эндо- и миометрия следует рекомендовать другие методы лечения.
По результатам нашего исследования у женщин репродуктивного возраста с сочетанными доброкачественными заболеваниями матки выявлено, что наиболее выраженные нарушения иммунитета (локального и общего) обнаружены при сочетании миомы матки с гиперплазией эндометрия; отсутствие экспрессии теломеразы в тканях эндо- и миометрия свидетельствует о доброкачественном процессе; при хирургическом лечении доступом выбора является лапароскопический или комбинированный; после ЭМА у каждой третьей пациентки с сочетанными доброкачественными заболеваниями матки наблюдаются рецидивы гиперпластических процессов эндометрия или отсроченный рост миоматозных узлов, которые приводят к необходимости повторных хирургических вмешательств.
ВЫВОДЫ
Сочетанные доброкачественные опухоли и гиперпластические процессы матки (миома матки, аденомиоз, гиперпластические процессы эндометрия) наблюдаются у 41,5% женщин репродуктивного возраста, оперированных по поводу заболеваний матки. Сочетание миомы матки и аденомиоза имеет место у 53,2%, миомы матки и гиперпластических процессов эндометрия – у 23,3%, аденомиоза и гиперпластических процессов эндометрия – у 10,2%, миомы матки, аденомиоза и гиперпластических процессов эндометрия – у 13,3%.
- По результатам гистологического исследования тканей, удаленных во время различных оперативных вмешательств на матке у женщин репродуктивного возраста, миома матки обнаружена у 89,7% пациенток (из них множественная миома матки у 67%, субмукозное расположение узлов у 9,5%), аденомиоз у 76,6% (в том числе диффузный аденомиоз II-III степени у 68,9%, очаговый аденомиоз у 18,2%, узловой аденомиоз у 7,4%), гиперпластические процессы эндометрия - у 46,8%.
- У больных с сочетанными доброкачественными заболеваниями матки имеет место отягощенный акушерско-гинекологический анамнез, большое число перенесенных и сопутствующих гинекологических и экстрагенитальных заболеваний: дисфункциональные маточные кровотечения - 70,4%, хронические воспалительные заболевания матки и ее придатков - 61,3%, инструментальные вмешательства при неоднократных искусственных и самопроизвольных абортах - 77,8%, наследственная отягощенность опухолевыми заболеваниями - 33,7%; из экстрагенитальных заболеваний выявлены болезни желудочно-кишечного тракта - у 55,7%, болезни сердечно-сосудистой системы – у 33,2%, анемия – у 48,2%, поливалентная аллергия –у 29,2% больных.
- Клинические проявления сочетанных доброкачественных заболеваний матки характеризуются нарушением менструального цикла (гиперполименорея – 77,7%, перименструальные кровянистые выделения – 25,9%), высокой частотой болевого синдрома (дисменорея – 77,4%, диспареуния – 44,4%), а также нарушениями репродуктивной функции (бесплодие I – 8,7%, бесплодие II – 14,9%). Клинические симптомы более выраженны при сочетании миомы матки и гиперпластических процессов эндометрия; миомы матки, аденомиоза и гиперпластических процессов эндометрия.
- Диагностика сочетанных доброкачественных заболеваний матки должна быть комплексной, включающей УЗИ, как скрининговый метод исследования, эндоскопические (лапароскопия, гистероскопия), с обязательным гистологическим подтверждением диагноза. Для больных с нереализованной детородной функцией с целью оценки степени распространения процесса, глубины поражения стенки матки, а также выявления риска злокачественного перерождения на этапе разработки плана реконструктивной операции (объема, доступа) и методов послеоперационного лечения целесообразно обследование с помощью магнитно-резонансной томографии, а также изучение различных звеньев локального и общего иммунитета (макрофагов, Т и В лимфоцитов, IL-6, IL-8, TNF-α, INF-γ), генетическое обследование (теломераза, PRAME).
- У больных с сочетанными доброкачественными заболеваниями матки отмечаются изменения показателей иммунитета на локальном (увеличение содержания в клеточной фракции перитонеальной жидкости активированных макрофагов и нейтрофильных лейкоцитов, повышение уровня провоспалительных цитокинов) и системном (увеличение пролиферативной активности и цитостатического потенциала Т-клеток, повышение концентрации провоспалительных цитокинов) уровнях. Указанные изменения наиболее выражены при гиперплазии эндометрия как в сочетании с миомой матки, так и аденомиозом. Это свидетельствует об определенной роли иммунной системы в развитии и распространении сочетанных доброкачественных заболеваний матки, о необходимости восстановления гомеостаза в послеоперационном периоде, выполнении менее травматичных операций и послеоперационной реабилитации.
- У больных с сочетанными доброкачественными заболеваниями матки активность теломеразы не выявлена. Отсутствие экспрессии гена hTERT в тканях матки и гена PRAME в периферической крови можно расценивать как критерий, свидетельствующий о доброкачественном характере патологии матке, и является дополнительным основанием для выполнения реконструктивной органосохраняющей операции.
- Хирургическое лечение сочетанных доброкачественных заболеваний матки может проводиться лапаротомным, лапароскопическим, влагалищным, комбинированным доступами. Доступом выбора является лапароскопический, при необходимости в сочетании с гистероскопическим, в связи с лучшей визуализацией (оптическим увеличением), снижением инвазивности вмешательства и кровопотери, быстрой послеоперационной реабилитацией. При выборе объема оперативного вмешательства необходимо руководствоваться тяжестью и распространенностью патологического процесса, возрастом пациенток, состоянием репродуктивной функции. У больных с нереализованной репродуктивной функцией целесообразно выполнение реконструктивно-пластических операций с использованием эндоскопических доступов.
- Результаты оперативного лечения больных с сочетанными доброкачественными опухолями матки по разработанным принципам свидетельствуют о высокой эффективности современных технологий и эндоскопических доступов. 84,6% больных после радикальных и 79,9% после реконструктивно-пластических операций считали лечение эффективным. После реконструктивно-пластических операций генеративная функция восстановлена у 28,1% больной, рецидивы гиперпластических заболеваний матки послужили показанием к новой операции у 20,9%.
- Эффективность ЭМА у больных с сочетанными заболеваниями эндо- и миометрия значительно ниже таковой при лечении миомы матки. У каждой третьей пациентки с сочетанными доброкачественными заболеваниями матки после ЭМА наблюдаются рецидивы гиперпластических процессов эндометрия или отсроченный рост миоматозных узлов, которые приводят к необходимости повторных хирургических вмешательств.
- Современный алгоритм обследования и лечения больных с сочетанными доброкачественными заболеваниями матки предполагает широкое применение методов визуализации (УЗИ, МРТ, гистероскопию, лапароскопию), изучение иммунологических показателей крови и перитонеальной жидкости (мононуклеаров, TNF-α, INF-γ, IL-6, IL-8), экспрессии теломеразы, дифференцированное по доступу и объему хирургическое вмешательство с применением малоинвазивных технологий.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
• Диагностика сочетанных доброкачественных заболеваний матки наряду с оценкой клинической симптоматики заболевания должна включать использование методов визуализации: УЗИ абдоминальным и влагалищным датчиком, по показаниям магнитно-резонансную томографию, диагностическую гистеро- и лапароскопию. Как при эхографии, так и по данным МРТ можно устанавливать наличие сочетанных доброкачественных заболеваний матки, но их возможности в точности диагностики и характеристики вовлечения в процесс различных органов и тканей малого таза различны. Эти методы являются взаимодополняющими и должны использоваться как с целью дооперационной диагностики, так и при проведении скрининга с целью раннего выявления рецидивов в послеоперационном периоде. Преимуществом магнитно-резонансной томографии является максимально точная диагностика заболеваний эндо- и миометрия.
• Исследование активности теломеразы и гена PRAME (на этапе обследования) при различных сочетаниях доброкачественных заболеваний эндо- и миометрия эффективно в построении прогноза течения заболевания. Это обеспечит более раннее выявление пролиферативной активности тканей матки, что, несомненно, важно для правильного подбора метода лечения.
• При обследовании женщин с сочетанными доброкачественными заболеваниями матки с целью повышения объективности оценки тяжести их состояния целесообразно проводить иммунологическое исследование с включением компьютерной фазометрии лимфоидных клеток для определения уровня качественных и количественных нарушений иммунореактивности пациенток. Это позволяет в рамках одного исследования при минимальном объеме крови (5-6 мл), отсутствии необходимости применения каких-либо реактивов и дополнительного оборудования оперативно оценить особенности морфофункционального состояния отдельных клеток.
• При необходимости проведения хирургического лечения у больных репродуктивного возраста с сочетанными доброкачественными заболеваниями матки следует учитывать показания со стороны каждого из сочетанных заболеваний, желание больной сохранить матку и целесообразность выполнения адекватного характеру сочетанной патологии объема операции в рамках одного вмешательства.
• У женщин репродуктивного возраста с сочетанными доброкачественными заболеваниями матки (миома матки, аденомиоз, гиперпластические процессы эндометрия) ЭМА не дает желаемого результата. Женщинам, желающим сохранить детородную функцию и менструальный цикл, желательно рекомендовать реконструктивно-пластические операции с использованием эндоскопических или комбинированных доступов.
