Интенсивное лечение эклампсической комы 14. 01. 20 Анестезиология и реаниматология
| Вид материала | Автореферат |
СодержаниеМфмос, % (15-18) Практические рекомендации. Список работ, опубликованных по теме диссертации 2 – содержание кислорода в артериальной крови СvО2 |
- Новые публикации по анестезиологии, 109.72kb.
- Вопросы к дифференцированному зачету по дисциплине «анестезиология и реаниматология», 87.11kb.
- Методические рекомендации по подготовке аттестационного дела на соискание квалификационной, 493.63kb.
- Предупреждение и лечение острой почечной недостаточности при критических состояниях, 678.3kb.
- Тесты для сертификационного экзамена по специальности «анестезиология и реаниматология», 3656.01kb.
- Опубликовано в Анестезиология и реаниматология 2004. № с 4-8, 206.91kb.
- Анестезиология и реаниматология, 184.1kb.
- Тесты по специальности «Анестезиология и реаниматология», 525.85kb.
- Вопросы к вступительному экзамену в клиническую ординатуру по специальности «анестезиология, 42kb.
- Календарно-тематический план лекций по курсу «Общая хирургия и анестезиология», 98.95kb.
1 2
Результаты исследования и их обсуждение Анализируемый комплекс исследований проведен у 30-и больных I группы и у 18-и - II группы.
При первичном обследовании родильниц на первые-вторые сутки после оперативного или консервативного родоразрешения обнаружены выраженные изменения центральной гемодинамики (табл. 4).
Таблица 4
Показатели центральной гемодинамики (M±m) у родильниц (n=48) при поступлении
-
Показатели (норма, Мin – Мaх)
Значения показателей при поступлении
абс.
% от верхней или нижней границы нормы
ЧСС, уд/мин (60-90)
109,0±6,9 *
121,1
УО, мл/мин (55-90)
31,7±4,3 *
57,6.
МОС, л/мин (4-6)
3,32±0,3 *
83,0
СИ, л/мин/м2( 2,8-4,2)
1,96±0,12 *
70,0
САД, мм рт. ст. (90-105 )
124,5±3,7 *
118,5
ОПСС, дин·см-5·сек-1 (1200-2500)
2785±141 *
111,4
ОЦК, мл/кг (70-75)
57,3±5,2 *
81,8
СДЛА, мм рт. ст. (17-23)
12,2±1,4 *
71,7
ДЗЛК, мм рт. ст. (5-15)
5,4±0,3
102,0
Примечание: * р<0,01 по сравнению с верхней или нижней границами нормы
В связи с представленными данными можно предположить, что эклампсия и эклампсическая кома, которые развиваются при тяжелой форме гестоза, возникают только на фоне гипокинетического типа кровообращения. Эукинетический и гиперкинетический типы кровообращения, обнаруженные при тяжелой форме гестоза беременных рядом авторов , возможно связаны с тем, что использовались неинвазивные методы исследования, точность которых уступает инвазивным.
На фоне выявленных нарушений гемодинамических показателей обнаружено не только значительное снижение мозгового кровотока, но и перераспределение кровотока по серому и белому веществу головного мозга. (табл. 5).
Таблица 5
Показатели мозгового кровотока и его компонентов (M±m)
у родильниц (n=48) при поступлении
-
Показатели (норма, Мin – Мaх)
Значения показателей при поступлении
абс.
% от верхней или нижней границы нормы
МК, мл/100г/мин (45-55)
38,3±2,4 *
83,7
МФМОС, % (15-18)
12,5±1,2
83,3
рМКб, мл/100г/мин (70-85)
42,4±3,0 *
60,5
рМКм, мл/100г/мин (20-35)
33,8±2,0
96,5
СПМО2 (3,3-3,5)
мл/100г/мин
1,20±0,16
36,3
Примечание: * р<0,01 по сравнению с верхней или нижней границами нормы
Как видно из таблицы 5, мозговой кровоток практически уменьшался только за счет кровотока в сером веществе мозга, при этом потребность коры в кислороде в 7 раз превышает таковые белого вещества. Более того сами пиальные сосуды расположены на поверхности мозга и не имеют никаких ограничений по регулированию их тонуса, тогда как возможности расширения, так и сужения внутримозговых сосудов, питающих белое вещество головного мозга, резко ограничены окружающими тканями (Беков Д.Б., Михайлов С.С., 1979).
Указанными особенностями кровотока в белом и сером веществе мозга можно объяснить и выявляемые на КТ и МРТ при эклампсии преходящие очаги повышенной и пониженной плотности с преимущественной локализацией в нижних базальных и задних отделах. С другой стороны, имеются данные о более слабой адренергической иннервации сосудов, питающих задние и базальные отделы мозга (Ikeda T., Urabe H., Mariak Z., Krejza J., 2002).
Указанные гемодинамические нарушения сопровождались выраженными изменениями водного баланса (табл. 6).
Таблица 6
Состояние водных секторов (M±m) у родильниц (n=48) при поступлении
| Показатели (норма, Мin – Мaх) | Значения показателей при поступлении | |
| абс. | % от верхней или нижней границы нормы | |
| ОЖ, мл/кг (460-600) | 656,3±32,8* | 109,3 |
| ВЖ, мл/кг (300-400) | 318,7±17,5 | 106,2 |
| ВнЖ, мл/кг (200-220) | 347,2±18,4* | 157,8 |
| ИнЖ, мл/кг (150-180) | 306,0±19,2* | 170,0 |
| ОЦП, мл/кг (37-48) | 37,2±3,4 | 100,5 |
| ГО, мл/кг (24-34) | 21,0±1,1* | 87,5 |
| ОЦК, мл/кг (70-75) | 57,3±4,2* | 81,8 |
Примечание: * р<0,01 по сравнению с верхней или нижней границами нормы
Гипергидратация во всех наблюдениях была обусловлена увеличением количества жидкости во внеклеточном пространстве, однако следует обратить внимание на то, что при анализе протоколов ведения анестезии или родов и интенсивного лечения в родовспомогательных учреждениях ЛПУ у всех родильниц объем инфузионно-трансфузионной терапии превышал потери на 600±24 мл, что не противоречит современным принципам обоснования интенсивного лечения.
При сопоставлении уровня натрия в плазме и эритроцитах видно, что в эритроцитах концентрация натрия превышала норму на 7,9% от верхней границы нормы, а уровень калия - на нижней границе нормы. Это свидетельствует, что рекомендации по применению гипертонического раствора натрия для нормализации волемических показателей при тяжелых формах гестоза недостаточно обоснованы.
При анализе состояния транспорта кислорода отмечено снижение индекса доставки и потребления кислорода при высоком уровне лактата на фоне низкого содержания кислорода в артериальной и достаточно высокого содержания кислорода в венозной крови (табл. 7).
Таблица 7
Состояние транспорта кислорода (M±m) у родильниц (n=48) при поступлении
| Показатели (норма, Мin – Мaх) | Значения показателей при поступлении | |
| абс. | % от верхней или нижней границы нормы | |
| СаО2, мл/л (190-210) | 131,4±2,8* | 69,1 |
| CvО2, мл/л (130-150) | 104,8±4,2* | 80,0 |
| C(a-v)O2, мл/л (30-50) | 26,6±0,9* | 88,6 |
| IDO2, мл/ мин х м2 (520-720) | 257,5±2,1* | 49,5 |
| IVO2, мл/мин х м2 (110-160) | 53,0 ± 3,4* | 48,1 |
| КЭО2, % (22-32) | 19,0±1,3* | 86,3 |
| La, ммоль/л (0,5-1,6) | 4,4±0,3* | 275,0 |
Примечание: * р<0,01 по сравнению с верхней или нижней границами нормы
Определение уровня глюкозы и лактата в артериальной крови и в луковице внутренней яремной вены показало, что при поступлении частота обнаружения отрицательной и нулевой АВРГ и ВАРЛ составила, соответственно, 80,8% и 65,4%, что дает основание считать полученные результаты неслучайными, а обнаруженный феномен выделения мозгом глюкозы и утилизация лактата у больных в коматозном состоянии – установленным фактом. Этот факт позже был подтвержден многими исследователями (Dringen R.; Schmoll D.; Cesar M.), что послужило основанием считать, что в определенных ситуациях мозг может выполнять функции неоглюкогенеза.
Проведенные впервые исследования показали, что у родильниц в эклампсической коме значительно повышены показатели свободно радикального перекисного окисления липидов (малоновый диальдегид – МДА, диеновые конъюгаты эритроцитов – ДKэр, перекисная резистентность эритроцитов – ПРЭ), и снижена антиоксидантная защита (активность супероксиддисмутазы - СОД, каталазы и витамина Е) - таблица 8.
Таблица 8
Показатели свободно-радикального перекисного окисления липидов и антиоксидантной защиты (М±m) в группе контроля (n=12) и
в исследуемой группе (n=26) при поступлении
| Показатели | Значения показателей в группах родильниц | |
| Контрольная | Исследуемая | |
| МДА, мкмоль/л эритроцитов | 4,90±0,46 | 6,92±0,35* |
| ПРЭ, усл.ед. | 1,69±0,10 | 3,82±0,49* |
| ДKэр., ед.опт.пл./мл эритромассы | 2,68±0,90 | 3,87±0,13 |
| СОД,ед.акт./мл плазмы | 380,36±17,40 | 206,9± 22,7* |
| Каталаза,мкЕ/л | 5,81±0,29 | 3,98,72±0,18* |
| Витамин Е,усл.ед. | 11,88±1,19 | 5,86±1,85* |
Примечание: *- разница достоверна между группами (р<0,01)
Контрольной группой являлись родильницы, сопоставимые по возрасту, весу, сопутствующей патологии и анестезиологическому обеспечению, кесарево сечение которым выполнялось по показаниям, не связанными с гестозом.
На основе анализа полученных результатов исследований в комплексе общепринятого (стандартного) лечения определены приоритетные направления, обеспечивающие эффективную коррекцию перфузионно-метаболических нарушений мозга, регулируемый гипотензивный эффект и восстановление волемических показателей, без выраженных колебаний АД, которые представлены на рисунке 1.




Адекватная Противосудорожная Повышение Ликвидация
оксигенация терапия МК, рМКб гиповолемии
крови и профилактика
 ДВС
ДВС


Г
 ипотензивная Снижение СР ПОЛ и
ипотензивная Снижение СР ПОЛ итерапия повышение АОЗ

П
 овышение Нейровегетативная
овышение Нейровегетативнаятранспорта О2 стабилизация ЦНС

Л
 иквидация Мембрано-
иквидация Мембрано-гипергидратации стабилизирующая и иммунная терапия





Профилактика Нутритивная Контроль Специальный
нозокомиальной поддержка динамики уход
инфекции сокращения
матки
 Приоритетность I уровня
Приоритетность I уровня Приоритетность II уровня
Приоритетность II уровня Приоритетность III уровня
Приоритетность III уровняРис.1. Алгоритм интенсивного лечения элампсической комы с учетом приоритетных направлений.
При этом необходимо учитывать, что в настоящее время не существует методов мгновенного воздействия на артериальную стенку при ее спазме, и резкое снижение САД является одной из ведущих причин прогрессирования перфузионно-метаболических нарушений головного мозга. Поэтому при лечении эклампсической комы заслуживает внимания блокатор кальциевых каналов (нимодипин), который в настоящее время среди всех известных антагонистов кальция наиболее хорошо изучен и эффективность его доказана при спазме мозговых сосудов.
Нимодипин обладает прямым церебральным эффектом, который проявляется в способности снижать сопротивление резистентных сосудов мозга, увеличивать МК, уменьшать гипоксические проявления. При сочетании нимодипина и сульфата магния в наших исследованиях не возникало необходимости в дополнительном использовании других гипотензивных средств. Следует напомнить, что в литературе нет подтвержденных данных по эффективности сульфата магния при спазме сосудов головного мозга с увеличением мозгового кровотока. Препарат вводили в центральную вену под контролем артериального давления до восстановления сознания в дозе 0,05±0,1 мг/кг/час.
В качестве основного плазмозамещающего компонента использовался высокомолекулярный гидроксиэтилированный крахмал 450/0,7 (стабизол). Одно из его преимуществ – невысокое коллоидно-осмотическое давление (19 мм. рт. ст.), благодаря которому его экспандерное действие по сравнению со среднемолекулярными растворами ГЭК (рефортан, венофундин и др.), имеющими более высокое КОД, менее выражено. Медленное привлечение в сосудистое русло жидкости из интерстиция и более длительное его действие (до 36 часов), благоприятно сказываются на показателях гемодинамики у родильниц с гестозом, для которых характерен артериолоспазм с гипертензивным синдромом.
Нормализация ОЦК, в основном, достигалась за счет привлечения жидкости из интерстициального пространства. Инфузионная терапия в остром периоде обеспечивалась высокомолекулярным ГЭК, свежезамороженной плазмой (от 1 дозы до 4 в сутки в зависимости от показаний) и 10-20% раствором альбумина при снижении его фракции до 30% или снижении общего белка до 50 г/л.
Для коррекции процессов СР ПОЛ использовали мафусол (до 400 мл/сутки), основным активным компонентом которого является фумарат натрия, активирующий адаптацию клетки к недостатку кислорода, способствующий восстановлению процессов выработки энергии в условиях кислородной задолженности (Селиванов Е.А. 2000).
Кроме вышеуказанных средств, в состав инфузии входили растворы электролитов. В остром периоде объем инфузионной терапии ограничивали до 20-25 мл/кг/сутки (1500-1700 мл). Соотношение коллоидных и кристаллоидных растворов составляло 2:1. Тем не менее, объем потерь жидкости превышал объем инфузии не менее, чем на 400-500 мл. Таким образом, основной задачей инфузионной терапии была ликвидация гиповолемии и интерстициального отека путем привлечения воды из интерстициального сектора с последующим ее удалением из организма без существенного снижения артериального давления. В тех случаях, когда самостоятельный диурез не был достаточен на фоне снижения САД, внутривенно капельно вводили дофамин в дозе 3-4 мкг/кг/час, а при стабильных показателях САД - лазикс в дозе 20-40 мг. Особое место в лечении отека мозга занимали кортикостероиды, которые использовали в остром периоде (3-4 дня) в дозе 5-6 мг/кг (в пересчете на преднизолон). Затем дозы ежедневно снижались в 2 раза и последнюю инъекцию преднизолона вводили на 6-8 день после начала кортикостероидной терапии.
Искусственная вентиляция легких является непременным и приоритетным компонентом 1 уровня в интенсивном лечении и она должна обеспечивать сатурацию артериальной крови не менее 97%. ИВЛ продолжалась до стабилизации САД не выше 105 мм рт. ст., исчезновения судорожной активности на энцефалограмме и восстановления сознания.
Считаем необходимым отметить, что одной из причин длительного сохранения судорожной активности мозга, является сохранение в полости матки элементов плаценты, которые, возможно, определенное время продолжают выделять биологически активные вещества. Из 68-и родильниц, у которых была сохранена матка, в 25-и наблюдениях (36,8%) возникла необходимость выполнения диагностического или лечебного выскабливания полости матки, из них 2-м родильницам, в связи с развитием миометрита, выполнена ампутация матки. Поэтому в комплексном лечении важное значение придается антибактериальной терапии и динамическому наблюдению за инволюцией матки, согласно принятым положениям в родовспомогательных учреждениях. В отделении реанимации МОНИКИ для этой категории больных используется цефалоспорин III поколения – роцефин. При этом всем родильницам используется весь комплекс профилактики нозокомиальной инфекции.
В комплекс интенсивного лечения включали реологические препараты и дезагреганты, препараты калия и коферменты, ингибиторы протеаз, микроэлементы и витамины, препараты, повышающие сократительную способность матки. Для оптимизации нуклеинового обмена и профилактики возникновения остаточных психо-неврологических дефектов, после исчезновения судорожной активности на электроэнцефалограмме, больные получали ноотропные препараты (пирацитам, аминалон, гаммалон).
Анализ полученных результатов при поступлении родильниц в эклампсической коме в клинику показал, что направленность системных гемодинамических и метаболических нарушений, в основном, характеризуются снижением сердечного индекса и потребления кислорода тканями на фоне гиповолемии, генерализованного артериолоспазма, интерстициальной гипергидратации и снижения функциональной способности сердечно-сосудистой системы. Перфузионно-метаболические изменения в тканях головного мозга характеризуются снижением мозгового кровотока за счет редукции кровоснабжения корковых структур, снижением потребления кислорода мозгом на фоне спазма пиальных сосудов с перестройкой обменных процессов мозга. При этом имеется смешанная форма гипоксии с выраженной кислородной задолженностью, нарушением метаболических процессов в организме, включая углеводный обмен с образованием глюкозы и потреблением лактата в головном мозге.
Сравнительная оценка общепринятых методик и предложенного алгоритма интенсивного лечения показала, что в динамике восстановления СИ и ОЦК нет достоверных различий. При этом обнаружено статистически достоверное различие в динамике САД, ОПСС, ЦПД, МК и СПМО2 при применении стандартной и предложенной тактики интенсивного лечения.
Так при стандартном лечении снижение САД, ОПСС и ЦПД отмечается на 2-м этапе, а во II группе – к моменту восстановления сознания - 3 этап, что показано на рисунке 2.
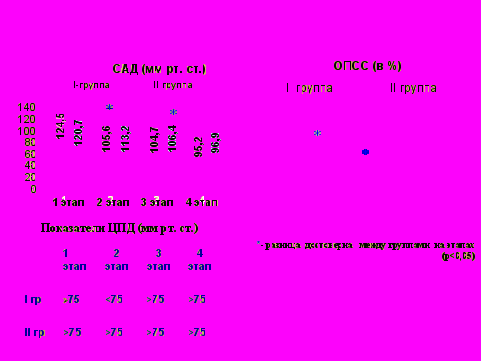
Рис. 2. Сравнительная динамика «нормализации» среднего артериального давления, общего периферического сосудистого сопротивления, церебрального перфузионного давления при применении стандартного лечения (I группа) и предложенного интенсивного лечения (II группа) на этапах исследования между группами.
ЦПД во II группе больных поддерживалось на уровне более 75 мм рт. ст.
Эффективность предложенной тактики интенсивного лечения подтверждает динамика МК, рМКб и рМКм (рис. 3).
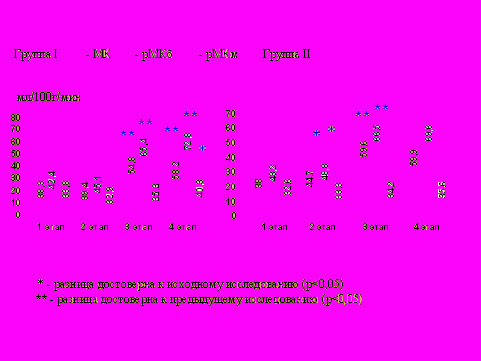
Рис.3. Динамика мозгового кровотока, кровотока по серому веществу и кровотока по белому веществу головного мозга у родильниц в эклампсической коме при применении стандартного лечения (I группа) и предложенного интенсивного лечения (II группа).
МК и рМКб в I группе увеличивается к 3 этапу, во II группе - уже на 2-м этапе.
Следует отметить, что родильницы при предложенном алгоритме лечения быстрее выходят из коматозного состояния (табл. 9)
Таблица 9
Длительность пребывания в коматозном состоянии родильниц при применении стандартного (I группа) и предложенного интенсивного лечения (II группа)
-
Длительность коматозного состояния
Число больных в %
I группа
(n=140)
II группа
(n=42)
От 2 до 10 суток
72,9
75,0
От 11 до 20 суток
15,2
25,0
свыше 20 суток
11,9*
0
Примечание: * - р ≤ 0,01 по сравнению с группой II
Длительность пребывания в коме у родильниц II группы не более 20-и суток, тогда как при использовании стандартного лечения продолжительность коматозного состояния в 11,9% превышала 20 суток.
Эффективность предложенной методики подтверждена и динамикой СПМО2 (рис. 4).
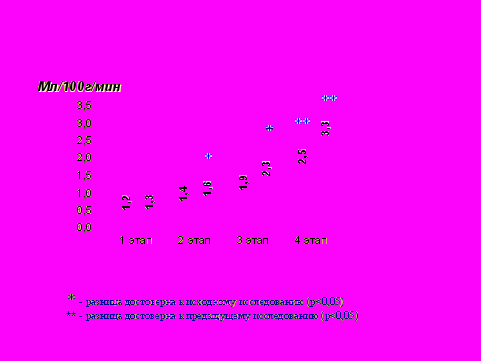
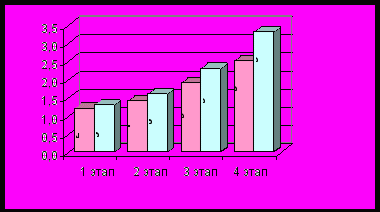
Рис.4. Динамика скорости потребления мозгом кислорода у родильниц в группе I (стандартное лечение) и в группе II (предложенное лечение).
СПМО2 увеличилась во II группе уже на 2 этапе, а к 3 этапу статистически достоверное различие между показателями групп возрастает.
Эффективность предложенной тактики подтверждена не только показателями летальности по группам, но изменением основных причин летальности (табл. 10)
Таблица 10
Причины летального исхода родильниц в эклампсической коме
-
Причины смерти
Число больных
I группа
II группа
Гипоксический аутолиз головного мозга
3
0
Обширная внутричерепная гематома с прорывом в желудочки мозга
6
0
Отек головного мозга с вклинением ствола
3
0
Регургитация, синдром Мендельсона
2
0
Тотальная двухсторонняя пневмония с деструкцией
6
2
Прочие
2
0
Всего
22
2
Летальность (%)
15,7
4,8*
Примечание: * - разница достоверна к исходному исследованию (р<0,05)
Как видно из таблицы, в группе родильниц, где использовалась предложенная тактика интенсивного лечения летальность была значительно снижена-4,8%. Более того во II группе родильниц летальных исходов, связанных с мозговыми осложнениями, не отмечено.
Представленные данные свидетельствуют, что при адекватном лечении прогноз эклампсии и эклампсической комы благоприятен. Возможно, что именно внедрение в ЛПУ области предложенной методики лечения тяжелых форм гестоза явилось основой того, что с 2007 г. это осложнение беременности уже не входит в Московской области в лидирующую тройку, определяющих материнскую летальность.
ВЫВОДЫ
Эклампсическая кома развивается только при гипокинетическом типе кровообращения при снижении сердечного индекса до 1,96±0,12 л/мин/м2 (70,0% от нижней границы нормы, p<0,01), из-за выраженной гиповолемии, возникающей в результате «капиллярной утечки» на фоне активации свободно-радикального перекисного окисления липидов (показатели МДА, ПРЭ и ДКэр увеличены, соответственно, на 36,7%, 126,1%, 44,5%), снижения коллоидно-осмотического давления до 19,4±0,9 мм рт. ст. (97,0% нижней границы нормы, p<0,01) с развитием нарушений водно-электролитного и белкового обмена, преимущественно по типу интерстициальной изотонической гипергидратации (ИнЖ - 170,0% нижней границы нормы, p<0,01). Гипертензионный синдром при эклампсической коме является компенсаторной реакцией, повышающей регионарный кровоток в жизненно-важных органах в условиях выраженного артериолоспазма (САД - 118,5% верхней границы и ОПСС - 111,4% верхней границы нормы, p<0,01).
- При эклампсической коме на фоне снижения сердечного индекса и развития артерио-венозного шунтирования крови наблюдаются нарушения индекса доставки кислорода (49,5% нижней границы нормы, p<0,01) и индекса потребления кислорода (48,1% нижней границы нормы, p<0,01) с развитием выраженной кислородной задолженности (La - 275,0% верхней границы нормы, p<0,01).
- Перфузионно – метаболические изменения в тканях головного мозга характеризуются снижением мозгового кровотока до 38,3±2,4 мл/100г/мин (83,7% нижней границы нормы, p<0,01 ) за счет кровотока в корковых структурах до 42,4±3,0 мл/100г/мин (60,5% нижней границы нормы, p<0,01), уменьшением скорости потребления мозгом кислорода до 1,20±0,16, мл/100г/мин (36,3% нижней границы нормы, p<0,01), накоплением недоокисленных продуктов, которые могут служить субстратом для глюконеогенеза в критических ситуациях (в частности, при эклампсической коме).
- Основой метаболических нарушений мозга является снижение перфузионного объема крови преимущественно в корковых структурах на фоне спазма пиальных сосудов. Эффективным средством устранения спазма с увеличением кровотока в корковых структурах мозга является блокатор кальциевых каналов L-типа VJCs (нимодипин), обладающий мягким общегипотензивным действием и противосудорожным эффектом.
- Снижение кровотока в сером веществе вызывает гипоксемию коры головного мозга, а сохранение кровотока по белому веществу мозга в пределах нормы (33,8±2,0 мл/100г/мин) при гипертензионном синдроме на фоне сосудистого эндотелиоза приводит к развитию вазогенного отека с увеличением объема мозга и нарушением ликвородинамики, что является непосредственной причиной наступления эклампсических судорог. Причиной трансформаци эклампсии в эклампсическую кому является прогрессирование вазогенного отека вследствие снижения церебрального перфузионного давления < 70 мм рт. ст. с последующей нейрональной гипоксией.
- Основой восстановления системных гемодинамическо-метаболических и перфузионно - метаболических нарушений при эклампсической коме являются: адекватная оксигенация крови, повышение мозгового кровотока и кровотока в корковых структурах на фоне восполнения объема циркулирующей крови, увеличения сердечного индекса, ликвидации интерстициальной гипергидратации.
- Основным компонентом инфузионно - трансфузионной терапии для восполнения объема циркулирующей крови и ликвидации интерстициальной гипергидратации в первые 3 суток является высокомолекулярный гидроксиэтилированный крахмал со средней молекулярной массой 450000 Дальтон (стабизол), который благодаря кумуляции и сохранению в плазме эффективного молекулярного веса обеспечивает мягкий и длительный «экспандерный» эффект и ограничивает применение «мощных» гипотензивных средств на фоне артериолоспазма.
- При эклампсии и в раннем периоде эклампсической комы необратимые повреждения головного мозга отсутствуют. Выявляемые изменения при проведении КТ исчезают на 3–4-е сутки; эклампсия трансформируется в эклампсическую кому при несвоевременном и неадекватном оказании лечебной помощи.
- Установлена причинная связь летальных исходов с неэффективным интенсивным лечением на ранних этапах и с поздней диагностикой возникших осложнений. Своевременное и адекватное интенсивное лечение эклампсической комы обеспечивает благоприятный прогноз.
- На основании проведенных исследований разработаны приоритетные направления базового лечения, предложен алгоритм интенсивного лечения эклампсической комы, направленный на коррекцию многочисленных нарушений гомеостаза. Разделение комплекса по приоритетности на 3 уровня связано с ограниченностью фактора времени для предупреждения необратимых структурных повреждений мозга и обеспечивает более ранний выход из коматозного состояния со снижением летальности с 15,7 до 4,8%.
Практические рекомендации.
Для успешного лечения эклампсической комы необходимо соблюдение принципа приоритетности направлений интенсивного лечения. При этом первостепенной задачей является обеспечение адекватного газообмена в легких и повышение МК, особенно рМКб. Повышение МК и рМКб обеспечивается на всех этапах лечения внутривенным капельным введение нимодипина в дозе 0,05-0,1 мг/кг/час до восстановления сознания на фоне постепенного восполнения ОЦК.
- Адекватный газообмен в легких обеспечивается применением современных технологий и концепций безопасной ИВЛ на фоне применения седативной терапии препаратами диазепама, наркотическими аналгетиками или пропофолом при ДО – 7-9 мл/кг. «Дыхательный комфорт» (синхронизация больной с аппаратам обеспечивается регулированием величины минутного объема вентиляции). Независимо от стадии ОРДС при эклампсической коме РаО2 должно ≈100 мм рт. ст.. При этом РаС02 на ранних этапах должно поддерживаться на уровне ≈ 27 мм рт. ст..
- Восстановление волемических показателей должно проводиться постепенно под контролем АД и динамики ЦПД с постоянной коррекцией гипотензивной терапии в зависимости от величины ЦПД с применением, при необходимости, кардиотонических средств (дофамин). ЦПД должно быть не ниже исходного.
- Для восполнения ОЦК, с учетом характерного для гестоза «повреждения» сосудистой системы, рекомендуется высокомолекулярный ГЭК (стабизол) в дозе 400 мл в первые 3-5 часов при суточной дозе не более 15 мл/кг, обеспечивающий постепенное восполнение ОЦК без эпизодов проявления гипертензионного синдрома. СЗП используется только для профилактики коагулопатических расстройств в дозе не более 300-400 мл в сутки, альбумин - при снижении белка ниже 50 г/л или снижении его фракции до 30% и отмытые эритроциты или эритромассу – при снижении гематокрита до 20-22 ед., реамберин – как донатор нейроаминокислот. Применение гипертонического раствора хлористого натрия для восполнения ОЦК при эклампсической коме противопоказано. Объем инфузионно - трансфузионной терапии не должен превышать 1500-1700 мл. Соотношение коллоидных и кристаллоидных растворов составляет 2:1.
- Использование осмодиуретиков без специальных показаний (например, феномен Кохера-Кушинга) при эклампсической коме противопоказано. Применение лазикса возможно только после «нормализации» ОЦК.
- Гипотензия при эклампсической коме опаснее незначительной гипертензии, поэтому применение сильно действующих гипотензивных средств при эклампсической коме противопоказано. Применяемые средства должны обеспечивать снижение систолического давления не более чем на 10-15% от исходного. Основными гипотензивными средствами должны служить нимодипин и сульфат магния.
- При эклампсической коме обязательно включение в комплекс интенсивного лечения препаратов, повышающих АОЗ (мафусол в дозе до 400 мл в сутки).
- Перевод на самостоятельное дыхание после длительной ИВЛ производится постепенно и не ранее, чем через 36 часов после последнего приступа эклампсии, при отсутствии судорожной готовности больной или судорожной активности на ЭЭГ на фоне стабилизации артериального давления (САД ≈105 мм рт. ст.) и полного восстановлении сознания.
- В комплекс интенсивного лечения обязательно включаются кортикостероиды в суточной дозе 300 мг (в пересчете на преднизолон) в течение 3-х суток. С уменьшением дозировки в последующие 3-е суток в 2 раза. Последняя доза преднизолона в дозе 30 мг вводится на 6-е сутки после начала кортикостероидной терапии.
Список работ, опубликованных по теме диссертации
- Подольский Ю.С., Хапий Н.Х., Хисматуллин Д.А., Сапичева Ю.Ю. Кислородный баланс головного мозга родильниц в эклампсической коме. Материалы конгресса анестезиологов-реаниматологов ЦФО.- М, 2003.- С. 131.
- Подольский Ю.С., Хапий Н.Х., Филипповская Ж.С., Хисматуллин Д.А. Динамика водно-электролитного баланса у родильниц в эклампсической коме. Материалы конгресса анестезиологов-реаниматологов ЦФО.- М, 2003.- С. 133.
- Kh. Khapiy, J. Podolsky. Determinasion of the glicemic and insulin indices of tube feeding formulas utilized in metabolically stressed patients. Clinical Nutrition, Vol. 23, august 2004, P. 777-778.
- Подольский Ю.С., Хапий Х.Х., Глумцева Н.А. Водно-секторальные нарушения у родильниц в эклампсической коме.// Клиническая анестезиология и реаниматология.- 2004- №3- С. 92-93.
- Подольский Ю.С., Хапий Х.Х. Оценка показателей гемодинамики у родильниц в эклампсической коме.// Клиническая анестезиология и реаниматология.- 2004- №3- С. 93.
- Подольский Ю.С., Хапий Х.Х. Эклампсическая кома, механизм ее развития. Материалы 2-го съезда Ассоциации анестезиологов-реаниматологов ЦФО.- М, 2005.- С. 113.
- Хапий Х.Х., Логутова Л.С., Подольский Ю.С., Хапий Н.Х., Глумцева Н.А. Интенсивная терапия эклампсической комы. Пособие для врачей.- М. 2005.
- Хапий Х.Х., Подольский Ю.С., Хапий Н.Х., Хисматуллин Д.А. Эклампсия. Причины ее развития.// Вестник интенсивной терапии.- М, 2005.- № 4.- С. 28-29.
- Подольский Ю.С., Круглов А.А., Штабницкий М.С., Хапий Х.Х. Углеводный обмен головного мозга у родильниц в эклампсической коме.// Вестник интенсивной терапии. – М, 2005.- № 5. – С. 323-324.
- Подольский Ю.С., Штабницкий М.С., Хапий Х.Х. Основные направления интенсивной терапии эклампсической комы. Материалы Всероссийского съезда анестезиологов-реаниматологов.- М, 2006.- С. 216.
- Подольский Ю.С. Проблемы интенсивной терапии эклампсической комы. //Вестник интенсивной терапии.- М, 2006.- №6.- С. 64-65.
- Подольский Ю.С., Хисматуллин Д.А. Состояние свободнорадикального перикисного окисления липидов (СР ПОЛ) и антиоксидантной защиты (АОЗ). Материалы III Всероссийской научно-методической конференции «Стандарты и индивидуальные подходы в анестезиологии, реаниматологии и интенсивной терапии»-Г, 2006.- С. 87.
- Хапий Х.Х., Логутова Л.С., Кассиль В.Л., Петрухин В.А., Лопатин А.Ф., Хапий Н.Х., Подольский Ю.С. Эклампсия, эклампсическая кома, интенсивная терапия. Методическое руководство для врачей.- М. 2008.
- Подольский Ю.С., Хапий И.Х. Нарушения водных секторов у родильниц в эклампсической коме.// Саратовский научно-медицинский журнал. С. 185-186, 2009,том 5, № 2.
- Хапий Х.Х., Кассиль В.А., Логутова Л.С., Петрухин В.А., Гридчик А.Л., Руденко М.В., Подольский Ю.С., Хапий Н.Х., Лопатин А.Ф. Эклампсическая кома. Патогенез и интенсивная терапия. Методическое руководство для врачей.- М. 2009.
- Подольский Ю.С., Хисматуллин Д.А., Хапий И.Х. Механизм развития эклампсической комы. // Анестезиология и реаниматология.- М, 2009.- №4.- С. 42-45.
- Подольский Ю.С., Хисматуллин Д.А., Хапий И.Х. Современные тенденции в интенсивной терапии эклампсической комы.// Общая реаниматология.- М,2009.-№5-С. 41-44.
- Подольский Ю.С., Хапий И.Х. Прогностическое значение тактики интенсивной терапии при эклампсической коме. // Вестник российской военно – медицинской академии. – С-П, 2009. - № 4. – С. 42-44.
- Подольский Ю.С., Хапий И.Х. Эклампсическая кома. Новый алгоритм лечения. .// Саратовский научно-медицинский журнал. С. 541-542, 2009,том 5, № 4.
- Подольский Ю.С., Хисматуллин Д.А., Хапий И.Х., Петровская Э.Л. Оценка эффективности мониторинга церебрального перфузионного давления в комплексной терапии эклампсической комы. Материалы II Всероссийского конгресса «Анестезия и реанимация в акушерстве и неонатологии» -М, 2009.- С. 84-86.
- Подольский Ю.С., Хапий И.Х. Оценка эффективности нимотопа в лечении эклампсической комы. Материалы Межрегиональной научно-практической конференции «Профилактика осложнений анестезии и интенсивной терапии в акушерстве».- М, 2009.- С. 17-18.
- Подольский Ю.С. О механизмах развития эклампсической комы. // Казанский медицинский журнал. С. 56-58, 2010,том 91, № 1.
Список сокращений
АВРГ – артерио-венозная разница по глюкозе
АОЗ – антиоксидантная защита
ВАРЛ – венозно-артериальная разница по лактату
ВнЖ – внеклеточный объем жидкости
ВЖ – внутриклеточная жидкость
ВЧД – внутричерепное давление
Hb- гемоглобин
ДО – дыхательный объем
ИВЛ – искусственная вентиляция легких
ИнЖ – интерстициальная жидкость
КТ – компьютерная томография
КОД – коллоидно-осмотическое давление
КЭО2 – коэффициент экстракции кислорода
ЛД – ликворное давление
МДА - малоновый диальдегид
La – концентрация лактата в артериальной крови
МК – мозговой кровоток
МКБ –международная классификация болезней
МФМОС – мозговая фракция сердечного выброса
ОЖ – объем общей жидкости
ОРДС – острый респираторный дистресс-синдром
ОЦЖ – объем циркулирующей жидкости
ОЦП – объем циркулирующей плазмы
ПОЛ – перекисное окисление липидов
ПРЭ – перекисная резистентность эритроцитов
рМКб – кровоток по серому веществу мозга
рМКм – кровоток по белому веществу мозга
СаО 2 – содержание кислорода в артериальной крови
СvО2 – содержание кислорода в венозной крови
СВМЛ – скорость выделения мозгом лактата
СОД – супероксиддисмутаза
СПМО2 – скорость потребления мозгом кислорода
СПМГ – скорость поглощения мозгом глюкозы
СР – свободные радикалы
СР ПОЛ – свободно-радикальное перекисное окисление липидов
ЦПД – церебральное перфузионное давление
IDO2 – индекс доставки кислорода
IVO2 – индекс потребления кислорода
Vj – внутренняя яремная вена
