Низкотемпературная технология формирования фаз кислородно-октаэдрического типа, содержащих nb (V) и свойства материалов на их основе
| Вид материала | Автореферат |
СодержаниеМетодика получения и состав гидроксидов ниобия. В четвёртой главе Основные результаты и выводы Основные положения и результаты диссертации опубликованы в следующих работах |
- Фазы, фазовые состояния и морфотропные области в n компонентных системах сегнетоэлектрических, 528.08kb.
- Лесничая марина Владимировна синтез и свойства ag(0)-, Au(0)-содержащих нанокомпозитов, 308.79kb.
- Материаловедение и технология конструкционных материалов, 37.46kb.
- Примерная программа дисциплины технология конструкционных материалов рекомендуется, 242.94kb.
- Методические указания по выполнению лабораторных работ по курсу "Механические и физические, 164.3kb.
- Реферат Отчет 124 с., 7 ч., 47 рис., 25 табл., 74 источника, 69.88kb.
- Рабочая программа учебной дисциплины ф тпу 1 -21 утверждаю, 464.86kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 312.72kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 178.17kb.
- Синтез и свойства композиционных материалов на основе матриц полиметилметакрилата, 303.47kb.
1 2
Методика получения и состав гидроксидов ниобия. В связи с тем, что известные способы получения гидроксида ниобия (V) не обеспечивают формирование его α-формы, нами была предпринята попытка решения данной проблемы. В качестве приоритетного был выбран фторидный метод вскрытия оксида ниобия (V), что позволяет получить смесь гептафтор- и оксопентафторниобиевой кислот.
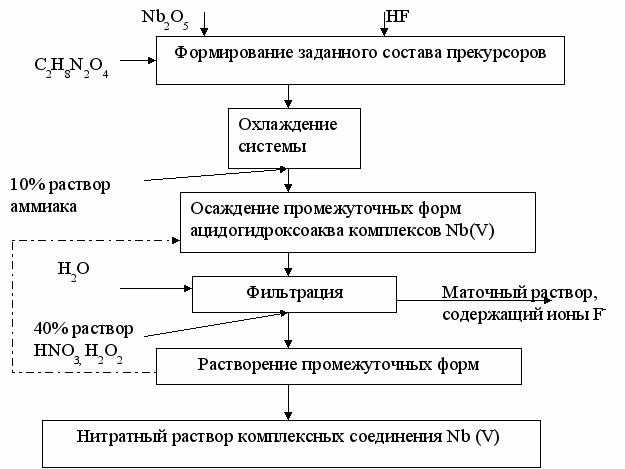
Рисунок 4 - Принципиальная технологическая схема изготовления нитратного раствора комплексных соединения Nb (V)
Для удаления ионов фтора из внутренней сферы комплексов на втором этапе синтеза к раствору, содержащему ионы NbOF52- и NbF72- , добавляется кристаллический оксалат аммония, что приводит к формированию в системе оксалато- или оксооксалатокомплексных ионов ниобия (V). Из полученного раствора с помощью 10 % раствора аммиака осаждалась гелеобразная фаза, которая отделялась от маточного раствора фильтрованием или центрифугированием (рН фильтрата = 8). Она промывалась водой для максимально возможного удаления из неё фторид- и оксалат-ионов. Из полученного продукта отбирали две пробы: одну растворяли в 40 % растворе HNO3, а другую- в концентрированном растворе лимонной кислоты. Из полученного раствора цитратного комплекса ниобия (V), описанным способом, осаждался гидроксид ниобия (V). Осадок промывался дистиллированной водой до отрицательной реакции на цитрат - ионы и растворялся в 40 % растворе азотной кислоты, содержащей около 1 мл H2O2 на 50 мл раствора HNO3. Добавление в систему H2O2 позволяет снизить расход используемой для растворения осадка HNO3 (рис. 4).
Составы как конечных, так и промежуточных форм гидроксидов анализировались методами ДТА, ТГА, химического и фотометрического анализов, а фазовый состав кристаллических фаз, образующихся в процессе термического разложения гидроксидов – методом РФА. Продукты разложения отгонялись в приемную колбу и анализировались на наличие в них CO2 (продукт разложения оксалат-ионов) и F-.
Исследование составов гидроксидов ниобия (V), осаждённых из следующих растворов соединений ниобия (V): а) фтор-оксалатных (форма 1); б) цитратных (форма 2); в) нитратных (формы 3 и 4), полученных растворением в азотной кислоте, соответственно, форм 1 и 2, показывает, что все эти фазы содержат переменное количество анионов, первоначально входивших в состав прекурсоров (табл. 1).
Таблица 1 - Содержание в гидроксидах ниобия (V) анионных примесей в зависимости от метода получения образца
Исходя из полученных результатов можно сделать вывод, что увеличение числа этапов перехода от фторидных комплексов, из которых осаждается первичный гидроксид, к комплексам с бидентатными лигандами, позволяет снизить концентрацию фторид-ионов в системе. В форме 4 фторид-ионы они не обнаружены.
ДТА и ТГА образцов различных форм показывает, что гидроксиды ниобия (V), не зависимо от их химической предыстории, разлагаются в интервале температур от 20 до 450 оС (максимальная скорость разложения при 180 – 270 оС).
При низких температурах (до 180 оС) в этих системах фиксируется эндотермические эффекты, связанные с формированием промежуточных оксоловых фаз, а при 260-280 оС – экзоэффект кристаллизации Nb2O5. Для форм 3 и 4 начало кристаллизации Nb2O5 инициируется протеканием в системах при 260-280 оС экзотермического процесса разложения нитрата аммония, который является побочным продуктом реакции между нитратными растворами соединений ниобия (V) и раствором аммиака.
Необходимо отметить, что разработка технологии отчистки Nb2O5∙xH2O от ионов F¯была основана на представлении об относительной стабильности различных комплексных соединений ниобия (V). Было высказано предположение, что, также как для других элементов начала переходных рядов, комплексные фториды ниобия превосходят по своей термодинамической стабильности все другие комплексы за исключением комплексов, содержащих в качестве лигандов анионы многоосновных карбоновых и α-оксикислот. Как показывают приведённые выше данные конкуренцию ионам F ˉ, в полной мере, не могут составить и оксалат-ионы, несмотря на хелатный характер образуемых ими комплексов. Значительно более высокая степень очистки обсуждаемой фазы была достигнута при использовании в качестве лигандов анионов лимонной кислоты.
Стоит отметить, что при термическом разложении Nb2O5∙xH2O, полученного методами 3 и 4, при температурах 500 – 600 оС образуется порошок оксида ниобия (V) со средним размером частиц 270-350 нм. Применяемый в электронной промышленности оксид ниобия (V) «НбО-Пт» имеет средний размер частиц 870 нм (данные получены методом СЗМ на сканирующем зондовом микроскопе Solver PRO «M»).
В четвёртой главе данной работы описана низкотемпературная технология формирования фаз кислородно-октаэдрического типа. После определения основных принципов метода «химической сборки», который является основой низкотемпературной технологии формирования фаз кислородно-октаэдрического типа, он был опробован на ряде модельных объектов:
а) фазах состава PbTixZr1-xO3, Pb2FeNbO6, PbTi0.07(Fe0.465Nb0.465)03, и Pb(Ti0.35Zr0,21)(Zn1/3Nb2/3)0.14(Nb2/3Ni1/3)0.3O3 со структурой перовскита;
б) фазах системы PbNb2O6 - BaNb2O6 cо структурой типа ТКВБ.

Рисунок 4 - Принципиальная технологическая схема изготовления нитратного раствора комплексных соединения Nb (V)
Для удаления ионов фтора из внутренней сферы комплексов на втором этапе синтеза к раствору, содержащему ионы NbOF52- и NbF72- , добавляется кристаллический оксалат аммония, что приводит к формированию в системе оксалато- или оксооксалатокомплексных ионов ниобия (V). Из полученного раствора с помощью 10 % раствора аммиака осаждалась гелеобразная фаза, которая отделялась от маточного раствора фильтрованием или центрифугированием (рН фильтрата = 8). Она промывалась водой для максимально возможного удаления из неё фторид- и оксалат-ионов. Из полученного продукта отбирали две пробы: одну растворяли в 40 % растворе HNO3, а другую- в концентрированном растворе лимонной кислоты. Из полученного раствора цитратного комплекса ниобия (V), описанным способом, осаждался гидроксид ниобия (V). Осадок промывался дистиллированной водой до отрицательной реакции на цитрат - ионы и растворялся в 40 % растворе азотной кислоты, содержащей около 1 мл H2O2 на 50 мл раствора HNO3. Добавление в систему H2O2 позволяет снизить расход используемой для растворения осадка HNO3 (рис. 4).
Составы как конечных, так и промежуточных форм гидроксидов анализировались методами ДТА, ТГА, химического и фотометрического анализов, а фазовый состав кристаллических фаз, образующихся в процессе термического разложения гидроксидов – методом РФА. Продукты разложения отгонялись в приемную колбу и анализировались на наличие в них CO2 (продукт разложения оксалат-ионов) и F-.
Исследование составов гидроксидов ниобия (V), осаждённых из следующих растворов соединений ниобия (V): а) фтор-оксалатных (форма 1); б) цитратных (форма 2); в) нитратных (формы 3 и 4), полученных растворением в азотной кислоте, соответственно, форм 1 и 2, показывает, что все эти фазы содержат переменное количество анионов, первоначально входивших в состав прекурсоров (табл. 1).
Таблица 1 - Содержание в гидроксидах ниобия (V) анионных примесей в зависимости от метода получения образца
| Анион | ммоль(Аn-)/моль(Nb2O5) | |||
| форма гидроксида (1) | форма гидроксида (2) | форма гидроксида (3) | форма гидроксида (4) | |
| F¯ | 96 | 38 | 16 | - |
| CO32- | 111 | 72 | 14 | 12 |
Исходя из полученных результатов можно сделать вывод, что увеличение числа этапов перехода от фторидных комплексов, из которых осаждается первичный гидроксид, к комплексам с бидентатными лигандами, позволяет снизить концентрацию фторид-ионов в системе. В форме 4 фторид-ионы они не обнаружены.
ДТА и ТГА образцов различных форм показывает, что гидроксиды ниобия (V), не зависимо от их химической предыстории, разлагаются в интервале температур от 20 до 450 оС (максимальная скорость разложения при 180 – 270 оС).
При низких температурах (до 180 оС) в этих системах фиксируется эндотермические эффекты, связанные с формированием промежуточных оксоловых фаз, а при 260-280 оС – экзоэффект кристаллизации Nb2O5. Для форм 3 и 4 начало кристаллизации Nb2O5 инициируется протеканием в системах при 260-280 оС экзотермического процесса разложения нитрата аммония, который является побочным продуктом реакции между нитратными растворами соединений ниобия (V) и раствором аммиака.
Необходимо отметить, что разработка технологии отчистки Nb2O5∙xH2O от ионов F¯была основана на представлении об относительной стабильности различных комплексных соединений ниобия (V). Было высказано предположение, что, также как для других элементов начала переходных рядов, комплексные фториды ниобия превосходят по своей термодинамической стабильности все другие комплексы за исключением комплексов, содержащих в качестве лигандов анионы многоосновных карбоновых и α-оксикислот. Как показывают приведённые выше данные конкуренцию ионам F ˉ, в полной мере, не могут составить и оксалат-ионы, несмотря на хелатный характер образуемых ими комплексов. Значительно более высокая степень очистки обсуждаемой фазы была достигнута при использовании в качестве лигандов анионов лимонной кислоты.
Стоит отметить, что при термическом разложении Nb2O5∙xH2O, полученного методами 3 и 4, при температурах 500 – 600 оС образуется порошок оксида ниобия (V) со средним размером частиц 270-350 нм. Применяемый в электронной промышленности оксид ниобия (V) «НбО-Пт» имеет средний размер частиц 870 нм (данные получены методом СЗМ на сканирующем зондовом микроскопе Solver PRO «M»).
В четвёртой главе данной работы описана низкотемпературная технология формирования фаз кислородно-октаэдрического типа. После определения основных принципов метода «химической сборки», который является основой низкотемпературной технологии формирования фаз кислородно-октаэдрического типа, он был опробован на ряде модельных объектов:
а) фазах состава PbTixZr1-xO3, Pb2FeNbO6, PbTi0.07(Fe0.465Nb0.465)03, и Pb(Ti0.35Zr0,21)(Zn1/3Nb2/3)0.14(Nb2/3Ni1/3)0.3O3 со структурой перовскита;
б) фазах системы PbNb2O6 - BaNb2O6 cо структурой типа ТКВБ.
Низкотемпературная технология формирования фаз состава PbTixZr1-xO3.
Используемые в качестве прекурсоров оловые формы TiO2∙xH2O и ZrO2∙xH2O осаждались из 0,1-0,3M (по TiO2 и ZrO2) кислых нитратных растворов соединений Ti(IV) и Zr(V) за счёт их нейтрализации 5-10 % раствором аммиака. Для предотвращения процессов оксоляции осаждение продуктов реакции проводилось при температуре ниже 10 оС и постоянном перемешивании. Для получения аморфной фазы PbTixZr1-xO3, α-формы TiO2∙xH2O и ZrO2∙xH2O, отделённые от маточного раствора декантацией, смешивались между собой в необходимом соотношении. На втором этапе к ним добавлялось рассчитанное количество кристаллического PbO. Полученная суспензия перетиралась при температуре ниже 10 оС в течение 40 минут. Образующиеся аморфные продукты реакции, прокаливались при 350-850 ºС (время обжига варьировалось от 1 до 6 часов). Принципиальная технологическая схема процесса приведена на рисунке 5.
По данным ДТА и ТГА термическое разложение продуктов реакций начинается при температуре около 50 оС. На первом этапе оно сопровождается интенсивным удалением из системы наименее прочно связанной воды примерно до температуры 170-200 ºС. В интервале температур 250 – 300 оС (в зависимости от состава системы) происходит разложение нитрата аммония, который является побочным продуктом протекающих в системе реакций. Так как процесс разложения NH4NO3 экзотермичен, то его протекание индуцирует процесс кристаллизации исходной аморфной фазы, сопровождающийся её разложением, удалением воды из системы и формированием кристаллической кубической фазы со структурой перовскита. С ростом температуры синтеза фаз системы PbTiO3 - PbZrO3 (при температурах выше 550 оС) наблюдается трансформация (рис.6) кубических фаз, образовавшихся при более низких температурах, в тетрагональные (области составов, прилегающих к PbTiO3) и ромбоэдрические (области составов, прилегающих к PbZrO3).
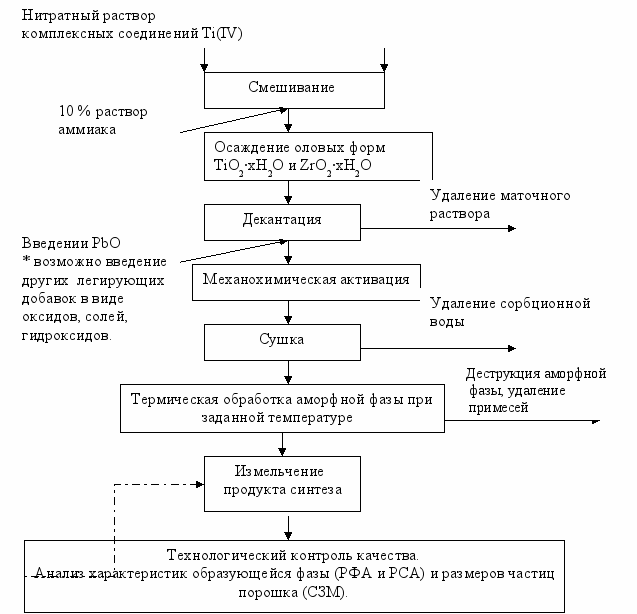
Нитратный раствор
комплексных соединений Zr(IV)
Рисунок 5 - Принципиальная технологическая схема формирования фаз системы PbTixZr1-xO3 методом «химической сборки»
Размер объектов в исследованных системах оценивался двумя методами: СЗМ и РСА. Было установлено, что размер частиц промежуточной аморфной фазы, образующейся в системе TiO2∙xH2O - ZrO2∙xH2O - PbO при 100 ºС лежит в пределах от 300 до 2000 нм. В процессе дальнейшей термической деструкции аморфных частиц в их объёме происходит формирование зародышей кубических кристаллических фаз, размер частиц которых растёт по мере увеличения температуры обжига (табл.2).
Из данных таблицы 2 также следует, что размер первичных кристаллических частиц в этих системах предопределяется ещё одним параметром – молярной концентрацией нитратных растворов соединений титана и циркония, из которых были осаждены гидроксиды данных элементов.
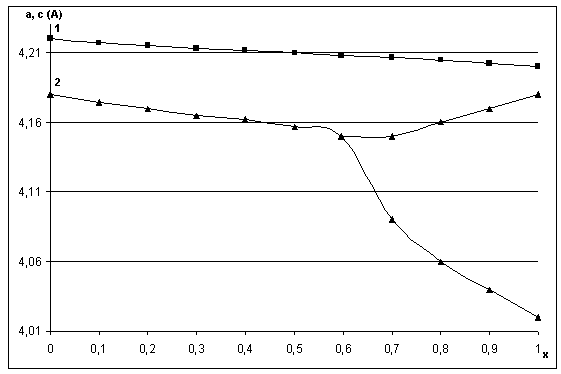
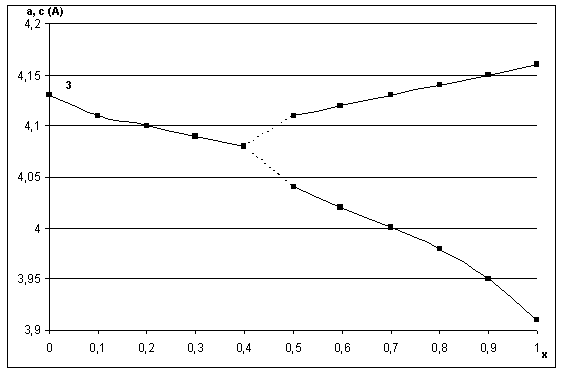
Рисунок 6 - Зависимость параметров элементарных ячеек фаз типа PbZr1-хTiхO3 от состава и условий термообработки шихты, синтезированной методом «химической сборки». 1. Температура обжига 350 °С 2. Температура обжига 450 °С 3. Температура обжига 700 °С. Время термообработки 2 часа.
Влияние методов получения фаз системы ЦТС на электрофизические параметры материалов, создаваемых на их основе.
Как отмечалось выше, частицы шихты, синтезированные МТФР, характеризуются высокой концентрацией неравновесных дефектов, что значительно снижает качество изготовленных из неё керамических материалов. Описанные выше низкотемпературные методы синтеза фаз со структурой перовскита устраняют основной недостаток МТФР и, следовательно, порошки, изготовленные по предлагаемым технологиям, должны способствовать снижению температуры спекания керамики и повышению её ЭФП. Исследование микроструктуры поверхности керамики методом зондовой микроскопии показало, что использование низкотемпературной шихты позволяет целенаправленно варьировать размер зёрен керамики в пределах от 50 до 1500 нм, в том числе, изготавливать образцы с размером зёрен, сравнимых с размерами доменов. В связи с этим, поляризация такой керамики протекает более эффективно, что с учётом более низкой неравновесной концентрации пьезофаз и высокой плотности образцов приводит к росту их диэлектрических и пьезоэлектрических параметров.
Таблица 2 - Изменение параметров элементарных ячеек и областей когерентного рассеяния (ОКР) образцов состава PbTi0.5Zr0.5O3 в зависимости от условий их синтеза
| Т обжига, ОС | CM [Me(NO3)6]2- Ме=∑Ti,Zr | параметр a, Ǻ | параметр c, Ǻ | параметр *ОКР, Ǻ |
| 450 | 0,2 | 4,11 | - | 120 |
| 0,5 | 4,06 | - | 210 | |
| 0,7 | 4,05 | - | 240 | |
| 0,9 | 4,04 | - | 260 | |
| 600 | 0,2 | 4,08 | - | 390 |
| 0,5 | 4,01 | 4,07 | 520 | |
| 0,7 | 4,00 | 4,09 | 580 | |
| 0,9 | 4,00 | 4,10 | 610 | |
| 750 | 0,2 | 4,04 | 4,08 | 480 |
| 0,5 | 4,00 | 4,09 | 710 | |
| 0,7 | 3,96 | 4,10 | 770 | |
| 0,9 | 3,98 | 4,11 | 890 | |
| 900 | 0,2 | 4,03 | 4,09 | 540 |
| 0,5 | 3,98 | 4,1 | 980 | |
| 0,7 | 3,97 | 4,11 | >1000 | |
| 0,9 | 3,952 | 4,125 | >1000 | |
| 1050 | 0,2 | 4,01 | 4,09 | >1000 |
| 0,5 | 3,973 | 4,105 | >1000 | |
| 0,7 | 3,964 | 4,114 | >1000 | |
| 0,9 | 3,952 | 4,125 | >1000 |
*ОКР рассчитаны по формуле Селакова-Шерера D=λ/βcosθ, где λ-длина рентгеновского излучения (нм), β-физическое уширение
Согласно полученным нами данным образцы, изготовленные из шихты, синтезированной по методу «химической сборки», превосходят керамику того же состава, изготовленную с использованием традиционной технологии по εТ33/ε0 на 130 %, по d33 и d31 на 30 – 35 %.
При этом появляется возможность в широких пределах варьировать точку Кюри материалов (рис. 7), а также на основе фазы фиксированного состава создавать пьезокерамику с различным сочетанием ЭФП (рис. 8).
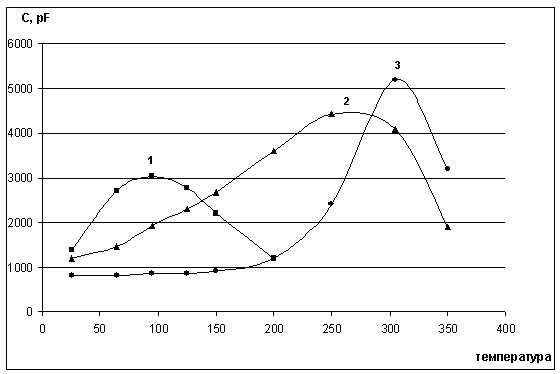
Рисунок 7 - Зависимость емкости стандартных образцов керамики ЦТС-36 ( h= 1 мм, d = 10 мм) от температуры: средний размер зёрен (1) - 150 нм ; (2) - 280 нм ; (3) - 600 нм. Плотность образцов не менее 87% от теоретической.
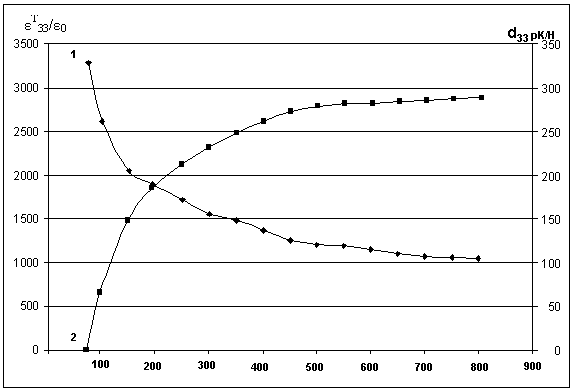
Рисунок 8 - Изменение ЭФП керамики ЦТС – 36 в зависимости от среднего размера её зёрен: 1 - εТ33/ε0 ; 2 – d33
ЭФП пьезокерамических материалов на основе фаз системы PbZrO3-PbTiO3-Pb(Ni1/3Nb2/3)O3-Pb(Zn1/3Nb2/3)O3.
На основе полученных данных по синтезу фаз системы ЦТС, нами была разработана низкотемпературная технология получения промышленного материала ЦТС-ЦНН состава Pb(Ti0.35Zr0,21)(Zn1/3Nb2/3)0.14(Nb2/3Ni1/3)0,3O3, содержащего в позиции В ионы Nb5+.
Таблица 3 - Зависимость электрофизических параметров керамики состава Pb(Ti0.35Zr0,21)(Zn1/3Nb2/3)0.14(Nb2/3Ni1/3)0.3O3 (ЦТС-ЦНН) от метода синтеза и условий спекания
| Параметр | Метод синтеза порошка | |||||
| 1 | 1 | 2 | 2 | 3 | 4 | |
| Тспек. (°С) | 1275 | 1250 | 1275 | 1250 | 1175 | 1175 |
| d* (мк) | >2 | 1-2,5 | >2 | 0,8-2,2 | 0,5-0,9 | 0,15-0,4 |
| ρ(г/см3) керамики | 7,2-7,25 | 7,3-7,4 | 7,35-7,48 | 7,45-7,55 | 7,6-7,72 | 7,2-7,45 |
| εТ33 /ε0 | 2290-2315 | 2750-2811 | 3015-3077 | 2850-2980 | 3210-3284 | 3615-3815 |
| tg δ | 0,019-0,025 | 0,019-0,022 | 0,017-0,02 | 0,017-0,02 | 0,016-0,019 | 0,029-0,04 |
| Кр | 0,38-0,4 | 0,44-0,48 | 0,45-0,49 | 0,5-0,52 | 0,57-0,59 | 0,2-0,25 |
| Тс (°С) | 225 | 225 | 225 | 225 | 220 | 170 |
| -d31, (пКл/Н) | 140-147 | 158-165 | 164-171 | 178-185 | 215-222 | 82-98 |
| d33, (пКл/Н) | 370-396 | 425-443 | 432-456 | 460-487 | 559-584 | 195-265 |
* диаметр зерна спечённой керамики (метод СЗМ)
В представленной работе синтез порошков фаз указанной системы проводился четырьмя методами:
1) методом твердофазных реакций (МТФР) с использованием в качестве прекурсоров оксидов Pb(II), Ti(IV), Zr(IV), Zn(II), Ni(II), Nb(V) (ступенчатый синтез при температурах от 600 до 1000 °С, время изотермических стадий 3-6 часов);
2) методом твердофазных реакций с использованием в качестве прекурсоров NiNb2O6, ZnNb2O6 и оксидов Pb(II), Ti(IV), Zr(IV) (ступенчатый синтез при температурах от 600 до 1000 °С, время изотермических стадий 3-6 часов);
3) методом «химической сборки», с использованием в качестве прекурсоров оловых форм гидроксидов титана (IV), циркония (IV) и ниобия (V), которые вводили во взаимодействие с оксидами Pb(II), Zn(II) и Ni(II);
4) методом «химической сборки», с использованием в качестве прекурсоров оловых форм гидроксидов титана (IV), циркония (IV), ниобия (V), а также суспензий, содержащих гидроксиды и аминокомплексы Pb(II), Zn(II), Ni(II). Исследование зависимости ЭФП (табл. 3) керамических материалов от метода получения исходной шихты показало, что использование метода химической сборки позволяет значительно повысить значения εТ33/ε0, пьезомодулей, коэффициентов электромеханической связи, плотности образцов, снизить tg δ и проводимость по сравнению с материалами, изготовленными по традиционной технологии, основанной на МТФР.
Низкотемпературная технология формирования фаз состава Pb(Fe0.5Nb0.5)03 (ФНС) и PbTi0.07(Fe0.465Nb0.465)03 (ФНТС).
Несмотря на целый комплекс практически важных свойств (пьезоэлектрических, конденсаторных, ферромагнитных, полупроводниковых), ФНС и ФНТС так и не получили широкого распространения, в связи с тем, что они относятся к числу материалов, критичных к условиям синтеза (образование устойчивых промежуточных фаз со структурой пирохлора, изменения степени окисления ионов железа и т.д.). В данной работе был проведён анализ механизмов образования фазы Pb(Fe0.5Nb0.5)03, что, по нашему мнению, должно способствовать пониманию причин низкой воспроизводимости ЭФП керамики на основе фаз Pb(Fe0.5Nb0.5)03 и PbTi0.07(Fe0.465Nb0.465)03.
Фаза состава Pb(Fe0.5Nb0.5)03 синтезировалась следующими методами:
1) МТФР с использованием в качестве прекурсоров оксидов PbO, Fe2O3, Nb2O5;
2) вариант метода 1, отличающийся введением (сверх стехиометрии) в исходную смесь оксидов Li2CO3 .
3) методом «химической сборки» с использованием в качестве прекурсоров α-формы гидроксидов Nb2O5∙хH2O, Fe2O3∙xH2O, PbO∙xH2O, осаждённых из азотнокислых растворов при температуре 5-10°C ;
4) комбинированным методом с использованием в качестве прекурсоров α-формы гидроксида Fe2O3xH2O, и оксидов PbO, Nb2O5 .
Анализ полученных экспериментальных данных (РФА) показал, что в методах 1 и 2 на первом этапе при t = 400 – 500 оС протекают процессы образования фаз со структурой пирохлора (индивидуальные или твёрдые растворы), в частности, Pb2Nb207, Pb3Nb4Ol3, Pb5Nb4Ol5 и т.д. Это связанно с более низкой (по сравнению с фазами со структурой перовскита) энергией активации указанных процессов. Данная особенность механизма реакций предопределяется тем, что для образования фаз со структурой перовскита необходимо участие в процессах Fe2O3, имеющего высокую энергию кристаллической решётки. В связи с этим, данный оксид приобретает способность вступать в реакции только при более высокой температуре, когда уже прореагировала большая часть Nb2O5 и половина оксида свинца, присутствовавшего в исходной шихте. По окончании первого этапа процесса в рассматриваемых системах (при t > 700 оС) наблюдается образование фаз состава: Pb2Fe2O5, Pb2Fe10O17 и PbFe10O16, которые разлагаются в интервале температур 840 – 1315 оС по схеме :
5 Pb2Fe2O5 → Pb2Fe10O17 + 8 PbO (при t≈ 900 оС) (1)
Pb2Fe10O17 → PbFe10O16 + PbO (при t > 950 оС) (2)
Одновременно фазы со структурой пирохлора могут взаимодействовать с ферритами свинца, в результате чего образуется новая фаза со структурой пирохлора (Pb5Fe4Nb4O21), например по схеме:
10 Pb2Nb207 + PbO + 2Pb2Fe10O17 → 5 Pb5Fe4Nb4O21 (3)
или целевая фаза:
Pb2Nb207 + Pb2Fe2O5 → 4 Pb(Fe0.5Nb0.5)03 (4)
Фаза Pb5Fe4Nb4O21 может трансформироваться в Pb(Fe0.5Nb0.5)03 в процессе взаимодействия с PbO, который образуется при термическом разложении Pb2Fe2O5 и Pb2Fe10O17 (уравнения 1 и 2):
Pb5Fe4Nb4O21 + 3PbO → 8Pb(Fe1/2Nb1/2)03 (5)
Таблица 4 - Фазовый состав порошков (по данным РФА), полученных в процессе синтеза фазы Pb(Fe1/2Nb1/2)03 (τобжига =2 часа)
| метод Тсинтеза, оС | 1 | 2 | 3 | 4 |
| 600 | ПХ + Fe2O3 | ПХ + Fe2O3 | Pb2Fe10O17, Pb5Fe4Nb4O21 Pb2Fe2O5 | Pb2Nb207 Pb2Fe2O5 |
| 700 | ПХ + Fe2O3 | ПХ + Fe2O3 | Pb2Fe10O17, Pb5Fe4Nb4O21 Pb2Fe2O5 | ПС + Pb2Nb207 Pb2Fe2O5 |
| 800 | ПС + ПХ + Fe2O3 Pb2Fe10O17 | ПС + Pb5Fe4Nb4O21 Pb2Fe2O5 | ПС + Pb2Fe10O17, Pb5Fe4Nb4O21 | ПС + ПХ (следы) |
| 900 | ПС + ПХ+ Pb2Fe10O17 PbFe10O16 | ПС + Pb2Fe10O17, Pb5Fe4Nb4O21 | ПС + Pb2Fe10O17, Pb5Fe4Nb4O21 | ПС |
| 1000 | ПС + ПХ + PbFe10O16 | ПС + Pb2Fe10O17, Pb5Fe4Nb4O21 | ПС + PbFe10O16, Pb5Fe4Nb4O21 | ПС |
ПС – фаза со структурой перовскита, ПХ – фазы со структурой пирохлора
Основываясь на данных таблицы 4 был сделан вывод, что в системе 1, в связи с низкой активностью использованного в данном случае Fe2O3, фаза состава Pb2Fe10O17 образуется только при температуре ≈ 800 оС. Отсутствие на рентгенограммах образцов данной системы (полученных в процессе обжига шихты при t<800 оС) максимумов, характерных для PbO, можно объяснить только образованием на начальных этапах процесса ниобатов, с соотношением Pb2+/Nb5+ > 1 (например, Pb5Nb4Ol5). Тогда образование фазы Pb5Fe4Nb4O21 происходит в результате процесса:
2,5Pb5Nb4Ol5 + Pb2Fe10O17 = 2,5Pb5Fe4Nb4O21 + 2 PbO,
но так как температура обжига образцов в данном случае уже ≈ 900 оС, в них параллельно протекает процесс образования наиболее термодинамически стабильной (в системе Fe2O3 - PbO) фазы PbFe10O16:
5Fe2O3 + PbO = PbFe10O16,
а также процесс образования целевого продукта (реакция 5). В связи с высокой стабильностью PbFe10O16 (эта фаза инконгруэнтно плавится при t > 1315 оС), её взаимодействие с ниобатами и феррониобатами, со структурой пирохлора, по-видимому, может протекать только при температурах, значительно превышающих 1000 оС и требует наличия в системе PbO:
2,5 Pb5Nb4Ol5 + PbFe10O16 + 6,5 PbO = 20 Pb(Fe1/2Nb1/2)03
Однако при таких температурах летучесть PbО очень высока, поэтому его количество в системе уже недостаточно для полного превращения промежуточных ниобатных, феррониобатых и ферритных фаз в фазу со структурой перовскита.
Роль Li2CO3 в системе 2 может сводиться к образованию при t > 700 оС лёгкоплавкой эвтектики (Fe2O3 – LiFe5O8), т.е. к активации наиболее стабильного компонента системы. Этим можно объяснить формирование при более низких температурах ферритов свинца, что способствует образованию в системе наименее стабильного из них - Pb2Fe2O5
Взаимодействие между гидроксидами свинца, железа и ниобия в системе 3 протекает при низкой температуре и, в связи с тем, что активность всех прекурсоров высока, в системе уже при 600 оС формируются три фазы Pb2Fe10O17, Pb5Fe4Nb4O21 и Pb2Fe2O5, энергия активации которых, по-видимому, в условиях синтеза минимальна. Дальнейшие изменения в системе связаны с протеканием в ней реакций 1, 2 и 5 в интервале температур 800 – 1000 оС. Следует обратить внимание, что фазовый состав образцов, полученных в системах 2 и 3, в процессе их обжига при 1000 оС идентичен, несмотря на различия в характере промежуточных стадий и, следовательно, причины, не позволяющие синтезировать целевую фазу, не содержащую примесей, в обоих случаях сходны.
Основываясь на данных, полученных при анализе процессов, протекающих в системах 1–3, нами в системе 4 при подборе прекурсоров была предпринята попытка селективно увеличить активность формы, в состав которой входит Fe3+. В результате этого на первом этапе в системе уже при t ≈ 400 оС происходит формирование фазы Pb2Fe2O5, что, при более высоких температурах, в соответствии с составом исходной смеси порошков, приводит к формированию в системе только одной формы ниобата свинца - Pb2Nb207. Промежуточные фазы при 800 – 900 оС взаимодействуют между собой с образованием однофазного целевого продукта по реакции 4.
Аналогичные данные по механизму процесса получены и для фазы состава: PbTi0.07(Fe0.465Nb0.465)03. В таблице 5 приведены ЭФП керамики, синтезированной из шихты, полученной различными методами. Представленные результаты, также как в случае материалов на основе фаз системы ЦТС, демонстрируют предпочтительность предлагаемого метода синтеза традиционному.
Таблица 5 - ЭФП пьезокерамики состава PbTi0.07(Fe0.465Nb0.465)03
| Метод синтеза | температура(ºС) /время спекания (часы) | плотность (г/см3) | tg δ 10-4 | ε33T /ε0 | kP | -d31, (пКл/Н) |
| 1 | 1125/1 | 7,3 | 6,2 | 2404 | 0,31 | 104,2 |
| 1 | 1125/2 | 7,45 | 2,6 | 2830 | 0,42 | 148,1 |
| 4 | 1075/1 | 7,63 | 2,8 | 3031 | 0,44 | 157,3 |
| 4 | 1075/2 | 7,67 | 2,5 | 3164 | 0,46 | 167,4 |
Низкотемпературная технология формирования фаз со структурой ТКВБ.
Процесс формирования фаз со структурой ТКВБ, основанный на МТФР, имеет те же недостатки, что и ранее рассмотренные процессы синтеза фаз со структурой типа перовскита. В связи с этим нами была предпринята попытка найти другие пути, способствующие образованию указанных фаз при более низких температурах. Для реализации этой задачи исследованы процессы взаимодействия α-Nb2O5∙xH2O с PbO∙xH2O и Ba(OH)2.
Таблица 6 - Состав фаз (по данным РФА), образующихся в системе 1(PbNb2O6) при различной температуре обжига образцов (время обжига 2 часа)
 Метод синтеза фаз Метод синтеза фазТ обжига образцов, ˚С | МТФР | Предлагаемый метод |
| 250 | исходные компоненты | Аморфная фаза |
| 350 | исходные компоненты | П |
| 450 | исходные компоненты + П | П + Р1 |
| 550 | П | Р1 + П |
| 700 | П + Р1 | Р1 + П |
| 800 | Р1 + П | Р1 + Р2 |
| 850 | Р1 | Р2 + Р1 |
| 1000 | Р1 | Р2 + Р1 |
| 1150 | Р1 | Р2 |
П – фазы со структурой пирохлора состава Pb2Nb2O7 ,Pb3Nb4O13 и т.д.;
Р1 – ромбоэдрическая; Р2 – ромбическая фаза PbNb2O6 (первой указана преобладающая в системе фаза)
Синтез PbNb2O6 осуществлялся путём перетирания смеси α-Nb2O5∙xH2O с PbO∙xH2O (состав 1). Для получения фаз состава BaxPb1-хNb2O6 к составу 1 перед перетиранием добавлялось рассчитанное количество суспензии гидроксида бария (состав 2), а при синтезе ВаNb2O6 - гель гидроксида ниобия обрабатывался рассчитанным количеством суспензии гидроксида бария (состав 3). Образцы состава 1,2 и 3 прокаливалась при температурах от 300 до 900 оС с шагом 50 оС (изотермическая выдержка от 1 до 6 часов), их фазовый состав определялся методом РФА.
Согласно данным РФА и ДТА во всех системах после перетирания исходных компонентов на первом этапе при с.у. формируются рентгеноаморфные фазы, первичная кристаллизация которых для образцов состава (1) и состава (2) с х<0.4 происходит в интервале температур 280– 310 оС и приводит к образованию смеси фаз (Pb2Nb2O7, Pb3Nb4O13 и т.д.) со структурой пирохлора. Взаимодействию этих фаз с аморфной формой Nb2O5 (с образованием ромбоэдрической фазы PbNb2O6) происходит при 540-570 ˚С. Полное исчезновение из системы фаз со структурой пирохлора наблюдается только при tобжига > 850 оС (τ = 2 часа). Одновременно с этим процессом (при 800 – 950 оС) начинается превращение ромбоэдрических фаз PbNb2O6 и BaxPb1-хNb2O6 в ромбическую (табл.6).
Обжиг образцов состава PbNb2O6 при 1150 ˚С в течение одного часа позволяет получить однофазный целевой продукт (ромбическую фазу), что в среднем на 100-150 оС ниже, чем в случае традиционной твердофазной технологии. Использование активных прекурсоров при синтезе BaNb2O6 позволило по сравнению с МТФР уменьшить время синтеза образцов в 1,5-2 раза и снизить температуру формирования сегнетоэлектрической фазы в среднем на 350 °С.
С учётом представленных выше данных синтез фаз состава BaxPb1-xNb2O6 проводился при температуре 700-900 °С (в зависимости от значения х). Керамика на основе полученной шихты изготавливалась по традиционной технологии (Тспекания =1100-1200 оС, τ = 1-2 часа). Плотность образцов, изготовленных из шихты, синтезированной предлагаемым методом, достигает 98,9 % от теоретически возможной, что на 10 – 18 % выше, чем у образцов, изготовленных в рамках технологий, основанных на МТФР. При этом температура спекания керамики, изготавливаемой в рамках предлагаемого метода, в среднем на пятьдесят-сто градусов ниже, по сравнению с образцами контрольных партий.
Основные результаты и выводы
1. В рамках концепции «химической сборки» выявлены прекурсоры, пригодные для низкотемпературного синтеза фаз со структурами типа перовскита и ТКВБ.
2. Разработана технология синтеза этих прекурсоров с заданным составом и строением, определены условия их формирования в нитратных системах и исследованы процессы взаимодействия указанных прекурсоров с солями, оксидами и гидроксидами щелочноземельных элементов и свинца.
3. Установлено, что способами, позволяющими варьировать конечный состав продукта реакции, могут быть: а) изменение концентрации раствора сорбата; б) изменение состава аниона соли данного элемента; в) использование буферных растворов; г) изменение типа вещества, взаимодействующего с матрицей; д) механическое активирование системы.
4. На основании изучения процессов формирования фаз в системах PbО – ЭO2·xH2O, PbO – ЭO2·xH2O – Me(NO3)2 – NH3·H2O, PbО – Э1O2·xH2O–Э2O2·xH2O (где Э = Ti, Zr), PbO·xH2O – Nb2O5·xH2O, Ba(OH)2 – Nb2O5·xH2O, PbO·xH2O – Ba(OH)2 – Nb2O5·xH2O, PbO·xH2O -Fe2O3·xH2O - Nb2O5·xH2O, заключающихся во взаимодействии указанных бифункциональных гидроксидов с различными типами прекурсоров выявлены условия формирования в указанных системах фаз со структурами типа перовскита и ТКВБ состава PbTi0.5Zr0.5O3, Pb(Fe0.5Nb0.5)03, PbTi0.07(Fe0.465Nb0.465)03, Pb(Ti0.35Zr0,21)(Zn1/3Nb2/3)0.14(Nb2/3Ni1/3)0.3O3, PbNb2O6, BaNb2O6 и BaxPb1-xNb2O6 и сформулированы критерии, позволяющие оптимизировать выбор варианта синтеза фаз заданного состава.
5. На основе полученных данных разработаны низкотемпературные технологии формирования ряда фаз кислородно-октаэдрического типа, основанные на методе «химической сборки». В частности, определены технологические параметры систем позволяющие формировать: фазы со структурой типа перовскита состава: PbTi0.5Zr0.5O3, Pb(Fe0.5Nb0.5)03, Pb(Ti0.35Zr0,21)(Zn1/3Nb2/3)0.14(Nb2/3Ni1/3)0.3O3, PbTi0.07(Fe0.465Nb0.465)03; фазы со структурой типа тетрагональной калий-вольфрамовой бронзы: PbNb2O6, BaNb2O6 и BaxPb1-xNb2O6.
6. Разработанная технология низкотемпературного процесса формирования фаз со структурой типа перовскита позволяет получать порошки этих фаз, задаваемого состава и строения, с задаваемым диаметром частиц в интервале от 50 до 800 нм, а на их основе изготавливать керамические пьезоматериалы с различным сочетанием ЭФП, превосходящие по основным пьезо- и диэлектрическим характеристикам пьезокерамику того же состава, изготовленную по традиционной технологии.
Основные положения и результаты диссертации опубликованы в следующих работах:
- Нестеров, А.А. Влияние дисперсности шихты на свойства керамических пьезоматериалов / А.А. Нестеров, К.С. Масуренков, Е.В. Карюков // Журнал прикладной химии. – 2008. – Т.81, №12. – С. 1949-1952.
- Нестеров, А.А. Низкотемпературный синтез фаз системы ЦТС и электрофизические свойства материалов на их основе / А.А. Нестеров, К.С. Масуренков, Е.В. Карюков // Журнал прикладной химии. – 2009. – Т.82, №3. – С. 377-381.
- Нестеров, А.А. Синтез фаз состава PbNb2O6 и ВаNb2O6 с использованием активных прекурсоров / А.А. Нестеров, К.С. Масуренков, Е.В. Карюков // Журнал прикладной химии. – 2009. – Т.82, №3. – С. 382-385.
- Карюков, Е.В. Электрофизические параметры керамики на основе ЦТС и фаз со структурой ТКВБ / Е.В. Карюков, А.А. Нестеров, А.С. Пахомов // Тезисы докладов V Всероссийской конференции «Керамика и композиционные материалы», Сыктывкар. – 2004. – С. 94.
- Карюков, Е.В. Влияние способов синтеза исходной шихты на электрофизические свойства керамики ЦТС-36 / Е.В. Карюков, А.А. Нестеров, А.С. Пахомов, А.А. Нестеров // Тезисы докладов Всероссийской конференции «Химия твердого тела и функциональные материалы- 2004», IV семинар СО РАН – УрО РАН «Термодинамика и материаловедение», Екатеринбург. – 2004. – С.302.
- Карюков, Е.В. Низкотемпературный синтез и изучение этапов фазообразования в системе PbTi0.07(Fe0.465Nb0.465)03» / Е.В. Карюков, А.А. Нестеров, Д.Г. Левшин // III Всероссийской научной конференции молодых ученых и студентов “Современное состояние и приоритеты развития фундаментальных наук” Анапа. – 2006. – С. 132-133.
- Нестеров, А.А. Электрофизические свойства керамики ЦТС, изготовленной из наноразмерной шихты / А.А. Нестеров, К.С. Масуренков, А.Ю. Копытин, Е.В. Карюков // Материалы международной научно-технической конференции «INTERMATIC», Москва. – 2006. – С. 209-211.
- Нестеров, А.А. Низкотемпературный синтез фаз состава PbTi0.07(Fe0.465Nb0.465)03 и 0,95 Pb(Ti0,47Zr0,53)O3 + 0,05 CdWO4 и свойства керамики на их основе / А.А. Нестеров, Е.В. Карюков, А.Ф. Пересунько // VI международная научная конференция «Химия твёрдого тела и современные микро- и нанотехнологии». Кисловодск. – 2006. – С. 472 473.
- Карюков, Е.В. Влияние способа получения наноразмерной шихты на электрофизические свойства керамики ЦТС / Е.В. Карюков, А.А. Нестеров, А.Ю. Копытин // Труды международной научно-практической конференции «Актуальные проблемы пьезоэлектрического приборостроения и нанотехнологий», Ростов-на-Дону. – 2006. – С. 204-208.
- Нестеров, А.А. Синтез фаз со структурой ТКВБ с использованием активных прекурсоров / А.А. Нестеров, Е.В. Карюков, А.А. Гриценко // Тезисы докладов международной научной конференции «Химия твёрдого тела и современные микро- и нанотехнологии», Кисловодск. – 2007. – С. 196-198.
- Масуренков, К.С. Некоторые проблемы получения пьезоэлектрических материалов на основе ниобатов щелочных металлов / К.С. Масуренков, Е.В. Карюков // Материалы международного конгресса студентов, аспирантов и молодых ученых «ПЕРСПЕКТИВА 2007», Нальчик. – 2007.- С. 277-279.
- Нестеров, А.А. Синтез фаз со структкрой ТКВБ с использованием активных прекурсоров / А.А. Нестеров, Е.В. Карюков // Труды ХVIII Менделеевского съезда, Москва. – 2007. – С. 452.
- Нестеров, А.А. Синтез Nb2O5·xH2O и его использование в качестве прекурсора при синтезе ниобатов s- и p-элементов / А.А. Нестеров, Е.В. Карюков, К.С. Масуренков // Тезисы докладов международной научной конференции «Химия твёрдого тела и современные микро- и нанотехнологии», Кисловодск. – 2008. – С. 238-241.
- Карюков, Е.В. Альтернативный метод изготовления пьезоматериала ТБК-3 / Е.В. Карюков, А.А. Панич // Труды международной научно-практической конференции «Инновационные процессы пьезоэлектрического приборостроения и нанотехнологий», Анапа. – 2008. – С. 25-29.
