Современные подходы к диагностике и хирургическому лечению хромаффинных опухолей 14. 00. 27 хирургия
| Вид материала | Автореферат |
- На правах рукописи, 279.48kb.
- 1. Современные подходы к хирургическому лечению онкологических больных, 563.78kb.
- Дифференциальные подходы к диагностике и лечению врождённой косолапости у детей 14., 567.67kb.
- Комплексный подход к диагностике и хирургическому лечению заболеваний щитовидной железы, 1223.26kb.
- Современные подходы к диагностике и лечению остеоартроза коленного сустава 14. 01., 590.91kb.
- Хирургические вмешательства в диагностике и терапии лимфатических опухолей средостения, 773.14kb.
- Клинико -эпидемиологические проявления, рациональные подходы к диагностике и лечению, 804.19kb.
- Современные подходы к диагностике и лечению аденом гипофиза и других образований хиазмально-селлярной, 225.66kb.
- Врезультате проведенной работы конференция приняла следующее решение: Тромбозы и геморрагии, 35.92kb.
- Современные аспекты хирургического лечения ибс, 84.02kb.
На правах рукописи
РОМАЩЕНКО Павел Николаевич
СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И
ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ ХРОМАФФИННЫХ ОПУХОЛЕЙ
14.00.27 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург
2007
Работа выполнена в Военно-медицинской академии имени С.М. Кирова
Научный консультант:
член-корреспондент РАМН
доктор медицинских наук профессор
МАЙСТРЕНКО Николай Анатольевич
Официальные оппоненты:
член-корреспондент РАМН
доктор медицинских наук профессор
ПОТАШОВ Лев Васильевич
доктор медицинских наук профессор
РОМАНЧИШЕН Анатолий Филиппович
доктор медицинских наук профессор
БЕРШТЕЙН Лев Михайлович
Ведущая организация – ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Росздрава»
Защита состоится 24 декабря 2007 года в 14 часов на заседании диссертационного совета Д 215.002.10 при Военно-медицинской академии имени С.М. Кирова (194044, Санкт-Петербург, ул. Академика Лебедева, д. 6).
С диссертацией можно ознакомиться в фундаментальной библиотеке
Военно-медицинской академии имени С.М. Кирова.
Автореферат разослан «___» сентября 2007 года
УЧЕНЫЙ СЕКРЕТАРЬ ДИССЕРТАЦИОННОГО СОВЕТА
доктор медицинских наук профессор
ДУЛАЕВ Александр Кайсинович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Повышенный интерес хирургов и эндокринологов к лечению пациентов с хромаффинными опухолями обусловлен как увеличением их числа в связи с совершенствованием лабораторно-инструментальных методов диагностики, так и отсутствием единых подходов в терминологии, классификации, обследовании и лечении таких больных [Дедов И.И. и соавт., 2003; Solcia E. et al., 2000]. Разнообразие клинических вариантов, а также недостаточная осведомленность практических врачей по различным аспектам хромаффином приводят к их несвоевременной диагностике и, нередко, к неоправданно длительному консервативному лечению [Ветшев П.С. и соавт., 2001; Шустов С.Б. и соавт., 1997; Manger W.M., Gifford R.W., 2002].
Весьма различны сведения о популяционной частоте: от 0,5–2 до 10 больных на 100 000 человек [Кушаковский М.С., 1995; Калинин А.П. и соавт., 1998; Doherty G.M., Skogseid B., 2001], а, по данным Gauer J.M. et al. (1988), на 100 000 аутопсий феохромоцитома выявляется в 20–150 наблюдениях. В то же время эпидемиологические исследования оценивают ежегодную заболеваемость хромаффиномой лишь от 0,8 на 100 000 человек до 1,5–2,1 на 1 000 000 [Schwartz A.E. et al., 2004].
Достаточно серьезные основания позволяют считать, что хромаффинные опухоли встречаются значительно чаще, чем указано выше. Так, по данным некоторых исследователей, симптоматическая артериальная гипертензия (АГ) встречается у 23% больных с высокими цифрами АД, при этом в 10% случаев ее развитие обусловлено эндокринными причинами [Баранов В.Г., Нечай А.И., 1988; Шустов С.Б. и соавт., 1997; Dugas G., Fuller J., Singh S. et al., 2004]. Американские исследователи утверждают, что, несмотря на совершенствование методов диагностики, приблизительно у 1/3 больных хромаффиномой при жизни установить диагноз этого заболевания не представляется возможным [Bravo E.L., 1994]. Так, только в США ежегодно умирает около 800 человек в результате осложнений, развившихся вследствие гиперкатехоламинемии при хромаффиноме [Schwartz A.E. et al., 2004]. Если учесть, что повышение АД наблюдается примерно у 30–40% взрослого населения РФ, то таких больных действительно должно быть значительно больше [Шустов С.Б. и соавт., 1997].
Несмотря на сравнительную редкость хромаффинных образований, социальная значимость проблемы обусловлена развитием АГ у людей в наиболее трудоспособном возрасте (30–50 лет), чаще у женщин, когда на фоне ее злокачественного течения часто отмечаются тяжелые, если не смертельные, сосудистые осложнения в бассейне сердечных и/или мозговых артерий [Schwartz A.E. et al., 2004].
Благодаря современным методам лучевой и лабораторной диагностики в последние годы участилось выявление больных с «немыми» хромаффиномами надпочечников до развития типичных клинических проявлений и тяжелых гемодинамических нарушений [Щетинин В.В. и соавт., 2002; Ветшев П.С. и соавт., 2004; Дедов И.И. и соавт., 2005; Mena A. et al., 1997]. Однако многообразие современных лабораторных и лучевых методов обследования при подозрении на хромаффиному надпочечниковой и вненадпочечниковой локализации порой ставят клинициста в тупик – какому методу обследования отдавать предпочтение и насколько ему доверять?
Разночтение программ предоперационной подготовки и анестезиологического пособия различными исследователями диктует необходимость поиска эффективных фармакологических препаратов для коррекции АГ и гемодинамических нарушений, особенно во время оперативного вмешательства и в раннем послеоперационном периоде [Бельцевич Д.Г., 2003; Лысенко М.А., 2003; Бондаренко В.О. и соавт., 2003; Неймарк М.И., Калинин А.П., 2004].
Оперативные вмешательства при хромаффиноме представляют значительные трудности в связи с особенностями надпочечникового и вненадпочечникового топографо-анатомического расположения, риском развития неуправляемой гемодинамики при их удалении, которые обусловливают развитие большого числа осложнений [Ветшев П.С. и соавт., 2003; Дедов И.И. и соавт., 2003; Naito S. еt al., 1995; Castilho L.N. et al., 2003]. Поэтому выбор малотравматичного доступа и отработка технических аспектов удаления хромаффиномы нередко определяет исход оперативного лечения [Трофимов В.М. и соавт., 1992; Майстренко Н.А. и соавт., 1996; Романчишен А.Ф. и соавт., 2000; Gagner M. et al., 1992; Kaouk J.H. et al., 2002].
Эффективность оперативного лечения больных хромаффиномой зависит от наличия признаков малигнизации удаленной опухоли и ее метастазирования на момент операции, а также в отдаленном периоде. Данные о частоте малигнизации хромаффином колеблются от 2 до 40%, что связано с использованием различных оценочных критериев, однако они не всегда обеспечивают достоверный прогноз исхода заболевания [Дедов И.И. и соавт., 2003; Берштейн Л.М., 2004; Doherty G.M., Skogseid B., 2000; Schwartz A.E. et al., 2004], что требует выделения достоверных критериев прогноза метастазирования или рецидивирования злокачественной хромаффиномы.
Наконец, до настоящего времени недостаточно изучены причины сохранения или рецидивирования АГ (до 22,9–40% оперированных) после удаления хромаффиномы и пути ее коррекции [Поташов Л.В. и соавт., 1993; Борисов А.Е. и соавт., 1998; Шустов С.Б., Баранов В.Л., 2002; Doherty G.M., Skogseid B., 2001]. Наряду с этим оценка отдаленных результатов не может ограничиваться только лишь изучением объективных сведений о больных, а в соответствии с современными требованиями должна обязательно дополняться исследованием качества жизни прооперированных. Такой подход позволяет адекватно оценивать эффективность применяемых способов хирургического лечения [Fletcher A. et al., 2002; Shumaker S.A., Naughton M.J., 2005].
Таким образом, несмотря на накопленный опыт лечения больных с хромаффинными опухолями, остается немало спорных, нерешенных вопросов в их диагностике и хирургическом лечении.
Цель исследования. Определить целесообразность комплексного использования современных методов диагностики и обосновать рациональную программу хирургического лечения больных с хромаффинными опухолями, позволяющую улучшить результаты оперативных вмешательств и качество жизни пациентов.
Задачи исследования:
1. Выделить основные варианты клинического течения хромаффином для определения диагностической программы, выбора адекватной предоперационной подготовки и методики оперативного вмешательства.
2. Оценить чувствительность современных лабораторных и инструментальных методов исследования при хромаффиномах и разработать рациональный алгоритм обследования больных, определяющий хирургические подходы.
3. Определить современные возможности морфологической диагностики хромаффинных опухолей и выделить значимые гистологические и иммуногистохимические критерии, обеспечивающие прогнозирование исходов лечения злокачественных новообразований у больных после их удаления.
4. Сформулировать показания и принципы индивидуализированной, патогенетически обоснованной, предоперационной подготовки больных с хромаффинными опухолями.с учетом ть.ю НИЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ БОЛЬНЫХ
5. Обосновать варианты операций на основе выбора рациональных хирургических доступов у больных с хромаффинными новообразованиями различной локализации.
6. Выявить причины сохранения АГ после хирургического лечения хромаффинных опухолей и определить пути ее коррекции.
7. Оценить отдаленные результаты оперативных вмешательств, в том числе качество жизни больных, при доброкачественных и злокачественных хромаффиномах.
Научная новизна. В рамках одного исследования, на достаточном числе клинических наблюдений (152), разработан комплексный подход к выявлению и определению программы лечения больных с хромаффинными опухолями при использовании современных методов инструментальной и лабораторной диагностики и осуществлена оценка их эффективности. Установлено, что повышение катехоламинов в моче или метанефрина и норметанефрина в крови в сочетании с высокой плотностью опухоли по данным компьютерной томографии (КТ), активно накапливающей введенный контрастный препарат, являются достоверными диагностическими маркерами хромаффинной опухоли.
Уточнены показания к выполнению и определены места в диагностическом алгоритме сцинтиграфических, ангиографических, флебографических и пункционно-биопсийных методов диагностики хромаффинных новообразований, особенно оценки функциональной активности и выработки оптимальной хирургической тактики лечения «немых» хромаффином.
Установлено, что проведение сцинтиграфии с метайодбензилгуанидином, меченным 123I, в виде однофотонной эмиссионной компьютерной томографии является высокоинформативным методом диагностики вненадпочечниковых хромаффином, «немой» и метастазирующей хромаффиномы с топической локализацией опухолевого поражения, которая не уступает по своей чувствительности и специфичности позитронно-эмиссионной компьютерной томографии (ПЭТ) с 18-фтордезоксиглюкозой.
На основании оригинальных клинико-морфологических сопоставлений определены критерии, позволяющие прогнозировать метастазирование или рецидивирование злокачественной хромаффиномы у больных после ее удаления и планировать им адъювантную химиотерапию и лечение радиоактивным метайодбензилгуанидином, меченным 123I, вызывающим деструкцию опухолевой хромаффинной ткани.
Уточнены и детализированы показания и варианты патогенетически обоснованной предоперационной подготовки у больных с хромаффинными опухолями с учетом характера АГ, снижения резервных возможностей сердечно-сосудистой и дыхательной систем. Уточнены прогностические критерии развития острого отека легких во время операции или в раннем послеоперационном периоде вследствие острой левожелудочковой недостаточности на фоне катехоламинового криза.
Детально разработаны показания и противопоказания к проведению эндовидеохирургических и открытых оперативных вмешательств, модифицированы варианты их выполнения применительно к удалению хромаффинных опухолей, позволяющие свести частоту интра- и послеоперационных осложнений, а также летальность к минимуму.
Установлены основные причины сохранения АГ после хирургического лечения хромаффинных опухолей и разработана оригинальная математическая модель ее прогнозирования, а также определены пути ее коррекции.
Дана оценка качества жизни больных после удаления хромаффинной опухоли с учетом реализации программы индивидуализированного подхода.
Практическая значимость. Разработан, апробирован и внедрен в широкую клиническую практику рациональный диагностический алгоритм на основе оценки чувствительности современных лабораторных и инструментальных методов исследования при хромаффиномах различной локализации с уточнением показаний к выполнению сцинтиграфических и ангиографических методик, пункционной биопсии, интраоперационного УЗИ, показавший свою высокую эффективность использования.
Определены показания и варианты предоперационной подготовки и интенсивной послеоперационной терапии с учетом характера АГ, эндокринных и метаболических нарушений, выраженности проявлений сердечно-легочной недостаточности у больных с хромаффинными опухолями.
Сформулированы критерии отбора больных для проведения эндовидео-хирургических и открытых операций при хромаффинных опухолях на основании изучения результатов оперативных вмешательств. Определены основные оперативные варианты хирургических вмешательств, модифицированы и внедрены в клиническую практику методические аспекты эндовидеохирургических вмешательств.
Установлены достоверные гистологические и иммуногистохимические критерии, обеспечивающие прогнозирование исходов злокачественной хромаффиномы у больных после ее удаления, и определена программа их лечения в послеоперационный период. Обоснованное использование лечебно-диагностических подходов обеспечило хорошие результаты хирургического лечения с минимизацией летальных исходов и послеоперационных осложнений и высокое качество жизни пациентов в ближайшие и отдаленные сроки наблюдения.
Основные положения, выносимые на защиту:
1. Современные возможности инструментальной и лабораторной диагностики при комплексном их использовании позволяют эффективно выявлять хромаффинные опухоли надпочечниковой и вненадпочечниковой локализации, нередко еще до развития типичных клинических проявлений и осложнений, а также обосновать программу индивидуального хирургического лечения.
2. Пациенты с пароксизмальной и смешанной формами АГ требуют проведения дифференцированной, патогенетически обоснованной предоперационной подготовки, направленной на компенсацию сердечно-сосудистых, дыхательных и метаболических нарушений.
3. Современные подходы диагностики и лечения требуют рационального использования открытых и закрытых доступов для удаления хромаффинных опухолей. Лапаротомия показана при вненадпочечниковой локализации хромаффиномы в забрюшинном пространстве или брюшной полости, а также двусторонней локализации в надпочечниках. Торакофренотомия обоснована при размере опухоли более 5 см в диаметре и признаках злокачественного роста.
4. Эндовидеохирургические вмешательства на надпочечниках показаны при размере хромаффиномы менее 5 см в диаметре, отсутствии признаков ее озлокачествления и выраженных гемодинамических нарушений. При локализации хромаффиномы в правом надпочечнике оправдана лапароскопическая адреналэктомия, в левом – ретроперитонеоскопическая.
5. Комплексная морфологическая диагностика, включающая оценку хромаффином по шкале PASS и иммуногистохимические исследования с использованием моноклональных антител (Ki-67, белок S-100, тенасцин, CD34), позволяет выявить достоверные диагностические критерии злокачественности и прогноза исхода заболевания.
6. Рациональное использование современного диагностического и лечебного алгоритмов обеспечивает снижение количества интра- и послеоперационных осложнений, процента летальности и повышает качество жизни непосредственно после операции и в отдаленный период.
Апробация работы. Основные положения диссертации доложены на IV Всероссийском конгрессе эндокринологов «Актуальные проблемы современной эндокринологии» (СПб., 2001); Всероссийской научной конференции «Теория и практика прикладных анатомических исследований в хирургии» (СПб., 2001); XX съезде хирургов Украины (Тернополь, 2002); на 2132-м (СПб., 1998), 2143-м (СПб., 1999), 2204-м (СПб., 2003) и 2273-м (СПб., 2007) заседаниях хирургического общества Пирогова; 12-м (Смоленск, 2002), 13-м (СПб., 2003), 14-м (Ярославль, 2004), 15-м (Рязань, 2005), 16-м (Саранск, 2007) Российских симпозиумах по хирургической эндокринологии «Современные аспекты хирургической эндокринологии»; Невском радиологическом форуме «Из будущего в настоящее» (СПб., 2003); Всероссийской научно-практической конференции «Клиническая эндокринология – достижения и перспективы», посвященной 80-летию со дня рождения проф. Д.Я. Шурыгина (СПб., 2003); VII Всероссийской научно-практической конференции «Актуальные вопросы клиники, диагностики и лечения больных в многопрофильном лечебном учреждении (СПб., 2005); Юбилейной конференции, посвященной 60-летию Санкт-Петербургского государственного учреждения здравоохранения и городского клинического онкологического диспансера (СПб., 2006); of IX International euroasian congress of surgery and gastroenterology (Baku, 2006); Пятом Всероссийском конгрессе эндокринологов «Высокие медицинские технологии в эндокринологии» (М., 2006); I Украинско-Российском симпозиуме по эндокринной хирургии с международным участием (Киев, 2006); съезде эндокринологов Северо-Запада (СПб., 2007); II научной конференции «Клиническая морфология новообразований эндокринных желез» (М., 2007).
Реализация работы. Результаты исследования используются в материалах отечественных руководств и лекций для врачей, а также при проведении занятий с курсантами факультета подготовки врачей и со слушателями академических курсов и факультета усовершенствования врачей ВМедА и других ВУЗов России и СНГ. Полученные данные внедрены в клиническую практику клиники факультетской хирургии Военно-медицинской академии, Ленинградской областной клинической больницы и других учреждений страны.
Публикации. По материалам диссертации опубликовано 47 печатных работ, из них в соавторстве 3 монографии, 3 руководства, 11 журнальных статей, 1 изобретение, выданы удостоверения на 7 рационализаторских предложений.
Структура и объем диссертации. Диссертация изложена на 342 страницах машинописного текста, состоит из введения, 7 глав, заключения, выводов, практических рекомендаций, указателя литературы и приложений. Текст иллюстрирован 30 таблицами, 8 схемами и 121 рисунком. В указателе литературы приведены 283 работы, из них 119 отечественных и 164 иностранных авторов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведен анализ результатов обследования и лечения с использованием новых технологий 152 больных с хромаффинными опухолями, находившимися в клинике факультетской (абдоминальной) хирургии им. С.П.Федорова ВМедА и ее клинических базах (ЛОКБ, 442 ОВКГ) в период с 1954 по 2007 год. При распределении больных использовали Международную статистическую классификацию болезней и проблем, связанных со здоровьем человека (10 пересмотр, 1995), учитывающую обобщенные сведения о наличии надпочечниковой и вненадпочечниковой хромаффиномы (рис.1). Хромаффинные опухоли преимущественно располагались в надпочечниках – у 141 (92,8%) больного, чаще в правом надпочечнике – у 78 (51,3%). Двустороннее поражение надпочечников отмечено у 5 (3,3%) больных. Вненадпочечниковая хромаффинома отмечалась у 11 (7,2%) больных. Множественная эндокринная неоплазия установлена у 2 (1,3%) больных в виде синдрома Горлинга (МЭН 2В), что указывало на генетическую обусловленность заболевания.
Возраст больных на момент проведения операции колебался от 15 до 79 лет, составив в среднем 40±4,7 лет. Большинство пациентов – 126 человек (82,9%) – находилось в активном (в трудовом отношении) возрасте от 20 до 59 лет. Больные пожилого (более 60 лет) и юношеского возраста (до 19 лет) соответственно составили – 18 (11,8%) и 8 (5,3%) человек. Среди обследованных больных преобладали женщины – 94 человека (61,8%).
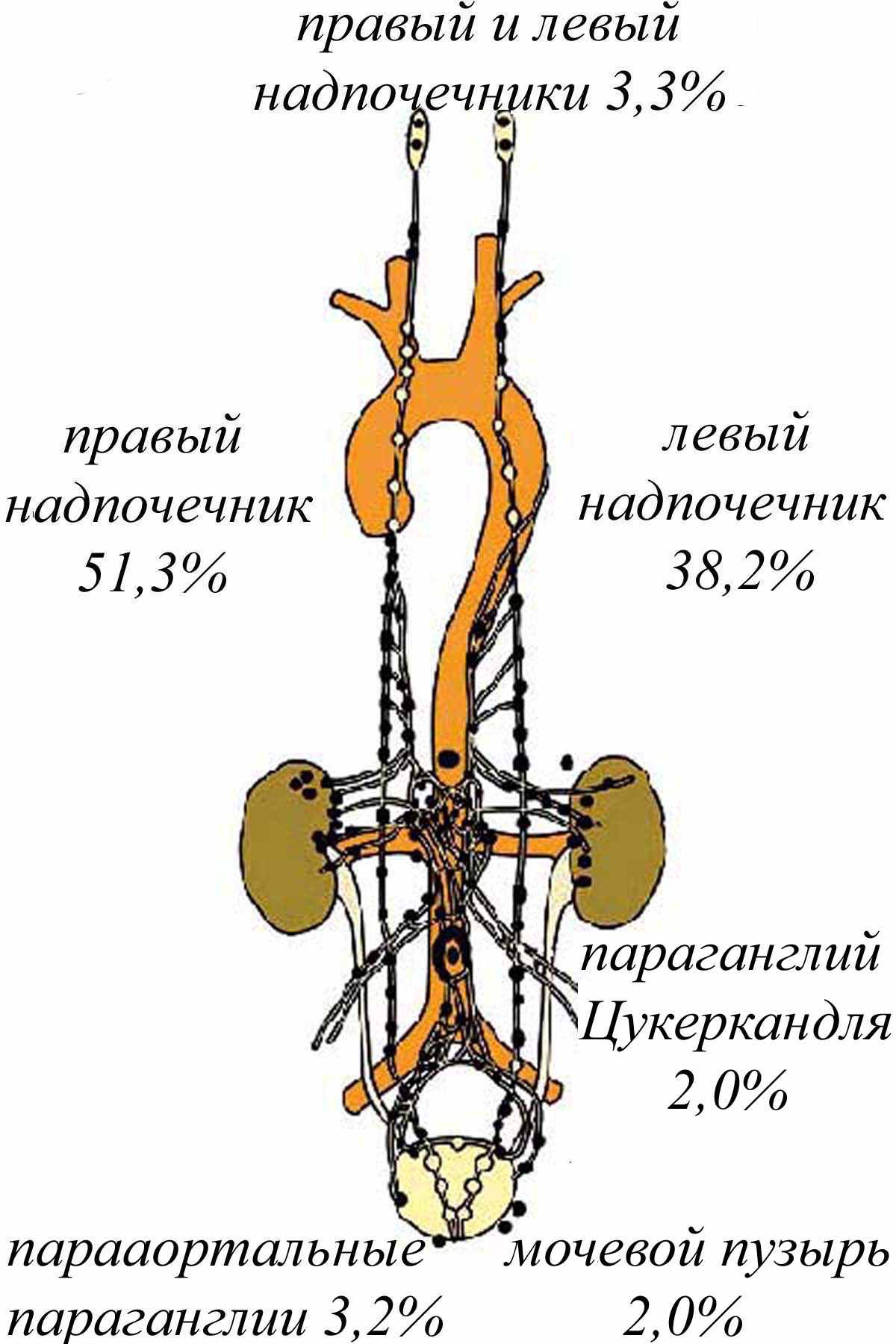         |
| Рис.1. Частота и локализация хромаффином. |
Учитывая характер клинических особенностей у больных хромаффиномой, нами выделены основные варианты течения заболевания: 1) с пароксизмальной формой АГ – 81 человек (53,3%); 2) со смешанной формой АГ – 56 (36,8%); 3) с нормальным АД – 15 (9,9%).
Вместе с тем, несмотря на типичные проявления хромаффиномы у 113 (82,5%) из 137 больных с повышенным АД, сроки заболевания составили от 2 до 30 лет. Средняя длительность заболевания у больных со смешанной формой АГ была большей – 6,942,66 лет, чем у пациентов с пароксизмальной – 4,302,11 лет. Эти больные наблюдались и лечились у терапевтов по месту жительства с диагнозами гипертоническая болезнь, ИБС, нейроциркуляторная дистония – без выполнения дифференциально-диагностической программы.
Повышенное АД и гиперкатехоламинемия у 137 (90,1%) из 152 больных с хромаффиномой приводили к развитию тяжелых гемодинамических нарушений и осложнений со стороны органов и систем, которые отмечались в количестве от одного до трех: острое нарушение мозгового кровообращения по геморрагическому типу в 10,2% случаев; острый инфаркт миокарда – 5,1%; сердечная недостаточность по NYHA II класса – 22,6%, III – 51,7%, IV – 14,6%; ангиоретинопатия – 11,7% и другие. С учетом характера осложнений АГ и наличия сопутствующих заболеваний больные хромаффиномой были отнесены в соответствии с классификацией Американской ассоциации анестезиологов (ASA): к I-II классу – 11,2%, III – 22,4%, IV – 66,4%.
Оперативные вмешательства выполнены 151 больному из 152 обследованных (один пациент умер до операции в связи с развившимся острым нарушением мозгового кровообращения на фоне некупируемого катехоламинового криза). У 5 пациентов по поводу двусторонней хромаффиномы выполнено две операции, следовательно, у 151 пациента с хромаффинными опухолями выполнено 156 оперативных вмешательств различными доступами (табл. 1).
Таблица 1
Оперативные доступы,
применявшиеся у больных хромаффиномой
| Оперативные доступы | Частота применения | |
| абс. | % | |
| Торакофренотомия в Х межреберье | 71 | 45,5 |
| Люмботомия | 40 | 25,6 |
| Лапаротомия | 17 | 10,9 |
| Лапароскопический | 17 | 10,9 |
| Ретроперитонеоскопический | 10 | 6,4 |
| Торакоскопический трансдиафрагмальный | 1 | 0,7 |
Всем больным с хромаффинными опухолями проводилось исследование экскреции адреналина, норадреналина и ванилилминдальной кислоты с суточной мочой флюориметрическим методом Эйлера–Лишайко в модификации Э.Ш. Матлиной (1967) и в иммуноферментном анализе. Определение уровня катехоламинов крови и их предшественников осуществляли иммуноферментным анализом с использованием тест-системы Cat Combi ELISA (Germany) [Ito Y., Obara T., Okamoto T. et al., 1998].
Свободные метанефрины и норметанефрины в моче и плазме крови изучены в иммуноферментном анализе с использованием тест-системы Met Combi ELISE (Urine) и Met Combi (Nephrines) Plasma ELISA (Germany) [Eisenhofer G., 1998].
Для дифференциальной диагностики с другими гормонально-активными опухолями надпочечников исследовалась экскреция с мочой 17-ОКС и 17-КС, в крови определялся уровень АКТГ, кортизола, альдостерона, ренина методами, опубликованными в литературе [Тиц Н.У., 1986]. Уровни гормонов коры надпочечников и их предшественников в крови у части больных определяли с помощью метода высокоэффективной жидкостной хроматографии [Великанова Л.И. и соавт., 2001].
УЗИ осуществляли на сонографе Sonoline Elegra фирмы Simens (Germany) с использованием линейных, секторных и конвексных датчиков 3.5 и 5 MHz. Подготовку к сканированию и само исследование проводили по общепринятой методике [Демидов В.Н., 1981].
КТ выполняли с целью топического выявления хромаффиномы на установках Volume Zoom и Somatom фирмы Simens (Germany) со спиральным ходом трубки и возможностью использования повторных реконструкций изображения из «сырых» данных в различных цифровых режимах (MPR, 3D SSD, MIP и т.д.) [Черемисин В.М. и соавт., 1996]. Изучалась компьютерная плотность и структура образований надпочечников и забрюшинного пространства, а также изменение этих показателей после внутривенного введения контрастного препарата «омнипак». С получением данных дальнейший анализ изображений осуществляли по различным программам графической станции «Sienet magic View» [Пчелин И.Г. и соавт., 1998].
МРТ хромаффином надпочечниковой и вненадпочечниковой локализации проводили на аппарате Symphony 1,5 Т фирмы Simens (Germany) с получением изображений, взвешенных в режимах Т1 и Т2 в стандартных аксиальной и фронтальной проекциях с толщиной срезов 5–6 мм [Правосудов В.В. и соавт., 2003].
Обязательным исследованием при неясной локализации опухоли, «немой» хромаффиноме и подозрении на метастазирование злокачественной хромаффинной опухоли была сцинтиграфия всего тела с метайодбензилгуанидином, меченным 123 I (МИБГ-123I). Исследование проводили на совмещенном аппарате, включающем в одном устройстве однофотонный эмиссионный и рентгеновский компьютерный томограф (ОФЭКТ). Для получения объективной информации сцинтиграфического исследования придерживались строго определенной методики [Ozer S. et al., 2004].
Позитронно-эмиссионная томография одномоментно со спиральной компьютерной томографией выполнена у пяти больных на ПЭТ/СКТ сканере «Biograph» фирмы Simens (Germany), объединяющем позитронно-эмиссионный томограф Somatom Emotion Duo и спиральный компьютерный томограф Ecat Exact HR. В качестве радиофармпрепарата применяли 2-дезоксиглюкозу, «меченную» изотопом 18-фтордезоксиглюкозы [Eriksson B. et al., 2002].
Диагностические и лечебные внутрисосудистые вмешательства выполнены в рентгеноперационной ЛОКБ, оснащенной установкой «Integris V 3000» фирмы Philips (Holland) совместно с д.мед.н. В.К. Рыжковым.
Пункционная трепанационная биопсия опухоли надпочечника под контролем УЗИ выполнялась только при подозрении на «немую» хромаффиному или при дифференциальной диагностике с злокачественной опухолью, когда неинвазивные методы исследования оказывались неинформативными. Для выполнения исследования использовали аппарат Sonoline Omnia фирмы Simens (Germany) с пункционной насадкой на линейный датчик 3,5 мГц и специальный биопсийный инструмент (в виде пистолета) для автоматического забора ткани опухоли для гистологического исследования фирмы MDTECH® (USA).
Показатели центрального кровообращения оценивались с помощью интегральной реографии тела (ИРГТ) реоанализатором «Диамант» (Россия) по методу М.И. Тищенко (1973).
Суточное изучение АД и Холтеровское мониторирование сердечного ритма проводилось с использованием диагностических компьютерных систем: GEMS IT CardioSoft V4.2 (Italy) и Holter ECG Report (England).
Оценку механической функции левого желудочка и параметров гемодинамики проводили с использованием стандартной методики в режимах одномерного (М-ЭхоКГ) и секторального сканирования (двухмерная ЭхоКГ) на приборе SIM-5000 (Italy).
Интраоперационный мониторинг сердечно-сосудистой и дыхательной систем осуществлялся за счет установки в лучевую артерию измерительного катетера «Arterofix» B.Braun диаметром 20G для инвазивной регистрации АД на мониторе «Simens SC 7000» в режиме реального времени или датчика с использованием аппарата «Piccoplus» (Germany), обеспечивающего непрерывную регистрацию сердечного выброса, АД, ЧСС, минутного объема кровообращения, ударного объема кровообращения, общего периферического сопротивления.
Для выполнения эндовидеовмешательств при хромаффиномах использовали стандартный лапароскопический комплекс фирмы «KARL STORZ» (Germany).
Все удаленные хромаффинные опухоли подвергнуты гистологическому исследованию с изготовлением серии микропрепаратов под руководством патоморфолога кафедры к.мед.н. С.А. Калашникова. При морфологическом типировании хромаффином руководствовались современной Международной гистологической классификацией эндокринных опухолей [Solcia E. et al., 2000; ВОЗ, Лион, 2004].
Комплексные морфологические и иммуногистохимические исследования хромаффином выполнены и проанализированы совместно с д.мед.н. профессором Г.А. Поляковой и д.биол.н. Л.Е. Гуревич (зав. лабораторией – д.мед.н. профессор И.А. Казанцева) в патологоанатомическом отделении МОНИКИ им. М.Ф. Владимирского. Иммуногистохимическое изучение проводили пероксидазно-антипероксидазным методом с применением антител фирм «DAKO» (Denmark) и «Novocastra» (England). Использовали антитела к синаптофизину и хромогранину А (маркеры нейроэндокринной дифференцировки), протеину S-100 (маркер клеток периферических нервов и сустентакулярных, поддерживающих клеток), Ki-67 (клон MIB-1) (протеин ядер пролиферирующих клеток), тенасцину (протеин экстрацеллюлярного матрикса), CD34 (маркер эндотелия сосудов).
Изучение отдаленных результатов проводилось путем изучения катамнезов, анкет стационарного и личного амбулаторного обследования больных после удаления хромаффиномы. Качество жизни оперированных пациентов оценивали с помощью опросника SF-36 [Ware J.E., 1993].
Содержащиеся в анкетах исследований количественные данные были подвергнуты вариационно-статистической обработке на IBM-совместимом персональном компьютере серии CPU INTEL Pentium III ATHLON 1500+ с помощью программы STATISTICA for Windows. Применялись методы статистического описания переменных, корреляционного, регрессионного, дисперсионного и дискриминантного анализа. Достоверность различий переменных в выборках оценивали по Т-критериям Стьюдента и Фишера (достоверным считали различие при р<0,05 и f<0,05) [Кувакин В.И., 1993]. Для каждого диагностического метода рассчитывали чувствительность, т.е. способность метода устанавливать наличие изменений, когда они есть [Двойрин В.В., Клименков А.А., 1985].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Особенности клинических проявлений хромаффином. Установлено, что клинические признаки пароксизмальной у 81 (53,3%) больного и смешанной – у 56 (36,8%) форм АГ в сочетании с определенными нейровегетативными проявлениями (головная боль, потливость, сердцебиение, слабость, повышение температуры тела, выраженные изменения окраски кожи и слизистых, тремор, полиурия после купирования приступа) являются достаточными критериями для включения больных в группу риска хромаффинной опухоли.
Наибольшие трудности диагностики составили 15 (9,9%) больных хромаффинными опухолями, у которых АД было нормальным или не превышало 140/90 мм рт.ст. Основанием для обращения к врачу 10 из 15 больных явились жалобы, как правило, на головную боль, слабость, сердцебиение, бледность кожного покрова, боль в животе или поясничной области. У других 5 пациентов хромаффинома в надпочечнике стала случайной находкой при обследовании по поводу заболеваний почек и позвоночника.
Трудности дооперационной диагностики хромаффином без АГ диктовали необходимость поиска современных лабораторно-инструментальных маркеров хромаффинных опухолей, особенно «немых». Важность доказательства опухоли до операции обусловлена решением вопроса о необходимости предоперационной подготовки и обоснованного выбора варианта оперативного вмешательства.
