Учебно-методическое пособие Минск 2007 удк 616-053. 2-097(075. 8)
| Вид материала | Учебно-методическое пособие |
- Учебно методическое пособие Минск 2007 удк 616. 16 002. 151 053. 1 (075., 476.7kb.
- Учебно-методическое пособие Минск бгму 2010 удк 616-092. 19-097 (075., 705.49kb.
- Учебно методическое пособие Минск 2006 удк 616. 42-006. 441-053. 2(075., 1819.29kb.
- Учебно-методическое пособие Минск, Белмапо 2007 удк 616. 9: 579. 845] 053. 2-036-07-08-084, 782.51kb.
- Учебно-методическое пособие минск 2006 г. Удк 616-053. 2/. 6-084-08(075., 769.65kb.
- Учебно методическое пособие Минск 2004 удк 616. 15 053. 2: 362. 147, 619.1kb.
- Учебно-методическое пособие Минск 2009 удк 616. 24(075., 960.79kb.
- Учебно-методическое пособие Минск 2009 удк 618. 19-006. 03 (075. 9) Ббк 57. 15я73, 956.31kb.
- Учебное пособие Тверь, 2007 удк 616-053. 5-084 (613. 955) ббк 51., 7388.84kb.
- Пособие для врачей Минск, 2006 удк 616. 8-053. 2(476), 404.21kb.
ОСОБЕНнОСТИ ВНУТРИУТРОБНЫХ ИНФЕКЦИЙ
И ИНФЕКЦИЙ ПЕРВОГО ГОДА ЖИЗНИ
Гистопатологические изменения органов при внутриутробных вирусных инфекциях показывают, что эмбрион человека на ранних стадиях формирования характеризуется исключительной чувствительностью к вирусной инфекции и ее деструктивным эффектам. Этот феномен объясняется множеством факторов:
- быстро делящиеся и метаболически высокоактивные клетки эмбриона представляют идеальную среду для репликации вирусов;
- клетки незрелого плода более восприимчивы к вирусам, чем зрелого;
- противоинфекционные защитные механизмы эмбриона и плода в совокупности не развиты;
4) первичные и вторичные лимфоидные органы значительной части плодов отстают в росте и дифференциации;
5) неспецифические механизмы защиты и эффективная регуляция специфического иммунного ответа отстают в развитии и недейственны.
В результате вирусной инфекции в органах выявляются типичные гистопатологические изменения. Они проявляются: а) интенсивной репликацией вирусов в тканях у места входных ворот; б) отсутствием тканевого и органного тропизма, т. е. диссеминацией вируса в большинство органов; в) персистенцией вирусов в клетках-мишенях, формированием персистенции и хронического течения инфекции; г) отсутствием выраженной воспалительной реакции, характерной для инфекций постнатального периода; д) формированием первичных и вторичных эффектов (гибель клеток, ингибиции митоза, синтеза интерферонов, токсическая деструкция); е) интенсивной экскрецией вируса выделительными системами организма.
На возникновение и течение внутриутробных инфекций указывает:
а) высокая частота выявления микробспецифических антител у беременных;
б) частота возникновения инфекции у женщин на разных стадиях беременности;
в) соотношение числа клинических и бессимптомных случаев инфекции при рождении и среди новорожденных;
г) наличие тератогенного эффекта и генетических врожденных дефектов после перенесения вирусной инфекции.
Наиболее распространенными внутриутробными вирусными инфекциями являются краснуха, герпес-вирусная инфекция 1, 2, 3 и 5-го типов, корь, гепатит В, лимфоцитарный хорионменингит (ЛХМ), ВИЧ-инфекция, эпидемический паротит.
Врожденные бактериальные инфекции наиболее часто вызываются гонококками, трепонемами, стрептококками, стафилококками, листериями, хламидиями, микоплазмами, уреаплазмами, микобактериями.
Среди инфекций, вызываемых простейшими, наиболее часто выявляется токсоплазмоз.
У новорожденных детей присоединяется еще ряд кишечных вирусных инфекций (рота-, адено-, коксаки-, экхо-, астро-, полиовирусная), а также респираторно-сентициальная и другие. К данным патогенам отмечается повышенная восприимчивость организма новорожденных. Эти инфекции, соответственно, имеют наиболее широкое распространение во всем мире.
Таким образом, эмбриональный период развития иммунной системы индивидуума характеризуется формированием и созреванием основных звеньев неспецифического (фагоцитарные клетки — микро- и макрофаги, система комплемента, цитокины, естественные киллеры и другие факторы) и адаптивного (В- и Т-системы лимфоцитов; биосинтез иммуноглобулинов (антител) и антигенспецифических рецепторов) иммунитета к встрече с еще неизвестными, но многочисленными факторами окружающей среды биологической или иной природы. Вместе с тем следует подчеркнуть, что иммунная система плода, ее системные и локальные механизмы к моменту рождения являются незрелыми, недостаточно эффективными и не имеющими опыта взаимодействия и организации многоуровневой защиты против опасных патогенов и других факторов агрессии. Второе важное обстоятельство заключается в том, что иммунная система новорожденного находится в состоянии непрерывного созревания, дифференцировки, обучения, совершенствования ее функции и накопления специфической иммунологической памяти о своих естественных врагах, является весьма уязвимой к воздействию факторов окружающей среды.
ФУНКЦИОНИРОВАНИЕ ИММУННОЙ СИСТЕМЫ
В ПОСТНАТАЛЬНОМ ПЕРИОДЕ
Здоровый ребенок, родившийся в срок от здоровой матери, имеет в достаточной мере сформированные центральные и периферические органы иммунной системы и обладает определенными гомеостатическими количественными и функциональными параметрами и резервами.
Лимфоидные органы детей раннего возраста реагируют выраженной гиперплазией на проникновение в организм патогенов, что сопровождается развитием ответной воспалительной реакции, увеличением объема и массы периферических лимфоидных органов — лимфатических узлов, аденоидов, селезенки.
Вместе с тем в период новорожденности велик риск инфицирования и агрессии в отношении ребенка со стороны всевозможных микроорганизмов. Организм новорожденного — весьма привлекательная среда для заселения и репродукции не только представителей нормальной микрофлоры, но и множества потенциально патогенных микробов.
Адаптация новорожденного к условиям окружающей среды является обязательным условием выживания. В разных регионах мира на популяцию детского населения воздействуют разные по характеру и интенсивности факторы: природные (климатические, ионизирующее и солнечное излучение, температура), антропогенные (химическое и микробное загрязнение воды и воздуха), социо-экономические (бедность, недостаточное и несбалансированное питание, некачественное медицинское обслуживание). Еще в XV веке, т. е. пять столетий тому назад, детская смертность составляла 300 на 1000 родившихся. С развитием медицинской науки, глобального здравоохранения, экономики стран она существенно снизилась и в развитых странах составляет 6–10 на 1000 родившихся. Однако ежегодно от инфекций и недостаточности питания в мире умирают более 5,0 млн детей.
Иммунобиология лактации
С точки зрения возможности противостояния организма новорожденных инфицированию, в биологическом плане важное значение имеет грудное вскармливание ребенка. В молочных железах матери происходит секреция иммуноглобулинов из сыворотки крови, а также локальный биосинтез антител, поэтому грудное молоко играет важную роль в обеспечении иммунологической защиты новорожденного. В первые 5 суток лактации секретируется молозиво, затем — транзиторное, или промежуточное, молоко, начиная с 15-го дня образуется зрелое молоко. Молозиво и молоко содержат все классы сывороточных иммуноглобулинов и секреторный IgA. Кроме того, в молоке содержатся белки системы комплемента, лактоферрин, лизоцим, цитокины (интерфероны и
интерлейкины), выявляются практически все типы иммунокомпетентных клеток — макрофаги, Т- и В-лимфоциты, а также жизнеспособные нейтрофилы и другие лейкоциты.
Клинические наблюдения указывают на положительную роль грудного молока для создания и поддержания пассивного естественного иммунитета в основных биотопах (желудочно-кишечном, бронхолегочном и урогенитальном) организма новорожденного. Вследствие этого, вскармливание детей грудью существенно снижает частоту кишечных и респираторных инфекций.
Содержание иммуноглобулинов А класса в молозиве женщин существенно выше, чем других классов. Более 90 % из них составляет секреторный иммуноглобулин А. Нейтрофилы, моноциты и макрофаги способны к фагоцитозу и умерщвлению бактерий, грибов, а также проявлению антителозависимой цитотоксичности. Макрофаги содержат внутриклеточно и продуцируют лизоцим, лактоферрин, компоненты комплемента, цитокины. В молоке содержатся эффекторные и регуляторные Т-лимфоциты, Т-клетки памяти. Все это облегчает возможность иммунной системы новорожденного отвечать на различные вирусные и бактериальные антигены. Эти клетки и продукты их активации стимулируют В-лимфоциты к биосинтезу специфических иммуноглобулинов А.
Молекулы и клетки иммунной системы матери, содержащиеся в молоке, восполняют незрелость иммунной системы новорожденного. Эта компенсация достигается поступлением антигенспецифических антител в желудочно-кишечный тракт новорожденного, а затем в респираторный тракт и другие области организма.
Грудное молоко содержит также огромное число неспецифических протективных факторов с разным механизмом антимикробного действия:
- полисахариды и гликопротеиды, предотвращающие адгезию патогенов (ротавирусы, ВИЧ, кишечная палочка, пневмококк, кампилобактер) к эпителию слизистой;
- лактоферрин (полипептид из 18 аминокислот), обладающий бактерицидной активностью;
- К-казеин, ингибирующий адгезию хеликобактера;
- лизоцим, обладающий бактериостатическим эффектом;
- жирные кислоты и моноглицериды, оказывающие литический эффект в отношении простейших, вирусов и бактерий;
- гормоны и ростовые факторы молока, способствующие созреванию желудочно-кишечного и респираторного тракта, снижают потенциальную инвазивность широко распространенных патогенов.
Установлена обратная зависимость между концентрацией в грудном молоке секреторного иммуноглобулина А и частотой высеваемости кишечной палочки из фекалий новорожденных. Секреторные антитела — IgA — грудного молока взаимодействуют с пневмококками, стрептококками, энтеровирусами, а также нейтрализуют эндо- и экзотоксины грамотрицательных бактерий.
КРИТИЧЕСКИЕ ПЕРИОДЫ РАЗВИТИЯ ИММУННОЙ СИСТЕМЫ
ДЕТСКОГО ОРГАНИЗМА
Критический период — этап развития и функционирования детского организма, характеризующийся наиболее низким уровнем защищенности, неэффективностью функции иммунной системы, необычайно высокой восприимчивостью к инфекции и сопряженный с нейрогуморальными, структурно-функциональными и/или геномическими перестройками организма в соответствии с возрастной стратегией развития. Отражением физиологических процессов развития иммунной системы детского организма является перестройка
миело- и лимфопоэза (рис. 3) в разные возрастные периоды жизни.
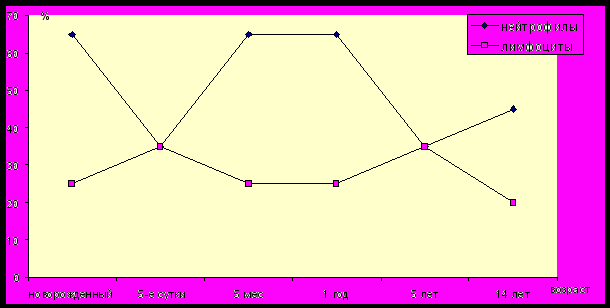

.
Рис. 3. Физиологические процессы миело- и лимфопоэза в разные возрастные
периоды развития детского организма
В период внутриутробного развития критическими считаются 8–12-я недели — время закладки основных структур иммунной системы, отлаживания механизмов дифференцировки клеток и органов иммунной системы плода.
В постнатальном развитии иммунной системы ребенка выделяют несколько таких периодов.
Первый период ассоциирован с новорожденностью и длится в среднем 25–35 дней. В это время отмечаются существенные изменения лейкоцитарной формулы: снижение количества клеток гранулоцитарного ряда и повышение лимфоцитарного пула клеток (абсолютный лимфоцитоз). При этом организм ребенка впервые подвергается атаке ранее незнакомых для иммунной системы многочисленных эндо- и экзогенных патогенов и их антигенов. Гуморальный и клеточный иммунитет, неспецифические факторы видового иммунитета в это время еще незрелы и малоэффективны. Пассивный материнский иммунитет варьирует и также относителен (у значительной части новорожденных материнские антитела отсутствуют или находятся на невысоком уровне). Именно в этот период отмечается наибольшая восприимчивость детей к патогенным и условно-патогенным микроорганизмам с развитием локальных (гнойно-воспалительных, респираторных, кишечных) и системных (бактериемия, сепсис) инфекций.
Второй период формируется между 3-м и 6-м месяцами жизни ребенка. Он обусловлен двумя факторами: а) постепенным ослаблением и исчезновением пассивного специфического материнского иммунитета; б) отставанием морфофункционального созревания иммунной системы некоторых детей. Этот период характеризуется слабыми возможностями для развития собственного гуморального и клеточного иммунного ответа, непродолжительной иммунологической памятью, развитием ненапряженного противоинфекционного активного естественного и искусственного иммунитета. При этом преимущественно формируется первичный иммунный ответ с синтезом низкоаффинных полиспецифических антител — IgM. Местный иммунитет также ослаблен. Для развития вторичного протективного иммунного ответа на детские вакцины против дифтерии, столбняка, коклюша, полиомиелита, кори требуется трехкратная иммунизация. Незрелость иммунной системы проявляется обычно повышенной чувствительностью таких детей к респираторным вирусным инфекциям (аденовирусам, вирусам гриппа и парагриппа, РСВ). К этому периоду среди новорожденных уже выявляются дети, характеризующиеся относительно более частым возникновением и длительным течением инфекций. Это своеобразный индикатор того, что у некоторых из них могут иметься определенные типы первичных генетических дефектов иммунной системы (преимущественно В-зависимых).
Синдром внезапной смерти. Особенностью перестройки иммунной системы детей этого периода является спонтанное возникновение у них синдрома внезапной смерти. Этот синдром является ведущей причиной летальности детей постнатального периода в развитых странах. Пик летальности приходится на возрастной промежуток между 1-й неделей и 1-м годом (наиболее часто возникает между 2-й неделей и 4-м месяцем) после рождения. Большинство случаев смерти приходится на зимний период. Синдром, как правило, возникает у детей с респираторной патологией, родившихся от курящих матерей. Смерть наступает внезапно во время сна в положении ничком. Возможные причины синдрома интенсивно исследуются. Предположительно этиологическими факторами являются измененная иммунологическая реактивность, инфекционные агенты респираторного тракта и их токсины. К инфекционным агентам, способствующим высокому риску развития синдрома внезапной смерти, относят возбудителей респираторной патологии преимущественно бактериальной природы: стафилококки, бордетеллы, Haemophilus influenzae, клостридии, кишечную палочку, хеликобактер и их токсины. Особую роль в генезе синдрома отводят экзотоксинам данных микроорганизмов, являющихся суперантигенами, вызывающими гиперстимуляцию Т-системы лимфоцитов, избыточную продукцию цитокинов. Гипрепродукция цитокинов IL-1, IL-6, TNF, а также высокий уровень IgE и повышенная функция Tх2 типа в связи с этим синдромом интенсивно обсуждаются.
Третий период проявляется на 2-м году жизни ребенка. На это время приходится важный физиологический переход формирования адаптивного иммунитета — созревание способности переключения изотипов иммуноглобулинов с IgM на IgG (вначале приобретается возможность синтеза IgG1, IgG3, а затем IgG2 и IgG4). В целом, системный и особенно местный иммунитет еще остаются недостаточно эффективными, сохраняется высокая восприимчивость к инфекциям. Это связано с недостаточностью регуляторной функции CD4+Tх1 типа, продукцией ИФН-, взаимодействия CD4+ Tх2 типа с В-лимфоцитами.
Четвертый период проявляется между 4-м и 6-м годами развития ребенка и связан со второй перестройкой в кроветворении и с изменением содержания основных типов форменных элементов. Следует отметить, что к этому возрасту у большинства детей иммунологические параметры уже близки к уровню взрослых. Иммунная система ребенка уже имеет достаточный персональный опыт по организации специфической противоинфекционной защиты от естественной локальной и системной инфекций, а также иммунного ответа на вакцинные препараты. К этому времени в популяции достаточно четко формируется группа часто и длительно болеющих респираторной патологией детей (ЧДБ). Частота респираторных инфекций в течение года может достигать 6–10 раз. Особенностью иммунной системы таких детей является сниженный уровень секреторного иммуноглобулина А или его селективный дефицит. У значительной части детей при этом отмечается повышение биосинтеза иммуноглобулинов Е, что является свидетельством доминирования функции CD4+ T-клеток Tх2 типа над субпопуляцией Tх1 типа. Для таких детей характерно более частое развитие атопических, паразитарных и иммунокомплексных процессов.
Пятый период в формировании иммунной системы ребенка приходится на подростковый возраст и обусловлен половой дифференциацией и процессами созревания организма. Начинается в возрасте 13–14 лет у мальчиков и 11–13 лет у девочек. Половые гормоны — андрогены и эстрогены — воздействуют на органы и клетки-мишени иммунной системы, стимулируют или ингибируют определенные субпопуляции, регуляторные и эффекторные механизмы. При этом отмечается снижение массы лимфоидных органов. Под действием андрогенов происходит подавление клеточного и стимуляция гуморального звена иммунитета. В этот период возможно формирование ряда иммунопатологических процессов, которые впоследствии могут способствовать формированию определенных иммунопатологических заболеваний. Базируются они на основе некоторых первичных или развившихся к этому времени вторичных иммунодефицитных состояний.
СИСТЕМА «МАТЬ–ПЛОД». ИММУНологическиЕ
ВЗАИМООТНОШЕНИЯ МАТЕРИ И ПЛОДА
Основная особенность беременности заключается в том, что плод по отношению к матери является генетически наполовину чужеродным организмом, который до положенного срока не отторгается. Аллогенность (чужеродность) плода заключается в том, что все клетки содержат гаплоидный набор ГКГС-антигенов не только матери, но и отца.
Особую опасность для клеток плода представляет иммунный ответ матери с развитием клонов Т-киллерных клеток (CD8+), специфичных к отцовским антигенам ГКГС I и II классов, ЕКК (CD16+ клетки) и цитотоксических антител против отцовских антигенов.
П
 оэтому с первых часов после зачатия и до момента родов развиваются супрессорные механизмы, которые не позволяют иммунной системе матери осуществлять атаку на плод и вызывать его отторжение на всех этапах развития.
оэтому с первых часов после зачатия и до момента родов развиваются супрессорные механизмы, которые не позволяют иммунной системе матери осуществлять атаку на плод и вызывать его отторжение на всех этапах развития.Роль иммуносупрессии в иммунологических реакциях «мать–плод» описана впервые в 1953 году. Стало классикой говорить о «состоянии иммунотолерантности матери к своему плоду». Результаты научных работ последних лет существенно расширили понимание этой проблемы.
Развивающаяся супрессия многофакторна и формируется за счет изменений в системных (особенность функционирования иммунной системы матери в период беременности) и местных иммунных реакциях (функционирование фетоплацентарной единицы).
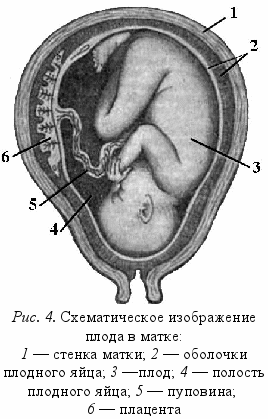
Во время беременности особую важность приобретает фетоплацентарная единица, которая индуцирует изменения в гормональном спектре матери и отвечает за динамическую перестройку иммунной системы (рис. 4).
Роль фетоплацентарной единицы
Роль фетоплацентарной единицы заключается в следующем:
- Трофобласт как плацентарный барьер изолирует кровоток плода от кровотока матери.
- Плацента («природный щит»):
а) нейтрализует материнские цитотоксические антитела против отцовских антигенов «антикомплементарными молекулами»: МСР (Membrane Cofactor Protein) и DAF (Decay Accelerating Factor). DAF контролирует также угрозу, исходящую из клеточного звена материнского иммунитета, из которого классически опасными считают клетки Т-киллеры;
б) является источником иммуносупрессивных факторов (в том числе супрессорного, изменяющего подвижность рецепторов к ИЛ-2), гормонов и негормональных белков, связанных с беременностью, что позволяет с одной стороны сохранить клеткам матери иммунокомпетентность для поддержания иммунного гомеостаза в организме, а с другой — эффективно защищать плод от иммунной агрессии материнских лимфоцитов.
Гормоны и белки беременности избирательно регулируют функциональную активность зрелых иммунокомпетентных клеток, результатом чего является антигенспецифическая супрессия, а также выступают в качестве медиаторов иммунной системы, ростовых или супрессорно-индуктивных факторов.
Примеры:
1. Под влиянием повышенного уровня прогестерона активированными Т-клетками секретируются два фактора: PIBF (progesterone induced blokmg factor) и TJ6. Эти факторы являются иммуносупрессивными молекулами, клонируют друг друга и регулируют активность СD3+ и CD16+ клеток (в присутствии PIBF в активированных лимфоцитах вырабатывается в 8 раз больше ИЛ-10 (цитокина Тх2), чем в его отсутствие).
2. Т-супрессоры — цитотоксические лимфоциты (CD8+) — имеют рецепторы к белку ранней фазы беременности. В результате их взаимодействия Т-клетки активируются и проявляют супрессорную активность.
Спектр гормонов и белков беременности достаточно велик, что позволяет создавать разнообразные комбинации (иммуномодулирующие «коктейли»), обеспечивающие выполнение задач каждого этапа беременности.
- Околоплодные воды играют роль антибактериальной защиты плода и являются стерильными, содержат лизоцим, β-лизин, трансферрин, иммуноглобулины (в основном IgG, незначительное количество IgА и sIgA, нет IgМ).
Во время беременности во всех звеньях иммунной системы происходят существенные сдвиги, меняющиеся в зависимости от сроков беременности, которые чрезвычайно динамичны и адаптируют данную систему к конкретным потребностям по защите матери и развитию плода.
Изменения в иммунной системе беременной
Изменения в иммунной системе будущей матери, которые обеспечивают физиологическое течение беременности:
- Уменьшение массы тимуса на фоне гипертрофии селезенки и регионарных по отношению к матке лимфоузлов. Эти изменения зависят от сроков беременности.
- Состав иммунокомпетентных клеток зависит от срока гестации:
- в первом триместре беременности отмечается снижение количества CD3+ Т-лимфоцитов (за счет низкого содержания CD4+ Т-хелперов) и ЕКК-клеток на фоне повышения В-лимфоцитов;
- третьем триместре беременности: снижение В-клеток и повышение ЕКК-клеток. В течение беременности меняется соотношение CD4/CD8 клеток.
В клинической практике данные показатели используются для прогнозирования невынашивания беременности (характерна обратная картина).
- Функциональная активность (в частности, митоген-индуцированный ответ) иммунокомпетентных клеток снижена. Обусловлено супрессирующим влиянием плазмы крови беременных (функциональная активность лимфоцитов не страдает).
- Гуморальный иммунитет также зависит от сроков беременности. Предполагается, что стимуляция гуморального иммунного ответа в ранние сроки является одним из механизмов компенсации угнетения в это время клеточного иммунитета и направлена на защиту матери от инфекционных антигенов. Отмечено увеличение изотипа IgGl, с которым связывают защиту плодных антигенов от материнских эффекторных клеток и специфическую индукцию роста и дифференцировки плодных клеток и тканей по типу гормон — IgG-рецептор — антигены ГКГС плода.
- Со стороны фагоцитарного звена отмечается резкое увеличение количества, поглотительной и метаболической активности фагоцитарных клеток.
- Репертуар молекул ГКГС при беременности:
- отсутствие классических молекул I и II классов ГКГС на трофобласте;
- экспрессия молекул ГКГС-G, С, Е.
Молекула ГКГС-G (открыта в 80-е годы группой американцев и англичан) экспрессируется только плацентой, не имеет межиндивидуальных различий и иммунологически не проявляет некоторых своих участков.
С молекулой ГКГС-G связывают следующие эффекты:
- блокаду киллерной активности ЕКК в отношении плаценты (предупреждение иммунологических реакций);
- регуляцию активности материнских Т-лимфоцитов (через связывание распознающих рецепторов);
- активацию продукции цитокинов, способствующих росту плода.
- Цитокиновый профиль при беременности. В настоящее время доминирует мнение о том, что цитокиновый профиль Тх2 типа (ИЛ-4, ИЛ-5, ИЛ-10) работает на поддержание беременности, а Тх1 типа (ИФН-γ, ФНО-α, ИЛ-2) — на отторжение зародыша. При нормальном течении беременности наблюдается динамическое равновесие цитокиновых профилей (с временным преобладанием в зависимости от сроков беременности).
В клинической практике эти данные используются для прогнозирования беременности: увеличение продукции ФНО-α и ИФН-γ на фоне снижения ИЛ-4 характерно для угрозы прерывания беременности.
Роль других цитокинов (например, ИЛ-12 и ИЛ-18) активно изучается.
- Роль апоптоза при беременности. Ограничение материнского иммунного ответа достигается связыванием пептида FasL, находящегося на поверхности клеток трофобласта, с рецепторами Fas на активированных лимфоцитах матери, что приводит к апоптозу последних.
Следует особо отметить, что мать и плод не пассивны в плане взаимной регуляции иммунных отношений (см. стр. 7 трансплацентарная передача материнских антител).
Основные меры профилактики во время беременности
Основные меры профилактики во время беременности:
- Бережное отношение к беременной женщине с минимальным медикаментозным вмешательством только по жизненным показаниям.
- Охрана беременной женщины от контактов с инфекционными агентами и агрессивными факторами внешней среды.
- Качественное и полноценное (прежде всего, белковое) питание с достаточным количеством витаминов и микроэлементов, особенно селена и цинка (во время беременности постоянно идет требующая полноценного энерго-пластического обеспечения перестройка основных компонентов иммунной системы).
- Контроль качества вакцинопрофилактики с определением иммунограммы и титра защитных антител у женщин, которые планируют ребенка.
- Во время беременности противопоказано применение иммунотропных препаратов, активирующих те или иные звенья иммунной системы.
