На основі взаємозвязку між термодинамічними
| Вид материала | Лекція |
- Зразок оформлення тез доповідей, 16.21kb.
- Міжпредметні зв'язки шкільного курсу біології, 822.5kb.
- Інвестиційні процеси в Україні розвиваються у тісному взаємозв’язку з загальноекономічним, 68.01kb.
- Як нова мегаінституція глобального економічного середовища, 249.01kb.
- Реферат на тему: Соціальна система: дії, взаємодії, конфлікти, 140.82kb.
- Воляють встановити оптимальний його перелік на підставі кількісного вираження взаємозв’язку, 166.98kb.
- Закон україни, 950.07kb.
- Еволюція соціальних мереж Історія поняття, 139.28kb.
- Національна Академія Наук України Інститут біохімії ім. О. В. Палладіна реферат, 192.56kb.
- Закон україни про виконавче провадження, 1267.36kb.
ЛЕКЦІЯ 5
ХІМІЧНА РІВНОВАГА
- Поняття про хімічний потенціал
На основі взаємозвязку між термодинамічними
потенціалами і параметрами системи припускалося, що маса системи незмінна. Тоді для визначення стану системи достатньо було задати дві незалежні змінні величини (наприклад, Р і Т, V і S тощо). У хімічних реакціях склад системи змінюється, часто речовина переходить з одного агрегатного стану в інший. У цьому випадку до незалежних змінних як складова входить ще й склад суміші.
Термодинамічні потенціали кожної частини такої системи можуть бути подані функцією двох змінних та кількості молів усіх речовин, що входять до системи. Наприклад:
U = f(S,V,n1,n2…nk), G = f(P,T,n1,n2…nk).
Повний диференціал енергії Гіббса можна записати цьому випадку так:
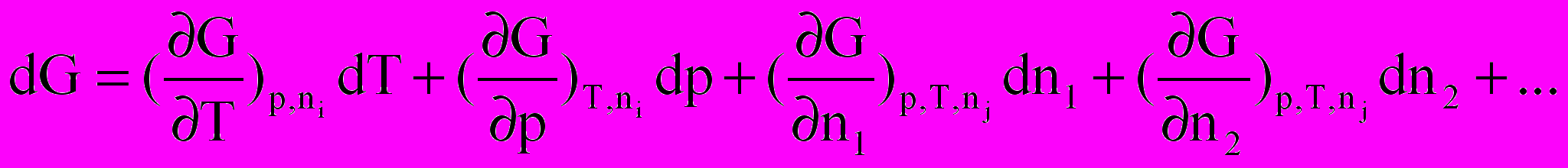
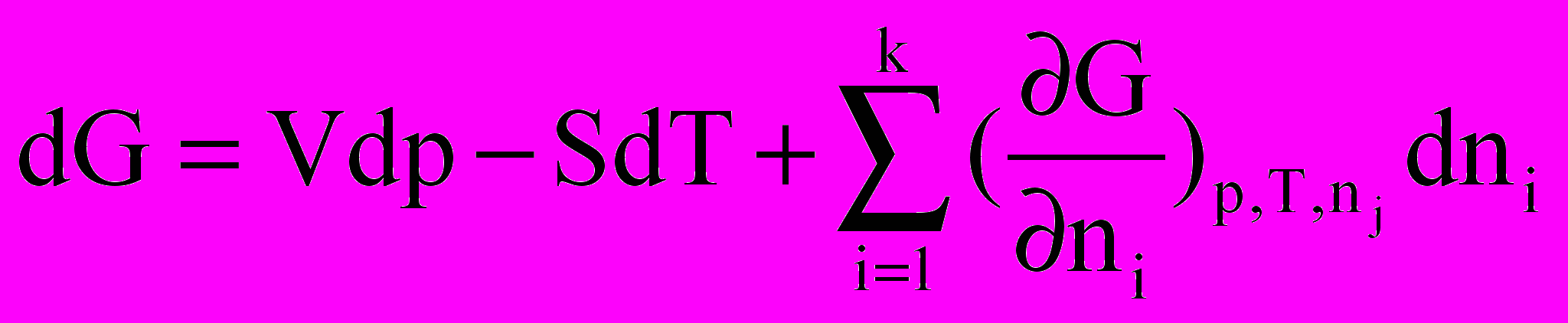
Частинна похідна енергії Гіббса за кількістю молів будь-якого(i) компонента при незмінній кількості молів усіх останніх компонентів(j) та при Р,Т = const називається хімічним потенціалом даного компонента
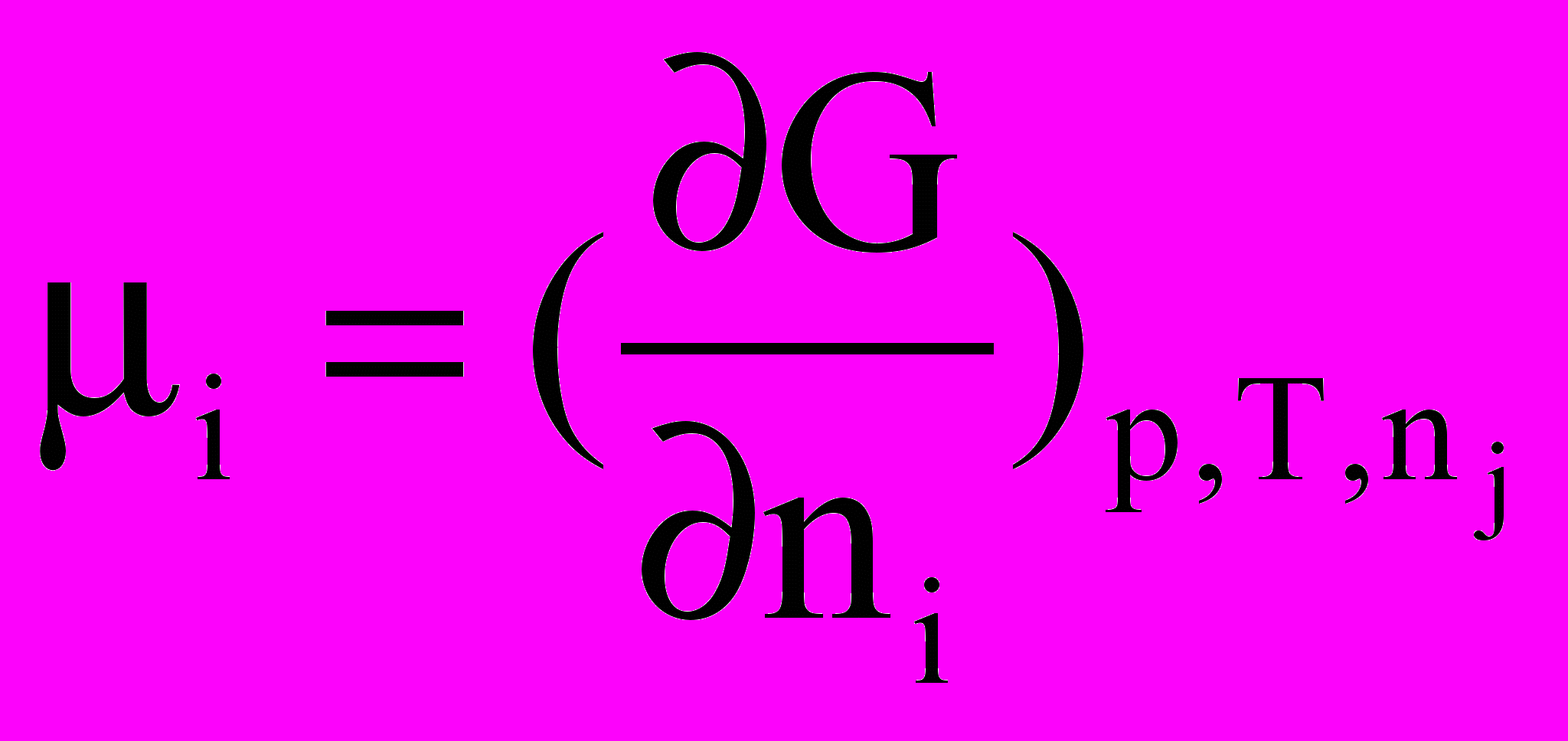
З урахуванням цього співвідношення вираз для повного диференціала енергії Гіббса набуде вигляду
k
dG = VdP – SdT + idni.
i=1
Якщо реакція проходить при постійних Р і Т, то
k
dG = idni. (*)
i=1
Після інтегрування отримуємо
G = ini i Gi = ini,
і
тобто хімічний потенціал чистої речовини дорівнює енергії Гіббса одного моля цієї речовини.
За умови рівноваги dG = 0 і з (*) отримуємо
i dni = 0.
і
Це рівняння називається рівнянням Гіббса-Дюгема і є загальною умовою рівноваги у системі зі змінною кількістю компонентів при постійних температурі та тиску.
Аналогічні міркування можна провести не тільки для енергії Гіббса, але й для внутрішньої енергії, ентальпії та енергії Гельмгольца. У цих випадках можна записати
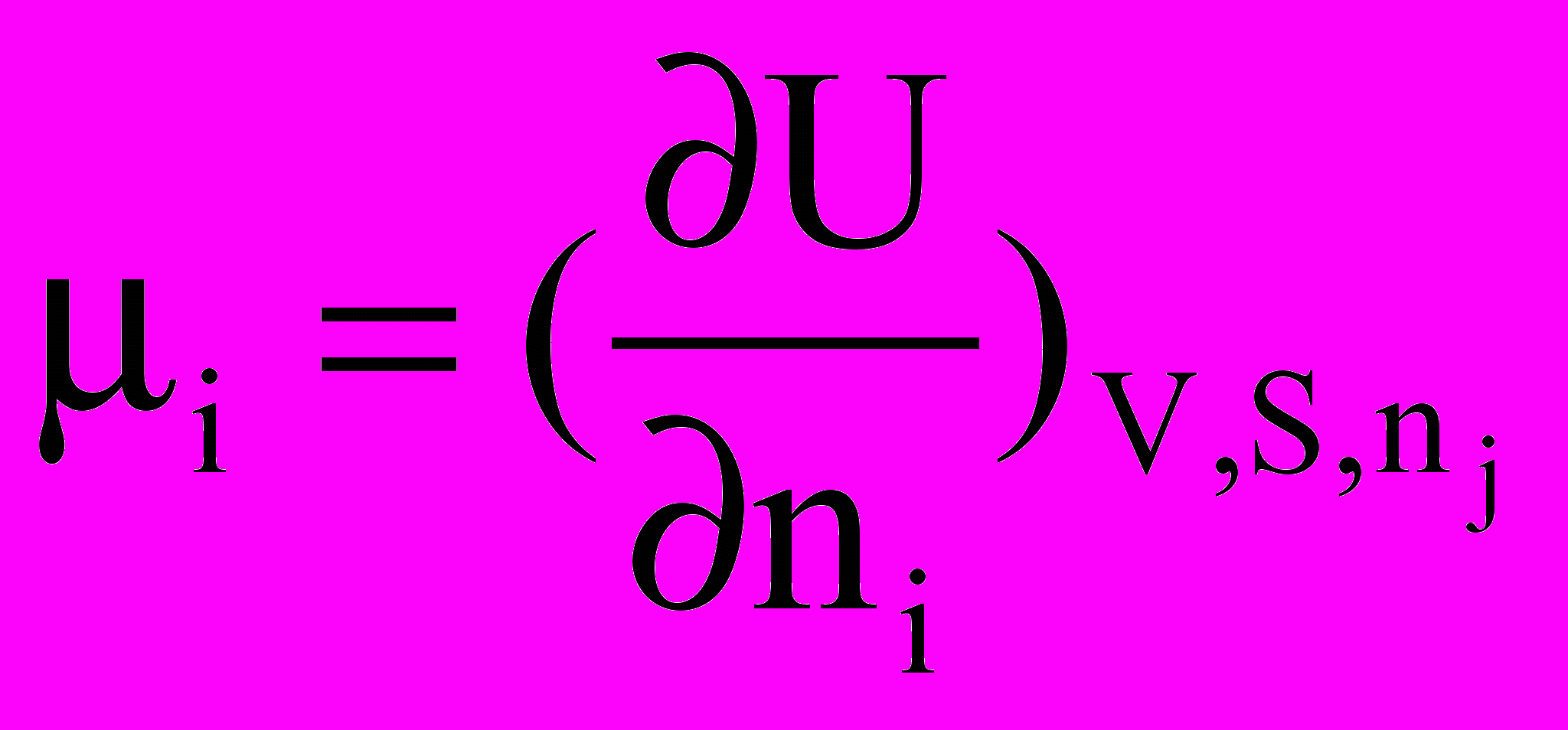 =
=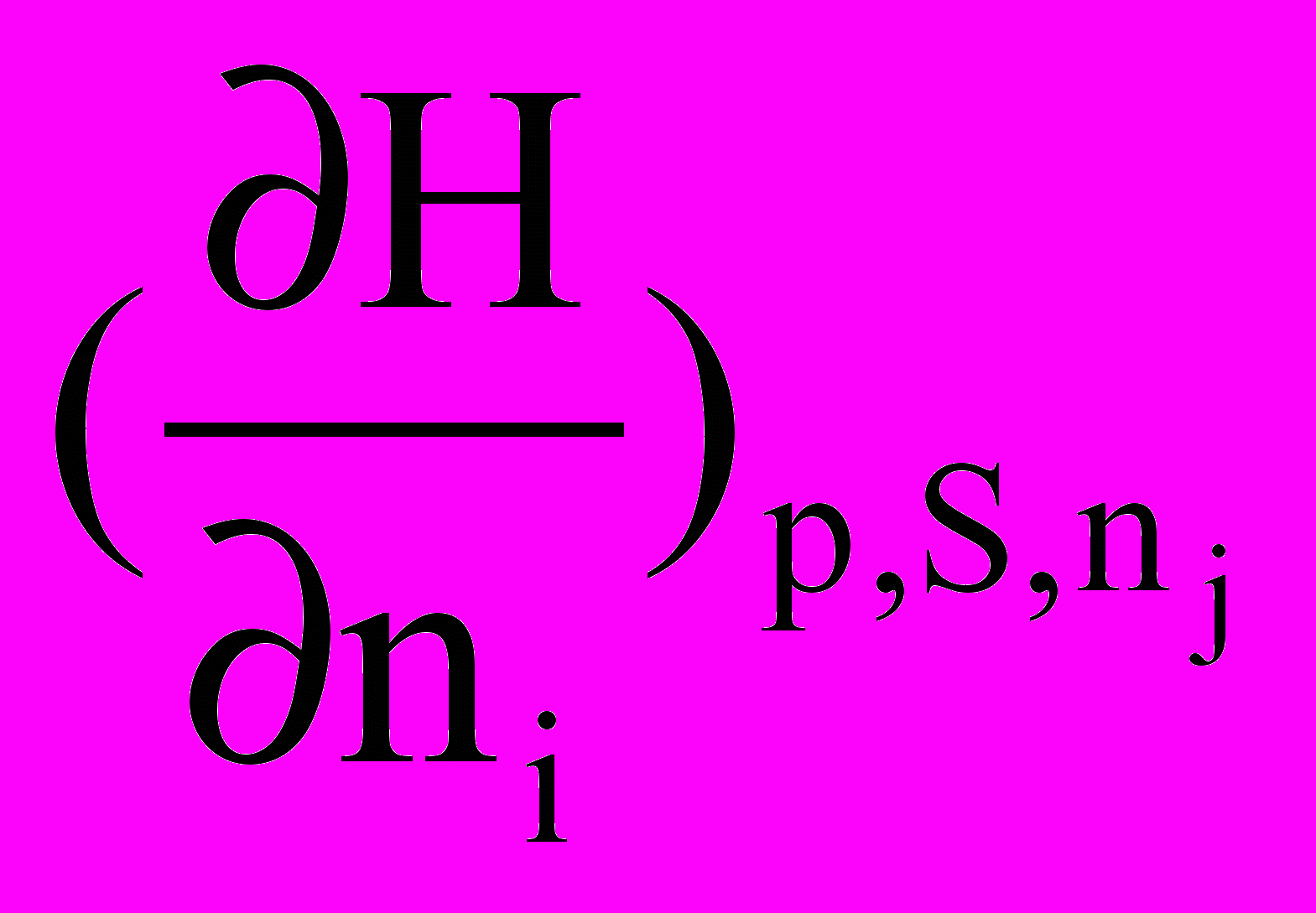
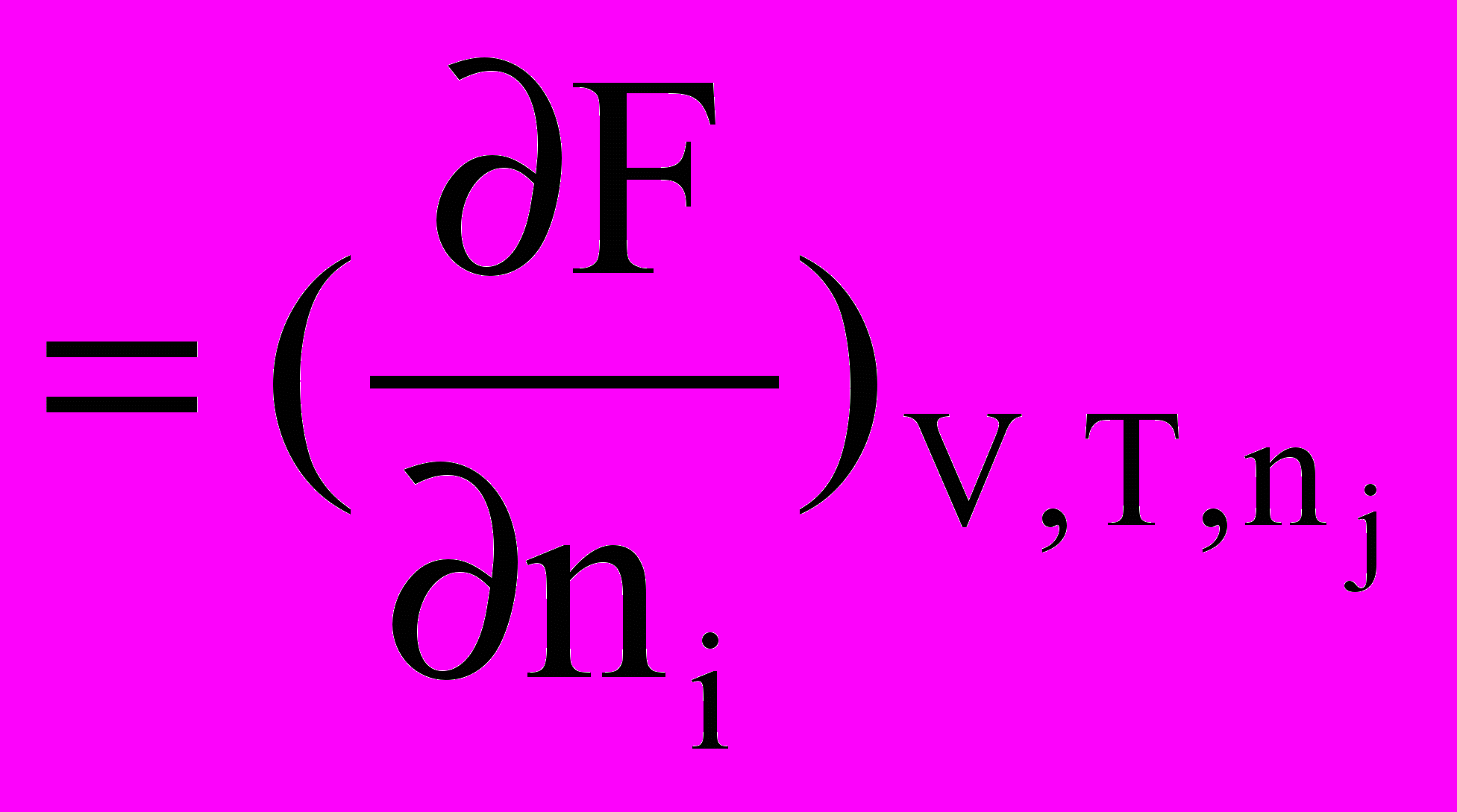
Таким чином, хімічний потенціал може бути виражений через частинну похідну будь-якого термодинамічного потенціалу при постійних значеннях відповідних незалежних змінних та кількостях молів усіх речовин (крім однією) за кількістю молів компонента, кількість якого змінюється.
Дуже часто хімічний потенціал подають у вигляді
= 0(T) + RTlnP,
де 0(Т) – стандартний хімічний потенціал ідеального газу.
Хімічний потенціал можна також виразити через концентрації. Оскільки для ідеальних газів Р = cRT, то
= 10(T) + RTlnс.
Сталі 0 та 10 поєднані між собою співвідношенням
10(Т) = 0(T) + RTlnRT.
- Константа хімічної рівноваги. Рівняння ізотерми хімічної реакції
Усі хімічні реакції тією чи іншою мірою оборотні,
тобто не проходять до кінця, до повного перетворення вихідних речовин у продукти. У реакційній суміші завжди відбуваються як пряма, так і зворотна реакції. У міру витрачання вихідних речовин швидкість прямої реакції зменшується; в міру накопичення продуктів зростає швидкість зворотної реакції. Коли ці швидкості зрівняються, встановиться динамічна рівновага: не буде відбуватися ні накопичення, ні витрачання вихідних речовин та продуктів. Сумарна швидкість прямої та зворотної реакцій буде дорівнювати нулю. Подібна рівновага називається хімічною рівновагою.
Умовою хімічної рівноваги є загальна умова термодинамічної рівноваги у системі – рівняння Гіббса-Дюгема:
і dni = 0.
Нехай у системі, що містить ідеальні гази А, В, D та F, проходить хімічна реакція
аА + вВ = dD + fF.
Тут а, в, d i f - стехіометричні коефіцієнти. Розраховуємо змінення енергії Гіббса цієї реакції. З урахуванням рівняння (*) одержуємо
G =Gкон-Gисх=(GD + GF)–(GA + GB) = dD + fF - aA - bB.
Ураховуючи, що = 0 + RTlnP, отримуємо
G = d0D + dRT lnPD + fF0 + fRTlnPF - a0A –
aRT lnPA- b0B - bRT lnPB.
У цьому співвідношенні PA, PB, PD i PF – парціальний тиск компонентів А, В, D i F у довільний момент часу (ці тиски у міру проходження реакції змінюються: зменшуються для речовин А і В і збільшуються для речовин D i F).
Очевидно, що алгебраїчна сума стандартних значень хімічних потенціалів є стандартним зміненням енергії Гіббса хімічної реакції G0 і з урахуванням цього
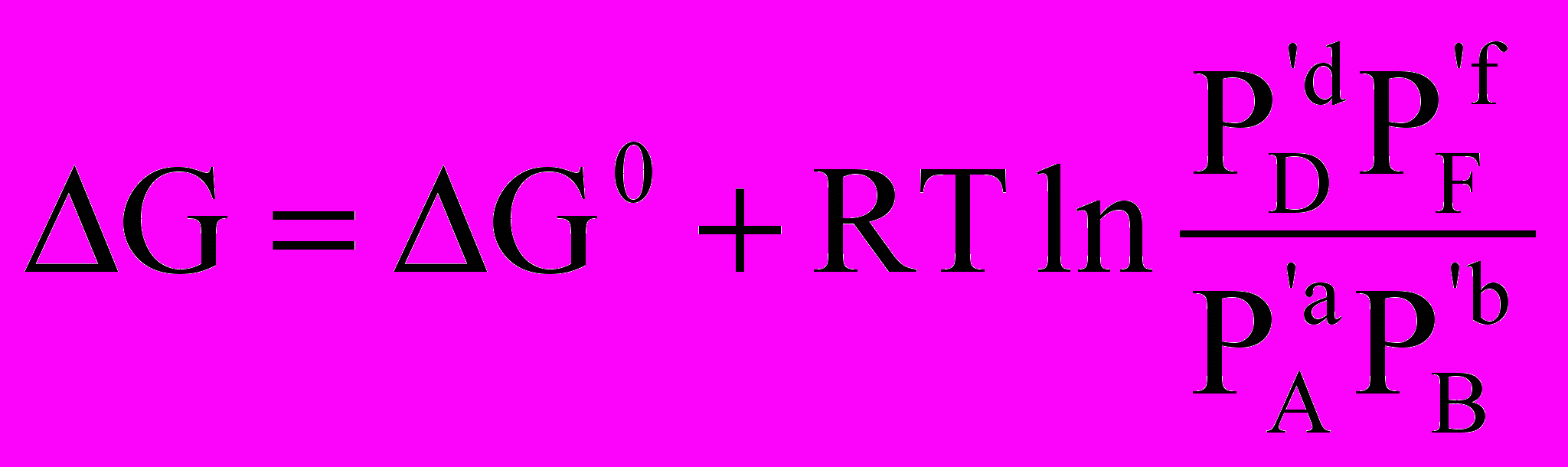 .
.Якщо хімічна реакція досягла стану рівноваги, то енергія Гіббса реакції дорівнює нулю: G = 0, тому
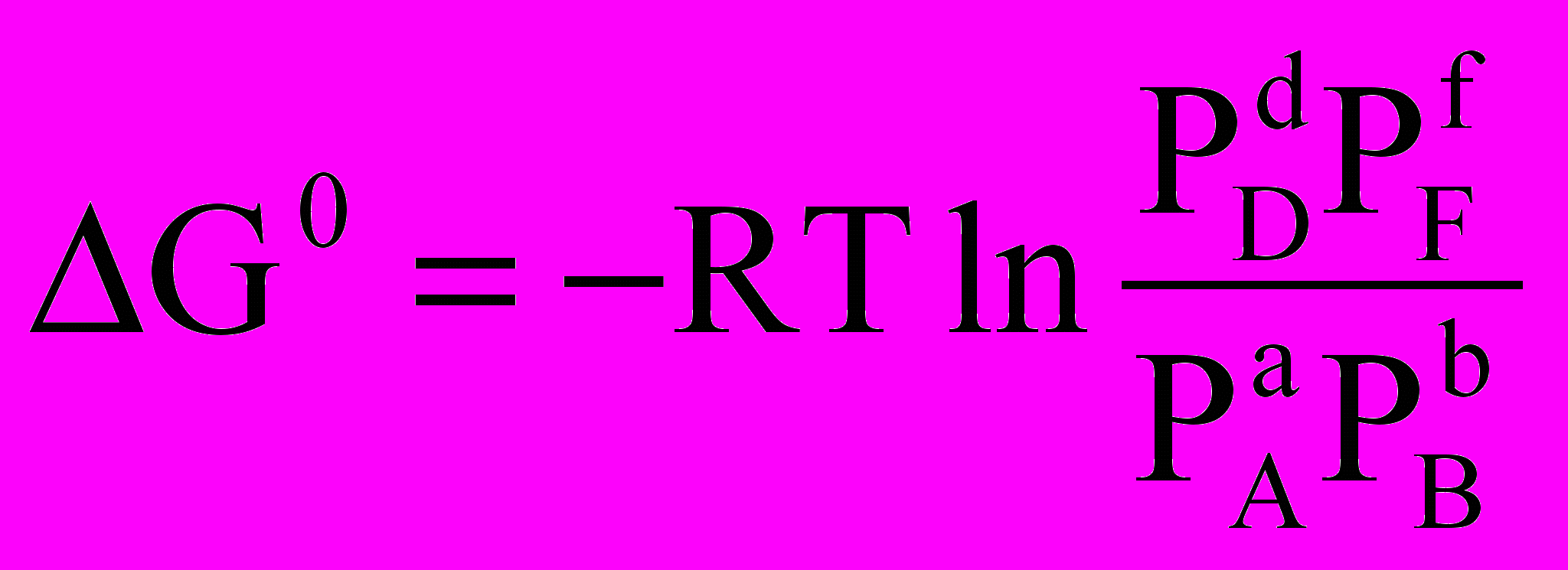 .
.Тут PA, PB, PD, PF уже не довільні парціальні тиски, а парціальні тиски речовин А, В, D, F у момент встановлення рівноваги, тобто постійні для даних умов величини. Отже, величина, що міститься під знаком логарифма, є величиною постійною. Вона позначається КР і називається константою хімічної рівноваги
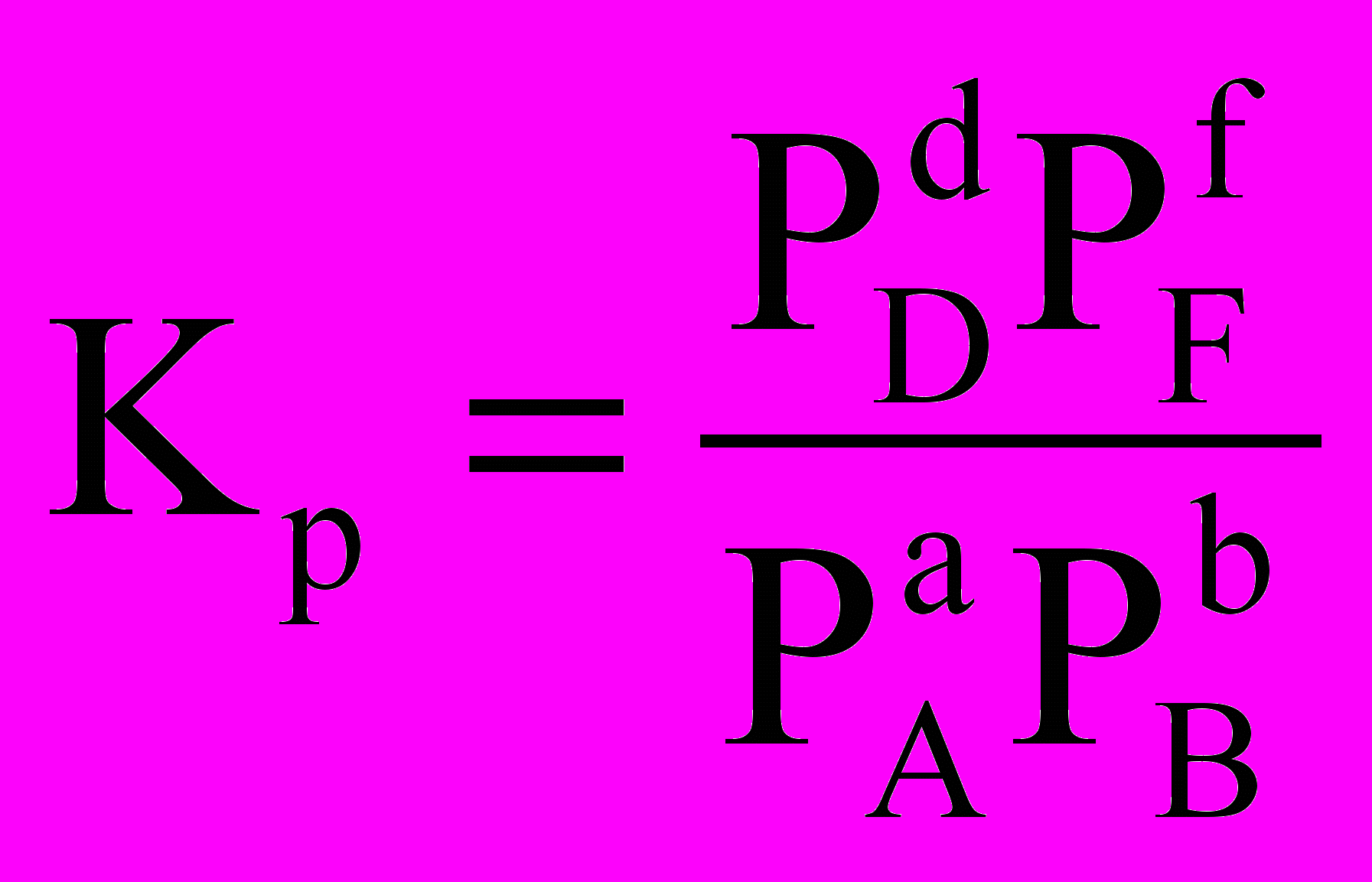
З урахуванням цього
G0 = - RT lnKP.
Остаточно, для енергії Гіббса даної хімічної реакції можна записати
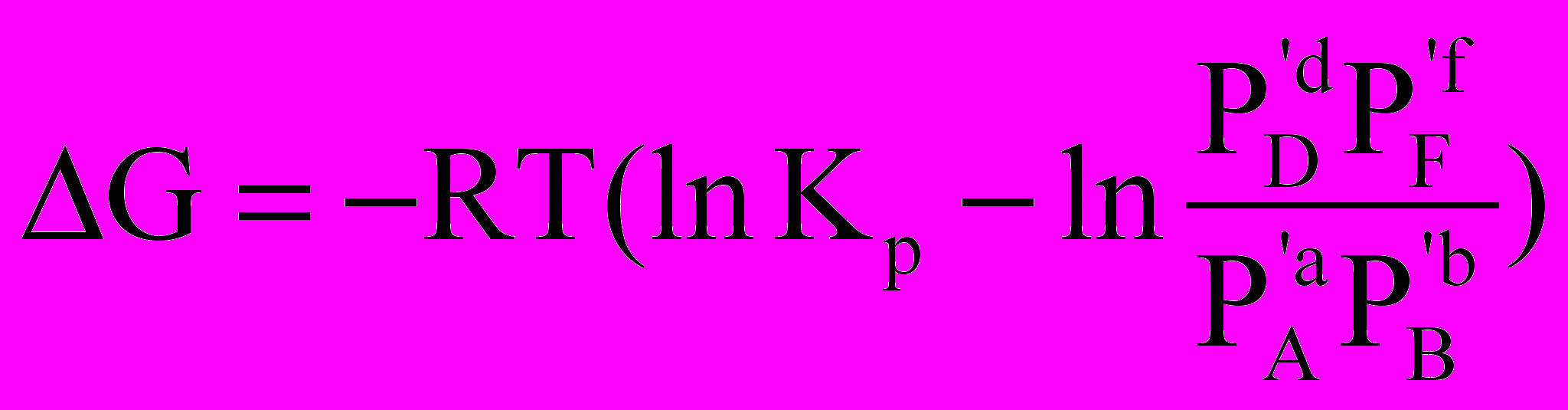 .
.Отримане співвідношення називається рівнянням ізотерми хімічної реакції. За цим рівнянням можна розрахувати змінення енергії Гіббса для перетворення зазначених вище кількостей вихідних речовин у продукти при Р,Т = const. Якщо відома константа рівноваги хімічної реакції, легко оцінити знак виразу, що поданий у дужках у правій частині рівняння. Якщо перший член цього виразу більший від другого, то реакція буде проходити довільно зліва направо, оскільки для цього процесу G 0. У противному разі довільно буде проходити зворотна реакція.
Якщо хімічна реакція проходить в ідеальному розчині, тобто при V,T = const, то віддаленість реакції від рівноваги визначається величиною енергії Гельмгольца хімічної реакції F, і шляхом аналогічних міркувань можна отримати такі співвідношення:
F0 = - RTlnKc =
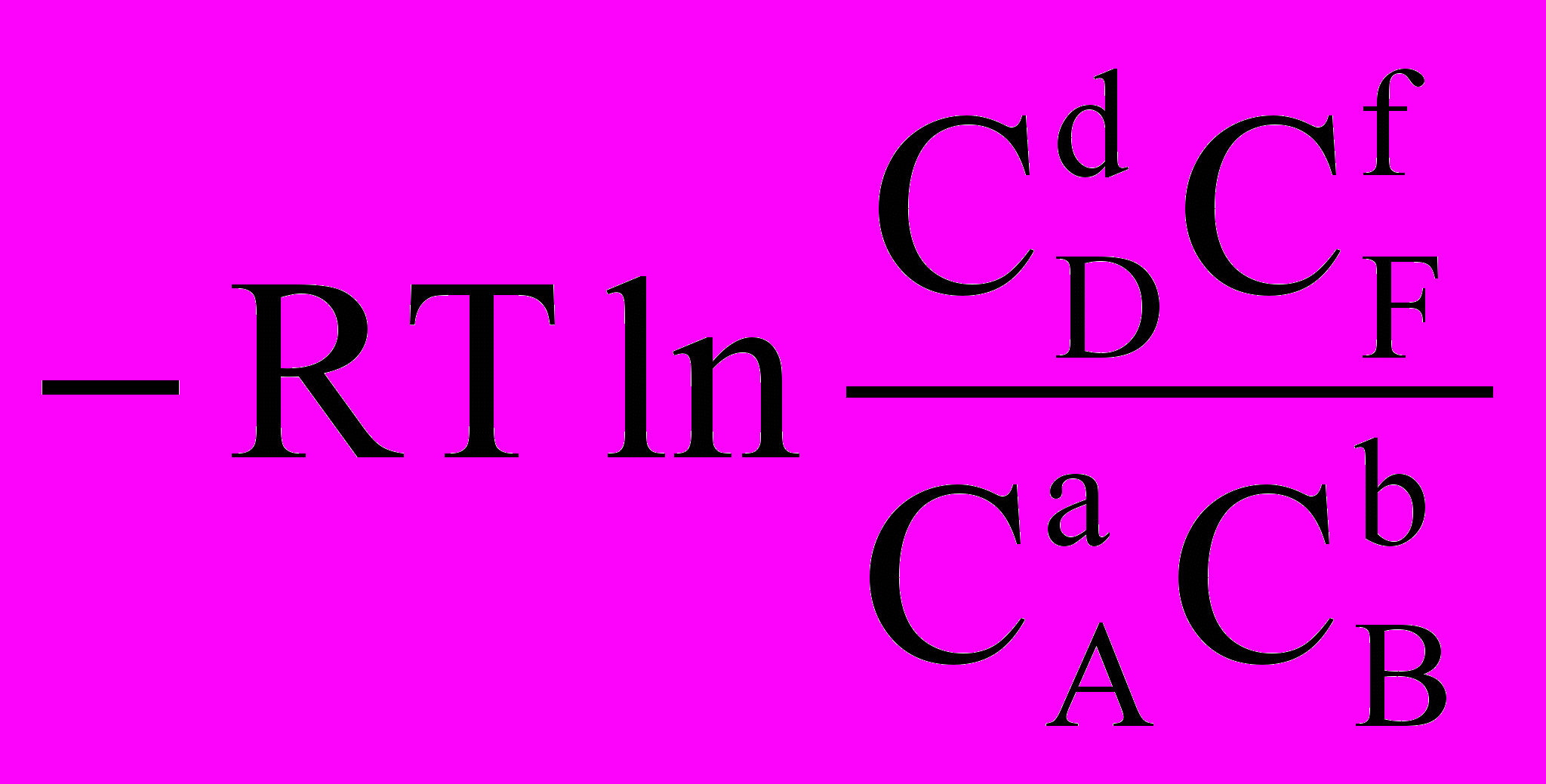 ,
,KC =
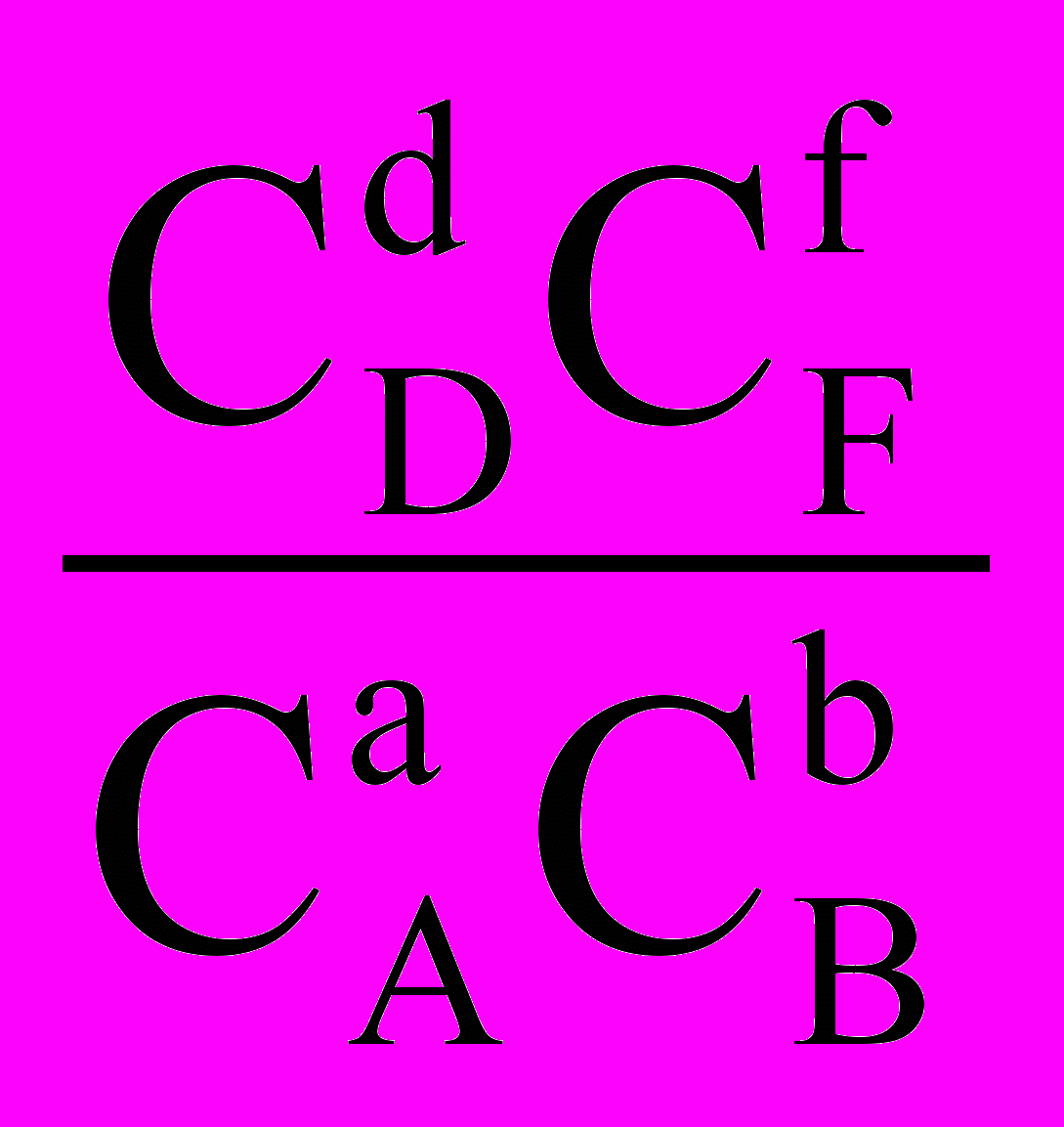 ,
,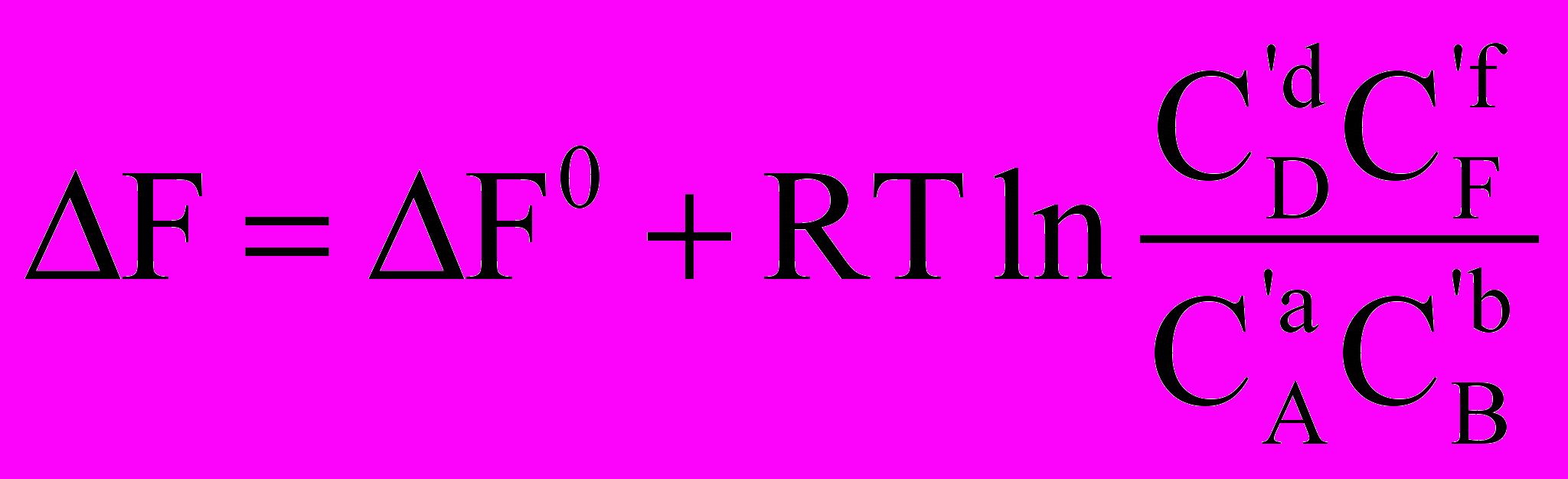 .
.У цих рівняннях F0 – стандартна енергія Гельмгольца хімічної реакції. КС – константа хімічної рівноваги, що виражена через рівноважні концентрації Cі речовин, Cі – концентрації речовин у довільний момент часу. Останнє рівняння також має назву рівняння ізотерми хімічної реакції.
Константи КР і КС звязані між собою простим співвідношенням. оскільки Рі = CіRT, то
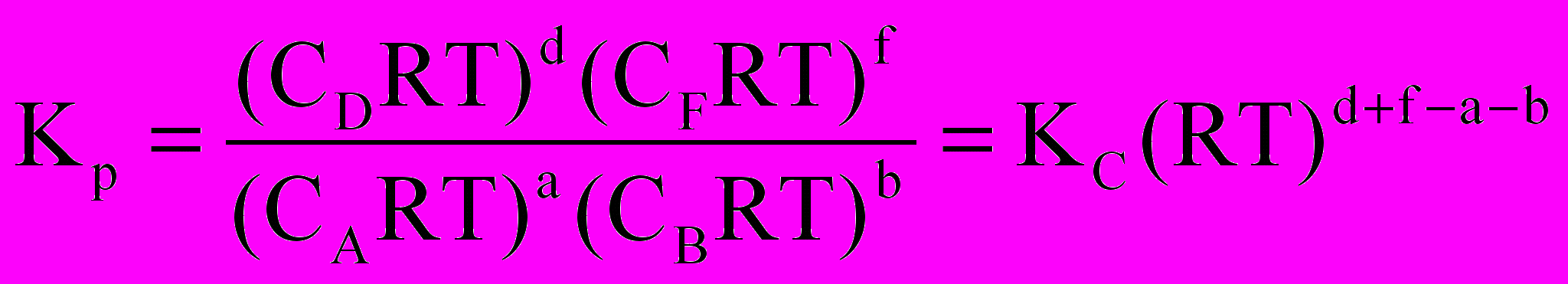
Із цього співвідношення випливає, що КР = КС, коли реакція проходить без змінення кількості молів у газовій фазі, тобто коли d+f = a+b.
Величина константи рівноваги дозволяє відповісти на питання про напрямок проходження хімічної реакції. Так, якщо константа рівноваги більша від одиниці, це означає відповідно до рівняння ізотерми реакції можливість довільного проходження реакції зліва направо. Якщо К < 1, то реакція буде проходити спонтанно у зворотному напрямку.
5.3 Вплив зовнішніх умов на хімічну рівновагу
Зміни зовнішніх умов, за яких система перебуває у стані рівноваги, призводить до змінення параметрів системи, тобто до зрушення хімічної рівноваги. Для якісного визначення напрямку зрушення рівноваги у хімічній реакції використовують правило:
якщо система, що перебуває у стані рівноваги,
зазнає впливу ззовні, тобто змінюються умови,
за яких система перебувала у стані рівноваги,
то в системі почнуть проходити процеси, що
ослаблюють зовнішню дію.
Це правило називається принципом Ле Шательє-Брауна. Розглянемо вплив концентрації, температури та тиску на зрушення хімічної рівноваги.
Із виразу для константи рівноваги КС можна зробити висновок про те, що збільшення концентрації продуктів реакції ( D i F) призведе до збільшення швидкості зворотної реакції, тобто рівновага зрушиться у напрямку утворення вихідних речовин. Збільшення концентрацій вихідних речовин призведе до зміщення рівноваги у напрямку проходження прямої реакції.
При зміні загального тиску у рівноважній суміші парціальні тиски всіх учасників реакції змінюються в однакову кількість разів. Якщо у реакції кількість молів газів не змінюється, як, наприклад, у реакції Н2 + Cl2 = =2HCl, то склад суміші залишиться рівноважним, тобто рівновага не зміститься. Якщо кількість молів газів змінюється, то склад суміші у результаті змінення тиску стане нерівноважним, і буде проходити хімічна реакція. Напрямок зміщення рівноваги у цьому випадку залежить від того, збільшилася чи зменшилася кількість молекул газів. Розглянемо, наприклад реакцію
N2 + 3H2 = 2NH3.
Усі учасники цієї реакції гази. Нехай у рівноважній суміші збільшили загальний тиск (різко стиснули суміш). Рівновага порушилася, у системі повинні початися процеси, що призведуть до зменшення тиску. Але тиск пропорційний кількості ударів молекул об стінки, тобто кількості молекул. Із рівняння реакції випливає, що у результаті проходження прямої реакції кількість молекул газів зменшується, а в результаті зворотної – збільшується. Отже, зменшення загального тиску відбудеться, якщо рівновага зрушиться у напрямку проходження прямої реакції. При зменшенні загального тиску у рівноважній суміші рівновага у розглядуваній реакції зміститься у напрямку проходження зворотної реакції, що призводить до збільшення кількості газових молекул, тобто до збільшення тиску.
Для встановлення напрямку зміщення рівноваги при змінюванні температури скористаємося рівнянням Гіббса-Гельмгольца ( див. лекцію 4)
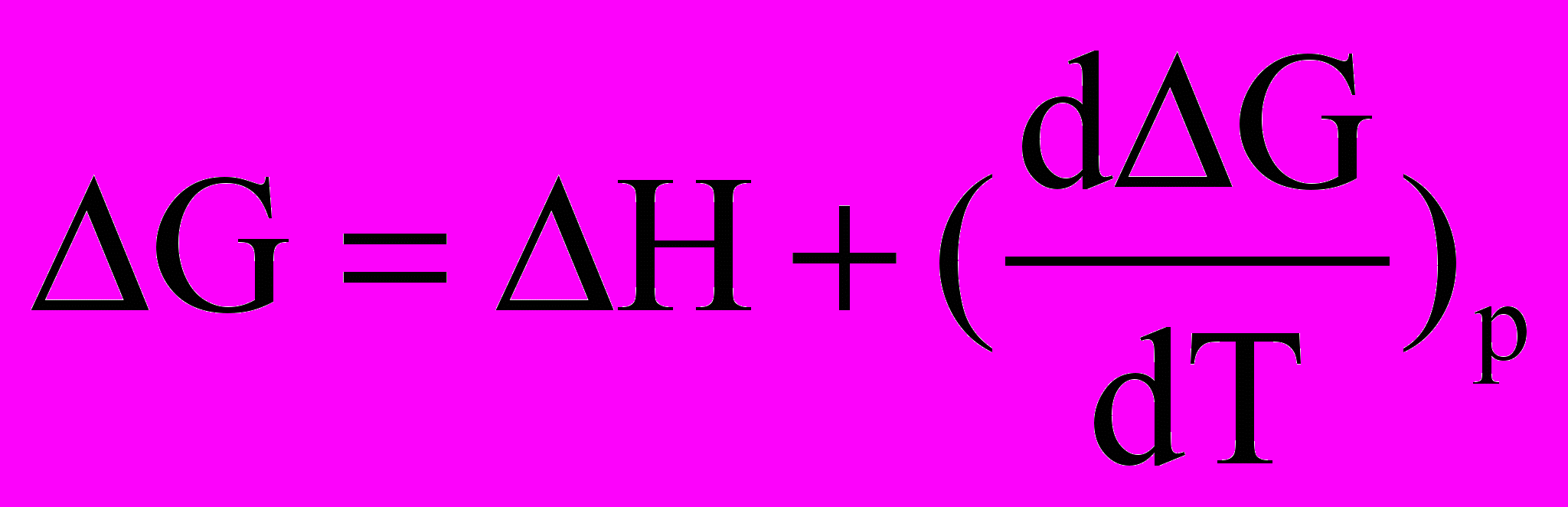
Підставимо у це рівняння рівняння ізотерми реакції
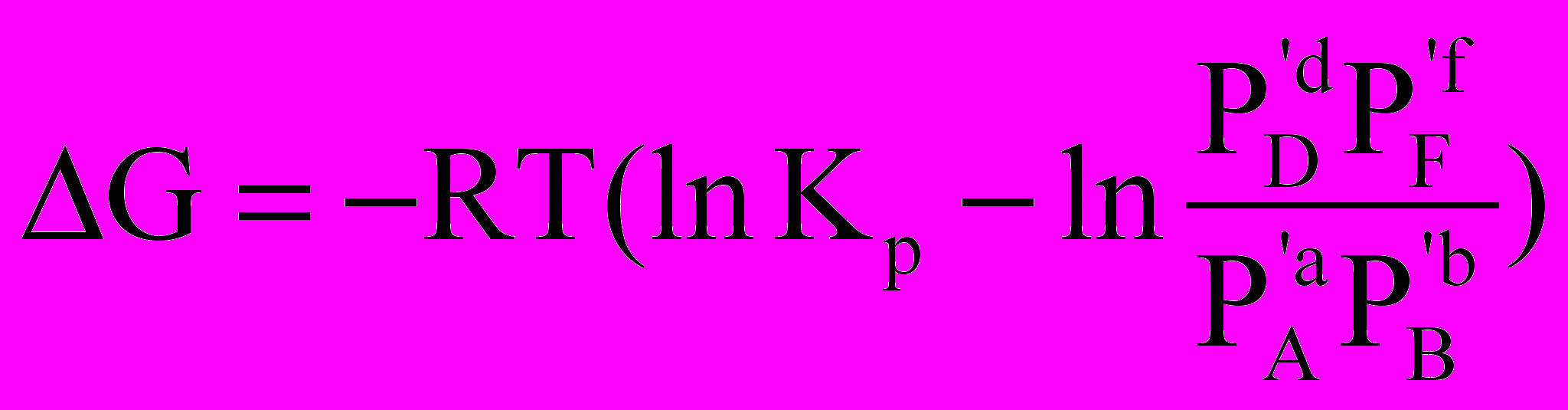
Враховуючи, що значення поточних тисків Рі від температури не залежать, отримуємо
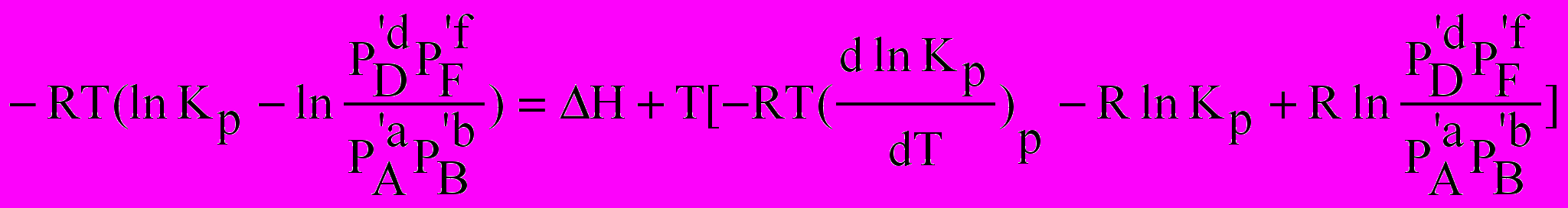 Після скорочення отримуємо
Після скорочення отримуємо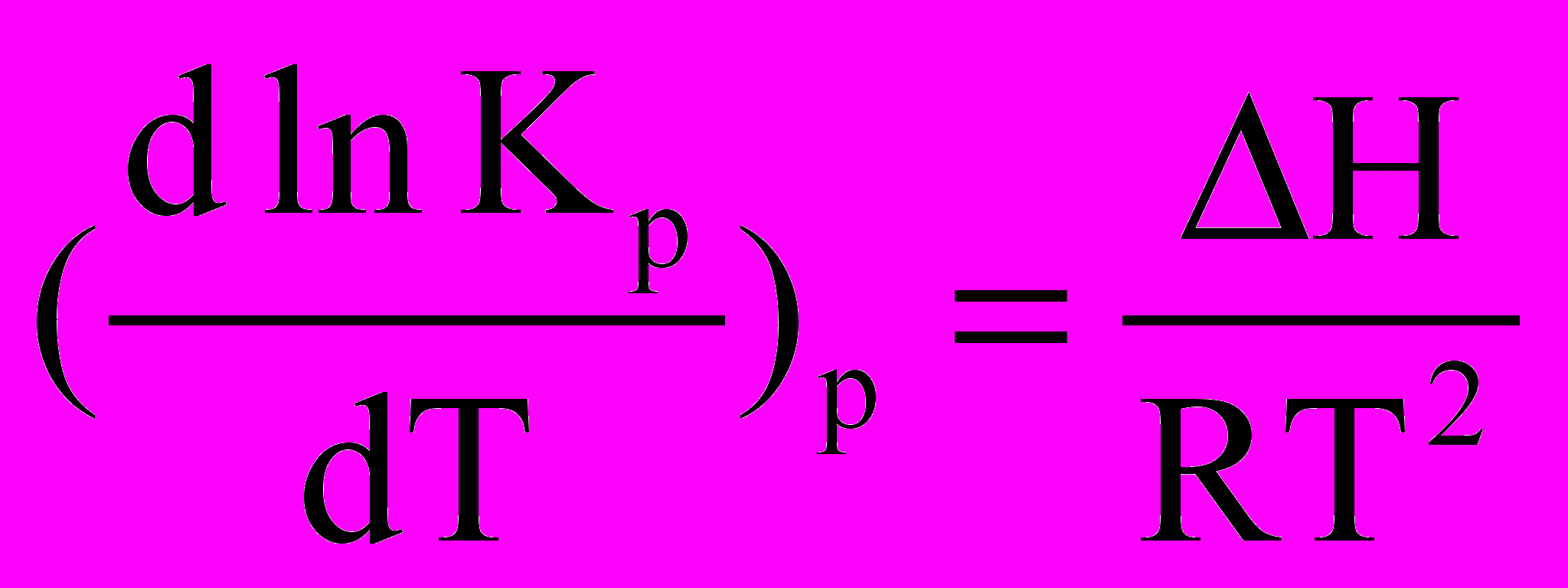 .
.Отримане рівняння називається рівнянням ізобари хімічної реакції. Аналогічним шляхом отримуємо рівняння ізохори хімічної реакції:
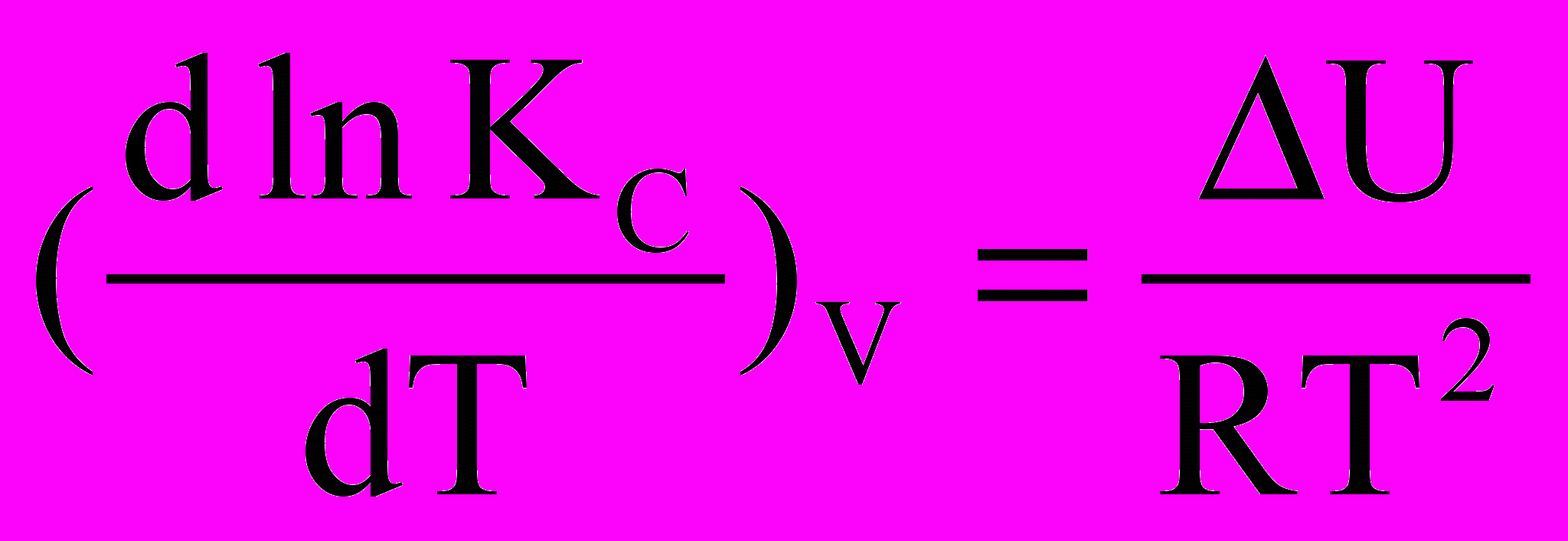 .
.Рівняння ізобари та ізохори хімічної реакції дозволяє передбачати та оцінювати ( якісно та кількісно) залежність константи рівноваги від температури і напрямок зміщення рівноваги. Якщо H > 0 (реакція ендотермічна), то dlnKP/dT>0. Це означає, що із підвищенням температури рівновага зміститься у бік прямої реакції і константа рівноваги збільшиться.
Якщо H > 0 (екзотермічна реакція), то dlnKp/dT>0 і рівновага зрушується у бік зворотної реакції.
Взагалі при підвищенні температури рівновага зміщується у бік ендотермічної реакції, а при зниженні температури – у бік екзотермічної реакції. ЯкщоH = 0, то рівновага при зміненні температури не зрушується. Наприклад, у системі
N2 + 3H2 = 2NH3, H = - 92,4 кДж/моль
при підвищенні температури рівновага зміститься у бік зворотної (ендотермічної) реакції, а при зниженні температури – у бік прямої реакції.
Щоб визначити змінення константи рівноваги при зміні температури на кінцеву величину, треба проінтегрувати рівняння ізобари та ізохори хімічної реакції. За умови постійності H і U (це справедливо при невеликій зміні температури) отримуємо:
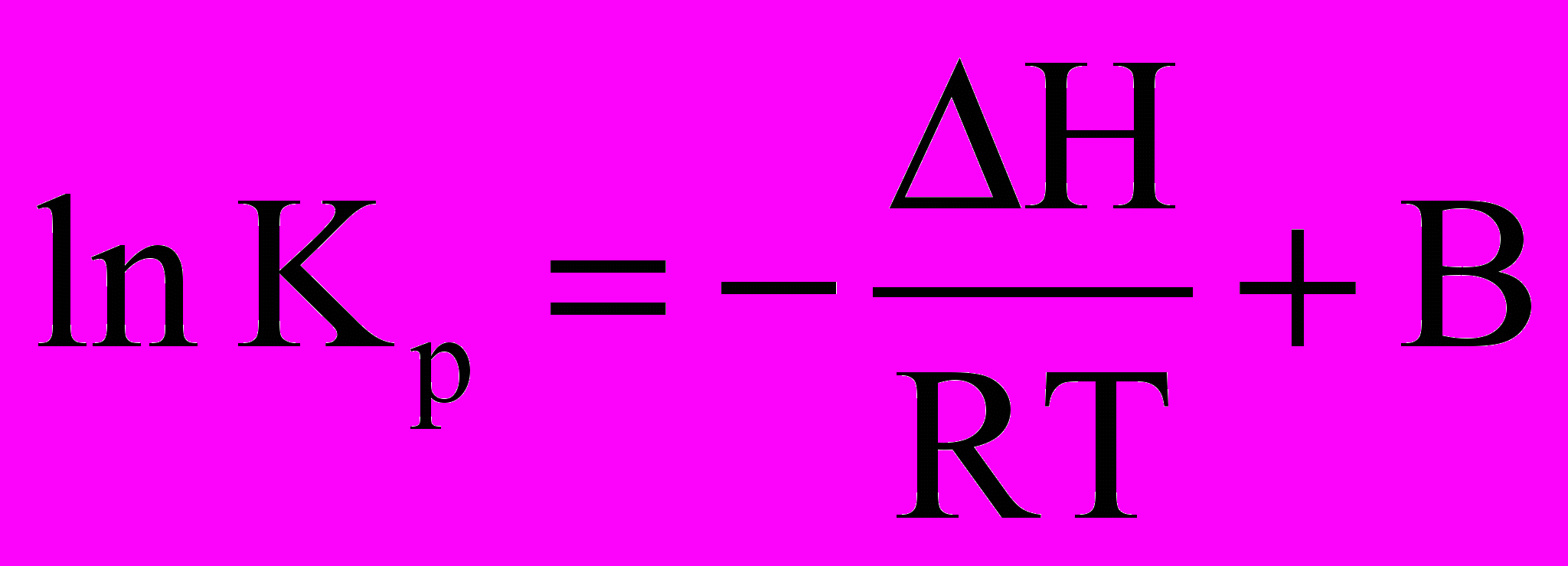 i
i 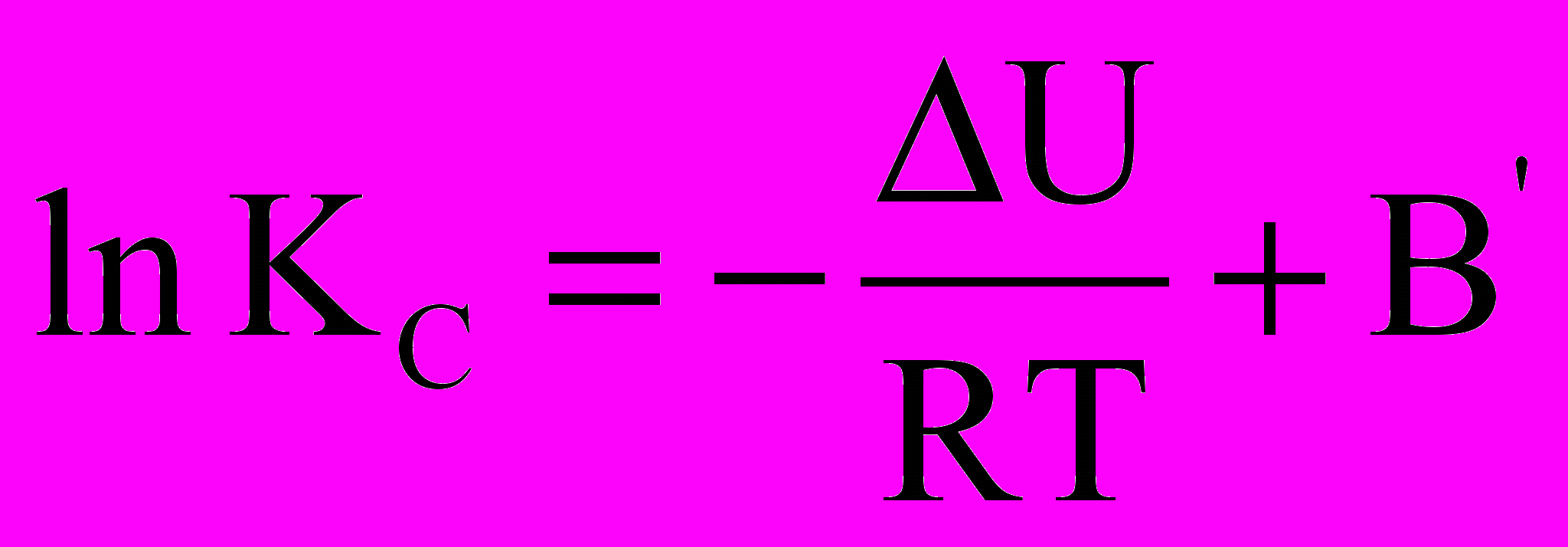 .
.Тут В і В - константи інтегрування.
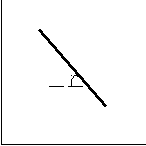 lnKP З цих рівнянь
lnKP З цих рівнянь випливає, якщо тепло-
вий ефект реакції не за-
tg =
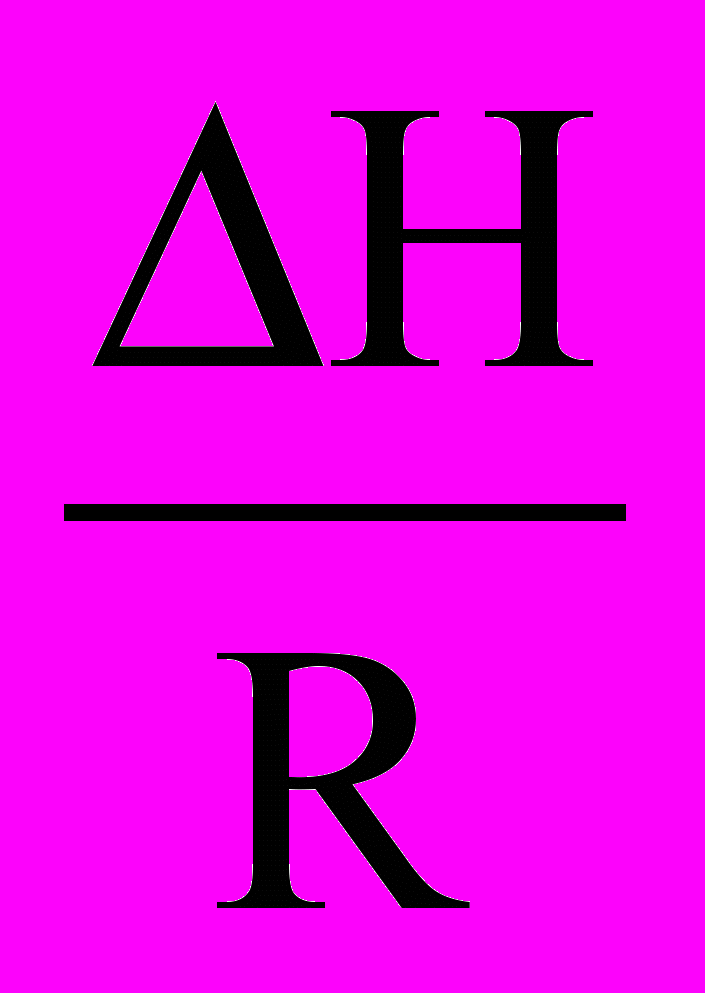 лежить від температури,
лежить від температури,- то графік залежності,
наприклад lnKP від 1/T,
є прямою лінією
(рис. 5.1). Якщо відомі
1/T константи рівноваги для
декількох температур,
Рисунок 5.1 – Залежність то побудувавши гра
lnKP = f(1/T) фік lnKP = f(1/T), можна визначити кон
станту інтегрування і
тепловий ефект реакції.
5.4 хімічна рівновага у гетерогенних системах
Гетерогенними реакціями називаються реакції, у яких речовини, що реагують, є у двох або декількох фазах, що не утворюють між собою розчинів. При визначенні тиску системи, у якій відбувається гетерогенна реакція, крім тиску речовин, які є в газовій фазі, ураховують тиск парів рідких та твердих речовин.
Над рідкими та твердими фазами при постійній температурі завжди є насичена пара, тиск якої постійний і не залежить від кількості речовини, що міститься у рідкій або твердій фазі, оскільки у міру витрачання пари речовини із твердої або рідкої фази знову утворюється насичена пара однакового за величиною тиску.
Таким чином, при проходженні гетерогенної реакції у системі змінюються парціальні тиски лише тих речовин, які є у газоподібному стані.
Отже, при визначенні константи рівноваги гетерогенної реакції можна використати формули для констант рівноваги гетерогенних реакцій, не враховуючи множники, що належать до рідких або твердих фаз.
Розглянемо для прикладу реакцію розкладання карбонату кальцію
СаСО3(тв) = СаО(тв) + СО2(г)
та реакцію утворення оксиду вуглецю (ІІ)
С(тв) + СО2(г) = 2СО(г).
Запишемо для цих реакцій значення констант рівноваги, що виражені через парціальні тиски компонентів:
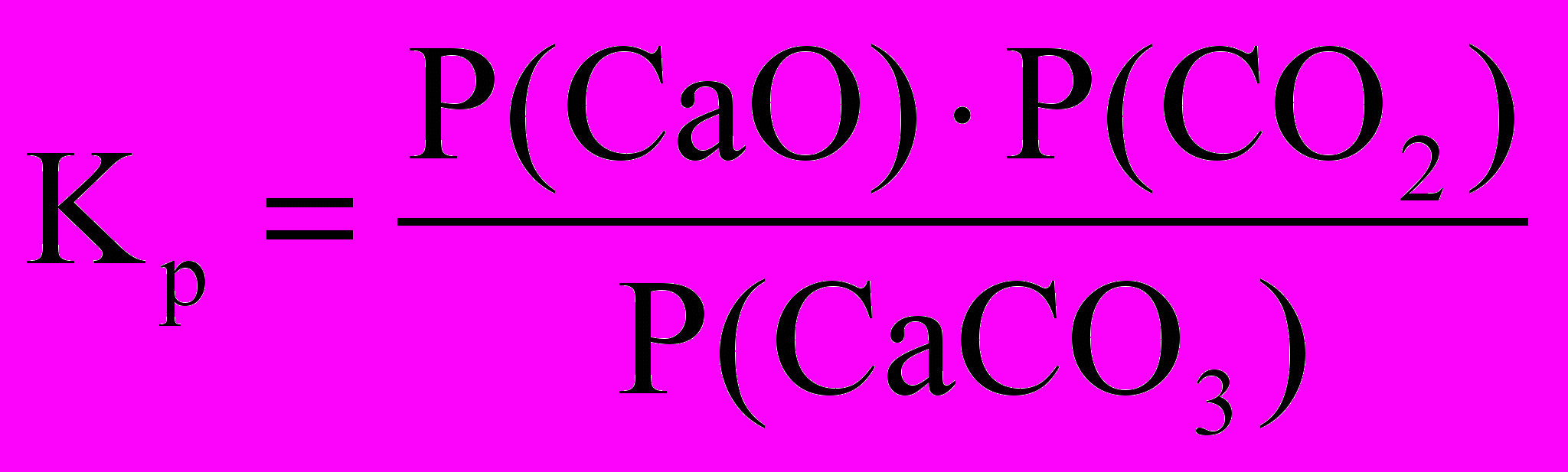 і
і 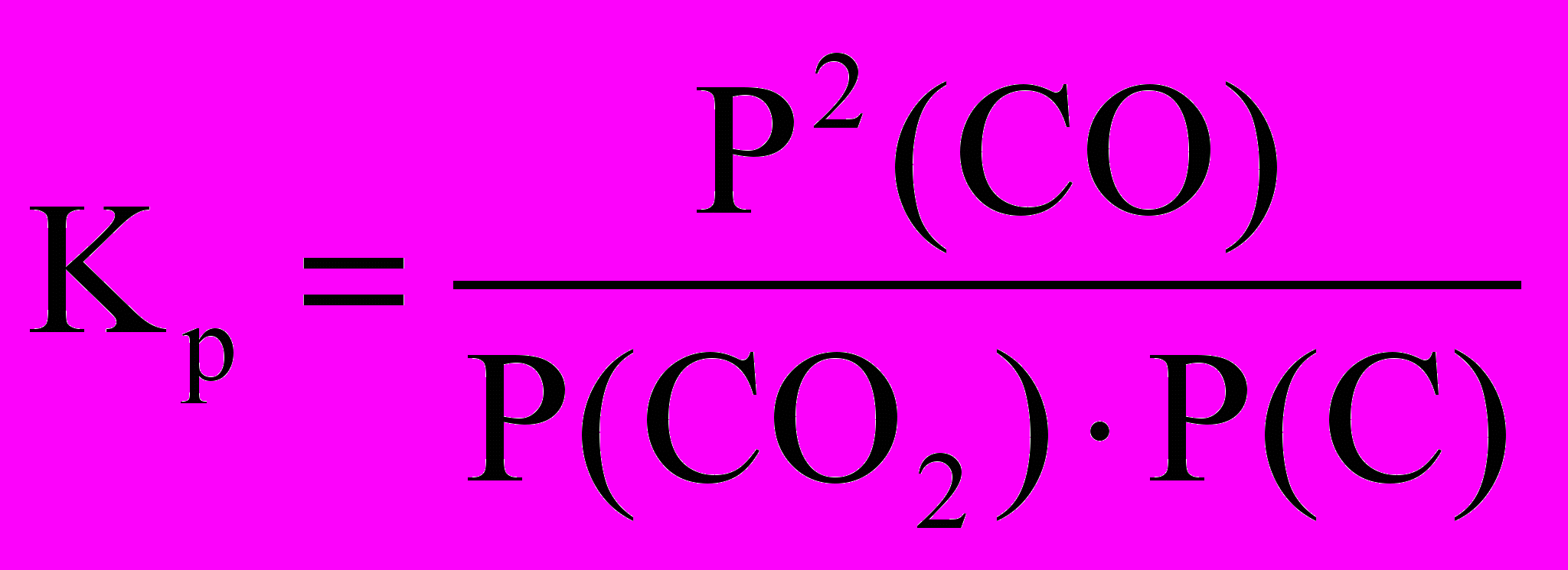 .
.У цих співвідношеннях величини Р(СаСО3), Р(СаО) і Р(С), тобто парціальні тиски карбонату кальцію, оксиду кальцію та вуглецю при заданій температурі постійні. Тоді константи рівноваги для наведених гетерогенних реакцій відповідно дорівнюють
Кp = Р(СО2) і Кp = Р2(СО)/Р(СО2).
Усі інші співвідношення, отримані нами для описування хімічної рівноваги, справедливі і для гетерогенних реакцій.
