На основі взаємозвязку між термодинамічними
| Вид материала | Лекція |
- Зразок оформлення тез доповідей, 16.21kb.
- Міжпредметні зв'язки шкільного курсу біології, 822.5kb.
- Інвестиційні процеси в Україні розвиваються у тісному взаємозв’язку з загальноекономічним, 68.01kb.
- Як нова мегаінституція глобального економічного середовища, 249.01kb.
- Реферат на тему: Соціальна система: дії, взаємодії, конфлікти, 140.82kb.
- Воляють встановити оптимальний його перелік на підставі кількісного вираження взаємозв’язку, 166.98kb.
- Закон україни, 950.07kb.
- Еволюція соціальних мереж Історія поняття, 139.28kb.
- Національна Академія Наук України Інститут біохімії ім. О. В. Палладіна реферат, 192.56kb.
- Закон україни про виконавче провадження, 1267.36kb.
В
an
an
a3
a2 a3 a1 a2
a1
в3
в2 в3
в1 в2
с3 а2 в1
с2 с3 а1
с1 с2
в2 с1
с3 в1
А с1 с2
0 Х2 1
Рисунок 8.6 – Ректифікація леткої суміші
збільшуються і утворюються практично чисті компоненти А і В.
При ректифікації операції конденсації та дистиляції автоматизуються. Апарати, в яких відбувається ректифікація, називаються ректифікаційними колонами. У цих колонах пара, що відходить з перегінного апарату, конденсується. Рідина, що утворюється при конденсації, стікає по контактним пристроям зверху вниз, а пара проходить із куба знизу вгору. При достатньо великій кількості ступенів контакту можна отримати практично чисті компоненти суміші, що розділяється.
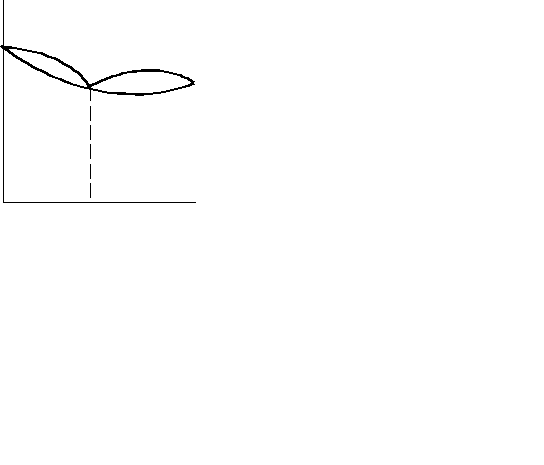 Якщо позитивні або негативні відхилення від закону Рауля набувають значних величин, то на діаграмах стану можуть виникнути максимуми або мінімуми. Виникнення таких екстремумів більш вірогідне для сумішей рідин, що мають близькі температури кипіння (рис. 8.7).
Якщо позитивні або негативні відхилення від закону Рауля набувають значних величин, то на діаграмах стану можуть виникнути максимуми або мінімуми. Виникнення таких екстремумів більш вірогідне для сумішей рідин, що мають близькі температури кипіння (рис. 8.7). Т T
Т T  Р = const
Р = const P = const
Х = У Х = У
А В А В
а б
Рисунок 8.7 – Діаграма стану з екстремумами:
а – максимум; б – мінімум
В екстремальних точках (максимумах або мінімумах температури кипіння) рідина і пара мають однаковий стан. На діаграмах криві рідина і пара поєднуються, тому для екстремальних точок Х = У. Звідси випливає, що суміші, для яких можливий максимум або мінімум температури кипіння на діаграмі стану, не можна розділити перегонкою. Перегонка завжди призводить до складу, що має екстремальну температуру кипіння (Х = У) та розділення припиняється. Далі розчин переганяється як окрема рідина.
Суміші, що відповідають мінімальній або максимальній температурі кипіння, називаються азеотропними сумішами. Існування азеотропу у леткій суміші , як правило, небажане. Одним із засобів усунення азеотропу є змінення зовнішнього тиску і, отже, температури кипіння леткої суміші. При цьому склад азеотропу та розміщення екстремальної точки на кривій температури кипіння змінюються, і в деяких випадках азеотроп зовсім зникає. Так, наприклад, при зниженні тиску над розчином етилового спирту – вода від 101325 Па (700 мм рт. ст.) до 18300 Па (100 мм рт. ст.) склад азеотропу змінюється від 95,6 до 99,6 %.
Утворення азеотропних сумішей може бути використано для розділення рідких розчинів речовин з близькими температурами кипіння. Річ іде про так звану азеотропну перегонку. Принцип її полягає у тому, що у розділяємий перегонкою розчин вводять речовину, що утворює з одним із компонентів азеотропну суміш з мінімальною температурою кипіння. У результаті один компонент розділяємого розчину утворюється у чистому вигляді, а інший – у виді азеотропної суміші зі спеціально введеною речовиною. Наприклад, при розділенні мета- і параксилолів (Ткип = 139,1 і 138,350С) у розділяємий розчин вводять метанол, що утворює з параксилолом азеотроп з Ткип = 640С. При перегонці такої системи з дистилятом виходить азеотропна суміш параксилолу з метанолом, а кубовий залишок є практично чистим мета-ксилолом. Для відділення параксилолу від метанолу у даному випадку використовують звичайну водну відмивку, оскільки метанол гарно розчиняється у воді.
8.3 кріоскопія і ебуліоскопія
Зупинимося тепер на важливому висновку, що випливає із закону Рауля. Він стосується температур кристалізації та кипіння розведених розчинів неелектро літів.
Розглянемо розведені водні розчини. На рис. 8.8 наведені фрагменти діаграми стану води (повну діаграму див. на рис. 7.1). Чиста рідина кристалізується (замерзає) тоді, коли тиск пари над нею буде дорівнювати тиску пари над кристалами цієї речовини. Для води це відбудеться при температурі, що відповідає перетину кривих ОК і ОВ,
тобто при температурі Т0кр.

 Р
Р

К К К




О

О
 О
О В
В Ткр Ткр Т0кр Т0кр Ткр Ткр Т
Ткр Ткр Т0кр Т0кр Ткр Ткр ТРисунок 8.8 – Визначення Ткр і Ткип
Якщо тепер додавати у воду речовину, що розчиняється, то тиск пари розчинника над розчином відповідно до закону Рауля зменшиться порівняно з тиском пари над чистою водою (крива ОК). Охолодження розведеного розчину речовини призводить до того, що при визначеній температурі, яка називається температурою кристалізації розчину, з нього починає виділятися твердий розчинник. Кристалізація розчинника у точці, де тиск пари розчинника над розчином дорівнює тиску пари над твердим розчинником, тобто в точці О. Цій точці буде відповідати більш низька температура кристалізації Ткр.
При додаванні наступної кількості розчиненої речовини відбудеться подальше зниження температури кристалізації до Ткр. Таким чином, зниження температури кристалізації Тікр = Т0кр – Тікр буде залежати від концентрації розчину Ткр = Кс, де К – кріоскопічна константа розчинника; с - моляльна концентрація розчину. Кріоскопічна константа характеризує зниження температури кристалізації розчинника при розчиненні у 1000 г його одного моля нелеткої речовини. Моляльна концентрація характеризується кількістю молів розчиненої речовини, що припадає на 1000 г розчинника.
Рідина кипить, коли тиск пари над нею дорівнює зовнішньому тиску. Із рис. 8.8 простежується, що розведені розчини киплять при температурах більш високих, ніж температура кипіння чистого розчинника. Причому підвищення температури кипіння залежить від концентрації розчину, тобто Ткип = Ес. Тут Е – ебуліоскопічна константа розчинника; с – моляльна концентрація розчину. Ебуліоскопічна константа характеризує підвищення температури кипіння розчинника при розчиненні у 1000 г його одного моля нелеткої речовини.
Кріоскопічна і ебуліоскопічна сталі залежать тільки від природи розчину. Як правило, їх значення визначають експериментально. У табл. 8.1 наведені значення К і Е деяких найбільш розповсюджених розчинників.
Отримані нами співвідношення є основою кріоскопічного та ебуліоскопічного методів визначення молекулярних мас нелетких речовин. При цьому вони використовуються у вигляді
Таблиця 8.1 – Величини К і Е ( Ккгмоль-1) деяких розчинників
Розчинник | К | Е |
| Вода Бензол Піклогексан Чотирихлористий вуглець | 1,86 5.12 20,22 - | 0,52 2,53 2,75 5,0 |
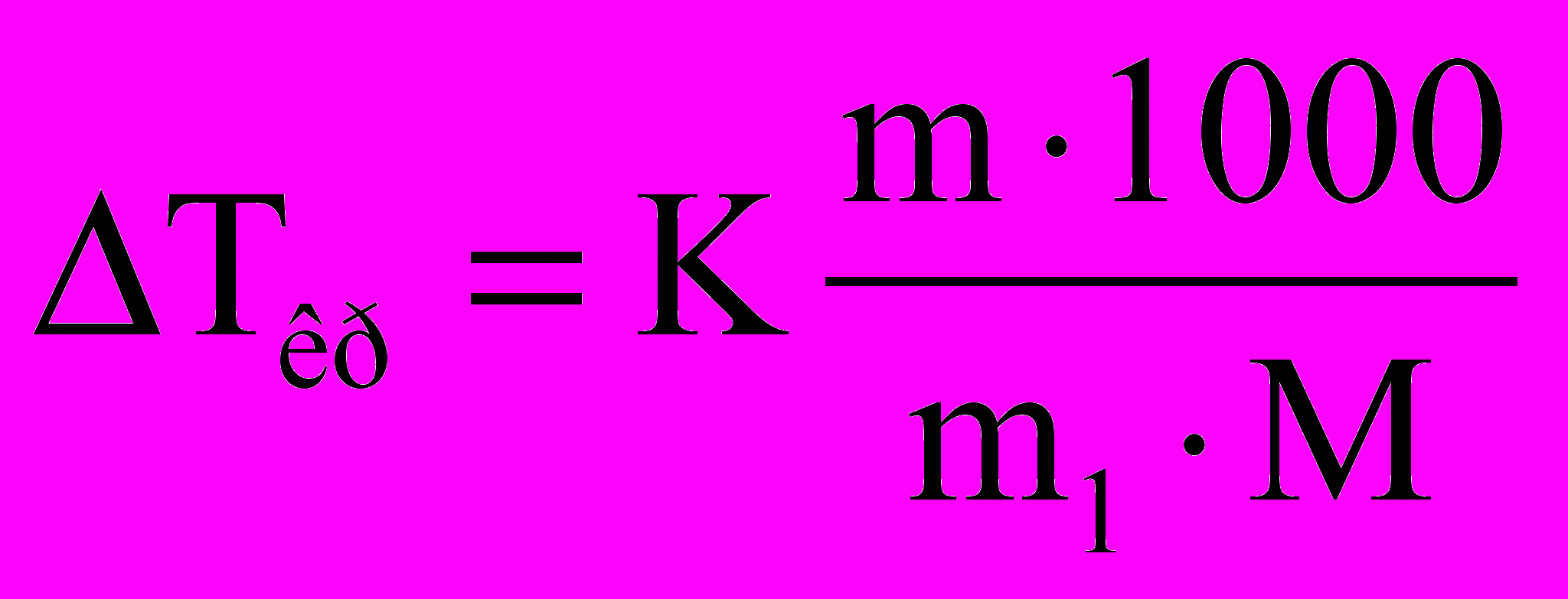 ,
,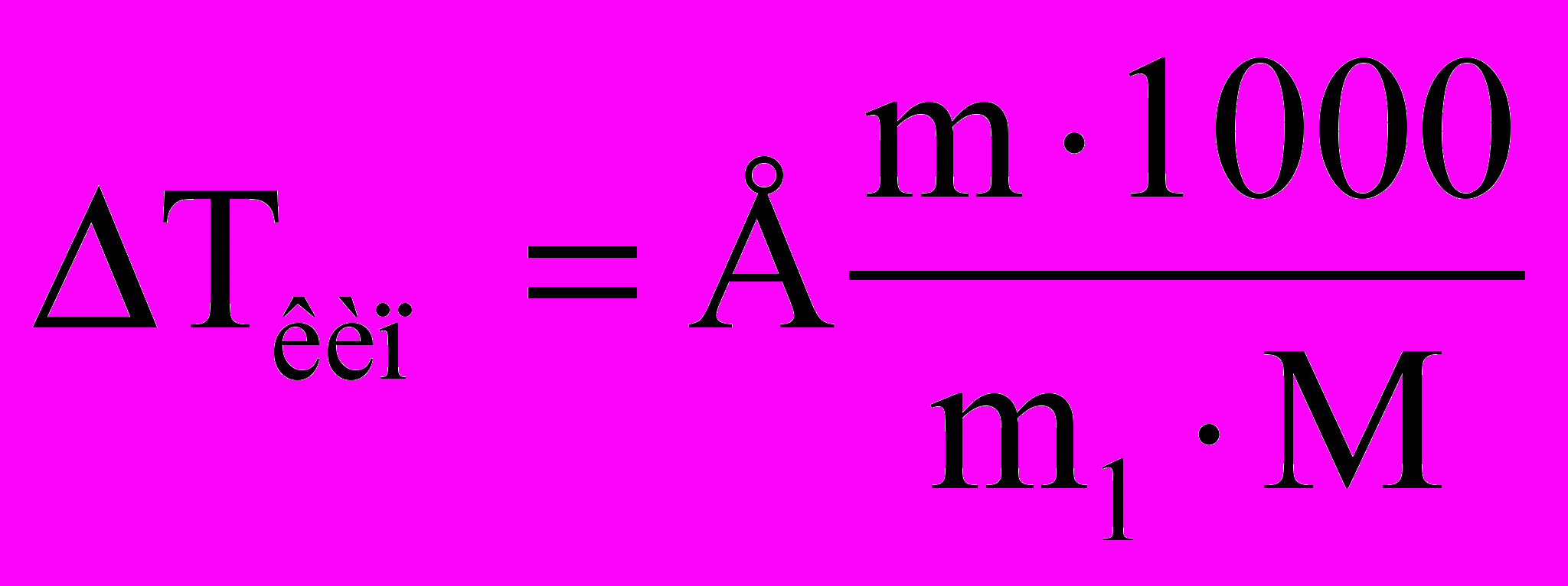 .
.Тут m і m1 – маси розчиненої речовини та розчинника ;
М – молекулярна маса розчиненої речовини.
8.4 розчинність газів у рідинах
Під розчинністю газів розуміють кількість газу, здатного розчинитися у одиниці обєму рідини при даній температурі. Теоретично ідеальна розчинність газів визначається законом Рауля: Р2 = Р20 Х2 або Х2 = Р2/Р20, де Х2 – мольна частка розчиненого газу. Тобто мольна частка розчиненого газу пропорційна його тиску і ідеальна розчинність газу не залежить від розчинника, а визначається тільки тиском пари розчиненої речовини.
 Р Для реальних розчи-
Р Для реальних розчи-нів спостерігаються
відхилення від закону
Рауля. Із рис. 8.9 про,
стежується, що у ви
падку позитивних від
хилень в області малих
концентрацій (мало
го вмісту розчиненого
газу) крива для роз
1 Х2 2 чинника практично
зливається з прямою
Рисунок 8.9 – До пояснення для ідеального розчину,
закону Генрі тобто для розчинника
виконується закон
Рауля: Р1 = Р10 Х1.
Для розчиненого газу у цій самій області також спостерігається лінійна залежність тиску пари від складу розчину, але коефіцієнт пропорційності вже не дорівнює тиску насиченої пари розчиненого газу:
Р2 = к Х2.
Ця закономірність вперше була виявлена у 1803 р. англійським ученим У.Генрі і називається законом Генрі:
при постійній температурі розчинність
газу у рідині пропорційна тиску цього газу
над розчином.
Коефіцієнт пропорційності к називається константою Генрі; її можна використовувати для характеристики розчинності газів у рідинах. У випадку ідеальної розчинності к = Р20. Для реальних розчинів ця константа відрізняється від тиску насиченої пари розчиненого газу.
У технології процес розчинення газів у рідинах називають абсорбційєю, а розчинність газів у рідинах прийнято характеризувати коефіцієнтом абсорбції іt. Останній – це обєм газу, зведений до нормальних умов і який розчиняється в одному обємі рідини при нормальному тиску і заданій температурі. Наприклад, коефіцієнт абсорбції кисню ацетоном при 200С дорівнює 20(О2) = 0,216. Розчинність газів у рідинах може характеризуватися і іншими одиницями.
список литературы
- Стромберг А.Г., Семиченко Д.П. Физическая химия. –
М.: Высшая школа, 1988.
- Киреев В.А. Краткий курс физической химии. – М.: Химия, 1978.
- Герасимов Я.И., Древинг В.П., Еремин Е.Н. и др. Курс физической химии. – М.: Химия, 1969. – Т.1. 1973. – Т.2.
