Лекции по биофизике Взаимодействия между разными аминокислотными остатками
| Вид материала | Лекции |
- Лекции по биофизике Электродиффузия Диффузия ионов при наличии электрического поля, 112.29kb.
- 1. Некоторые вопросы строения веществ, 1501.26kb.
- Впрошлой лекции мы познакомились с функциональными блоками ЭВМ и основными принципами, 110.21kb.
- А. З. Моделирование отношений между разными типами представлений (модель управления), 2313.08kb.
- А. С. Кожин Alexey Kozhin проблемы передачи данных между асинхронными доменами вычислительного, 122.63kb.
- Номинальные и реальные величины, 50.96kb.
- Действующие закон, 770.6kb.
- Россия в 1907-1914 гг, 70.71kb.
- Происхождение многоклеточных организмов, 123.51kb.
- Информационное письмо благодаря таким экономическим мероприятиям мы двигаемся вперёд!, 129.24kb.
Лекции по биофизике
Взаимодействия между разными аминокислотными остатками
Введение
В предыдущей лекции мы рассматривали взаимодействия между атомами в пределах одного аминокислотного остатка. Эти взаимодействия приводят к тому, что конформация остатка, которая определяется двумя углами вращения вокруг одинарной связи, названой углами и , во-первых, ограничена стерическим фактором, а во-вторых зависит от энергии системы, определяемой вкладом трех составляющих:
- Дисперсионными взаимодействиями (силы Лондона).
- Электростатическими (диполь-дипольными) взаимодействиями
- Торсионными силами, которые несколько ограничивают вращение при некоторых углах и .
Очевидно, однако, что в составе полипептидной цепи могут существовать взаимодействия между атомами, принадлежащими разным аминокислотным остаткам. К ним причисляют четыре типа взаимодействий:
- Водородные связи
- Гидрофобные взаимодействия
- Ионные взаимодействия
- Дисульфидные химические связи.
Первые два типа взаимодействий относятся как к взаимодействию соседних, так и отдаленных аминокислотных остатков; третье и четвертое – только к остаткам, расположенным в разных участках одной и той же полипептидной цепи или даже двух разных полипептидных цепей.
Именно наличием взаимодействий между аминокислотными остатками и объясняются случаи расхождения между рассчитанными и реальными углами и в полипетидных цепях, о котором говорилось в конце предыдущей лекции (см. рис. 8 в лекции 1).
Водородные связи
Водородные связи образуются между донорной молекулой D–H и молекулой-акцептором A:
D–H···A
Экспериментально водородные связи между донорной и акцепторной химическими группами обнаруживаются по сдвигу полос соответствующих групп в инфракрасных спектрах поглощения, спектрах комбинационного рассеяния, в спектрах ЯМР. Образование водородных связей между молекулами того же самого вещества проявляется в изменении температуры плавления или кипения соответствующей чистой жидкости. Сравним , например, этан, метиламин, сероводород и воду (см. таблицу 1).
Таблица 1. Температуры плавления и кипения близких по строению молекул
-
Вещество
Формула
Водородная связь
Т-ра плавления (К)
Т-ра кипения (К)
Этан
H3C–CH3
Нет
101
185
Метиламин
H3C–NH2
N···H–
181
267
Сероводород
HSH
=S···H–
190
211
Вода
HOH
=O···H–
273
373
Из этой таблицы видно, что при образовании водородной связи между молекулами происходит рост как температуры плавления, так и температура кипения, причем это действие усиливается в ряду: углерод < азот < сера < кислород, в строгом соответствии с ростом электронегативности атома.
Идея водородной связи, как известно, легла в основу гипотезы Полинга и Кори о вторичной структуре белка. На рис. 1 дано схематическое изображение спирали.
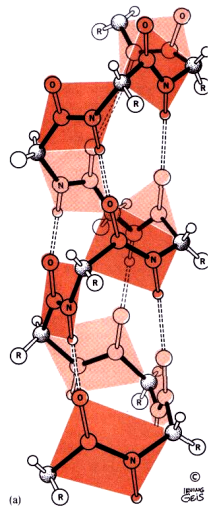 | Рис. 1. Вторичная структура полипептида. Слева показана правая спираль. Показаны только атомы в основной цепи пептида. Параллелограмм показывает плоскость каждой пептидной связи. [Рисунок Ирвинга Геиса]. Справа – изображение -складчатой структуры. Видно образование большого числа водородных связей =N–H···O=Сº . Фактически все иминогруппы образуют водородные связи со всеми карбонильными группами. | 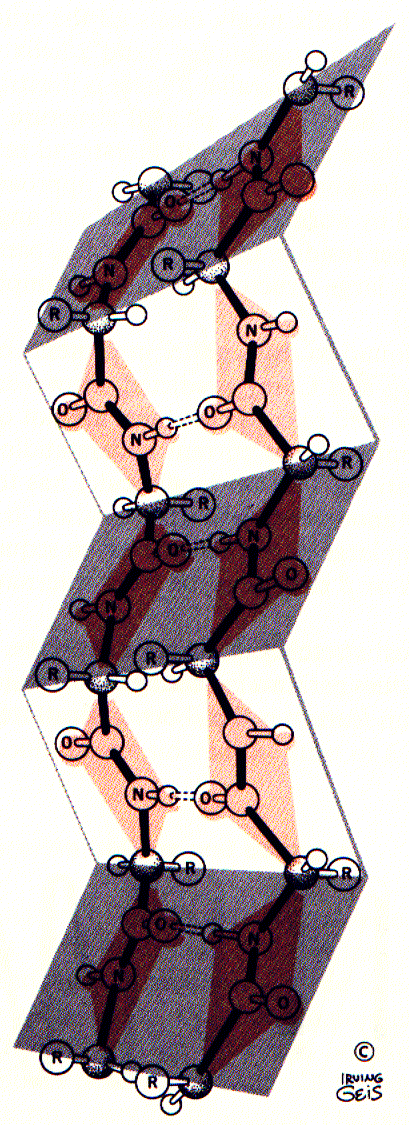 |
Рисунок 1
Создавая модели вторичной структуры белков, Полинг и Кори исходили из того, что в газовой фазе образование каждой такой связи дает выигрыш энтальпии около 5–7 ккал/моль; ясно, что число связей должно быть максимально возможным. Однако надо сказать, что при более пристальном рассмотрении проблемы энергетический выигрыш от образования водородных связей оказывается не столь безусловным. Дело в том, что в водном окружении на месте разорванных водородных связей =N–H···O=Сº образуются новые водородные связи с молекулами воды:
=N–H···O=Сº + H2=O···H–O–H =N–H···O=H2 + H–O–H···O=Сº
Энергетический эффект такой замены одних водородных связей на другие неочевиден. Эксперимент показывает, что, во всяком случае, заметного выигрыша энергии теперь не происходит, если не наоборот.
Моделью водородных связей в белках может служить раствор N-метилацетамида, молекулы которого образуют водородные связи друг с другом.

Как показали еще в 1962 году Клотц и Францен, в совершенно аполярном растворителе – четыреххлористом углероде при образовании водородных связей происходит выигрыш энергии, в результате чего эти молекулы охотно дают агрегаты, регистрируемые по инфракрасным спектрам поглощения. Концентрация 50% агрегации – менее 0,1 М. В диоксане могут образовываться водородные связи с молекулами растворителя, и 50% агрегация метилацетамида имеет место лишь при его концентрации около 1 М. В воде агрегаты образуются при огромных концентрациях метилацетамида – более 10 М.
Эти данные говорят о том, что стабилизирующая роль водородных связей при образовании вторичной структуры белков может происходить лишь в неводном окружении. По этой причине в белках участки спирали и -структуры образуются гидрофобными аминокислотами в неполярных зонах (т.е. в глубине) белковой глобулы.
Структура воды и гидрофобные взаимодействия
Особенности воды как жидкости
Напомним некоторые свойства воды, известные каждому школьнику:
При охлаждении вода сжимается только до 4оС, а затем начинает расширяться. Объем льда существенно превышает объем воды при 0оС. Другие жидкости сжимаются и при охлаждении, и при замерзании.
Теплоемкость воды намного превышает теплоемкость других жидкостей, состоящих из молекул близкой молекулярной массы.
Строение молекулы воды
Многие свойства воды, о которых говорилось выше, объясняются особенностями строения ее молекулы и их взаимодействием в жидкой воде и кристаллах льда.
На рис. 2 схематически представлено строение молекулы воды.

Рисунок 2. Строение молекулы воды
А – Кислород имеет р–электронные орбитами, оси которых перпендикулярны друг другу.
Б – В силу отталкивания электронных облаков, угол между осями р–орбиталей увеличивается от 90о до почти 120о. В результате молекула воды приобретает структуру тетраэдра, в центре которого расположет атом кислорода, по двум углам – атомы водорода, а по двум другим – вакансии, где электронные орбитали кислорода могут взаимодействовать с атомами водорода соседних молекул воды, образуя с ними водородные связи (см. следующий рисунок).
В кристаллах льда молекулы-тетраэдры образуют рыхлую пространственную решетку, изображенную на рис. 3, А. Поскольку трехмерные фигуры плохо изображаются на плоском листе бумаги, мы будем в дальнейшем представлять структуру воды в виде схемы на плоскости (рис. 3Б), не забывая об условности такого представления.

Рисунок 3. Трехмерная кристаллическая структура льда.
А – как она выглядит в действительности (в пространстве). Б – как мы будем изображать ее для простоты (на плоскости).
Как на рис. 3А, так и на рис 3Б хорошо видно, что атом кислорода образует две ковалентные связи и две водородные связи с четырьмя окружающими его атомами водорода; два из них принадлежат той же самой, а два других – соседним молекулам воды. Видно также, что между атомами образуются значительные пустоты. Эти пустоты и предопределяют низкую плотность льда. В жидкой воде часть молекул также организована в маленькие «айсберги», структура которых аналогична структуре льда. Но другая часть молекул находится в неорганизованной форме, а некоторые из них заполняют пустоты в решетке айсбергов» (см. рис. 4).
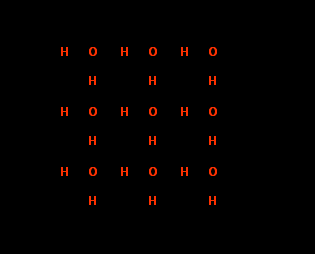
Рисунок 4. Структура воды.
В жидкой воде при комнатной температуре около половины молекул входит в состав микрокристаллов, называемых обычно кластерами. (На схеме атомы этих молекул даны более мелким шрифтом). Остальные молекулы расположены хаотически, при этом часть их заходит в полости решетки кластеров. В результате этого плотность воды при температуре плавления выше плотности льда, что не характерно для других жидкостей.
Как неполярные молекулы растворяются в воде?
Небольшие неполярные молекулы могут проникать в кристаллическую решетку воды и размещаться в полостях этой решетки, как это схематически изображено на рис. 5. В действительности полости – не пустые квадратики, как показано на рисунке 5 А, а трехмерные ячейки пентагонального додекаэдра (рис. 5 Б, В).

Рисунок 5. Полости в кристаллической решетке водных кластеров, в которых могут размещаться небольшие (до 5 А диаметром) молекулы гидрофобных соединений.
А –двумерное изображение. Б, В – трехмерные изображения.
Энергия перехода неполярных молекул из гидрофобной в водную фазу
Как изменится энергия системы, если молекулы неполярного соединения будут переходить из неполярного растворителя в водный раствор?
С одной стороны, вытеснение одиночных молекул воды из полостей решетки кластеров должно сопровождаться снижением энергии системы за счет образования дополнительных водородных связей при кластеризации воды. Очевидно, что сам по себе переход:
Разобщенные молекулы воды Кристаллическая решетка кластеров
приводит к выделению энергии в форме тепла (энтальпия перехода H < 0).
С другой стороны, упорядочение системы (кристаллизация) будет сопровождаться ростом энтропии (S > 0).
Вопрос в том, каким окажется в итоге изменение свободной энергии системы ( G), а вместе с тем – направление процесса. Напомним, что:
H = G + TS ; G = RTlnK,
где K – константа равновесия (в нашем случае – равновесие между неупорядоченной водой и кластерами).
Ответ на вопрос дал эксперимент. Некоторые результаты измерений термодинамических параметров переноса углеводородов из неполярных растворителей в воду приведены в таблице 1.
Таблица 2
Термодинамические параметры переноса углеводородов из неполярных растворителей в воду при 25оС
-
Реакция переноса
H, ккал/моль
S, кал/моль
G, ккал/моль
CH4 из бензола
– 2,8
– 18
+ 2,6
CH4 из эфира
– 2,4
– 19
+ 3,3
CH4 из CCl4
– 2,5
– 18
+ 2,9
C2H6 из бензола
– 2,2
– 20
+ 3,8
C2H6 из CCl4
– 1,7
– 18
+ 3,7
ИСТОЧНИК: W. Kauzmann, Adv. Protein Chem. 14:1(1959)
Можно видеть, что во всех случаях перехода неполярной молекулы в воду из неполярного растворителя происходит выделение энергии, но одновременно резко уменьшается энтропия системы, что приводит к росту свободной энергии системы.
Таким образом, высвобождение энергии в результате образования новых водородных связей в воде при растворении углеводородов не делает этот процесс в целом энергетически выгодным: резкое снижение энтропии приводит к тому, что в итоге свободная энергия системы существенно возрастает, а это значит, что процесс будет идти «не туда, а обратно». По этой причине, углеводороды в воде не растворяются.
Вопросы к зачету
- Перечислите основные виды взаомодействий (1) между соседними атомами в полипептидной цепи и (2) между группами, принадлежащим разным аминокислотным остаткам в полипептидной цепи.
- Водородная связь. Ее роль в формировании структуры белка.
- Особенности структуры воды и ее свойства.
- Что происходит при растворении в воде неполярных молекул?
- Энергия перехода неполярных молекул из гидрофобной в водную фазу.
- Как можно количественно выразить гидрофобность данного вещества?
Оптические методы изучения вторичной структуры синтетических полипептидов и белков
Молекулярные орбитали и электронные переходы
Прежде чем рассматривать поглощение света группами, входящими в состав белков и нуклеиновых кислот, рассмотрим свойства более простых молекул. В общем случае для ответа на этот вопрос необходимо решить стационарное уравнение Шредингера для системы из нескольких атомов частиц. Точное решение обычно получить не удается, но при помощи приближенных методов удалось сделать некоторые полезные выводы. Главное упрощение состоит в том, что не рассматриваются электроны, которые находятся вблизи какого-либо одного ядра, поскольку их орбитали мало отличаются от орбиталей в случае изолированного атома и не принимают участия в образовании химических связей и в электронных переходах при поглощении видимого и ультрафиолетового излучения в оптическом диапазоне, т.е. между 180 и 800 нм. Рассматриваются только те электроны, которые делокализованы по орбиталям, окружают одновременно два или несколько ядер и образуют, таким образом, химические связи. Именно эти электроны участвуют в поглощении света.
Результаты приближенных квантово-механических расчетов, рассмотрим на примере молекулы формальдегида.
Молекулярные орбитали в молекуле формальдегида
Формальдегид имеет следующую структурную формулу:

Четыре атома, входящие в состав молекулы формальдегида, содержат в общей сложности 16 электронов.
Рассмотрим вначале распределение электронов по орбиталям в атомах водорода углерода и кислорода из которых состоит молекула формальдегида.
| В атоме водорода единственный электрон занимает 1s орбиталь. |  |
В атоме углерода из 6 электронов 4 должны занимать 1s и 2s орбитали, а еще два – орбитали 2py и 2px.

Однако в результате электростатического отталкивания электронных облаков угол между 2py, 2px и 2pz орбиталями увеличивается с 90 до 120о, происходит гибридизация орбиталей 2s2, 2py, 2px с образованием тетраэдрической конфигурации из трех 2sp орбиталей и орбитали 2рz, направленных из центра тетраэдра к его вершинам.

Объединение 1s орбиталей водорода и 2 sp орбиталей углерода образует группу CH2.

Схематическое изображение образования химических связей между группой CH2 и атомом кислорода, которое приводит к образованию молекулы формальдегида, приведено ниже. В верхней части схемы показано размещение электронов на орбиталях атома кислорода. В нижней части повторена электронная структура группы CH2. Пунктиром обведены пары электронов, образующие химические связи между углеродом и кислородом. Пунктирный овал –-связь, пунктирная «восьмерка» – –связь.

П
рис. 1
ервая из этих связей, -связь, образуется объединением орбиталей углерода и кислорода, причем образующееся электронное облако обладает осевой симметрией и не имеет узлов, т.е. участков с нулевой электронной плотностью (см. рис. 1).
Расчеты энергии молекулярных орбиталей (проведенные например методом МО ЛКАО – «Молекулярные Орбитали есть Линейная Комбинация Атомных Орбиталей»), показывают, что наивысшими заполненными молекулярными орбиталями оказываются связывающая -орбиталь и несвязывающая 2py орбиталь кислорода. Последняя получила название n-орбитали (от слова non-bonding, несвязывающая).
Электронные переходы в молекуле формальдегида
Р
Рис. 2
асчеты молекулярных орбиталей позволяют найти энергию не только верхних заполненных (ВЗМО), но и нижних свободных молекулярных орбиталей (НСМО). В случае формальдегида нижняя свободная молекулярная орбиталь образуется разрыхляющей -орбиталью, обозначаемой как *. Схема энергетических уровней n, и * орбиталей дана на рис. 2.
Электронные переходы при поглощении света пептидной связью
Н
Рис. 3
а рис. 3 приведена схема энергетических электронных уровней пептидной связи. Основным оказался --переход, обусловленный, как и в случае формальдегида, поглощением -связи –C=O.
Рис. 4
Некоторый вклад в данную орбиталь дает азот, поскольку, как уже говорилось, связь C–N в пептидной группе «чуть-чуть двойная». Поглощение при -*-переходе в пептидной группе лежит в области 190 нм. Примером спектра поглощения, обусловленного таким переходом, может служить поглощение поли—L-лизина, спектр которого приведен на рис. 4.
Гипохромный эффект
И
Рис. 5
нтересно, что в зависимости от конформации полимера, оптическая плотность раствора оказывается несколько разной. Наименьшим поглощением обладает спираль (см. рис. 4, II), в которой векторы электронных -*-переходов параллельны друг другу и направлены приблизительно вдоль спирали, как это показано на рисунке 5.
При плавлении спирали ориентация диполей электронных переходов становится хаотической, и оптическая плотность раствора возрастает (рис. 4, I). Это позволяет изучать плавление спиралей, регистрируя изменения оптической плотности полипептидов при 190 нм. Впрочем в случае полипептидов более удобным показателем, чем гипохромный эффект, служит оптическое вращение и круговой (циркулярный) дихроизм, о которых речь пойдет ниже.
Линейный дихроизм ориентированных волокон полипептида
Если все диполи электронных переходов в какой-нибудь системе ориентированы совершенно одинаковым образом, то такая система будет хорошо поглощать плоско поляризованный монохроматический свет, плоскость поляризации которого параллельна направлению диполя электронного перехода, и совсем не будет поглощать свет с плоскостью поляризации, перпендикулярной этому направлению. В действительности таких идеальных образцов не бывает, да к тому же ориентация диполей слегка меняется во времени из-за теплового движения молекул. Тем не менее пленки и волокна, изготовленные из полипептидов, в которых спирали или -структуры ориентированы, обладают дихроизмом, т.е. различием в поглощении плоско поляризованного света при различном направлении вектора поляризации.
Экспериментальные приемы, позволяющие ориентировать удлиненные молекулы, такие как полипептиды со структурой спирали или фибриллярные белки, такие как коллаген, чаще всего основаны на ориентации этих молекул в потоке, например, внутри тонкого капилляра. Степень дихроизма d находят по уравнению:
d = (A║ – A)/(A║ + A) (1)
Рис.6
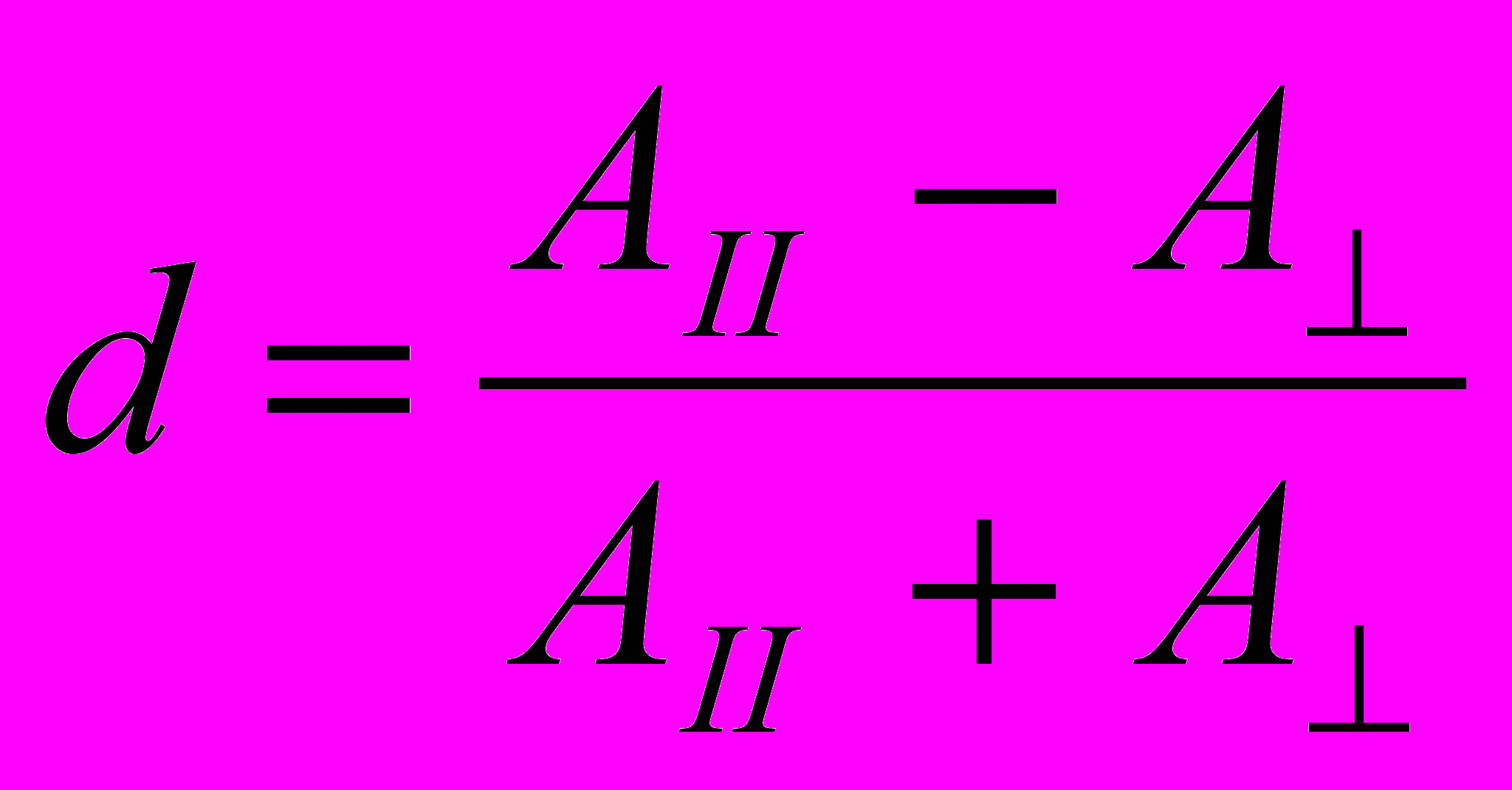 . (1)
. (1)Принцип измерения дихроизма поглощения показан на рисунке 6. Луч плоско поляризованного света направляют на образец. Направление вдоль предполагаемого расположения длинной оси молекул и перпендикулярно лучу света (ось x) принимают за ось z. Измеряют интенсивность света при ориентации плоскости поляризации света вдоль оси z (I||) и оси y (I).
Поглощательную способность (absorbency) находят, как обычно, по уравнению:
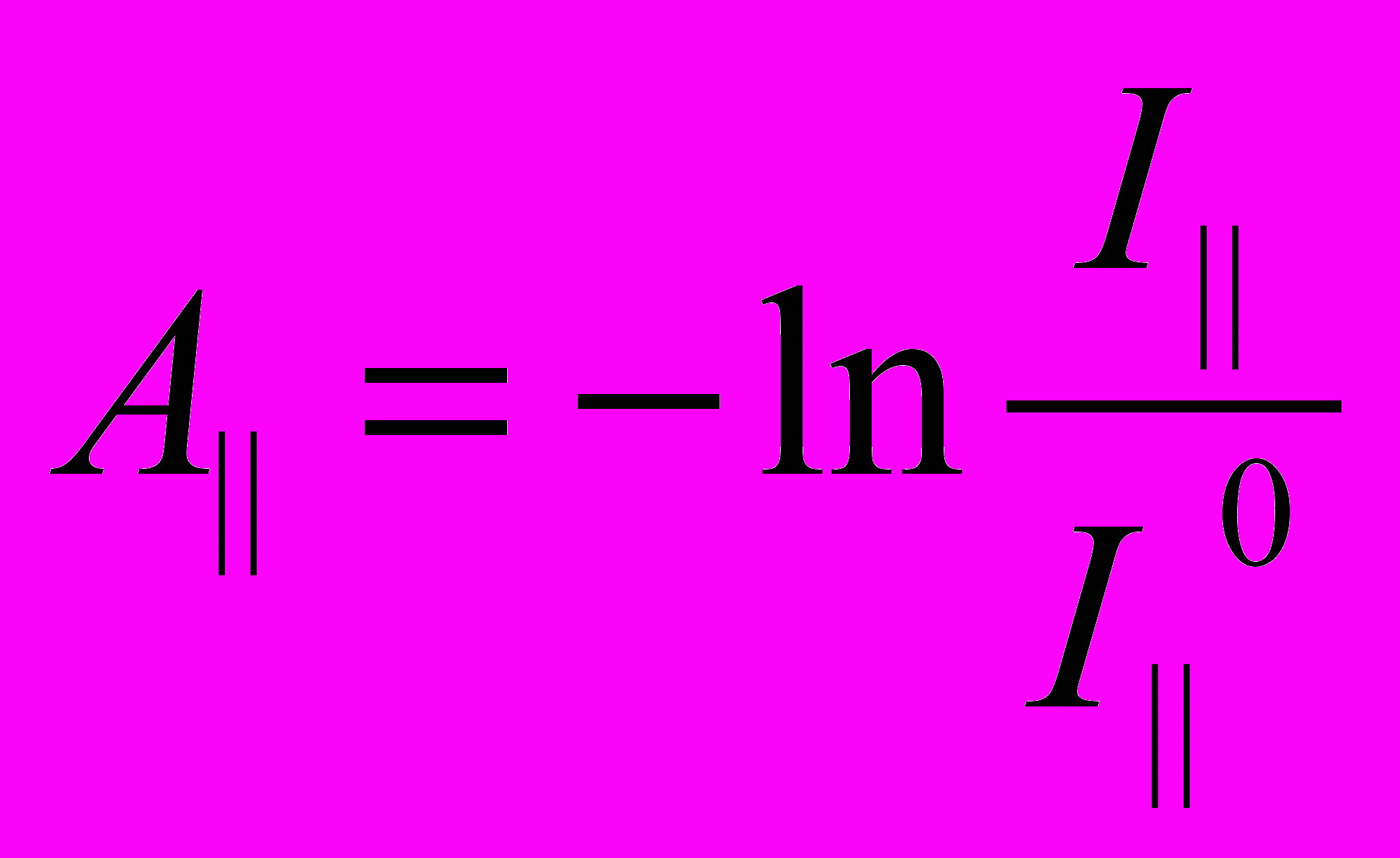 и
и 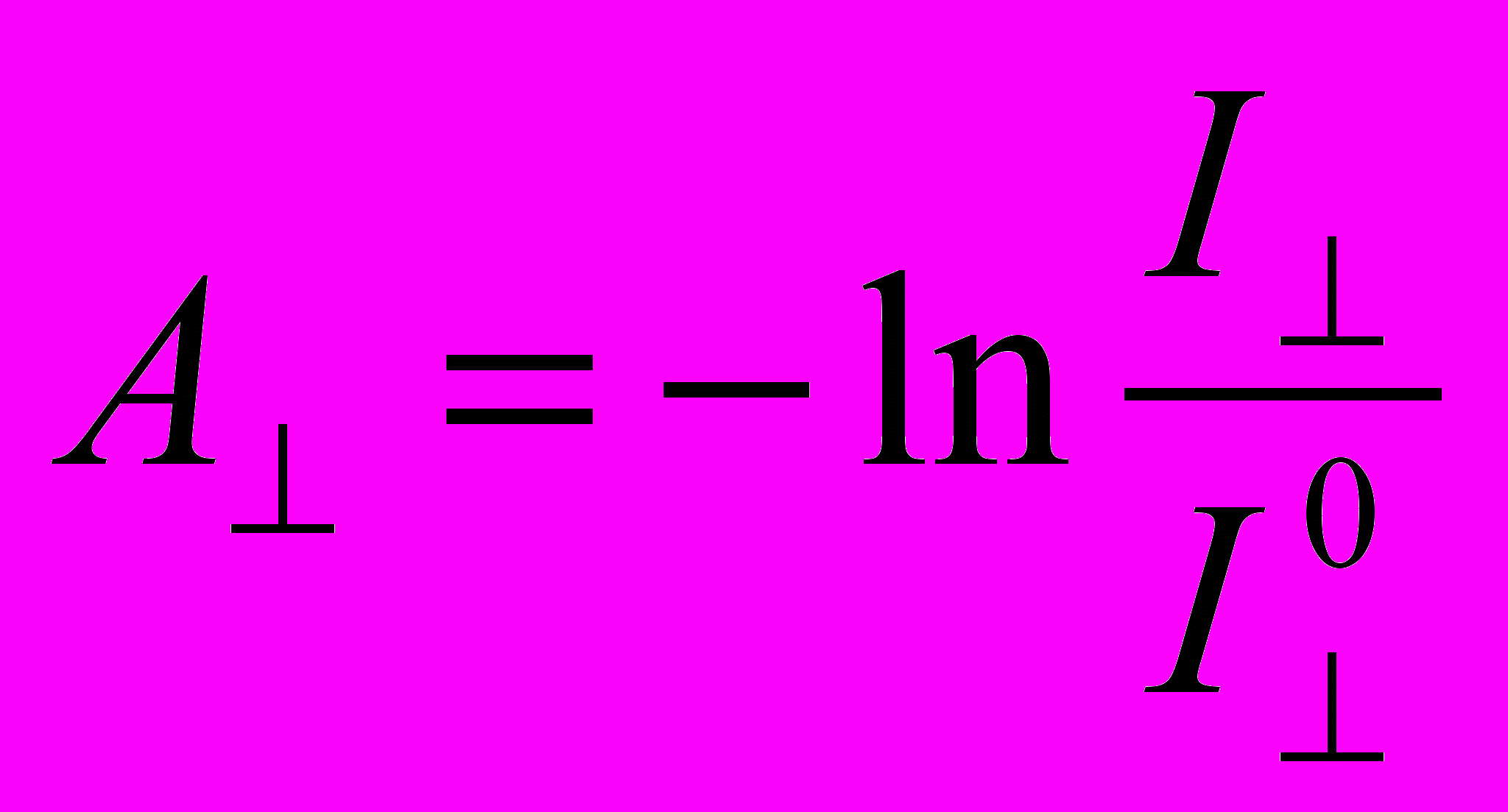 . (2)
. (2)Затем по уравнению (1) находят степень дихроизма образца.
В качестве примера на рисунке 7 приведен спектр линейного дихроизма пленки поли—L-глутаминовой кислоты при низких pH (ниже 4,5), в которой спирали вытянуты в нужном направлении в результате растяжения пленки.
Излишне добавлять, что при плавлении спиралей линейный дихроизм поглощения образца исчезает. Плавление в данном случае может быть вызвано появлением зарядов на остатках глутаминовой кислоты при достаточно высоких pH (т.е. при pH > pK карбоксильных групп, т.е. выше 4,5).
Таким образом, линейный дихроизм, как и гипохромный эффект, могут быть использованы для изучения спиральных структур в полипептидах. К сожалению, эти методы мало пригодны для изучения белков, поскольку в них поглощение пептидной связи маскируется мощным поглощением ароматических аминокислот и остатков гистидина и цистина.
Вопросы к зачету
- Молекулярные орбитали в молекуле формальдегида
- Электронные переходы в молекуле формальдегида
- Электронные переходы при поглощении света пептидной связью
- Гипохромный эффект
Линейный дих
