Взаимодействие ассоциативных бактерий и растений в зависимости от биотических и абиотических факторов 03. 00. 07 Микробиология
| Вид материала | Автореферат |
- Концепция уровней организации живой природы > Понятие об экологических факторах,, 19.35kb.
- Ирина Ивановна Сидорова. Объем курса 28 часов. Форма отчет, 24.09kb.
- Тесты по микробиологии, 156.97kb.
- Программа вступительного экзамена в аспирантуру по специальной дисциплине 06. 02., 270.79kb.
- В. Г. Гомберг " " 1999, 54.43kb.
- Методические рекомендации по выполнению лабораторной работы по курсу «Биология с основами, 402.75kb.
- Лекция 8 Эдафические факторы Греческое слово «эдафос» означает «земля» или «почва»., 162.42kb.
- Лекция Вторичные метаболиты (конспект), 36.18kb.
- Каталазная активность углеводородокисляющих бактерий 03. 02. 03 «Микробиология», 250.08kb.
- На прошлой лекции, обсуждая эдафические факторы, я сказал, что они являются логичным, 132.62kb.
3. Значение взаимодействия ассоциативных бактерий в ризосфере для эффективности инокуляции растений
3.1. Ассоциации интродуцируемых бактерий, обладающих аддитивным эффектом на питание и рост растений
Целью исследований являлось оценить влияние совместной интродукции производственных штаммов ризобактерий на растения и изучить взаимодействие интродуцентов как дополнительный фактор эффективности инокуляции. На первых этапах работы, результаты которой частично опубликованы (Белимов и Кожемяков, 1988; Белимов, 1990; Belimov et al., 1995), были использованы разные штаммы бактерий и их комбинации, а также различные виды растений. Наиболее интересные результаты были получены со штаммами Az. lipoferum 137 и Ag. radiobacter 10, которые были известны соответственно как азотфиксатор (Васюк, 1989) и мобилизатор фосфатов (Павлова и Горская, 1987). Установлено, что Ag. radiobacter 10 стимулирует нитрогеназную активность (Табл. 1) и рост штамма Az. lipoferum 137 при совместном культивировании. Вероятными механизмами положительного
Таблица 1. Взаимодействие штаммов Az. lipoferum 137 и Ag. radiobacter 10, и их влияние на потребление ячменем азотного и фосфорного удобрений
| Вариант опыта | Нитрогеназная активность | Накопление удобрений ячменем | ||
| Периодическая культура, нмоль С2Н4/ч/ 1 млн. азоспирилл | Ризосфера ячменя А, нмоль С2Н4/ч/ г корней | N удобренияБ, мг N/сосуд | Р удобренияВ, имп. 33Р /мин/ сосуд х 1000 | |
| Без инокуляции | 0 | 50 a | 39 a | 133 a |
| Az. lipoferum 137 | 2 a | 63 a | 58 bc | 134 a |
| Ag. radiobacter 10 | 0 | 89 a | 53 b | 172 b |
| Смесь штаммов | 12 b | 205 b | 64 c | 228 c |
А Измерения проводили в фазу выхода в трубку. Б Сумма зерна и соломы зрелых растений. В Побеги в фазу выхода в трубку. Разные латинские буквы указывают на существенное различие по критерию Фишера при Р < 0,05.
взаимодействия бактерий являлись потребление агробактериями избытка кислорода и стабилизация рН среды. Повышение нитрогеназной активности (Табл. 1) и приживаемости азоспирилл в ризосфере наблюдалось при инокуляции ячменя смесью штаммов. Оба штамма были способны активно колонизировать корни растений и поддерживать относительно высокую численность популяции (105÷106 кл./г корней) в течение всего периода вегетации растений. Инокуляция ячменя смесью Az. lipoferum 137 и Ag. radiobacter 10 оказывала максимальный эффект на массу зерна, а в некоторых случаях урожай был существенно выше по сравнению с вариантами инокуляций отдельными штаммами. У инокулированных растений повышались эффективность использования азотного удобрения (Табл. 1). Помимо способности Ag. radiobacter 10 растворять труднодоступные фосфаты, важную роль во взаимодействии этого штамма с растением играет стимуляция потребления фосфора из удобрений (Табл. 1). Однако Az. lipoferum 137 не влиял на фосфорное питание растений, и не являлся мобилизатором фосфатов (Белимов и др., 1999). Полученные данные указывают на различия в механизмах воздействия данных штаммов на растения, что приводит к аддитивному или синергическому эффекту на их питание и рост при совместной инокуляции. Результаты полевых опытов, в которых использовали биопрепараты на основе штаммов Az. lipoferum 137 (азоризин) и Ag. radiobacter 10 (агрофил), подтвердили более высокую эффективность инокуляции ячменя смесью штаммов (Рис. 1). Применение отдельных препаратов оказалось малоэффективным, за исключением достоверного увеличения урожая с. Темп на 12% при использовании агрофила в 1987 г. Обнаружена вариабельность реакции растений на инокуляцию в зависимости от сорта ячменя: максимальной отзывчивостью на инокуляцию обладал с. Темп, в то же время инокуляция с. Каскад оказалась неэффективной.
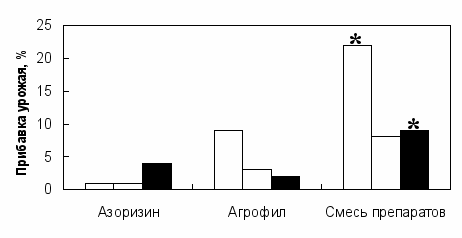
Рис. 1. Средние значения эффективности применения азоризина и агрофила для инокуляции ячменя в полевых опытах. Обозначения: (□) сорт Темп, среднее 2-х опытов 1987 и 1988 гг.; (▒) сорт Каскад, среднее 2-х опытов 1989 г.; (■) сорт Циклон, среднее 3-х опытов 1988 и 1990 гг. Символ * означает существенное повышение урожая по критерию Фишера при Р < 0,05.
Наблюдаемые положительные взаимодействия между Az. lipoferum 137 и Ag. radiobacter 10 свидетельствуют об образовании бактериальной ассоциации, в которой азоспириллы не только активнее фиксируют азот, но и лучше приживаются в ризосфере. Находясь в таких ассоциациях, бактерии существенно повышали свой потенциал положительного воздействия на растение. Наряду с этим, совместная интродукция штаммов, дополняющих друг друга по своим ростстимулирующим свойствам, оказывает аддитивные и синэргические эффекты на рост и питание растений. В результате положительных микробных взаимодействий в ризосфере и интеграции эффектов образуется растительно-бактериальная система, которая обладает достаточной устойчивостью и стабильностью функционирования. Результаты исследований, включая полевые опыты, показывают целесообразность совместного использования биопрепаратов азоризина и агрофила.
3.2. Роль взаимодействия интродуцируемых бактерий с аборигенной микрофлорой ризосферы в реакции растений на инокуляцию
В первый этап исследований входило выделение и характеристика представителей аборигенных бактерий (ДР-бактерий) доминирующих в ризосфере проростков ячменя, выращенного на 8 различных почвах. Затем эти ДР-бактерии были использованы для изучения роли аборигенной микрофлоры в эффективности взаимодействия интродуцируемых популяций ризобактерий с растениями. Изучение влияния метаболитов ДР-бактерий (всего 115 штаммов) на рост 22-х коллекционных штаммов ассоциативных бактерий методом агаровых пластинок показало, что 55 ДР-бактерий полностью ингибировали рост хотя бы одного коллекционного штамма, 12 ДР-бактерий ингибировали рост большинства штаммов, а 6 ДР-бактерий полностью ингибировали рост всех коллекционных культур. Только 13 штаммов ДР-бактерий стимулировали рост 1-3 коллекционных культур, которыми, как правило, являлись Flavobacterium sp. Л30 или Ar. mysorens 7. Штаммы рода Azospirillum были наиболее чувствительны к метаболитам ДР-бактерий. Представители семейства энтеробактерий были сравнительно устойчивы и положительного влияния ДР-бактерий на их рост не обнаружено. Наиболее устойчивыми являлись штаммы, относящиеся к родам Agrobacterium, Arthrobacter и Flavobacterium. Эти результаты согласовывались с данными о выживаемости в почве двух коллекционных штаммов. Так, численность чувствительного штамма Az. lipoferum 137 была существенно выше при внесении в почву рифампицина, который препятствовал развитию аборигенных микроорганизмов. Однако добавление в почву рифампицина не оказало существенного влияния на выживаемость устойчивого к микробным метаболитам штамма Ar. mysorens 7. Среди ДР-бактерий был отобран штамм Cytophaga jonsonae Д1, метаболиты которого in vitro улучшали рост Az. lipoferum 137. Динамика нитрогеназной
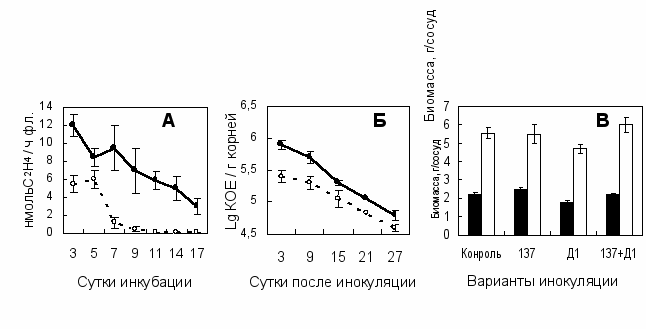
Рис. 2. Взаимодействие Az. lipoferum 137 с C. jonsonae Д1 и их влияние на инокулированные растения ячменя сорта Темп. А - нитрогеназная активность Az. lipoferum 137 при культивировании в жидкой среде; Б - численность Az. lipoferum 137 в ризосфере ячменя; В - надземная масса растений в фазу выхода в трубку (■) и урожай зерна (□) растений ячменя. Варианты опыта на А и Б: чистая культура Az. lipoferum 137 (○); смесь Az. lipoferum 137 и C. jonsonae Д1 (●). Варианты инокуляции на В: без инокуляции (Контроль), Az. lipoferum 137 (137), C. jonsonae Д1 (Д1), смесь Az. lipoferum 137 и C. jonsonae Д1 (137+Д1). Вертикальные отрезки обозначают доверительный интервал при Р < 0,05.
активности у азоспирилл в присутствие C. jonsonae Д1 указывала на то, что бактерии образовывали устойчивую ассоциацию с высокой азотфиксирующей активностью (Рис. 2А). В вегетационном опыте C. jonsonae Д1 повысил также способность Az. lipoferum 137 колонизировать корни ячменя при совместной инокуляции (Рис. 2Б). Тем не менее, совместная инокуляция данными штаммами оказалась неэффективной из-за того, что C. jonsonae Д1 отрицательно повлиял на рост растений (Рис. 2В). Известно, что некоторые штаммы C. johnsonae являются фитопатогенными (Wells et al., 1998).
Из 115 изолированных культур ДР-бактерий 18 изолятов ингибировали, а 10 изолятов стимулировали всхожесть семян ячменя. Методом агаровых пластинок было установлено, что метаболиты производственного штамма Flavobacterium sp. Л30, способного продуцировать антибиотик (Шенин и др., 1996), полностью подавляли рост всех штаммов ДР-бактерий. В вегетационном опыте некоторые штаммы ДР-бактерий повысили урожай зерна ячменя на 17-19% (Табл. 2). В то же время, при совместной инокуляции ДР-бактериями и Flavobacterium sp. Л30, положительного эффекта не обнаружено.
Таблица 2. Влияние Flavobacterium sp. Л30 на эффективность инокуляции ячменя ростстимулирующими ДР-бактериями
| Вариант инокуляции | Урожай зерна, г / сосуд | |
| Контроль | Flavobacterium sp. Л30 | |
| Без инокуляции | 3,23 | 3,59 |
| ДР24 | 3,79* | 3,17 |
| ДР25 | 3,79* | 3,30 |
| ДР46 | 3,82* | 3,63 |
| ДР84 | 3,84* | 3,21 |
(*) Различие между вариантами существенно относительно контроля по критерию Фишера при Р < 0,05).
Результаты исследований показали, что интродуцируемые популяции ассоциативных бактерий вступают в сложные взаимодействия с бактериальной микрофлорой, колонизирующей ризосферу. Выживаемость и эффективность интродуцента зависят от его устойчивости к антагонистическому воздействию аборигенов. Образование ассоциации с фитопатогенами или ингибирование активности полезных аборигенных микроорганизмов приводит к ослаблению ростстимулирующего эффекта интродуцента и аборигенных бактерий, и этим искажает ожидаемую реакцию растений на инокуляцию.
3.3. Популяционное доминирование в ризосфере прорастающих семян как критерий селекции ростстимулирующих бактерий
Нами предложено использовать способность бактерий активно колонизировать ризосферу прорастающих в нестерильной почве семян в качестве предварительного критерия для отбора высокоэффективных ростстимулирующих штаммов. Для реализации этого подхода были использованы два штамма ДР-бактерий Arthrobacter sp. ДР12. и Sinorhizobium sp. ДР65, которые повышали всхожесть и корнеобразование у семян ячменя, продуцировали ИУК, обладали цитокининовой и фосфат-мобилизирующей активностью, но не фиксировали азот, не имели бактериостатической активности и не утилизировали АЦК.
В вегетационных опытах штамм Arthrobacter sp. ДР12 достоверно повысил количество зерен и урожай ячменя на 18-25% (Табл. 3). Положительное влияние Sinorhizobium sp. ДР65 на урожай зерна проявилось в эксперименте 1, при этом инокуляция увеличила также массу соломы относительно производственного штамма Flavobacterium sp. Л30. Изучаемые ДР-бактерии успешно реализуют свою высокую колонизирующую способность при интродукции на семена и поддерживают численность популяции в процессе вегетации на высоком уровне (Рис. 3). Сравнительные испытания эффективности ДР-бактерий в полевых условиях показали, что Arthrobacter sp. ДР12 повысил урожай зерна в двух опытах с ячменем сорта Абава на 6% и 12%, в одном из двух опытов с пшеницей сорта Омская-18 на 9%, и обеспечивал максимальный урожай зерна ячменя сорта Омский-88 и пшеницы сорта Омская-18. Использование биопрепаратов на основе Sinorhizobium sp. ДР65, а также флавобактерина или мизорина в полевых условиях оказалась неэффективной. Результаты показали, что Arthrobacter sp. ДР12 может быть рекомендован для создания ростстимулирующего биопрепарата.
Таблица 3. Влияние ассоциативных бактерий Arthrobacter sp. ДР12 и Sinorhizobium sp. ДР65 на урожай ячменя сорта Темп в вегетационных опытах
| Варианты инокуляции | Эксперимент 1 | Эксперимент 2 | ||||
| Кол-во зерен, шт/сосуд | Масса, г/сосуд | Кол-во зерен, шт/сосуд | Масса, г/сосуд | |||
| Зерно | Солома | Зерно | Солома | |||
| Без инокуляции | 66 | 3,2 | 3,7 | 64 | 2,8 | 5,5 |
| Flavobacterium sp. Л30 | 74 | 3,6 | 4,1 | 83* | 3,5* | 5,8 |
| Arthrobacter sp. ДР12 | 80* | 4,0* | 4,4 | 79* | 3,3* | 6,1 |
| Sinorhizobium sp. ДР65 | 78* | 3,9* | 5,0* | 72 | 3,1 | 5,5 |
(*) Различие между вариантами существенно относительно варианта без инокуляции по критерию Фишера при Р < 0,05.
Были обобщены проведенные нами эксперименты по изучению динамики численности популяций производственных штаммов в ризосфере. Эти исследования доказали способность штаммов активно колонизировать ризосферу различных сельскохозяйственных культур в широком диапазоне почвенно-климатических условий. Показано, что активная колонизация корней является необходимым, но недостаточным условием для эффективного взаимодействия интродуцента с растением. Интродуценты, как правило, реализуют свой потенциал колонизации ризосферы, однако эффект бактерий на растение проявляется не всегда. Установлено, что независимо от вида растения и условий среды численность штаммов Ar. mysorens 7 и Ag. radiobacter 10 была выше по сравнению со штаммами Az. lipoferum 137 и Flavobacterium sp. Л30. Это указывает на ведущую роль генотипа бактерий в колонизации ризосферы и подтверждает важность селекции активных колонизаторов, сохраняющих это свойство в разнообразных условиях. Поэтому перспективным представляется поиск интродуцентов, обладающих высокой «буферностью» и популяционной эврибионтностью – качествами, способствующими активной колонизации ризосферы. Показана также относительная независимость численности интродуцента в ризосфере и реакции растений на инокуляцию, свидетельствуя о том, что способность растения использовать полезный потенциал интродуцируемых бактерий во многом зависит от генотипа растения.
Таким образом, селекция эффективных штаммов ассоциативных ростстимулирующих бактерий по признаку доминирования популяции в культурабельном бактериальном сообществе ризосферы прорастающих семян может быть весьма перспективна. Такой подход учитывает высокую конкурентоспособность микроорганизмов в процессе колонизации корней
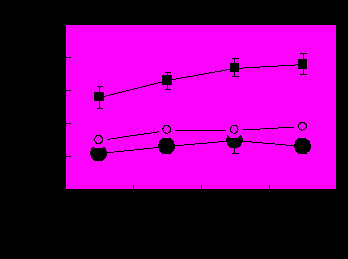
Рис. 3. Численность интродуцированных бактерий в ризосфере ячменя сорта Темп (эксперимент 2). Варианты опыта: Arthrobacter sp. ДР12 (●); Sinorhizobium sp. ДР65 (○); общая численность бактерий на среде без стрептомицина (■). Вертикальные отрезки обозначают доверительный интервал при Р 0,05.
проростков в реальных условиях с учетом влияния комплекса биотических и абиотических факторов конкретной среды и генотипа растения. Впоследствии это дает возможность успешно интродуцировать полезную для растений популяцию примерно в ту же экологическую нишу, из которой она была первоначально изолирована. Это обосновывает высокую вероятность образования эффективной растительно-бактериальной ассоциации.
4. Роль ризобактерий, содержащих фермент АЦК деаминазу, в устойчивости растений к абиотическим стрессам
4.1. Выделение и характеристика устойчивых к кадмию ассоциативных бактерий содержащих фермент АЦК деаминазу
Исследования были инициированы важностью проблемы поиска новых путей повышения устойчивости растений к неблагоприятным условиям среды. В этой связи интересными являлись публикациями о том, что снижение уровня гормона этилена в корнях растений, опосредованное утилизацией бактериями аминокислоты АЦК с помощью фермента АЦК деаминазы, является одним из механизмов положительного растительно-микробного взаимодействия (Glick et al., 1994; Glick, 1995). Учитывая важную роль этилена в реакции растений на стрессовые факторы, представлялось перспективным выделить и изучить АЦК-утилизирующие бактерии, ассоциированные с корнями подверженных стрессу растений. В наших исследованиях стрессором послужили кадмий и другие тяжелые металлы, которые являются распространенными и высокотоксичными загрязнителями почв и индуцируют биосинтез стрессового этилена в растениях. Из ризосферы проростков горчицы сарептской и гороха выращенных на загрязненных почвах и осадках сточных вод были селектированы устойчивые к тяжелым металлам ростстимулирующие бактерии, содержащие АЦК деаминазу. В 1996 г. было выделено 22 АЦК-утилизирующих штамма с использованием питательных сред, содержащих АЦК в качестве единственного источника азота, а в 2001 г. выделено 11 штаммов на среде с АЦК в качестве
Таблица 4. Характеристика штаммов содержащих фермент АЦК-деаминазу
| Штамм | Активность АЦК-деаминазы, нмоль -КВ /мг/ч | Раство-рение фосфатовА, мм | Устойчи-вость к кадмиюБ, мкM CdCl2 |
| Achromobacter xylosoxidans Cm4 | 1,8 | 0 / 0 / 0 | 210 / 550 |
| Pseudomonas brassicacearum Am3 | 11,7 | 6 / 2 / 10 | 240 / 500 |
| Pseudomonas marginalis Dp1 | 12,9 | 3 / 4 / 2 | 210 / 500 |
| Pseudomonas putida Am2 | 6,5 | 11 / 0 / 15 | 210 / 450 |
| Pseudomonas putida Bm3 | 4,6 | 2 / 1 / 7 | 240 / 500 |
| Pseudomonas sp. Dp2 | 11,5 | 11 / 1 / 12 | 210 / 450 |
| Pseudomonas sp. Ep2 | 6,5 | 7 / 1 / 20 | 240 / 750 |
| Rhodococcus sp. Fp2 | 10,0 | 0 / 0 / 0 | 600 / 1000 |
| Variovorax paradoxus Ep1 | 8,6 | 0 / 0 / 0 | 400 / 950 |
| Variovorax paradoxus 5C2 | 7,1 | 0 / 0 / 0 | 1400/3500 |
| НСР (P ≤ 0.05) | 2,1 | 3 / 1 / 4 | - / - |
(А) Указан диаметр зоны растворения фосфатов (Ca3(PO4)2 / FePO4 / Ca-фитат) вокруг колоний бактерий. (Б) Указаны минимальные ростингибирующие и летальные концентрации при культивировании на агаризованной среде.
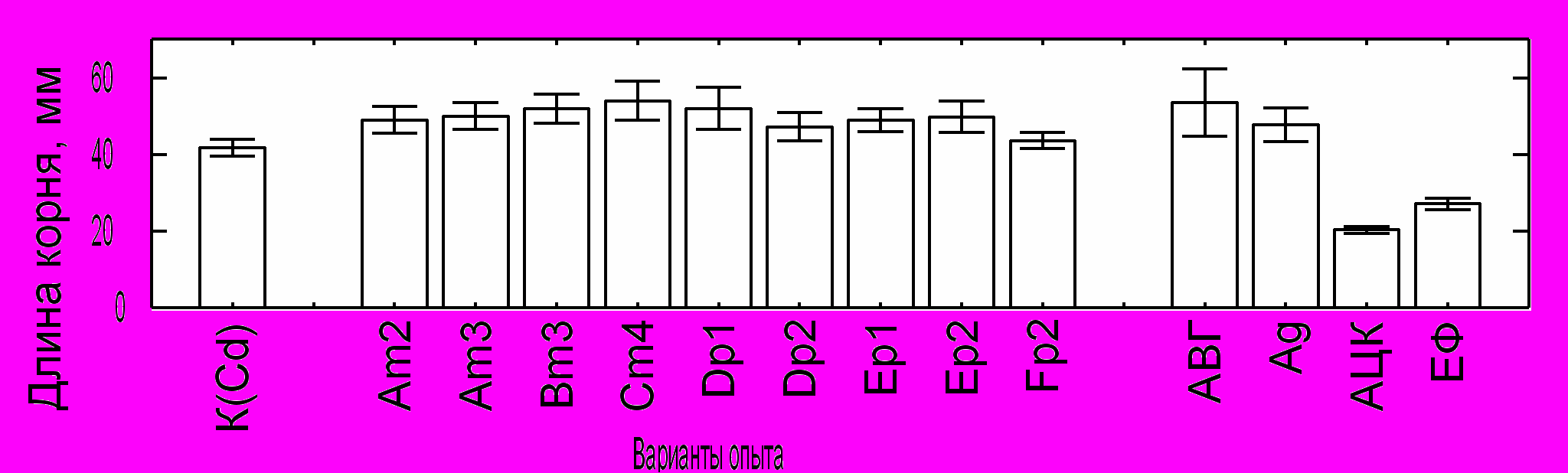
Рис. 4. Эффект АЦК-утилизирующих бактерий и химических регуляторов этилена на длину корней проростков рапса в присутствие 300 мкМ CdCl2. Обозначения: К(Cd) - контроль без инокуляции; АВГ - 10 мкМ АВГ; Ag - 10 мкМ Ag2SO4; АЦК- 200 мкМ АЦК; ЕФ - 10 мкМ эфефона. Вертикальные отрезки обозначают стандартное отклонение.
единственного источника азота и углерода. Во всех использованных почвах присутствовали ассоциативные АЦК-утилизирующие бактерии. Все штаммы были идентифицированы и их свойства детально охарактеризованы. Штаммы относились к Pseudomonas brassicacearum, Ps. marginalis, Ps. oryzihabitans, Ps. putida и Pseudomonas sp., а также Achromobacter xylosoxidans, Acidovorax facilis, Bacillus pumilus, Rhodococcus sp. и Variovorax paradoxus. У большинства этих таксонов наличие АЦК деаминазы ранее не было описано. В настоящей диссертации представлена информация только о 10 штаммах (Табл. 4). Данные штаммы обладали высокой устойчивостью к тяжелым металлам, и многие из них растворяли труднодоступные фосфаты (Табл. 4). Штаммы Am2, Ep2 и 5C-2 продуцировали ИУК, но ни один из штаммов не продуцировал этилен и не обладал нитрогеназной активностью. Впервые показано, что АЦК-утилизиующие бактерии используют АЦК в качестве единственного источника углерода. Ростстимулирующая активность штаммов проявлялась в удлинении корней проростков горчицы сарептской и рапса, как в отсутствие, так и в присутствие кадмия в питательном растворе (Рис. 4). О важной роли АЦК деаминазы в способности бактерий стимулировать удлинение корней свидетельствуют результаты обработки растений аминоэтоксивинилглицином (АВГ, ингибитор АЦК синтазы), ионами серебра (конкурент за рецепторы этилена), АЦК (предшественник в биосинтезе этилена) и этефоном (генератор этилена) (Рис. 4). Производственные штаммы, не имеющие АЦК деаминазной активности, не влияли на длину корней.
4.2. Взаимодействие АЦК-утилизирующих бактерий с растениями в стрессовых условиях, вызванных токсичностью кадмия
Результаты вегетационных опытов с рапсом показали, что штаммы P. brassicacearum Am3, P. putida Bm3 и P. marginalis Dp1 стимулировали развитие корней у растений, выращенных на незагрязненной почве. При внесении в почву кадмия (35 мг Cd/кг) положительное действие бактерий проявилось также и в повышении биомассы побегов. Однако инокуляция не влияла на содержание Cd в побегах рапса.
В опыте №1 с горчицей сарептской штаммы P. brassicacearum Am3 и V. paradoxus 5C-2 увеличили массу побегов на необогащенной кадмием слабоокультуренной дерново-подзолистой почве. Однако при добавлении в почву кадмия (30 или 60 мг Cd/кг) эффект проявился только в стимуляции роста корней штаммом V. paradoxus 5C-2. Численность P. brassicacearum Am3 в ризосфере снижалась в ходе эксперимента, а при 60 мг Cd/кг популяция элиминировалась из зоны корней. Напротив, V. paradoxus 5C-2 интенсивно колонизировал корни в отсутствии и, особенно в присутствии Cd в почве. Инокуляция не влияла на содержание Cd в побегах горчицы. В опыте №2 горчицу выращивали в коммерческом компосте “Pro-Mix BX” и инокулировали штаммом V. paradoxus 5C-2. Добавление кадмия в компост (24 мг Cd/кг) приводило к ингибированию роста растений, но инокуляция снимала этот негативный эффект и существенно повышала содержание и вынос кадмия побегами (Табл. 5). Возможно, что различное влияние бактерий на аккумуляцию кадмия горчицей связаны со степенью его доступности для растений в дерновоподзолистой почве (после внесения в почву кадмий быстро переходил в нерастворимые формы) и в компосте (в компосте хелатирующие вещества поддерживали микроэлементы в растворенной форме). Можно предположить, что способность бактерий активизировать поступление кадмия в растения может проявляться при условии его высокой подвижности в ризосфере. Полученные результаты указывают на два важных момента в отношении проблемы повышения эффективности технологий фитоэкстракции металлов с использованием горчицы сарептской. Во-первых, необходимо активизировать поглощение корнями и/или повысить мобильность тяжелых металлов в ризосфере инокулированных растений. Во-вторых, при повышенном поступлении токсикантов в растения становится особенно актуальным поиск приемов стимуляции роста растений, в том числе основанных на взаимодействии растений с полезными микроорганизмами.
Таблица 5. Влияние инокуляции на рост и аккумуляцию кадмия побегами горчицы сарептской
| Вариант опыта | Биомасса, мг/сосуд | Содержание Cd, мг/кг | Вынос Cd, мкг/сосуд |
| Без Cd и инокуляции | 489 a | не определяли | не определяли |
| Cd + без инокуляции | 394 b | 27 a | 11 a |
| Cd + V. paradoxus 5C-2 | 438 a | 59 b | 26 b |
Разные буквы указывают на различия по критерию Фишера (Р < 0,05).
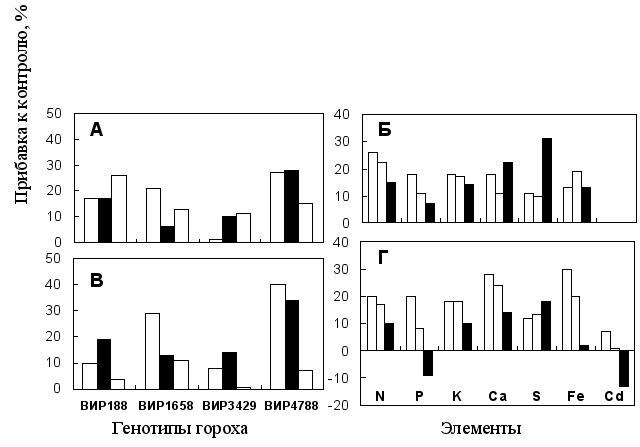
Рис. 5. Влияние АЦК-утилизирующих бактерий на биомассу (А, В) и накопление элементов (Б, С) побегами гороха. (А) и (Б) - незагрязненная почва; (В) и (Г) - внесено 10 мг Cd/кг. (Б) и (В) - средние для 4-х генотипов гороха. Варианты: (□) P. brassicacearum Am3, (■) P. marginalis Dp1, (░) Rhodococcus sp. Fp2. (*) - существенный эффект инокуляции по критерию Фишера (Р < 0,05).
В вегетационном опыте с горохом инокуляция штаммами P. brassicacearum Am3 и P. marginalis Dp1 стимулировала рост корней, как на незагрязненной почве, так и при внесении кадмия. Положительный эффект бактерии оказали также на рост побегов (Рис. 5). Устойчивый к кадмию штамм Rhodococcus sp. Fp2 не стимулировал рост обработанного кадмием гороха. Это вероятно было связано с тем, что в модельных экспериментах кадмий полностью ингибировал АЦК-деаминазную активность этого штамма. Добавление Cd в почву приводило к снижению содержания питательных элементов в растениях. Эффект бактерий на элементный состав побегов существенно варьировал в зависимости от штамма, генотипа гороха и концентрации Cd в почве. Действие инокуляции в основном проявлялось в повышении содержания N, Ca и S, и в тенденции к снижению содержания P и Fe в побегах. Снижение содержания Cd происходило при инокуляции генотипа ВИР-1658 штаммами Dp1 и Fp2, генотипа ВИР-3429 штаммами Am3 и Dp1, и генотипа ВИР-4788 штаммом Fp2. У инокулированных растений повышалось накопление питательных элементов в побегах (Рис. 5). Rhodococcus sp. Fp2 потерял способность улучшать аккумуляцию растениями N, K, Ca и Fe в условиях загрязнения почвы кадмием. Наблюдаемое повышение накопления P, K, и Fe в побегах было вероятно опосредовано лучшим развитием корневой системы, а повышение аккумуляции N, S, и Ca, могло быть результатом мобилизации этих элементов в ризосфере и стимуляции процессов их ассимиляции и транспорта в побег. Полученные результаты свидетельствуют о том, что: (1) АЦК деаминаза играет важную роль в стимуляции роста растений в присутствие токсичного кадмия; (2) улучшение минерального питания гороха бактериями и эффект бактерий на биосинтез этилена в растении посредством АЦК деаминазы являются частично независимыми процессами; (2) снижение содержания Cd в побегах гороха не являлось причиной улучшения роста инокулированных растений, и не было связано с утилизацией АЦК бактериями.
4.3. Зависимость эффекта АЦК-утилизирующих бактерий от уровня минерального питания растений
Интенсивность биосинтеза гормона этилена у растений зависит от концентрации и доступности питательных элементов. Поэтому мы предположили, что уровень минерального питания может быть важным фактором во взаимодействии АЦК-утилизирующих бактерий с растениями. Была проведена серия опытов с растениями рапса в условиях гидропоники при варьировании состава питательного раствора, в ходе которых выявлены следующие закономерности (Рис. 6А): (1) длина корней проростков уменьшалась с увеличением концентрации фосфора (K2HPO4) в растворе; (2) ростстимулирующий эффект ингибитора этилена (Ag+) и бактерий проявился только в присутствии фосфора (K2HPO4, Ca-фитат или CaHPO4); (3) при добавлении сульфата аммония стимулирующее действие бактерий исчезало, а эффект Ag+ сохранялся. Исключение калия из состава раствора не влияло на рост корней во всех вариантах опыта. Количество интродуцированных штаммов на корнях растений в присутствии и отсутствии фосфора было примерно одинаковым и составляло от 2,0 х 106 до 3,3 х 106 кл./мг, свидетельствуя о том, что рост бактерий не был ограничен дефицитом фосфора. Бактерии не влияли на концентрацию Pi в питательном растворе с фосфатами. Не обнаружено корреляции между фосфат-растворяющей активностью штаммов in vitro и их воздействием на корни или потреблением фосфора растениями. В присутствии K2HPO4 штаммы P. putida Bm3, A. xylosoxidans Cm4 и Pseudomonas sp. Dp2 снижали содержание (Pi), а обработка Ag+ уменьшила накопление Pi в побегах. Масса побегов отрицательно коррелировала с содержанием Pi (r = -0.40; P = 0.015; n = 24). Образование этилена в отсутствии фосфора снижалось и сопровождалось удлинением корней (Рис. 6Б). Снижение биосинтеза АЦК и этилена является адаптацией, направленной на поиск доступного источника фосфора за счет более развитой корневой системы (Rengel and Kordan, 1988). Инокуляция снижала количество выделяемого растениями этилена только в присутствии фосфора, при этом добавление сернокислого аммония в качестве дополнительного источника азота снижало бактериальный эффект. Вероятно, что при дефиците фосфора количество доступного для бактерий АЦК в прикорневой зоне уменьшалось, взаимодействие растительно-бактериальной ассоциации нарушалось, и это приводило к ослаблению положительного действия бактерий. Высокая концентрация аммония, более доступного источника азота, может ингибировать активность АЦК деаминазы (Jacobson et al., 1994). Поэтому сульфат аммония нивелировал только эффект бактерий, но не химического ингибитора этилена Ag+. Эти результаты являются оригинальным подтверждением участия АЦК деаминазы во взаимодействии бактерий с растениями. В вегетационных опытах положительный эффект бактерий на массу побегов рапса повышался примерно в два раза при внесении в почву фосфорных удобрений. Содержание питательных элементов (P, K, S, Mo, Zn и Ba) в побегах инокулированных растений не повышалось или понижалось (в зависимости от штамма интродуцента) и отрицательно коррелировало с биомассой побегов. Это указывало на то, что происходило разбавление концентрации элементов массой
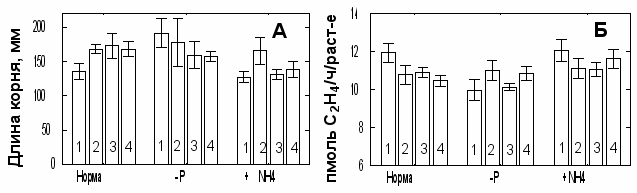
Рис. 6. Реакция проростков рапса на инокуляцию АЦК-утилизирующими бактериями в зависимости от содержания фосфора и азота в питательном растворе. А – длина корня. Б – образование этилена. Варианты опыта: Норма, полный питательный раствор; -Р, раствор без фосфора; +NH4, дополнительно внесен 1 мМ (NH4)2SO4; 1, без инокуляции; 2, 10 мкМ Ag2SO4; 3, A. xylosoxidans Cm4; 4, Pseudomonas sp. Dp2. Вертикальными отрезками обозначены стандартные отклонения.
растений, а специфические эффекты бактерий на ассимиляцию питательных элементов не проявлялись. Таким образом, уровень фосфорного и азотного питания растений оказывает существенное влияние на реакцию растений на инокуляцию бактериями содержащими АЦК деаминазу. Стимуляция роста растения происходит при относительно высоком уровне гормона этилена, и при отсутствии факторов ингибирующих активность АЦК деаминазы.
4.4. Роль АЦК деаминазы в реакции растений на дефицит почвенной влаги
Инокуляция штаммом V. paradoxus 5C-2 и обработка ингибитором биосинтеза этилена (10 мкМ АВГ) стимулировали рост корней и побегов гороха сорта Sparkle в большей степени при недостаточном увлажнении почвы по сравнению с вариантами оптимального увлажнения. Ростстимулирующий эффект сопровождался повышением транспирации воды, пропорциональным массе побегов. Однако влияние мутанта V. paradoxus 5С-2M4, который имел активность АЦК деаминазы в 7 раз ниже дикого типа, на рост растений и транспирацию воды было несущественным.
При выращивании гороха в условиях дефицита влаги до стадии полной спелости растения инокулированные V. paradoxus 5C-2 превосходили контрольные по количеству семян, массе семян и накоплению в них азота (Табл. 6). Содержание азота в семенах не изменялось, поэтому повышение накопления азота было обусловлено увеличением биомассы. При оптимальном режиме полива положительное действие V. paradoxus 5C-2 на рост растений проявилось только в виде тенденции. Инокуляция стимулировала образование клубеньков таким образом, что полностью снимала ингибирующий эффект засухи на клубенькообразование. Инокулированные растения образовывали дополнительные побеги и зацветали на 1-2 дня раньше контрольных. Образование дополнительных побегов приводило к затенению участков почвы вокруг растений, и это могло снижать потери влаги, испаряющейся с поверхности почвы. V. paradoxus 5C-2 активно колонизировал корни гороха во всех экспериментах при оптимальном и недостаточном увлажнении, а его численность в конце опытов была около 1 млн кл./г корней. В условиях дефицита влаги количество биомассы семян в расчете на 1 литр поливной воды было на 12% больше (Р=0,02) при инокуляции, свидетельствуя о повышении эффективности использования воды растениями.
Таблица 6. Эффект V. paradoxus 5C-2 на рост и азотфиксирующий симбиоз гороха сорта Sparkle в зависимости от уровня увлажнения почвы
| Вариант полива и инокуляции | Кол-во семян, шт/растение | Масса семян, г/растение | Накопление N в семенах, мг/растение | Кол-во клубеньков, шт/растение |
| 70% ПВ | ||||
| Штамм 1026А | 11 a | 3,3 ab | 139 ab | 38 a |
| Штаммы 1026 и 5C-2 | 14 a | 3,9 a | 156 a | 54 b |
| 40% ПВ | ||||
| Штамм 1026 | 7 b | 2,1 c | 79 c | 13 c |
| Штаммы 1026 и 5C-2 | 11 a | 2,9 b | 117 b | 40 ab |
АРастения инокулировали R. leguminosarum bv. viciae 1026. Разные латинские буквы указывают на существенные различия (критерий Фишера, Р < 0,05).
Дефицит влаги приводил к повышению содержания АЦК и АБК в ксилемном соке растений (Рис. 7А). При недостаточном увлажнении наблюдалось снижение концентрации АЦК у обработанных АВГ и инокулированных растений. Это наблюдение имеет большое значение для понимания механизма воздействия АЦК-утилизирующих бактерий, поскольку указывает на то, что АЦК деаминаза вызывает не только локальные эффекты на корни, но может индуцировать системную устойчивость. Содержание АБК, основной сигнальной молекулы в реакции растения на засуху, также повышалось при дефиците влаги, свидетельствуя о развитии стрессовой реакции (Рис. 7Б). Инокуляция диким типом V. paradoxus 5C-2 и его мутантом 5С-2М4 не повлияла на концентрацию АБК по отношению к соответствующим контролям. Однако наиболее заметное повышение АБК при дефиците влаги происходило у растений, инокулированных диким типом V. paradoxus 5C-2, вероятно в результате более быстрой ассимиляции ограниченного ресурса поливной воды. Это указывает на то, что передаваемый посредством АБК сигнал, может ограничивать ростстимулирующее и антистрессовое воздействие АЦК-утизирующих бактерий. С другой стороны высокая концентрация АБК могла ограничивать потери воды листьями за счет транспирации.
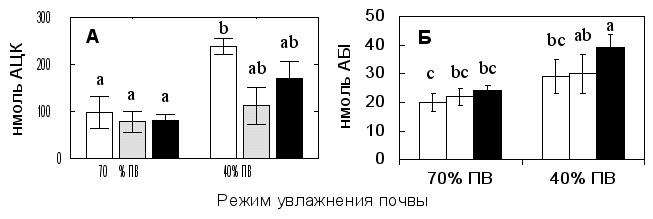
Рис. 7. Содержание АЦК (А) и АБК (Б) в ксилемном соке гороха в зависимости от инокуляции и режима увлажнения почвы. Варианты: (□) контроль; (▒) АВГ на (А) или мутант М4 на (Б); (■) дикий тип V. paradoxus 5C-2. Вертикальными отрезками обозначены ошибки средних. Разные латинские буквы указывают на существенные различия (критерий Фишера, Р < 0,05).
В вегетационном опыте с карликовым сортом томатов MicroTom растения выращивали в узких, но объемных (диаметр 10 см; 10 кг компоста) пластиковых колоннах, что позволяло вырастить их до фазы зрелых плодов при полном прекращении полива в начале вегетации. При поддержании полива инокуляция V. paradoxus 5C-2 не оказала существенного эффекта на массу плодов. В условиях засухи масса плодов снизилась в 6 раз, но урожай инокулированных растений был на 30% выше относительно контроля, что свидетельствовало о повышении эффективности использования воды растениями. Численность интродуцента в ризосфере составляла около 5 млн. кл./г корней, при этом прекращение полива не изменяло его колонизирующую способность. Используя агарозную гнотобиотическую систему, было установлено, что V. paradoxus 5C-2, P brassicacearum Am3 и его мутант Am3T8-1, имевший активность АЦК деаминазы в 37 раз ниже дикого типа, стимулируют удлинение корневых волосков у томатов. Микроскопирование показало, что маркированные GFP бактерии интенсивно колонизируют корневые волоски. Стимуляция развития корневых волосков может вносить вклад в улучшение водного питания инокулированных растений, однако этот эффект не зависит от активности АЦК деаминазы бактерий.
5. Взаимодействие производственных штаммов ассоциативных бактерий с растениями в зависимости от агроклиматических факторов
5.1. Экстремальные температуры среды
Штаммы Az. lipoferum 137, Ar. mysorens 7, Ag. radiobacter 10 и Flavobacterium sp. Л30 используются во многих регионах, которые существенно различаются по температурному режиму. В связи с этим, представлялось важным изучить, как температура влияет на эффективность инокуляции растений данными бактериями. Для этого были проведены вегетационные опыты, в которых инокулированные растения ячменя выращивали в климатических камерах, имитируя оптимальное (+18оС), холодное (+14оС) и жаркое (+23оС) лето. Ar. mysorens 7 повысил массу зерна не только при оптимальной, но и при пониженной температуре, при этом эффект составил соответственно +17% и +25%. Положительный эффект от штамма Ag. radiobacter 10 был существенен только при пониженной или повышенной температурах. При повышенной температуре отмечена тенденция увеличения массы зерна при инокуляции Az. lipoferum 137 и Flavobacterium sp. Л30 на 9% и 12%, однако, разница с контролем была несущественной. В среднем для всех испытанных штаммов реакция растений на инокуляцию была выше при экстремальных температурах. Поддержание пониженной и повышенной температур приводило к существенному снижению массы зерна растений, свидетельствуя о том, что растения были подвержены сильному стрессу. Температура культивирования растений не влияла на численность интродуцированных бактерий в ризосфере в фазы всходов и кущения. В дальнейшем численность Ag. radiobacter 10 и Flavobacterium sp. Л30 была выше при имитации жаркого лета, но снижалась при имитации холодного лета. Активная колонизация корней во всех режимах указывает на способность бактерий легко адаптироваться к различным температурам и поддерживать численность популяции относительно стабильной. Вероятно, что повышение реакции растений на инокуляцию при неблагоприятных температурах связано не с популяционными эффектами температуры на бактерии, а с изменением их активности и метаболизма, которые могут быть зависимы от самого растения.
5.2. Повышенная кислотность почвы
При культивировании на питательной среде штамм Ar. mysorens 7 был наиболее устойчив к подкислению среды и нормально развивался при рН=4,5. Ингибирование роста Ag. radiobacter 10 и Flavobacterium sp. Л30 наблюдалось при рН=5,0÷4,5. Сильное ингибирование роста наиболее чувствительного штамма Az. lipoferum 137 происходило уже при рН=5,0. При рН=6,5 все штаммы обладали относительно высокой устойчивостью к ионам Al+3. Однако при подкислении среды (рН=4,5) токсичность алюминия существенно повышалась, и рост бактерий прекращался при концентрации 30÷40 мг Al+3/л.
В условиях гидропоники при создании стрессовых условий (рН=4,5 и добавлении 5 мг/л Al+3) инокуляция стимулировала рост корней проростков различных сортов ячменя примерно на 15÷25%. Однако в оптимальных условиях (рН=5,8 без добавления Al+3), ассоциативные бактерии не оказали влияния на рост корней. В вегетационных опытах использовали кислые
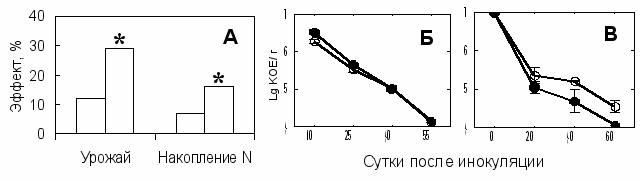
Рис. 8. Взаимодействие ячменя Целинный-5 с Az. lipoferum 137 в зависимости от рН почвы. (А) - эффект бактерий на урожай зерна (г/сосуд) и накопление азота в зерне (мг N/сосуд). Численность интродуцента в ризосфере (Б) и в почве без растений (В). Обозначения: рН почвы 6,1 (□, ○) или 5,0 (■, ●). (*) означает существенную разницу с контролем по критерию Фишера (Р<0,05). Вертикальные отрезки обозначают ошибку средних.
дерновоподзолистые почвы, кислотность которых изменяли добавлением мела. В опыте №1 с сортом Целинный-5 положительное действие на продуктивность растений ячменя проявилось только при инокуляции Az. lipoferum 137 и Flavobacterium sp. Л30 в условиях слабокислой реакции почвы (рН=5,0), но не в нейтрализованной почве (рН=6,1) (Рис. 8А). Содержание свободного пролина в корнях инокулированных растений было в 4 раза ниже по сравнению с контрольными, свидетельствуя о способности бактерий понижать интенсивность стресса, вызываемого неблагоприятными условиями. Сравнение популяционных кривых бактерий полученных для ризосферы и почвы без растений позволило установить, что в слабокислой почве присутствие растения улучшало выживаемость Az. lipoferum 137 (Рис. 8Б, В) и Flavobacterium sp. Л30. Важно отметить, что именно эти штаммы стимулировали рост растений, свидетельствуя об образовании эффективных ассоциаций в данных условиях. Однако в опыте №2, когда рост растений был сильно ингибирован при рН почвы 4,5, инокуляция Az. lipoferum 137 или Ar. mysorens 7 снижала соответственно массу соломы или урожай зерна. Отрицательный эффект возможно связан с утилизацией бактериями органических кислот, выделяемых корнями для хелатирования алюминия (Foy and Lee, 1987), и повышением его подвижности в ризосфере.
5.3. Дефицит почвенной влаги
Расчет средних значений прибавок массы зерна в серии вегетационных опытов показал, что инокуляция всеми штаммами была более эффективной в условиях дефицита влаги в почве (Рис. 9А). Вероятно, что целый ряд известных механизмов действия бактерий на растения мог быть вовлечен в наблюдаемый эффект. Стимуляция роста корней бактериями могла быть исключительно важна при засухе, поскольку лучшее развитие корневой системы обеспечивает растение дополнительной влагой. Биологическая азотфиксация и улучшение минерального питания инокулированных растений могло снижать возникающий дефицит и ограниченный транспорт питательных элементов. Продуцирование бактериями ауксинов, антагонистов стрессового фитогормона АБК, могло ослаблять процессы, останавливающие рост растения в условиях дефицита влаги. Режим увлажнения почвы существенно повлиял на выживаемость бактерий в ризосфере растений: численность всех штаммов в середине и в конце вегетации поддерживалась на более высоком уровне при недостатке почвенной влаги. Сравнение популяционных кривых выживаемости бактерий в почве без растений и в ризосфере показало, что при дефиците
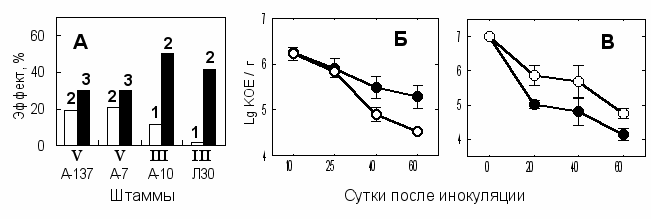
Рис. 9. Взаимодействие ячменя Целинный-5 с ассоциативными бактериями в зависимости от влажности почвы. (А) - эффект бактерий на урожай зерна (г/сосуд). Штаммы: А-137 - Az. lipoferum 137, А-7 - Ar. mysorens 7, А-10 - Ag. radiobacter 10 и Л30 - Flavobacterium sp. Л30. Римскими цифрами обозначено количество проведенных опытов, а арабскими цифрами обозначено количество опытов с достоверной прибавкой урожая (критерий Фишера, Р<0,05). Численность Az. lipoferum 137 в ризосфере (Б) и в почве без растений (В). Обозначения: влажность почвы 60% ПВ (□, ○) или 30% ПВ (■, ●). Вертикальные отрезки обозначают ошибку средних.
влаги более благоприятные условия для интродуцентов создаются на корнях растений по сравнению с почвой (Рис. 9 Б, В). Это указывает на активную роль растения в образовании ассоциаций с интродуцентамии и может служить аргументом в пользу того, что в условиях стресса растение ведет поиск дополнительных ресурсов, которые могут стать доступны ему благодаря активизации функций полезной ризосферной микрофлоры. Возможно также, что при дефиците влаги в ризосфере ослабевали конкурентные и антагонистические взаимодействия между интродуцируемыми штаммами и аборигенной микрофлорой, а внесение большого количества клеток интродуцента при инокуляции позволяло ему успешно конкурировать с аборигенными микробами, колонизирующая способность которых была снижена недостатком влаги.
5.4. Загрязнение почвы тяжелыми металлами
Целью данной работы являлось изучение возможности применения биопрепаратов ассоциативных бактерий на загрязненных почвах для получения качественной продукции растениеводства. При культивировании на питательных средах бактерии были устойчивы к относительно высоким концентрациям Pb, Cd, Cu, Ni и Zn, за исключением штамма Flavobacterium sp. Л30, который оказался высокочувствительным к Cd (Табл. 7).
Важным результатом стало обнаружение стимуляции продукции индолов у обработанных кадмием бактерий (Табл. 7). Устойчивые штаммы были способны активно сорбировать Cd при культивировании на питательной среде (Табл. 7), при этом максимальный коэффициент распределения Cd (соотношение концентраций Cd в клетках и среде) получено у Az. lipoferum 137 и равнялось 5000 ± 500. В гидропонной культуре в присутствии кадмия все штаммы увеличили массу корней ячменя, а Ar. mysorens 7 повысил также массу побегов. В отсутствии кадмия бактериальный эффект выражался в повышении содержания питательных элементов (Р, К, Mg, Ca, Fe и Mn) в корнях и/или побегах. Кадмий ингибировал поступление питательных элементов в растения.
Таблица 7. Влияние кадмия на ассоциативные бактерии и их взаимодействие с растениями ячменя на загрязненной почве
| Штамм | Устойчи- вость к Cd / PbА, мМ | Эффект Cd на синтез ИУКБ, % | Сорбция Cd бакте-риями, мкг Cd/мг | Эффект бактерий на побеги ячменя:В | |
| на массу, % | на содер-жание Cd, % | ||||
| Az. lipoferum 137 | 0,4 / 0,7 | + 28 | 7,8 ± 1,0 | + 73* | - 19* |
| Ar. mysorens 7 | 0,6 / 1,0 | + 48 | 1,3 ± 0,3 | + 57 | - 9 |
| Ag. radiobacter 10 | 0,5 / 0,8 | + 2 | 2,0 ± 0,1 | + 72* | - 19* |
| Flavobacterium sp. Л30 | <0,05/ 0,5 | + 50 | н/о | + 56 | - 11* |
АУказаны минимальные летальные концентрации металлов. БУказано соотношение интенсивности продуцирования ИУК (мкг/мг) в присутствии и отсутствии CdCl2 в питательной среде. ВРастения выращивали в почве обогащенной 75 мг Cd/кг. (*) Указывает на существенное влияние инокуляции (критерий Фишера, Р 0,05). (н/о) не определяли.
Эффект бактерий на элементный состав растений был сходным в присутствии и отсутствии Cd. Бактерии повышали накопление К, Mg, S, Fe, Mn и Zn в корнях, а также накопление P, K, S, Zn и Na в побегах, при этом воздействие разных штаммов на аккумуляцию элементов было сходным. В вегетационном опыте инокуляция ячменя стимулировала рост растений в присутствии токсичных концентраций кадмия в почве (Табл. 7). В побегах инокулированных растений содержание Cd снижалось (Табл. 7), но содержание питательных элементов (Р, К, S и Ca) в некоторых случаях повышалось. Все штаммы активно колонизировали корни ячменя на почве загрязненной свинцом или кадмием, за исключением Cd-чувствительного штамма Flavobacterium sp. Л30, который в середине вегетации не обнаруживался в ризосфере. В некоторых случаях численность других штаммов в ризосфере повышалась в присутствии тяжелых металлов, что вероятно было связано с конкурентными преимуществами устойчивых к металлам интродуцентов по отношению к аборигенной микрофлоре. Результаты трех полевых опытов показали, что применение биопрепаратов азоризина, мизорина, агрофила и флавобактерина проявлялось в повышении урожая зерна и активизации потребления растениями питательных элементов, таких как P, K, S и Ca. Известно, что эти элементы играют важную роль в процессах детоксикации тяжелых металлов растениями, однако токсичные металлы ингибируют ассимиляцию растениями питательных элементов. Результаты наших экспериментов свидетельствуют о способности инокулированнных растений более эффективно противодействовать отрицательному эффекту тяжелых металлов на усвоение питательных элементов, и это может быть важным механизмом положительного действия бактерий на устойчивость растений. Содержание Pb и Cd в зерне обработанных биопрепаратами растений не повышалось, а в отдельных случаях снижалось. Вероятными механизмами такого эффекта бактерий может быть иммобилизация металлов в ризосфере и активизация защитных реакций растений бактериальными биологически активными веществами. Результаты проведенных исследований показали, что биопрепараты на основе ассоциативных бактерий могут быть успешно применены для бактеризации ячменя в условиях загрязнения почвы свинцом и кадмием.
ВЫВОДЫ
1. Совместная инокуляция растений производственными штаммами Az. lipoferum 137 и Ag. radiobacter 10 превосходит по эффективности инокуляцию отдельными штаммами. Данные штаммы образуют ассоциацию в периодической культуре и при интродукции в ризосферу. Механизмами аддитивных и синергических эффектов смеси данных штаммов являются активизация и сбалансированность минерального питания растений за счет интенсивного поглощения азотных и фосфорных удобрений, а также повышенная азотфиксирующая активность и лучшая приживаемость Az. lipoferum 137 на корнях.
2. При интродукции на семена производственные штаммы Az. lipoferum 137, Ag. radiobacter 10, Ar. mysorens 7 и Flavobacterium sp. Л30 способны активно колонизировать корни различных видов и сортов сельскохозяйственных растений, выращиваемых в различных почвах и климатических условиях. Установлены детерминированные штаммом сходства популяционной динамики и различия в численности популяций на корнях инокулированных растений, что позволяют оценить экологическую пластичность и адаптационный потенциал ризобактериальных интродуцентов по таким характеристикам как «буферность» и эврибионтность популяций. Однако активная колонизация ризосферы ростостимулирующим штаммом не является достаточным условием реализации его положительного действия на растение.
3. Интродуцируемые ассоциативные бактерии активно вступают в конкурентные и в меньшей степени симбиотические взаимодействия с аборигенной почвенной микрофлорой. Приживаемость в ризосфере и эффективность инокуляции во многом зависит от устойчивости интродуцента к воздействию аборигенных микроорганизмов. Образование ассоциаций интродуцента с микрофлорой, ингибирующей рост растений, а также антагонизм интродуцента к полезным формам аборигенных бактерий искажает ожидаемую реакцию растений на инокуляцию.
4. Скрининг штаммов ассоциативных ростостимулирующих бактерий по признаку доминирования популяции в культурабельном бактериальном сообществе ризосферы прорастающих в почве семян является перспективным приемом для обнаружения интродуцентов с высокой колонизирующей способностью. Предложенный метод позволил селектировать высокоэффективные штаммы Arthrobacter sp. ДР12, Sinorhizobium sp. ДР65 и V. paradoxus 5C-2, которые обладают высокой колонизирующей активностью.
5. Во всех использованных нами почвах, отвалах горных пород и осадках сточных вод различного типа и географического положения присутствуют устойчивые к тяжелым металлам ростстимулирующие бактерии, содержащие фермент АЦК деаминазу и способные активно колонизировать корни прорастающих семян. Изолированные бактерии относятся к различным таксономическим группам, при этом впервые наличие АЦК деаминазы описано нами у видов Achromobacter xylosoxidans, Pseudomonas brassicacearum, Pseudomonas marginalis, Rhodococcus sp. и Variovorax paradoxus.
6. Инокуляция производственными штаммами и вновь выделенными ризобактериями, содержащими АЦК деаминазу, повышает устойчивость растений к токсичности тяжелых металлов, таких как кадмий и свинец. Степень антистрессового эффекта бактерий существенно варьирует в зависимости от штамма, генотипа растения и токсиканта. Важными механизмами ростостимулирующего эффекта бактерий в условиях токсичности тяжелых металлов являются: (1) стимуляция роста растений благодаря продуцированию бактериями ауксинов и снижению негативных этилен-зависимых реакций растения на стресс посредством АЦК деаминазной активности; (3) иммобилизации бактериями токсикантов в прикорневой зоне; (4) снижение ингибирующего действия металлов на потребление питательных элементов инокулированными растениями за счет стимуляции роста корней и активизации процессов ассимиляции или мобилизации элементов.
7. Инокуляция изучаемыми ассоциативными бактериями, как правило, не приводит к повышению содержания токсичных тяжелых металлов в растениях, а в некоторых случаях противодействует аккумуляции этих элементов в надземных органах. Для интенсификации процесса фитоэкстракции тяжелых металлов с помощью ассоциаций растений и ростстимулирующих бактерий необходимо разрабатывать дополнительные приемы и средства, направленные на мобилизацию металлов в ризосфере.
8. Уровень минерального питания растений оказывает существенное влияние на реакцию растений на инокуляцию бактериями содержащими АЦК деаминазу. Стимуляция роста растения происходит (1) в присутствии доступного фосфора, который обеспечивает высокий уровень гормона этилена в корнях, и (2) при отсутствии избытка доступного азота в виде аммония, который ингибирует активность фермента АЦК деаминазы, Дефицит фосфора для растений и избыток доступного азота для бактерий могут нарушать растительно-бактериальное взаимодействие, которое приводит к ограничению или нивелированию положительного действия АЦК-утилизирующих бактерий на растения.
9. Изучаемые штаммы АЦК-утилизирующих бактерий растворяют малодоступные фосфаты in vitro на питательных средах, однако не повышают потребление фосфора растениями из почвы. Поэтому роль мобилизации фосфатов данными бактериями в их ростостимулирующем эффекте на инокулированные растения несущественна.
10. Эффективность инокуляции ячменя производственными штаммами варьирует в зависимости от температуры среды, при этом положительный эффект бактерий на рост растений может быть достигнут при пониженных и повышенных температурах. Установлено, что для каждого из штаммов имеются особенности во взаимодействии с растением, обусловленные влиянием температуры. Популяции интродуцированных бактерий в ризосфере легко адаптируются к экстремальным температурам.
11. Производственные штаммы ассоциативных бактерий, за исключением Az. lipoferum 137, способны развиваться в кислой среде при рН=4,5 и устойчивы к относительно высоким концентрациям ионов Al+3. Направленность бактериального эффекта на рост растений в почвах с повышенной кислотностью существенно варьирует от положительной до отрицательной в зависимости от генотипа растения и, возможно, от особенностей реакции сортов на кислотный стресс.
12. Ассоциативные бактерии повышают адаптацию растений к стрессу, вызванному дефицитом влаги в почве, стимулируя рост корней и увеличивая доступ к дополнительным ресурсам находящейся в почве влаги. В этих условиях АЦК-утилизирующие бактерии способны стимулировать рост корней за счет регуляции уровня этилена. Снижение концентрации сигнальной молекулы АЦК в ксилемном соке инокулированных растений указывает на присутствие не только локального эффекта АЦК деаминазы на корни, но и на индукцию системного антистрессового эффекта. Концентрация гормона абсцизовой кислоты при этом остается высокой, что ограничивает потери воды листьями за счет транспирации.
13. Различия в популяционных кривых выживаемости производственных штаммов в ризосфере и почве, а также корреляция между численностью интродуцента и его эффектом на растения в зависимости от условий роста растений служат доказательствами активной роли растения в формировании ассоциаций с полезными формами ризобактерий при неблагоприятных условиях среды.
14. Инокуляция гороха АЦК-утилизирующими бактериями стимулирует образование азотфиксирующих клубеньков на корнях. Данный эффект в большей степени проявился в стрессовых условиях ингибирования клубенькообразования дефицитом влаги. Поэтому положительное действие ассоциативных бактерий, содержащих АЦК деаминазу, на симбиоз бобовых растений с клубеньковыми бактериями является важным механизмом их антистрессового эффекта.
15. Вероятность получения положительного ростостимулирующего эффекта от инокуляции ассоциативными бактериями выше в таких условиях, в которых рост растений лимитирован некоторыми биотическими или абиотическими факторами. При этом необходимыми условиями реализации ростостимулирующего эффекта являются устойчивость бактерий к данному фактору и способность бактерий противодействовать негативному проявлению этих факторов. Такое воздействие бактерий может быть направлено на регуляцию роста и метаболических процессов в растении, а также на благоприятные для растений изменения в окружающей растение среде.
