Программа курса лекций
| Вид материала | Программа курса |
- Программа предусматривает проведение лекций, проведение семинарских занятий, подготовку, 17.19kb.
- Программа курса лекций для студентов специальности «История», 109.25kb.
- Программа курса Конспект лекций > Тесты Задачи > Вопросы к экзамену Методические рекомендации, 1693.2kb.
- Программа курса лекций "Языки программирования Internet", 61.91kb.
- М. Н. Общая риторика программа курса лекций общая риторика программа курса, 236.54kb.
- Программа регионоведческого курса, 292.18kb.
- Программа регионоведческого курса, 292.24kb.
- Программа курса лекций, 27.96kb.
- М. В. Кричевцев Программа курса лекций Предлагаемый курс лекций, 215.31kb.
- Название курса, 106.28kb.
Квантовая механика молекул
Программа курса лекций
(4 курс, 7 сем, 32 ч, экзамен)
Профессор, д.х.н. Плюснин Виктор Федорович
Электронное строение и спектроскопия атомов
Заполнение электронных орбиталей, электронные конфигурации. Термы атомов, схемы Рассел - Саундерса и j-j-связей. Волновые функции и энергии термов. Правила Гунда. Спин-орбитальное взаимодействие, образование прямых и обращенных мультиплетов.
Двухатомные молекулы, электронные термы
Систематика термов двухатомных молекул. Правила отбора для дипольных переходов. Вариационные методы и метод молекулярных орбиталей (МО). Нахождение основного терма двухатомных молекул, молекула кислорода. Различные виды связей (s, p, d).
Электронное строение и спектроскопия сложных молекул
Теория групп, точечные группы, операции симметрии, теория представлений, характеры операций симметрии, прямое произведение представлений. Применение теории групп для нахождения МО. Электронные конфигурации и термы сложных молекул. Правила отбора для оптических дипольных переходов в сложных молекулах.
Метод молекулярных орбиталей в приближении Хюккеля
Метод МО в приближении Хюккеля (МОХ). Молекулярные p-системы. Применение метода МОХ к ароматическим системам. Заряд, порядок связи, индекс свободной валентности. Альтернантные углеводороды, расположение уровней энергии, симметрия молекулярных орбиталей, распределение спиновой плотности в нечетных альтернантных углеводородах. Циклические p-системы, энергии и вид МО. Правило 4n+2. Длинные одномерные p-системы, распространение представлений теории МО на описание твердого тела.
Учет гетероатомов в методе МОХ. Индуктивные и мезомерные заместители. Поляризуемость атом-атом. Альтернирование заряда в ароматических молекулах с заместителями. Влияние заместителей на вырожденные уровни энергии в p-системах.
Реакционная способность молекул
Метод возмущенных МО. Индексы реакционной способности, индекс локализации. Энергии конечных состояний, правило непересечения потенциальных поверхностей. Реакция двух p-радикалов, реакция молекул и радикалов. Устойчивость p-углеводородов, реакционная способность радикалов. Ориентация в реакциях нуклеофильного, радикального и электрофильного замещения в ароматическом кольце с различными типами заместителей.
Правила Вудворда – Гоффмана
Использование представлений симметрии при рассмотрении реакционной способности. Правила Вудворда - Гоффмана для синхронных реакций. Электроциклические реакции, реакции замыкания и размыкания цикла, сигматропные реакции.
Строение и спектроскопия координационных соединений
Теория кристаллического поля, потенциал кристаллического поля, использование симметрии. Расщепление d-орбиталей в октаэдрическом и тетраэдрическом полях. Диаграмма Оргела. Учет искажения симметрии комплекса. Сильное и слабое кристаллические поля, диаграммы Танабе - Сугано, спектрохимический и нефелоксетический ряды.
Теория поля лигандов (метод МО) для описания электронной структуры координационных соединений. Сравнение двух подходов. Природа оптических переходов координационных соединений. Причины появления d-d-переходов. Фотохимические реакции координационных соединений.
Электронная спектроскопия
Классификация электронных переходов. Интенсивность и положение полос поглощения. Колебательная структура электронных переходов, принцип Франка - Кондона. Связь спектров поглощения и люминесценции. Время жизни и квантовый выход люминесценции, внутренняя и интеркомбинационная конверсия. Основные законы люминесценции. Флуоресценция и фосфоресценция.
Колебательная спектроскопия
Колебания многоатомных молекул, нормальные колебания, частоты колебаний. Типы колебательных переходов, фундаментальные переходы. Классификация нормальных колебаний с помощью теории групп. Проявление колебательных переходов в спектрах инфракрасного (ИК) поглощения и комбинационного рассеяния (КР), правила отбора. Валентные и деформационные колебания, характеристические частоты, применение ИК- и КР-спектроскопии в химических исследованиях. Электронно-колебательное взаимодействие, эффект Яна - Теллера. Влияние электронно-колебательного взаимодействия на запрещенные оптические переходы.
Вращательная спектроскопия
Вращательные уровни энергии и волновые функции для различных типов молекул. Определение структуры молекул из вращательных спектров. Колебательно-вращательное взаимодействие, диаграммы Фортра. Связь ядерного спина и вращения молекул.
Квантовая механика молекул
Программа семинарских занятий
(4 курс, 7 сем, 34 ч, зачет)
Профессор, д.х.н. Плюснин Виктор Федорович
Семинар 1
1. Сложить моменты: 2 и 2; 1 и 4; 1,2 и 3; 1/2, 1/2 и 1/2.
2. Найти возможные значения орбитального момента при сложении моментов трех p-электронов.
3. Чему равно среднее значение операторов Lx, Lz, L2 в состояниях px, py, pz?
4. Найти вид операторов Lx, Ly, Lz, L+ и L- через функции от углов q, j и их производных.
5. Определить, как действует оператор L+ на функцию Ylm.
6. Определить действие операторов Lx, Lz, L2 на функции dx2, dxz, dyz, dxy, dx2-y2.
7. Найти собственную функцию оператора Lx, если известно, что собственное значение равно нулю, а орбитальное квантовое число l = 1.
8. Чему равно L2pxb = ?; S2pxa = ?
9. Определить все значения полного орбитального момента для системы из трех d-электронов. Какие значения реализуются в действительности при учете принципа Паули?
Семинар 2
1. Записать операторы Sz, S2, S+, S- для системы из двух электронов. Найти собственные спиновые функции для синглетного и триплетного состояний.
2. Спины N частиц, равные каждый s, складываются в результирующий спин S = Ns. Каков суммарный спин любых 2, 3, ... n частиц в указанном состоянии?
3. Проверить, является ли функция aa собственной функцией оператора S2.
4. Найти спиновые функции для системы из двух частиц, имеющих спины: a) s1 = 1/2, s2 = 1; б) s1 = 0, s2 = 1.
5. Определить спиновые функции для системы из трех частиц, у которых спины равны 1, 1/2 и 1/2.
6. Для системы из двух одинаковых частиц со спином s определить число симметричных и антисимметричных спиновых функций по отношению к перестановкам частиц.
7. Спиновая функция из N электронов имеет вид y = a...ab...b (n штук a-функций и N-n штук b-функций). Найти среднее значение квадрата суммарного спина и вероятности различных значений полного спина S в частных случаях n = 1 и n = N - 1.
Семинар 3
1. Найти слейтеровские орбитали для Ar2+ (1s22s22p23s23p4).
2. Используя слейтеровские функции, определить каковы размеры атома и ионов Fe0 (1,24 A), Fe1+, Fe2+ (0,80 A), Fe3+ (0,67 A), Fe4+.
3. Первый потенциал ионизации атома кислорода – 13,614 эВ, серы – 10,357 эВ, селена – 9,75 эВ. Дать качественное объяснение этому изменению. Оценить потенциал ионизации, если в приближении слейтеровских функций средняя энергия
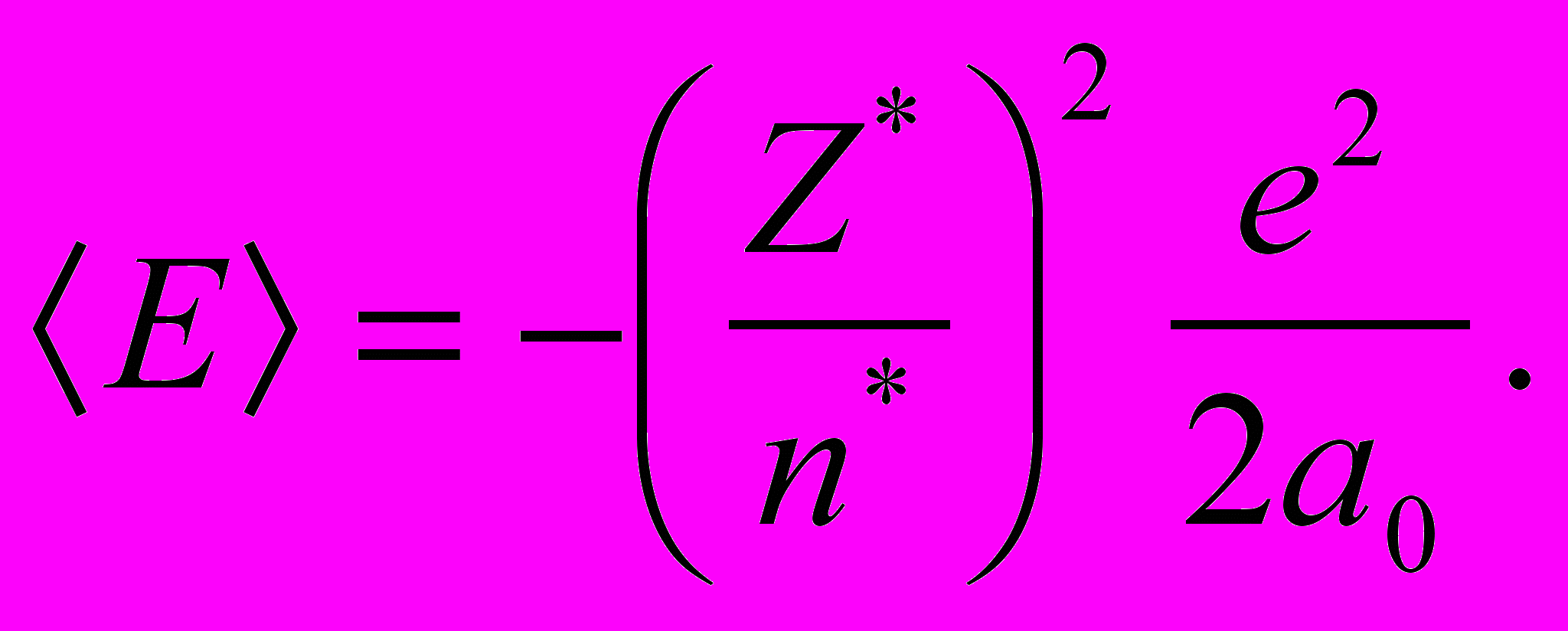
4. Определить вырождение и четность конфигураций s1p1d1, s2p2d2 и т. д.
5. Найти термы конфигураций p2, d3, s1p1, s1p1d1 и т. д.
6. Определить результат действия оператора V = x(l·s) на функции Ylma, Ylmb; оператора Lx на функции dxy и dz2.
7. Определить волновую функцию нижнего по энергии мультиплета конфигурации s1p1 в случае LS-связи.
8. С учетом спин-орбитального взаимодействия построить диаграмму уровней для конфигураций p2, d2, p1d1 и т. д.
9. Как действуют операторы L2, S2 и J2 на функции термов 2P1/2 и 2P3/2 (конфигурация p1)?
10. Выписать функции основного терма p3 электронной конфигурации.
Семинар 4
1. Найти спин-орбитальное расщепление основного терма конфигураций d4, d5, d6 и т. д.
2. Найти разрешенные переходы из термов 1S, 2P, 3D и т. д.
3. Найти основной терм и его энергию для электронной конфигурации ln в случае jj – связи.
4. Для терма 2P1/2 (конфигурация p1) определить <Lz>, <Sz> и <Jz>.
5. Найти расщепление спектральных линий в сильном магнитном поле длинноволнового перехода в атоме бора.
6. Определить поляризацию дипольных переходов в спектре атома Na, находящегося в слабом и в сильном магнитных полях.
Семинар 5
1. Определить вырождение термов: 1Sg+, 3Su-, 3П, 4Фu и т. д.
2. Найти термы, которые могут возникнуть при сближении атомов, находящихся в основных состояниях: O + O; O + H; O + F.
3. Определить основной терм радикала OD. Какие термы могут возникнуть у линейного комплекса H-O...O-D при образовании его из радикалов в основных состояниях?
4. Найти молекулярные термы, которые могут возникнуть при сближении двух ионов золота Au3+, находящихся в основных состояниях, и образовании кластера Au26+.
5. Построить диаграмму молекулярных уровней для молекул H2, HCl, C2, N2, NO.
6. Найти термы основных электронных конфигураций молекул H2, HCl, O2, O2-, O2+ и т. д.
7. Найти основной терм молекулярного иона Mo2+–С. Электронная конфигурация иона Mo2+ – 4d4.
8. Найти разрешенные электронные переходы из термов: 1Sg+, 3Su-, 3П, 4Фu, 2S-, 1S+, 2П, 2Du, 3Пu.
9. Показать, что молекула He2 неустойчива, а ион He2+ устойчив.
Семинар 6
1. Как изменяется энергия связи в ряду молекул: O2, F2, Ne2?
2. Оценить дипольный момент линейного радикала H-D-D.
3. Найти молекулярные орбитали аллильного радикала.
4. Рассчитать заряды, спиновую плотность, порядки связи и индексы свободной валентности для аллильного радикала, циклобутадиена.
5. Имеется орбиталь y=с1j1 + с2j2 + с3j3. Чему равна ее энергия?
6. Определить МО p-систем циклобутадиена и бутадиена.
7. Найти МО в приближении Хюккеля пентильного радикала.
8. Найти МО в приближении Хюккеля бензильного радикала.
9. Определить p-молекулярные орбитали триметиленметила.
10. Рассчитать энергию делокализации для аллильного радикала, бутадиена, бензола.
Семинар 7
1. Определить, какая из структур (линейная или треугольная) более устойчива для частиц H3+, H3, H3-.
2. Найти все операции симметрии и определить группу симметрии молекул: NH3, H2O, C2H4, C2H6, CH4, CH3, SF6.
3. Построить таблицу умножений операций симметрии для групп C2v, C3v, C4v.
4. Определить группу симметрии Cnv (найти n), в которой число двумерных представлений в 2 раза больше одномерных.
5. Определить МО p-системы циклобутадиена с помощью теории групп.
6. Найти вид МО молекулы H2O с помощью теории групп и определить разрешенные оптические переходы.
Семинар 8
1. Все элементы группы симметрии, содержащей 16 элементов, разбиваются на 10 классов. Определить размерности неприводимых представлений данной группы.
2. Найти характеры симметричного и антисимметричного прямого произведений представлений [Е ´ Е] в C3v-группе. По каким неприводимым представлениям они преобразуются?
3. Определить неприводимые представления, по которым преобразуются компоненты оператора импульса в группе C3v.
4. Определить неприводимые представления, по которым преобразуются компоненты орбитального момента в группе D3h.
5. С помощью теории групп найти МО p-систем: аллильного радикала, циклобутадиена, нафталина, бензола, бензильного радикала.
6. Определить на какие неприводимые представления распадется Т2 представление группы Тd при понижении симметрии от Тd до C3v.
7. Определить группу Cnv (определить n), в которой число двумерных представлений в 2 раза больше, чем одномерных.
8. Определить группу Dnd, в которой число двумерных неприводимых представлений в 10 раз больше одномерных НП.
9. Построить таблицу характеров для D3d группы.
10. По каким неприводимым представлениям преобразуются прямые произведения следующих представлений: S ´ П; П ´ П; Sg+ ´ Su-; Su-´ Пg.
Семинар 9
1. Проверить, являются ли альтернантными следующие радикалы и молекулы:
2. Доказать, что в нейтральных альтернантных углеводородах плотность p-зарядов на каждом центре равна 1.
3. В каком случае циклические углеводороды являются альтернантными?
4. Доказать, что в альтернантных углеводородах порядок связи между двумя мечеными (или немечеными) атомами равен нулю.
5. В рамках МОХ рассмотреть линейную бесконечную p-систему. Показать возникновение разрешенной энергетической зоны вместо отдельных уровней, определить ее ширину.
 6. Найти МО циклического p-радикала, состоящего из трех p-центров.
6. Найти МО циклического p-радикала, состоящего из трех p-центров.7. Найти энергии и МО, пользуясь теорией циклических углеводородов, для циклобутадиена, циклопента-диенильного радикала.
 8. Определить распределение спиновой плотности в радикале H15, строение которого представлено на рисунке.
8. Определить распределение спиновой плотности в радикале H15, строение которого представлено на рисунке.9. Определить распределение спиновой плотности для радикала H5 (группа D4h), строение которого показано на рисунке.
10. Определить изменение энергии орбитали неспаренного электрона для длинной p-системы, состоящей из N центров, при ее замыкании на концах в циклическую p-систему.
 Семинар 10
Семинар 101. Определить изменение спиновой плотности при введении заместителя CF3 в разные положения пентадиенильного радикала (x = 0,3).
2. Определить относительную стабильность различных геометрических изомеров антрацена, тетрацена, пентацена (см. рисунок).
 3. Линейная молекула, состоящая из N атомов водорода, замыкается на концах. Определить изменение энергии самой нижней молекулярной орбитали.
3. Линейная молекула, состоящая из N атомов водорода, замыкается на концах. Определить изменение энергии самой нижней молекулярной орбитали.4. Чему равен выигрыш энергии при объединении ЧАУ и НАУ?

 5. Определить ориентацию радикального замещения для замещенного циклобутадиена CH3-C4H2-CF3.
5. Определить ориентацию радикального замещения для замещенного циклобутадиена CH3-C4H2-CF3.6. Определить направление преимущественного присоединения атома водорода к p-системе молекулы, геометрия, которой представлена на рисунке.
7. Определить распределение заряда в бензильном радикале при введении индуктивного заместителя в первое положение.
Семинар 11
1. Правила Вудворда – Гоффмана для реакции циклоприсоединения молекул. Вывести общие правила.

2. С точки зрения правил Вудворда – Гоффмана рассмотреть возможность протекания реакции Н2 + N2 Û N2H2 и Н2 + J2 Û 2HJ.
3. Pассмотpеть с точки зpения пpавил Вудвоpда-Гоффмана pеакцию обpазования аммиака пpи взамодействии pадикала NH с молекулой водоpода. Для атома азота учитывать только p-оpбитали. Геометpия сближения показана на pисунке. Постpоить коppеляционную диагpамму c указанием типа молекуляpных оpбиталей.
4. Рассмотреть реакцию циклозамыкания пентильного радикала (катиона или аниона этого радикала) с точки зрения правил Вудворда – Гоффмана.

5. С точки зрения правил Вудворда – Гоффмана рассмотреть реакцию.
 6. Для двух одинаковых молекул Hn с точки зрения правил Вудворда – Гоффмана рассмотреть реакцию превращения, представленную на рисунке.
6. Для двух одинаковых молекул Hn с точки зрения правил Вудворда – Гоффмана рассмотреть реакцию превращения, представленную на рисунке.7. Изобразить корреляционную диаграмму для реакции бензола с молекулой этилена.
Семинар 12
1. Написать потенциал кристаллического поля для иона с электронной конфигурацией d2 в поле Тd.
2. Указать причины появления d-d-полос поглощения в оптических спектрах координационных соединений.
3. Как соотносятся величины расщеплений d-орбиталей в поле тетраэдра, октаэдра и куба?
4. Определить оператор кристаллического поля для комплекса, имеющего форму правильной тригональной бипирамиды.
5. На какие электронные состояния расщепляются термы конфигурации p2 в поле правильного квадрата?
6. Предсказать характер расщепления d-орбиталей в поле тетрагональной бипирамиды.
7. Качественно изобразить поведение энергии d-орбиталей при искажении правильного тетраэдра до правильного квадрата.
8. Предсказать окраску растворов комплексов Co(H2O)6 и CoCl42-.
9. Определить электронные состояния конфигураций e2 и t22 в поле тетраэдра.
10. Показать, что тетраэдрические комплексы с электронной конфигурацией d7 всегда являются высокоспиновыми.
11. Раствор комплекса Fe(H2O)6 бесцветен. Определить число неспаренных электронов в этом комплексе.
12. Найти расщепление (энергии) электронных состояний конфигурации p2 в поле правильного треугольника.
Семинар 13
1. Определить поляризацию в спектрах оптического поглощения молекулы сим-триазин (Н3С3N3).
2. Определить поляризацию электронных переходов в молекуле H2O.
3. Определить основной терм и поляризацию переходов для p-системы аллильного радикала (C2v).
4. Найти матрицу дипольных переходов для группы D4h.
5. Найти отношение интенсивностей люминесценции вдоль осей Z и Y при облучении образца светом вдоль оси X и с поляризацией по оси Z.
6. Найти характер электронных переходов в ионе ванадила VO(H2O)5 (группа симметрии C4v).
7. Предсказать поляризацию самой длинноволновой полосы поглощения в оптическом спектре формальдегида H2CO.
8. Оценить интенсивность лазерного излучения, необходимую для насыщения синглетного разрешенного перехода.
9. Вывести формулу Перрена для тушения люминесценции по обменному механизму в жестких матрицах.
10. Переход (S0 ® S1) в пиридине поляризован вдоль оси, перпендикулярной плоскости молекулы. Определить поляризацию перехода S0 ® T1.
11. Вывести формулу Штерна - Фольмера для тушения люминесценции.
12. Определить отношение интенсивностей люминесценции вдоль осей Z и Y с поляризацией вдоль оси X, если образец возбуждается вдоль оси X с поляризацией под 450 к оси Z.
13. В какой из молекул (бензол, нафталин, антрацен) расщепление между уровнями S1 и T1 больше?
14. При введении в раствор эффективного тушителя (концентрация 10-3 М) квантовый выход люминесценции уменьшился в 1000 раз. Оценить время жизни люминесценции.
Семинар 14
1. Определить типы колебаний, проявляющихся для молекулы цикло-бутадиена в ИК-спектре.
2. Охарактеризовать КР-спектр молекулы Н2, D2.
3. Можно ли, анализируя экспериментальные ИК- и КР-спектры, сделать однозначный вывод о строении молекулы, состоящей из четырех одинаковых атомов?
4. Сколько валентных и деформационных колебаний имеется у молекул H2O, NH3, CO2, C6H6, нафталина и т. д?
5. Найти неприводимые представления, по которым преобразуются деформационные колебания бензола. Сколько деформационных частот будет реализоваться в ИК- и КР-спектрах?
6. Найти колебания, разрешенные в ИК- и КР-спектрах молекул этилена, аммиака, SF5Cl.
7. Найти разрешенные в ИК-спектре колебания для молекулы нафталина.
8. В КР-спектре иона CO проявляются три частоты. Определить строение этой частицы (плоское или объемное).
9. Для молекулы, состоящей из N атомов и принадлежащей к C4v группе, определить число различных частот колебаний.
10. При рекомбинации двух молекул количество колебательных степеней свободы увеличилось на 4. Что можно сказать о строении реагирующих частиц и геометрии реакции?
Семинар 15
1. Определить число деформационных колебаний для молекулы СnH2n+1.
2. Вывести формулу для характера тензора поляризуемости для операции Sn, Cn.
3. Частота колебаний молекулы H2 равна 4400 см-1. Чему равна эта величина для молекулы TD?
4. Для плоской молекулы, имеющей центр инверсии, определить число четных и нечетных плоских (неплоских) колебаний.
5. Для линейной молекулы, состоящей из N атомов, определить количество различных частот колебаний.
6. Для молекулы, состоящей из N атомов и принадлежащей к C3v-группе, определить число различных частот колебаний.
7. Для молекулы, состоящей из N атомов и принадлежащей к группе D4h, определить число различных частот колебаний, проявляющихся в ИК спектре.
8. Можно ли однозначно решить вопрос о геометрическом строении молекулы X4 с помощью ИК- и КР-спектроскопии?

9. Чему равно отношение числа полносимметричных деформационных колебаний к числу плоских неполно-симметричных для молекулы из N одинаковых атомов, имеющей строение, показанное на рисунке.
10. Для линейной молекулы Xn найти число четных и нечетных колебаний.
11. Определить количество различных частот плоских колебаний для молекулы из 4-х атомов, имеющей строение плоского квадрата (прямоугольника).
12. Для молекулы, состоящей из N атомов и принадлежащей к D4h-группе, определить число различных частот колебаний, проявляющихся в ИК-спектре.
Семинар 16
1. Рассмотреть эффект Яна – Теллера на примере плоского p-анион радикала Н6C4, имеющего симметрию D3h.
2. Показать, что в линейной многоатомной молекуле не будет проявления эффекта Яна – Теллера.
3. Доказать теорему Яна – Теллера для D4h-группы.
4. Существует ли эффект Яна – Теллера для отрицательного иона бензола? Если да, то какие колебания снимают это вырождение?
5. Что можно сказать о геометрической структуре иона CH4+?
6. В каком из тетраэдрических комплексов (FeСl4- или CuCl42-) будет наблюдаться эффект Яна – Теллера?
7. Доказать теорему Яна – Теллера для группы C6v.
8. Возможен ли эффект Яна – Теллера для молекул H4, имещих строение сжатого тетраэдра (группа симметрии D2d)?
9. Рассмотреть возможность проявления эффекта Яна – Теллера для p-катион-радикала (см. рисунок).
10. В каком случае (Td или D4h) для молекулы CuH4+ будет проявляться эффект Яна – Теллера? Определить тип колебаний, снимающих вырождение. Центральный ион имеет конфигурацию 3d10.
11. Будет ли проявляться эффект Яна – Теллера для иона PuH43+ (электронная конфигурация иона плутония Pu3+ - 5f5) и какие колебания снимут вырождение, если эффект будет?
Семинар 17
1. Определить связь вращения молекулы и ядерного спина для линейного радикала H3.
2. Связь вращения молекул с ядерным спином. Можно ли из вращательного спектра молекулы НСl определить, является ли спин ядра хлора целым или полуцелым?
3. Построить в масштабе схему вращательных уровней для плоского CH3-радикала. Длина связи C-H равна 1,09 A.
4. Определить типы вращательных уровней для ион-радикала J2-.
5. Дать классификацию вращательных уровней молекулы D2.
6. В спектре КР на чисто вращательных переходах для двухатомной гомоядерной молекулы отношение интенсивностей первой (ближайшей к линии возбуждения) линии в стоксовой области ко второй равно 1/4. Определить ядерный спин атомов молекулы.
7. Во вращательном спектре трехатомной молекулы наблюдается эквидистантный набор линий поглощения. Что можно сказать о строении такой молекулы?
8. В колебательно-вращательном спектре двухатомной молекулы существует предел сходимости линий поглощения в области меньших частот по сравнению с 0-0-переходом. В каком колебательном состоянии вращательная константа больше?
9. Построить вращательный спектр молекулы H2.
10. Что произойдет с вращательным спектром линейной молекулы, если ее изогнуть на малый угол?
11. Установить связь вращения и ядерного спина для молекулы метана.
12. Дать классификацию вращательных уровней линейного ион-радикала (H-Be-H)-.
13. Определить полные ядерные спины для систем протонов и дейтонов в молекуле CH2D2 при Т = 0 К.
14. Дать классификацию вращательных уровней молекулы Ti2.
Задание
1. Имеется 10 одинаковых орбитальных моментов l = 2. Сколько раз встретится значение полного момента L = 1 для такой системы?
2. Найти вырождение конфигурации f2, ее основной терм и его расщепление за счет спин-орбитального взаимодействия.
3. Определить термы конфигурации s1d1 в случае j-j-связи.
4. Под действием спин-орбитального взаимодействия терм расщепляется на 5 мультиплетов. Интервалы по энергии между соседними мультиплетами, начиная с нижнего, равны 125, 100, 75 и 50 см-1. Кроме того, известно, что один из мультиплетов не расщепляется в магнитном поле. Каким образом из этих данных определить величины L и S для исходного терма?
5. На сколько уровней и с каким вырождением расщепляется основной терм конфигурации ln в слабом магнитном поле?
6. Определить количество молекулярных термов, которые могут возникнуть при сближении двух ионов Mn2+ (3d5-конфигурация) в основных состояниях и при образовании молекулярного иона Mn2+-Mn2+.
7. Найти основной терм линейной молекулы D-Co2+-D.
8. Построить матрицу дипольных переходов для группы C4v.
9. Определить число и размерность НП в группе Dkh.
10. Найти разложение симметричной части прямого произведения [E´E] в группе C4v.
11. С помощью теории групп рассмотреть электронное строение молекулы NaH4, имеющей квадратное строение.

12. Найти энергию, приходящуюся в среднем на один p-электрон (Еср=Еpполн/N) для бесконечно большой (N®¥) циклической p-системы.
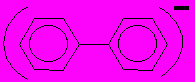
13. С помощью теории групп найти распределение спиновой плотности в p-радикале.

14. Используя теорию возмущений, определить распределение спиновой плотности в p-системе анион-радикала.
15. Используя теорию возмущений, определить, какой из двух радикалов более стабильный.

16. Определить по Вудворду - Хоффману путь для реакции циклозамыкания линейной p-системы, состоящей из N p-центров.
17. Определить разрешенность (кТ, hn) реакции метилена и молекулы водорода образованием метана. Геометрия сближения показана на рисунке. Построить корреляционную диаграмму. У атома углерода учитывать только p-орбитали.
18. Написать выражение для потенциала кристаллического поля для иона с электронной конфигурацией p1 в поле N эквивалентных лигандов.
19. Для молекулы, состоящей из N атомов и принадлежащей к C4v-группе определить число различных частот колебаний.
19. Определить типы колебаний (симметрию) для линейной молекулы, состоящей из N атомов и принадлежащей к группе C¥v.
20. В плоскую молекулу (группа D4h), состоящую из N атомов, в центр вставили атом (его там не было). Насколько увеличится количество частот плоских колебаний, проявляющихся в ИК-спектре?
22. Будет ли проявляться эффект Яна-Теллера для молекулы DH4 (C4v)? Найдите терм основного состояния. Считать bH-H = 0.
23. Будет ли проявляться эффект Яна - Теллера для иона CuH82+ с симметрией D4h (ион Cu2+ - конфигурация 3d9)?
24. Дать систематику вращательных уровней для линейного CH2-радикала. Для молекулярной диаграммы считать орбитали 2s и 2p вырожденными.
Литература
Ландау Л.Д., Лившиц Е.М. Квантовая механика.М.:Наука, 1974
- Маррелл Дж., Кеттл С., Теддер Дж. Теория валентности. М.: Мир, 1968.
- Маррелл Дж., Кеттл С., Теддер Дж. Химическая связь. М.: Мир, 1980.
- Герцберг Г. Спектры и строение простых свободных радикалов. М.: Мир, 1974.
- Плюснин В.Ф., Бажин Н.М. Двухатомные молекулы. Новосибирск: Изд-во НГУ, 1991.
- Герцберг Г. Электронные спектры и строение многоатомных молекул. М.: Мир, 1969.
- Дьюар М. Теория молекулярных орбиталей в органической химии. М.: Мир, 1972.
- Дьюар М., Догерти Р. Теория возмущенных молекулярных орбиталей в органической химии. М.: Мир, 1977.
- Войтюк А.А. Симметрия молекул. Новосибирск: Изд-во НГУ, 1988.
- Яцимирский К.Б., Яцимирский В.К. Химическая связь. М.: Наука, 1975.
- Бальхаузен К. Введение в теорию поля лигандов. М.: Мир, 1964.
- Берсукер И.Б. Электронное строение и свойства координационных соединений. Л.: Химия, 1976.
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Шусторович Е.М. Химическая связь. М.: Наука, 1973.
- Вудворд Р., Гоффман Р. Сохранение орбитальной симметрии. М.: Мир, 1971.
- Джаффе Г., Орчин М. Симметрия в химии. М.: Мир, 1977.
- Лер Р., Марчланд А. Орбитальная симметрия в вопросах и ответах. М.: Мир, 1976.
- Джилкрист Т., Сторр Р. Органические реакции и орбитальная симметрия. М.: Мир, 1976.
- Пирсон Р. Правила симметрии в химических реакциях. М.: Мир, 1979.
- Берсукер И.Б. Эффект Яна-Теллера и вибронные взаимодействия в современной химии. М.: Наука, 1987.
- Плюснин В.Ф., Бажин Н.М. Электронная спектроскопия координационных соединений. Новосибирск: Изд-во НГУ, 1995.
- Свердлова О.В. Электронные спектры в органической химии. М.: Наука, 1973.
- Грибов Л.А. Введение в молекулярную спектроскопию. М.: Наука, 1976.
- Наберухин Ю.И. Лекции по молекулярной спектроскопии. Новосибирск: Изд-во НГУ, 1973.
- Степанов Б.И., Грибковский В.П. Введение в теорию люминесценции. М.: Наука, 1963.
- Ермолаев В.Л., Бодунов Е.Н., Свешникова Е.Б., Шахвердов Т.А., Безизлучательный перенос энергии электронного возбуждения. Л.: Наука. Ленингр. отд-ние, 1977.
- Уитли П. Определение молекулярной структуры. М.: Мир, 1970
- Волькенштейн М.В., Грибов Л.А., Ельяшевич М.А., Степанов Б.И. Колебания молекул. М.: Наука, 1972.
- Свердлов Л.М., Ковнер М.А., Крайнов Е.П. Колебательные спектры многоатомных молекул. М.: Наука, 1970.
- Герцберг Г. Колебательные и вращательные спектры многоатомных молекул. М.: Мир, 1949.
- Конингстайн И.А. Введение в теорию комбинационного рассеяния. М.: Мир, 1975.
- Колебательная спектроскопия. Современные воззрения. /Под ред. А.Барнса и У.Орвилл-Томаса. М.: Мир, 1981.
