Donetsk compartment of shevchenko scientific society
| Вид материала | Документы |
- Donetsk compartment of shevchenko scientific society, 2259.73kb.
- Donetsk compartment of shevchenko scientific society, 3938.75kb.
- Donetsk compartment of shevchenko scientific society, 4086.35kb.
- Donetsk compartment of shevchenko scientific society, 3610.42kb.
- Donetsk compartment of shevchenko scientific society, 16031.76kb.
- Donetsk compartment of shevchenko scientific society, 2424.3kb.
- Донецьке відділення наукового товариства ім. Шевченка donetsk compartment of shevchenko, 3687.32kb.
- Донецьке відділення наукового товариства ім. Шевченка donetsk compartment of shevchenko, 3817.8kb.
- Донецьке відділення наукового товариства ім. Шевченка donetsk compartment of shevchenko, 3413.53kb.
- Донецьке відділення наукового товариства ім. Шевченка donetsk compartment of shevchenko, 398.96kb.
ВПЛИВ РУЙНУВАННЯ СУПРАХІАЗМАТИчних ЯДЕР ГІПОТАЛАМУСА ЩУРІВ НА АУТОСЕНСІБІЛІЗАЦІЮ ОРГАНІЗМУ
Останнім часом серед основних систем організму виділяють єдину нейроімуноендокринну систему, що виконує гомеостатичну та інформаційну функції. Питання про взаємодію окремих складових нейроімуноендокриної системи залишаються дотепер недостатньо вивченими, особливо це відноситься до взаємовпливів між імунною ланкою і структурами центральної нервової системи. В той же час встановлено наявність на клітинах нервової тканини і імунокомпетентних клітинах загальних антигенних детермінант, рецепторів до інтерлейкінів та гормонів [1, 2].
Нейронні структури переднього гіпоталамуса, з одного боку, є ініціаторами і модуляторами багатьох біологічних ритмів [3], з іншого - вони беруть участь в підтримці постійності внутрішнього середовища організму [4]. Проте, незважаючи на широкий спектр досліджень функціональної активності даної області гіпоталамусу, його роль у взаємодії з імунною системою до кінця не з’ясована.
Мета даної роботи: виявити взаємозв’язок між нервовою і імунною системами а також участь структур переднього гіпоталамуса в нейроімунній взаємодії.
Матеріали та методи
Дослідження проводилося на 64 білих безпородних статевозрілих щурах обох статей, вагою 200 - 220 г. Тварин розділяли на 2 рівноцінні групи. I контрольна група - інтактні тварини, II - дослідна група - тварини з пошкодженими супрахіазматичними ядрами (СХЯ). Для електролітичного руйнування необхідних структур тварину дослідної групи наркотизували етаміналом натрію (30 міліграм/кг маси тіла) і фіксували в стереотаксичному апараті. Руйнування СХЯ здійснювали шляхом пропускання постійного струму (1 мА) протягом 10 сек через срібний електрод, який занурювали в мозкові структури за координатами стереотаксичного атласу Л. Пеллегріно [5].
Для морфологічного контролю локалізації пошкодження на заморожуючому мікротомі виготовлялися фронтальні зрізи мозку завтовшки 50 - 75 мкм, що поміщалися на предметне скло й вивчалися під мікроскопом. Зріз з найбільш вираженим слідом деструкції (рис. 1) порівнювався із слайдом стандартного зрізу атласу Л. Пеллегріно.
Для оцінки показників гемато-імунологічного стану, кров у тварин забирали з хвостової вени в гепаринізовану пробірку, що містила 2 од. гепарину на 1 мл крові. У тварин загальноприйнятими методами визначали вміст лейкоцитів периферичної крові [6].
Для оцінки ступеня сенсибілізації імунокомпетентних клітин організму до власних тканин (нирка, щитовидна залоза, селезінка, тімус, кора головного мозку, мозочок, стовбур мозку) використовували метод імунолейколізу (РІЛ) [7] у власній модифікації [8]. Принцип методу полягає в руйнуванні лейкоцитів, що містять фрагменти білків і полісахаридів під впливом гуморальних і клітинних чинників імунітету при порушенні толерантності до них.
Тканинні антигени для РІЛ готували за методом [9], у власній модифікації [10]. У сироватці крові визначали вміст циркулюючих імунних комплексів за методом M. Digeone et al., 1965 [11].
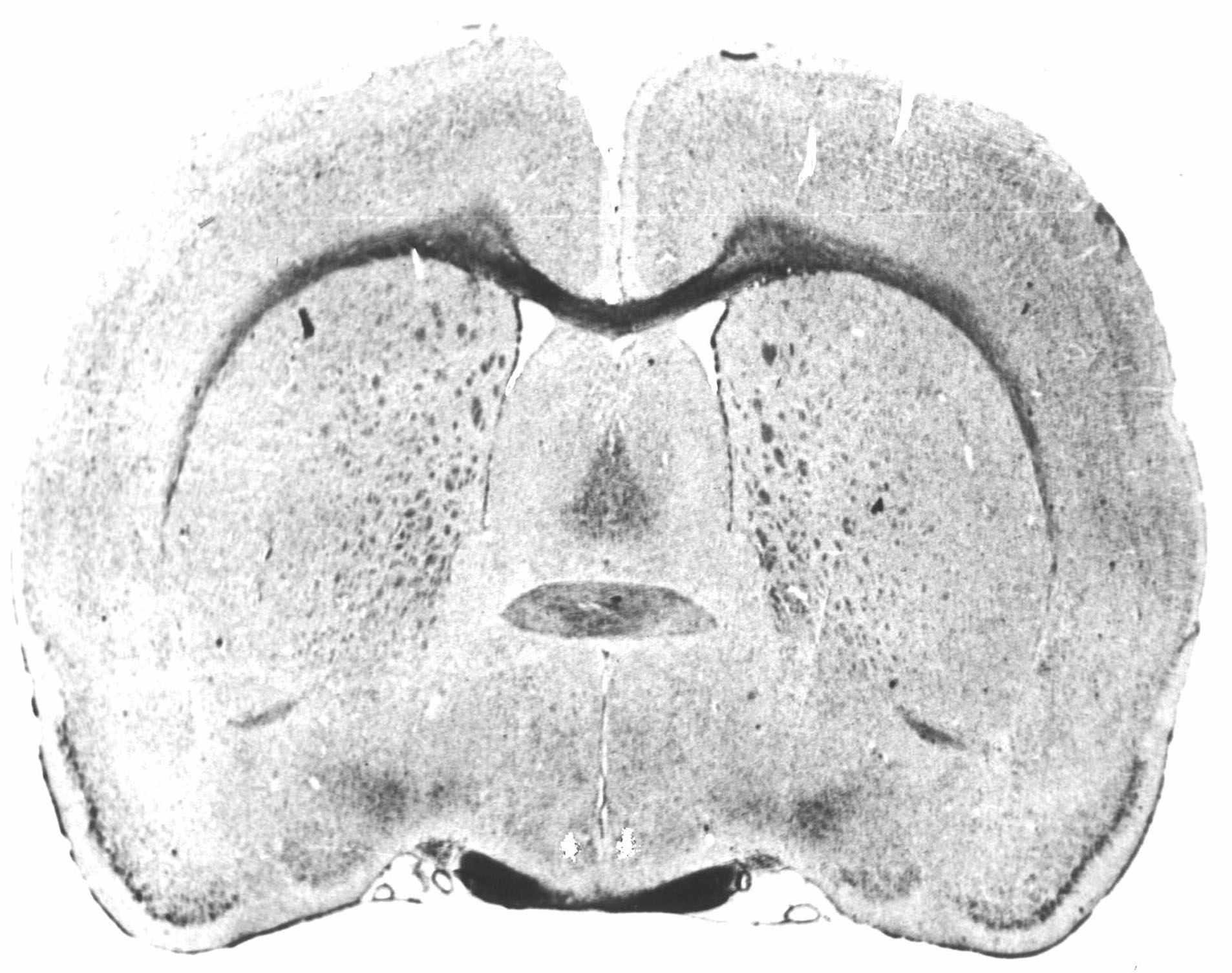


Рис. 1. Зріз мозку щура по фронту АР+1,6 атласу Л. Пеллегіно.
Примітка: стрілками вказані місця пошкодження.
Досліджувану кров поміщали в рівних кількостях (40 мкл) в дослідну й контрольну пробірки. У контрольну пробірку вносили 10 мкл 0,9% розчину NaCI, а в дослідну - 10 мкл алергену. Пробірки струшували, а потім інкубували в термостаті при tº = 37º С протягом 30 хв. Після інкубації в кожну з пробірок додавали 400 мкл 3% оцтової кислоти. Вміст пробірок ресуспендували (перемішували) і витримували 15 хвилин при кімнатній температурі. Після цього проводили підрахунок лейкоцитів у вмісті кожної з пробірок. Підрахунок клітин здійснювався в камері Горяєва в 25 великих квадратах, згідно загальноприйнятому методу підрахунку лейкоцитів.
Сенсибілізацію імунокомпетентних клітин організму обчислювали, як відношення різниці (контроль-дослід) до контролю.
Статистичну обробку матеріалу проводили за допомогою PC, використовуючи пакет відповідних програм Statistic Windows. Аналізували середньоквадратичні відхилення і обчислювали коефіцієнт Стьюдента.
Результати та їх обговорення
В результаті проведених досліджень було встановлено, що через 14 діб після руйнування СХЯ у тварин дослідної групи розвивалася лейкопенія. При цьому вміст лейкоцитів периферичної крові в групі тварин II зменшувався практично втричі і складав 4,34±0,26 Г/л при нормі для контрольних тварин - 12,80±1,9 Г/л при Р <0.05 (рис.2).
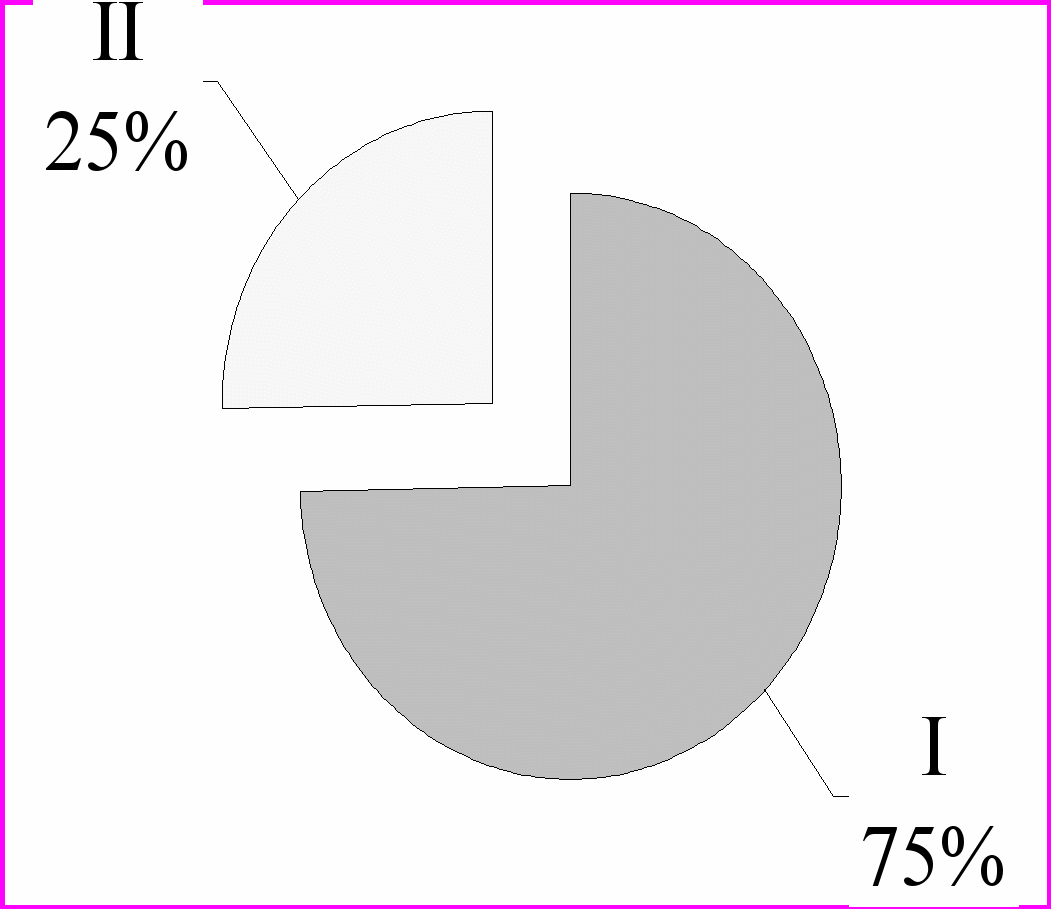
Рис. 2. Вміст лейкоцитів периферичної крові у тварин контрольної (I) та дослідної груп (II).
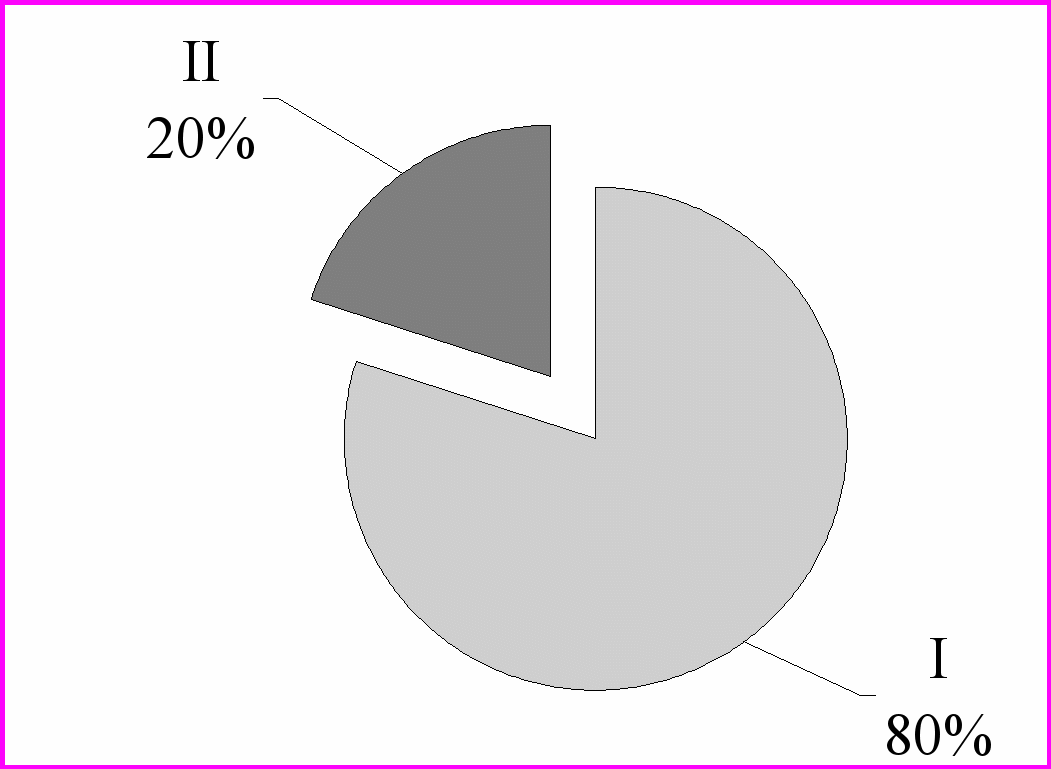
Рис. 3. Рівень циркулюючих імунних комплексів у контрольної групи тварин (I) та в дослідній (II) групі.
У тварин дослідної групи (II) зареєстроване вірогідне зниження вмісту циркулюючих імунних комплексів - 6,3±0,45 од. опт пл. (одиниця оптичної густини), порівняно з групою контрольних тварин (I) 25,3±0,62 од. опт. пл. (рис.3.)
У
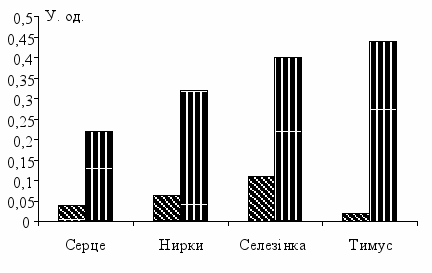 групі тварин II через 14 днів після руйнування СХЯ зареєстровано розвиток аутоіммунного процесу, що виявлявся сенсибілізацією імунокомптентних клітин організму до власних тканин. Так, встановлено, що у тварин дослідної групи в порівнянні з контрольною збільшилася сенсибілізація імунокомпетентних клітин організму до тканин серця з 0,04±0,02 у.од. до 0,22±0,13 у.од. (умовних одиниць), а до тканин нирки - з 0,09±0,04 у.од. до 0,34±0,11 у.од. при P < 0,05 (рис. 4).
групі тварин II через 14 днів після руйнування СХЯ зареєстровано розвиток аутоіммунного процесу, що виявлявся сенсибілізацією імунокомптентних клітин організму до власних тканин. Так, встановлено, що у тварин дослідної групи в порівнянні з контрольною збільшилася сенсибілізація імунокомпетентних клітин організму до тканин серця з 0,04±0,02 у.од. до 0,22±0,13 у.од. (умовних одиниць), а до тканин нирки - з 0,09±0,04 у.од. до 0,34±0,11 у.од. при P < 0,05 (рис. 4). Рис. 4. Сенсибілізація імунокомпетентних клітин організму
(СІКО) до тканин серця, нирки, селезінки та тимусу у тварин після руйнування ядер гіпоталамуса.
Примітка: К - контрольна група; Д - дослідна група.
Особливо високою була сенсибілізація імунокомпетентних клітин організму до тканин органів системи імунітету селезінки та виделкової залози, що складало, відповідно 0,40±0,16 у. од і 0,43±0,1 у.од при відповідних показниках у контрольної групи 0,11±0,04 у.од. і 0,02±0,02 у.од.
А
 наліз результатів дослідження сенсибілізації імунокомпетентних клітин організму до власних тканин кори головного мозку, мозочка і стовбура мозку (рис. 5) показав наявність високого її ступеня до структур мозочка та стовбура мозку.
наліз результатів дослідження сенсибілізації імунокомпетентних клітин організму до власних тканин кори головного мозку, мозочка і стовбура мозку (рис. 5) показав наявність високого її ступеня до структур мозочка та стовбура мозку. Рис. 5. Сенсибілізація імунокомпетентних клітин організму (СІКО) до тканин мозочка, стовбуру і кори головного мозку у тварин після руйнування ядер гіпоталамуса.
Примітка: К - контрольна група; Д - дослідна група.
Рівень сенсибілізації імунокомпетентних клітин до тканин мозочка і стовбура мозку був значно і вірогідно вище за норму і складав 0,41±0,13 у.од та 0,34±0,13 у.од, при таких показниках у інтактних щурів 0,06±0,03 у.од і 0,01±0,01 у.од. відповідно. Сенсибілізація іммунокомпетентних кліток організму до кори головного мозку не була зареєстрована: 0,03±0,03 у.од. і 0,03±0,03 у.од.
Специфічна імунологічна невідповідь - імунологічна толерантність до власних тканин організму за Ф.М. Бернетом закладається в ембріональному періоді і забезпечується елімінацією клітин-родоначальниць клонів, преадаптованих до розвитку імунної відповіді до власних тканин організму[12].
Сьогодні відсутність імунної відповіді до власних тканин організму пов’язують як із загибеллю (апоптозом) клітин-родоначальниць клонів при контакті з власними антигенами у процесі ембріогенезу, так і з функцією специфічних клітин супресорів - вето-клітин [13]. В той же час механізм формування імунологічної толерантності, поза сумнівом, неоднозначний, оскільки відомі феномени низькодозової (феномен Дресслера) та високодозової (імунологічний параліч Фелтона) специфічної імунної невідповіді [14]. Очевидно, стан специфічної аутотолерантності динамічний і не забезпечується тільки загибеллю “заборонених клонів” [12] - імуноцитів до власних тканин, оскільки в клініці і експерименті спостерігаються зриви аутотолерантності, зокрема при розвитку аутоімунних процесів.
Одержані результати підтверджують наявність нейроімунної взаємодії і дають можливість в новому світлі поглянути на роль ядер переднього гіпоталамусу у формуванні стану специфічної невідповіді до власних тканин організму, оскільки руйнування СХЯ привело до значного й вірогідного збільшення сенсибілізації до тканин імунокомпетентних органів (тимус, селезінка), тканин головного мозку, а також серця й нирок. Виняток становила кора головного мозку, що, можливо, пов’язане з ще не до кінця з’ясованою функцією нейроглії, яка може брати на себе роль клітин-супресорів. Проте зараз важко чітко уявити механізми ймовірно опосередкованого впливу СХЯ на супресорну ланку імунітету (вето-клітини).
Можна припустити, що СХЯ, як первинний осцилятор біологічних ритмів виділення нейропептидів, опосередкує через них свій вплив на імунну систему, виконуючи функцію апарату тонкого настроювання системи імунітету до умов внутрішнього і зовнішнього середовища, що змінюються. Руйнування СХЯ призводить до зміни тимчасового патерну секреції нейропептидів, що, можливо, запускає процес активації Т-хелперів, В-клітин та макрофагів, минуючи супресорний механізм вето-клітин.
Одержані результати свідчать про участь супрахіазматичних ядер в регуляції толерантних відносин між системою імунітету і власними тканинами.
ЛІТЕРАТУРА
- Акмаев И.Г. Нейроиммуноэндокринология: факты и гипотезы // Проблемы эндокринологии. - 1997. - Том 43, № 1. - С. 3 - 8.
- Крыжановский Г.Н., Магаева С.В. Патология нервной регуляции в генезе иммунных расстройств при заболеваниях центральной нервной системы // Журнал неврологии и психиатрии. - 1998. - №5. - С. 60 - 64.
- Арушанян Э.Б., Батурин В.А., Попов А.В. Супрахиазматическое ядро гипоталамуса как регулятор циркадианной системы млекопитающих // Успехи физиологических наук. - 1988. - Т. 19., № 2. - С. 54 - 58.
- Баклаваджян О.Г. Центральные механизмы гомеостаза // Частная физиология нервной системы. - Л.: Наука, 1983. - С. 218 - 312.
- .Pellegrino L. J., Pellegrino A.S., Cushman A.J. A Stereotaxic Atlas of the Rat Brain. - Plenum Press, New York, 1979.
- Западнюк А.И., Западнюк В.И., Захария Е.А., Западнюк Б.В. Лабораторные животные. Разведение, содержание, использование в эксперименте. - Киев: Вища шк.,1983.- 383 с.
- Некоторые иммунологические методы исследований в профилактике инфекций, управляемых вакцинацией /Л.И. Слюсарь, А.А. Сохин, Ю.В. Лагунов и др. :Метод. рекомендации для врачей-курсантов циклов усовершенствования по микробиологии и эпидемиологии. - Новокузнецк, 1991. - 22 с.
- Ракша-Слюсарева Е.А. Гематоиммунологический статус ликвидаторов последствий аварии на ЧАЭС, проживающих в экокризисном регионе Донбасса, и обоснование коррекции его нарушений. Диссерт. д.б.н. М. - 1998. - 356 с.
- Иммунологические методы / Под ред. Г. Фримеля / М.: Медицина. - 1987. - 472 с.
- Ли Я.Б., Слюсарев А.А. Экспериментальное исследование аутоимунных процессов при воздействии новой эпоксидной смолы на лабораторных животных // В кн.: Сборник трудов молодых ученых и специалистов, посвященный 65-летию Донецкого медицинского университета. Донецк.-1996. - С. 194 - 196.
- Digeone M. Detection of circulating immune complexes in human serum by simple assays with polyetilenglycol // J. Immunol. Methods. - 1977/ - V.16. - P.165 - 183.
- Бернет Ф.М. Клеточная иммунология. - Москва: Мир, 1971. - 542 с.
- Фонталин Л.Н., Певницкий Л.А. Иммунологическая толерантность, М.: М., 1978. - с. 255.
- Ярилин А.А. Основы иммунологии. - М.: Медицина, 1999. - 608 с.
ББК 28.903.1
Олексій Слюсарєв,
кандидат медичних наук, доцент кафедри мікробіології,
вірусології та епідеміології, Донецький державний
медичний університет
Олена Ракша-Слюсарева,
кандидат медичних наук, доктор біологічних наук,
ст. науковий співробітник, професор кафедри
товарознавства та експертизи продовольчих товарів
Донецького державного університету економіки і торгівлі ім. М.Туган-Барановського
ЕКОІМУНОЛОГІЧНІ ОСОБЛИВОСТІ УМОВНО ЗДОРОВИХ МЕШКАНЦІВ ДОНЕЦЬКОГО РЕГІОНУ В ДИНАМІЦІ МОНІТОРИНГУ
ПІСЛЯ АВАРІЇ НА ЧАЕС
Після аварії на ЧАЕС на території Донецького регіону виникла нова радіоекологічна обстановка, яка ускладнила раніше сформовану екологічно несприятливу ситуацію та дотепер ще не повністю вивчена. Так, на “слідах” радіоактивної хмари, що виникла у зв’язку з аварією на Чорнобильській АЕС, на території області сформувалися близько 13000 „плям” забруднення радіоактивними осадами різної величини, іноді до 1 км². Проведені дослідження показали, що середній рівень потужності дози на цих територіях складає 17-20 мкр/год, тоді як на всій території області він рівний 11-14 мкр/год. [1,2]. Дослідження 90-х років зафіксували перехід радіоактивних речовин з ґрунтів в рослини, а потім попадання їх в продовольчі товари. Так, було встановлено, що в 80 % відібраних проб продуктів (молоко, овочі, зернові, м’ясо) в контрольних населених пунктах по всіх районах області містили цезій 137. Проведені нами в 1990 - 2000 роках дослідження показали, що погіршення екологічної обстановки в Донецькому регіоні останніми роками привело до несприятливих зрушень в стані здоров’я населення [3-6]. Зокрема, спостерігається зростання ряду захворювань, пов’язаних з порушеннями в системі крові і імунітету [7-8].
Не викликає сумніву, що моніторинг гемато-імунного стану організму як віддзеркалення загального стану психонеройімуноендокринної системи, є одним з найвірогідніших сучасних методів оцінки стану здоров’я популяції. Моніторингові дослідження стану імунітету, що обов’язково включають і починаються аналізом гемограми, і цитоморфологічних змін лейкоцитів периферичної крові дають можливість не тільки об’єктивно оцінити стан здоров’я популяції, визначити найбільш ослаблені контингенти, але й дати рекомендації з корегування виявлених порушень нейроімуноендокринної системи, попередивши економічний збиток, пов’язаний з втратою здоров’я частиною населення.
Метою роботи був аналіз результатів дослідження показників гемато-імунологічного стану умовно здорового населення Донецького регіону у 1990-2000 роках, як основного етапу загального моніторингу стану здоров’я різних контингентів населення на протязі 20 років після аварії на ЧАЕС.
Матеріали і методи
Для вивчення стану здоров’я населення Донецької області була обстежена група умовно здорових осіб у віці від 22 до 52 років - 75 чоловіків і 81 жінка, що постійно мешкають в регіоні. Професійна діяльність вказаних осіб не була пов’язана з роботою в умовах підвищеного радіаційного навантаження і гірничодобувної промисловості. Обстежені оцінювали стан свого здоров’я як хороший. Попередні клініко-лабораторні дослідження і огляд їх терапевтом, невропатологом і дерматологом показав відсутність у даної групи, будь-яких захворювань.
Визначення й оцінка показників гемограми проводилась звичайними лабораторними методами. Дослідження складу популяцій і субпопуляцій лімфоцитів у умовно здорового населення Донецького регіону проводилося методом імунофлюоресценції за допомогою вітчизняної панелі моноклональних антитіл для виявлення експресії рецепторів мембранами мононуклеарів, аналогічних СD 3+, CD 4+, CD 8+, CD 20+,CD 16+, СD25+, CD38+, HLA, HLA-Dr, виробництва Лабораторії біотехнології Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, зареєстрованої й затвердженої Міжнародними робочими комітетами. Як вторинні антитіла використовувалися F(ab’)-фрагменти козиної антимишачої сироватки, міченої флуоресцєінатіоізоцианатом (FITC), виробництва США. Вміст імуноглобулінів класів А, М, G визначали методом радіальної імунодіфузії за Mancini G. et all, 1965. Для дослідження використовувалися комерційні препарати моноспецифічних сироваток проти імуноглобулінів людини А, М, G, виробництва Інституту епідеміології, мікробіології ним Н.Ф. Гамалеї АМН РФ (Москва). Рівень циркулюючих імунних комплексів (ЦІК) визначали колориметричним методом, з використанням фотоелектроколориметра (ФЕК) КФК -2МП при довжині хвилі 450 нм за методу Digione Мetall, 1964. Одержані результати оброблялися методами варіаційної статистики і рангової кореляції з використанням PCL. Були використані програми "Statistica Window, і пакет відповідних програм вимірювань
Результати та обговорення
Показники гемограми обстежених дещо відрізнялися, залежно від статі. При цьому відмінності у вмісті елементів лейкограми чоловіків і жінок реєструвалися й при їх виразі як у відносних, так і в абсолютних величинах.
У чоловіків були зареєстровані вищі показники таких елементів гемограми, як вміст гемоглобіну, тромбоцитів, еритроцитів, лейкоцитів периферичної крові. При цьому вірогідні відмінності виявлені лише у вмісті гемоглобіну периферичної крові, що був вищим у чоловіків (Р<0,05). В середньому його величина у умовно здорового населення (УЗН) складала 138,10±3,00 г/л. Число еритроцитів дорівнювало 4,30 +0,06 Т в 1 л, тромбоцитів - 251,7+10,5 Г в 1 л, лейкоцитів 5,27+0,07 Г в 1 л, величина гематокриту становила - 43,2 +1,4%.
Показники лейкограми чоловіків, виражені у відносних і абсолютних значеннях, більші, ніж у жінок (за винятком відносного вмісту сегментоядерних нейтрофілів і моноцитів) і вірогідно не відрізнялись від таких у жінок. При цьому аналіз та співставлення показників лейкограми УЗН Донецької області й інших регіонів України показало їх значні відмінності між собою й більш низький вміст елементів лейкограми у донеччан [9-12].
Вміст лейкоцитів периферичної крові у умовно здорових донеччан, які не працюють в умовах шкідливих факторів професійного середовища, у 1990- 2000 роках коливалась в межах 4,00 Г в 1 л -5,90 Г в 1 л. В цих же межах зберігались нормальні співвідношення елементів лейкограми, зокрема, найбільших її складових: сегментоядерних нейтрофілів і лімфоцитів. Середній вміст мієлоцитів, що іноді зустрічаються в периферичній крові, складав 0,027+0,008 Г в 1 л. Вміст паличкоядерних нейтрофілів в середньому відповідав 0,12+0,01 Г в 1 л. Абсолютне число нейтрофілів -2,62+0,06 Г в 1 л. Еозинофіли могли бути відсутніми в периферичній крові, проте, при виявленні їх середній вміст складав - 0,08+0,01 Г в 1 л. Моноцити реєструвались далеко не завжди, при середньому їх вмісті - 0,11+0,01 Г в 1 л. Кількість лімфоцитів периферичної крові, в середньому, в нормі становив 2,20+0,08 Г в 1 л. Природні кілери в периферичній крові донеччан, на відміну від мешканців інших регіонів України, були та є, на жаль, швидше, знахідкою, ніж правилом. Їх середній вміст знижений в крові УЗН області і складав у відповідний період моніторингу 0,06 + 0,01 Г в 1 л.
В 1990-2000 році у УЗН області кількість клітинних розпадів складала 8,50+0,54 на 100 клітин. У периферичній крові в невеликій кількості реєструвалися нейтрофіли з токсогенною зернистістю (4,10+0,90%), ворсинчатістю хроматину (5,60+0,65%), фрагментованими ядрами (8,90+1,03%), набуханням хроматину (10,30+1,33%), гіпер- (5,50+0.80%) і гіпосегментованими (0,45+0,05%) ядрами. Адгезія нейтрофілів реєструвалася практично у всіх обстежених і складала 2,30+0,33 %.
У невеликій кількості були виявлені атипові форми лімфоцитів і моноцитів. При цьому 1,60+0,30 % лімфоцитів складали бобовидні, 0,40+0,19 % лімфоцити у вигляді ручки дзеркала, 0,85+0,27 % - лімфоцити з ядром неправильної форми у вигляді сухого листка. Веретеноподібних і витягнутих лімфоцитів налічувалося до 0,73+0,32 %. 0,12+0,05% лімфоцитів були представлені молодими клітками, відмінними великою кількістю цитоплазми і гладким круглим ядром. Двоядерні лімфоцити складали 0,13+0,05 %. Атипові і двоядерні лімфоцити складали 0,09 + 0,07 % і 0,12+0,09 % від вмісту цих клітин в периферичній крові. Хоча в групах чоловіків і жінок кількість цитоморфологічних змін коливалася в ту або іншу сторону, вірогідних відмінностей в їх вмісті залежно від статі обстежених виявлено не було.
Поява в крові УЗН в незначній кількості клітин з цитоморфологічними змінами, що відображають наявність токсико-запалювального процесу, змін на рівні ядра і клітин нейтрофілів, поява атипових лімфоцитів і моноцитів, найвірогідніше є проявами дії на організм комплексу негативних чинників навколишнього зовнішнього середовища, яке включає й постійну дію низькоінтенсивної природної радіації й, частково, забруднень регіону в результаті випадання радіоактивних осадів після аварії на ЧАЕС.
Дослідження складу популяції лімфоцитів за даними експресії антигенних рецепторів мембранами цих клітин свідчило про наявність деяких відмінностей в групах чоловіків і жінок Донецького регіону. (Р> 0,05). У чоловіків був нижчим вміст популяції Т, В-лімфоцітов і природних кілерів за рівнем експресії мембраною лімфоцитів антигенних рецепторів CD3+, CD22+, СD16+. Крім того, у чоловіків був декілька нижчим вміст субпопуляцій лімфоцитів Т-хелперів (CD4)+ й Т-супресорів (CD8+), а вміст активованих пулів Т (CD 25+) і В (CD 38+) лімфоцитів - трохи вищим. Експресія антигенів гістосумісності I (HLA), II (HLA-Dr) класів, що забезпечують взаємодію імунокомпетентних клітин, та експресія антигену, що індукує апоптоз (CD95+), також були вищими у чоловіків. Проте при статистичній обробці ці відмінності виявилися недостовірними (Р>0,05)
