«микроэлементный спектр плазмы крови при геморрагическом инсульте» 14. 00. 13 нервные болезни
| Вид материала | Автореферат |
- Задачи по оказанию доврачебной помощи при неотложных состояниях 43 акушерство, 1884.21kb.
- Плазмаферезом (ПА) называется метод экстракорпоральной гемокоррекции, основанный, 143.35kb.
- Урок №17 «Состав и функции крови», 42.32kb.
- Нервные болезни, 77.54kb.
- Оценка пластичности протеома плазмы крови здорового человека в экстремальных условиях, 453.97kb.
- Обоснование механизмов действия гирудорефлексотерапии в комплексном лечении бронхиальной, 390.9kb.
- План лекции: Состав и функции крови. Схема кроветворения у животных. Анемии > Постгеморрагическая, 386.71kb.
- Клинико-неврологические и нейропсихологические особенности ишемической болезни мозга, 367.52kb.
- Сосудистые заболевания головного мозга у военнослужащих инженерно-технического состава, 310.05kb.
- Специальность: 051301 общая медицина, 70.4kb.
На правах рукописи
Маликова Альбина Гамидовна
«МИКРОЭЛЕМЕНТНЫЙ СПЕКТР ПЛАЗМЫ КРОВИ ПРИ ГЕМОРРАГИЧЕСКОМ ИНСУЛЬТЕ»
14.00.13 – нервные болезни
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2008
Работа выполнена в Государственном образовательном учреждении
высшего профессионального образования «Российский Государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
кандидат медицинских наук, профессор Никонов Алексей Алексеевич
Официальные оппоненты:
заслуженный деятель науки РФ, доктор медицинских наук,
профессор Маслова Ольга Ивановна
Государственное учреждение «Научный центр здоровья детей РАМН»
доктор медицинских наук, профессор Румянцева Софья Алексеевна
Российский государственный медицинский университет
Ведущая организация:
Московская государственная медицинская академия им. И.М.Сеченова
Защита диссертации состоится 24 ноября 2008 года в 14.00 часов на заседании диссертационного совета Д 208.072.09 при Российском государственном медицинском университете по адресу: 117997, Москва, улица Островитянова, д.1.
С диссертацией можно ознакомиться в библиотеке Российского государственного медицинского университета по адресу: 117997, Москва, ул. Островитянова, д.1.
Автореферат разослан « 25 » сентября 2008 года
Ученый секретарь диссертационного совета
кандидат медицинских наук, профессор Л.В. Губский
Общая характеристика работы.
Актуальность работы. Цереброваскулярная патология занимает второе место в ряду основных причин смерти, уступая лишь смертности от заболеваний сердца и опережая смертность от опухолей всех локализаций, и является ведущей причиной инвалидизации населения, что определяет ее как одну из важнейших медицинских и социальных проблем (Е.И.Гусев 2002, 2005, В.И.Скворцова 2006). По материалам ВОЗ частота инсульта колеблется от 1,5 до 7,4 на 1000 населения. В Российской Федерации и странах СНГ отмечается прогрессирующий рост данной заболеваемости. По данным регистра заболеваемость инсультом в России составляет 3,48 ± 0,21 на 1000 в год, что почти в 2,5-3 раза превышает показатели экономически развитых стран. Летальность в острой стадии всех видов инсульта составляет примерно 35%, увеличиваясь на 12-15% к концу первого года (Н.В.Верещагин 2003).
Соотношение между ишемическим и геморрагическим инсультом ранее составляло 5:1, однако за последние годы прослеживается отчетливая тенденция к увеличению доли геморрагического инсульта. Данные регистра 2001-2003 гг. показали, что в России ишемические инсульты составили 65,6% всех случаев инсульта, внутримозговые кровоизлияния – 14,1%, субарахноидальные кровоизлияния – 3,0%, в 18,7% отмечены случаи недифференцированных инсультов (В.И.Скворцова 2006, Е.И.Гусев 2005), то есть в последние годы соотношение частоты ишемического и геморрагического инсульта изменилось и составило 4:1, за счет увеличения геморрагического инсульта. Повсеместное внедрение в практику здравоохранения нейровизуализационных методов исследований, скорее всего, приведет к выявлению большего процента геморрагического характера инсульта в общей структуре острых нарушений мозгового кровообращения.
Несмостря на внедрение в клиническую практику современных методов диагностики и лечения, смертность при нетравматических внутримозговых гематомах остается очень высокой, варьируя по данным ряда авторов от 38 до 73%. При гипертензивных внутримозговых кровоизлияниях 30-суточная летальность достигает 44-52%, при чем половина из них погибают в течение первых трех суток (Е.И.Гусев 2005, Н.В.Верещагин 2003, Скворцова В.И. 2006). Только 10% пациентов к концу первого месяца являются независимыми в повседневной жизни; 20% - независимы к полугоду; 25-40% больных имеют умеренно выраженную, 35-55% - тяжелую инвалидизацию (Гусев Е.И. 2002; Н.В.Верещагин 2003, Суслина З.А. 2003).
Стойкая тенденция к увеличению частоты геморрагического инсульта, высокие цифры летальности и инвалидизации обуславливают необходимость тщательного изучения всех аспектов этой формы цереброваскулярной патологии и делают «жизненно» необходимой разработку максимально эффективных методов лечения.
В настоящее время не вызывает сомнения роль микроэлементов в многообразных функциях организма и каждой клетки в отдельности. В последние годы сформировалась новая наука – клиническая элементология.
Оценка метаболизма микроэлементов весьма сложна из-за существования большого количества двусторонних и трехсторонних синергичных и антагонистических взаимоотношений между 15 эссенциальными микроэлементами. Данные взаимоотношения играют значительную роль в поддержании внутриклеточного гомеостаза и связанными с ним процессами клеточного роста, дифференцировки и клеточной смерти (некроз и апоптоз). Чрезвычайно интересно и важно изучение роли микроэлементов при патологии нервной системы. Отклонения в содержании микроэлементов, дисбаланс металлолигандного гомеостаза, вызванные пищевыми и экологическими факторами, соматическими заболеваниями, формируют неблагоприятный фон для дебюта геморрагического инсульта (Кудрин А.В., Громова О.А., 2006). Кроме того, вышеуказанные изменения могут предопределить направленность процесса восстановления, а также эффективность последующей реабилитации больных. Исследования ряда авторов показали, что нормализация баланса микроэлементов может стать ключевым компонентом терапии больных с геморрагическим инсультом, в том числе и в острейшую фазу заболевания (Райцеса В.С., 1981; Anthony M., 1995; R.A. Goyer, 1995). Разработка рекомендаций по коррекции микроэлементного состава крови у больных с геморрагическим инсультом может способствовать дальнейшему улучшению качества их лечения и снижению неблагоприятных медико-социальных последствий данного заболевания.
Цель исследования
Изучение клинических особенностей течения геморрагического инсульта в сопоставлении с изменением спектра микроэлементов и выяснение роли отдельных микроэлементов в патогенезе и прогнозе заболевания.
Задачи исследования
- Изучить в динамике спектр микроэлементов больных геморрагическим инсультом.
- Проанализировать микроэлементный состав плазмы крови больных геморрагическим инсультом в разных возрастных группах.
- Определить благоприятные и неблагоприятные паттерны микроэлементов, характерные для различных вариантов течения геморрагического инсульта.
- Выявить взаимосвязь концентраций отдельных микроэлементов и исходов геморрагического инсульта.
Научная новизна
1. Впервые описаны изменения спектра микроэлементов плазмы крови у больных с геморрагическим инсультом в динамике.
2. Впервые выявлены статистически достоверные изменения микроэлементов у больных с геморрагическим инсультом в зависимости от возраста. У больных, относящихся к более старшим возрастным группам, отмечено увеличение концентрации селена в сочетании со снижением концентраций лития и висмута.
3. Впервые выявлены изменения соотношений в микроэлементном составе в зависимости от исхода геморрагического инсульта. У больных геморрагическим инсультом с удовлетворительным восстановлением неврологического дефицита – индекс Бартель 95,1±2,3 (1-ая основная группа) отмечается повышение эссенциальных микроэлементов (цинка, хрома, селена и алюминия) в сочетании со снижением умеренно- и высокотоксичных микроэлементов (кобальта, кадмия, таллия и ртути).
4. У больных с тяжелым течением геморрагического инсульта - индекс Бартель 39,8±9,7 (2-я основная группа) и плохим восстановлением утраченных функций зарегистрировано снижение эссенциальных микроэлементов (йода, хрома, лития и магния) в сочетании с повышением высокотоксичных микроэлементов (таллия, меди и кадмия).
- Впервые в группе умерших больных (3-я основная группа) описано статистически достоверно значимое (p<0,01) повышение высокотоксичных микроэлементов (таллия, ртути и золота), что сочеталось с низкими цифрами малотоксичных микроэлементов (магния и лития).
Практическая и теоретическая значимость
Результаты исследования формируют представление о микроэлементном составе плазмы крови и их корреляционных взаимосвязей у больных с дисциркуляторной энцефалопатией (группа контроля) с учетом экологических особенностей прикаспийского региона. Эти данные могут быть использованы как основа для анализа изменений микроэлементов при острых нарушениях мозгового кровообращения различного генеза и локализации.
Описанные изменения микроэлементного спектра плазмы крови у больных с геморрагическим инсультом в зависимости от течения и исхода заболевания предопределяют медико-социальную значимость работы, связанную с возможностью снижения частоты неблагоприятных исходов геморрагического инсульта и вероятности формирования на его фоне грубых неврологических нарушений.
Результаты исследования, описывающие характер изменения концентрации микро- и макроэлементов у больных с геморрагическим инсультом в динамике заболевания, могут способствовать улучшению госпитального ведения таких больных, оптимизации их лечения и постгоспитальной реабилитации.
Обоснована значимость применения отдельных микроэлементов в лечении пациентов с внутримозговой нетравматической гематомой.
Внедрение результатов исследований в практику
Материалы диссертации используются в лекциях и на практических занятиях, проводимых со студентами на кафедрах неврологии и нейрохирургии лечебного и медико-биологического факультетов Российского Государственного медицинского Университета, а также на лекциях и семинарских занятиях цикла усовершенствования врачей «Актуальные вопросы неврологии» кафедры неврологии и нейрохирургии лечебного факультета ГОУ ВПО РГМУ.
Полученные результаты диссертационной работы внедрены в практическую работу неврологических отделений №12 и №13 ГКБ №1 г. Москвы, неврологических отделений РКБ и ММБ № 1 г. Махачкалы.
Основные положения, выносимые на защиту
- Анализ информативности спектра микроэлементов и их корреляционных сопоставлений у пациентов с дисциркуляторной энцефалопатией Прикаспийского региона дает возможность коррегировать соотношения микро- и макроэлементного состава, что позволит улучшить прогноз течения цереброваскулярной недостаточности.
- Выявленные статистически достоверные изменения соотношений микроэлементного состава у больных с развившимся геморрагическим инсультом свидетельствуют о степени тяжести изменений, происходящих в мозге, и возможности репаративных процессов.
- Повышение количества эссенциальных микроэлементов (цинка, хрома, селена и алюминия) в сочетании со снижением умеренно- и высокотоксичных микроэлементов (кобальта, кадмия, таллия и ртути) свидетельствует о благоприятном течении внутримозговых кровоизлияний с быстрым и хорошим восстановлением неврологических синдромов (Бартель 95,1±2,3).
- Статистически достоверное снижение эссенциальных микроэлементов (йода, хрома, лития и магния) в сочетании с повышением высокотоксичных микроэлементов (таллия, меди и кадмия) позволяет прогнозировать неблагоприятное течение геморрагического инсульта с плохим восстановлением неврологических синдромов и значимым снижением активностей повседневной жизни – индекс Бартель 39,8±9,7.
- Выявление статистически достоверного повышения уровней высокотоксичных микроэлементов более чем в 2,5 раза свидетельствует о крайне неблагоприятном течении геморрагического инсульта, приводящем к летальному исходу заболевания.
Апробация работы
Основные положения диссертации представлены на совместной научно-практической конференции сотрудников кафедры неврологии и нейрохирургии лечебного факультета ГОУ ВПО РГМУ, 12 и 13 неврологических отделений ГКБ №1 (2007 г.); на совместной научно-практической конференции сотрудников кафедры неврологии, нейрохирургии с курсом медицинской генетики, кафедры неврологии ФПО ДГМА и дагестанского республиканского общества невропатологов и нейрохирургов (2008 г.); на IX съезде Неврологов в г. Ярославле (2006г.), а также на секции «Изучение микроэлементов в современной медицине» на конгрессе «Человек и лекарство» в г. Москве (2007г.).
Публикации
По материалам работы опубликованы 3 печатные работы, из них 2 - в центральной печати.
Структура и объем диссертации
Диссертация содержит 130 страниц машинописного текста, включает 4 главы: обзор литературы, 3 главы результатов собственного исследования, выводы и библиографический указатель, содержащий 204 литературных источника (84 отечественных и 120 зарубежных). Диссертация содержит 7 таблиц, 47 рисунков.
Содержание работы
Клинические наблюдения и методы исследования
Для решения поставленных задач исследования было проведено клинико-неврологическое обследование 63 больных с острым нарушением мозгового кровообращения по геморрагическому типу, госпитализированных в неврологическое отделение РОСМП (Республиканское отделение скорой медицинской помощи) г.Махачкалы. Медиана возраста исследованных пациентов составила 65,1 ± 7,7 (40-81) лет. Среди больных с геморрагическим инсультом было 35 (55,6%) мужчин и 28 (44,4%) женщин. Контрольную группу составили 24 пациента с дисциркуляторной энцефалопатией II стадии, медиана возраста которых составила 61,4± 11,6 (42-79) год, 45,8% больных были мужского пола.
С целью стандартизации сбора информации для проведения диссертационного исследования была создана анкета, включающая в себя раздел демографических данных (возраст больного, пол, место жительства, сроки проживания в данном регионе), семейный анамнез, факторы риска, сопутствующие заболевания, клиническую базу данных (результаты шкал неврологического тестирования), данные обо всех особенностях лечебно-диагностического процесса, перечень используемых для лечения препаратов с учетом доз и способов их введения, а также показатели микроэлементного спектра плазмы крови в динамике.
С целью детальной оценки неврологического статуса и возможности последующей обработки данных применялись следующие шкалы: шкала комы Глазго; шкала Инсульта (National Institutes of Health Stroke Scale), индекс активностей повседневной жизни Бартель.
Встречаемость у больных основной группы факторов риска и сопутствующих заболеваний представлена в таблице 1.
Больные основной группы, включенные в исследование, были разделены на 3 группы в зависимости от вариантов течения и исходов заболевания. В 1-ую группу были включены 26 пациентов с благоприятным исходом геморрагического инсульта с хорошим регрессом неврологического дефицита (индекс Бартель ≥ 45 баллов). Во 2-ую группу вошли 18 выживших пациентов с неблагоприятным течением инсульта и плохим восстановлением утраченных функций (индекс Бартель < 45 баллов). Третью группу составили умершие пациенты (19 человек).
В группе больных с летальным исходом инсульта (3-я группа) чаще отмечались анамнестические указания на наличие заболеваний желудочно-кишечного тракта (ЗЖКТ), наличие стенозирующего атеросклероза сосудов нижних конечностей (таблица 1). Вместе с тем, больные с летальным исходом инсульта и выжившие пациенты были сопоставимы по полу, частоте наличия у них факторов риска развития цереброваскулярной патологии (АГ, ИБС, нарушение сердечного ритма, хроническая сердечная недостаточность, сахарный диабет 2-го типа, ожирение), а также хронической обструктивной болезни легких (ХОБЛ).
У пациентов данной подгруппы в острейшем периоде инсульта чаще регистрировались нарушения сознания (наличие сопора, коматозных состояний, дезориентировки в месте, времени, собственной личности), имелась тенденция к более частому выявлению речевых нарушений. Частота развития и выраженность общемозговых, менингеальных, равно как и очаговых симптомов, при развитии геморрагического инсульта, в группах больных с летальным исходом и у выживших пациентов регистрировались одинаково часто (таблица 1). В группе больных с летальным исходом инсульта правосторонняя локализация очага отмечалась у 74% больных ( у 41% больных с благоприятным исходом).
Таблица 1 Клиническая характеристика исследованных больных
| Показатель | Исход заболевания, % больных | P | |
| Летальный n=19 | Благоприятный, n=44 | ||
| Возраст, годы | 75 (73;76) | 68 (53;72) | <0,001 |
| Пол, мужчины | 47,4 | 45,5 | >0,05 |
| АГ | 100 | 97,7 | >0,05 |
| ССЗ | 78,9 | 72,7 | >0,05 |
| Болезни легких | 31,6 | 34,1 | >0,05 |
| Сахарный диабет 2 типа | 0,0 | 11,4 | >0,05 |
| Ожирение | 15,8 | 25,0 | >0,05 |
| Болезни ЖКТ | 84,2 | 46,2 | <0,004 |
| Болезни сосудов | 100 | 86,4 | >0,05 |
| Локализация инсульта: правое полушарие левое полушарие двухсторонняя | 73,7 16,7 10,5 | 40,9 59,1 - | <0,01 <0,01 <0,01 |
| Менингеальные симптомы: Ригидность мышц затылка Симптом Кернинга Симптом Брудзинского Симптом Бехтерева | 84,2 68,4 68,4 84,2 | 61,4 61,4 72,7 79,5 | >0,05 >0,05 >0,05 >0,05 |
| Нарушения сознания | 68,4 | 25,0 | <0,001 |
| Амнезия | 42,1 | 31,8 | >0,05 |
| Возбуждение (двигательное, речевое) | 31,6 | 18,2 | >0,05 |
| Головная боль | 100 | 93,2 | >0,05 |
| Головокружение | 42,1 | 31,8 | >0,05 |
| Рвота | 47,4 | 68,2 | >0,05 |
| Нарушение ориентировки | 68,4 | 25,0 | <0,003 |
| Нарушение ритма дыхания | 16,7 | 4,5 | < 0,075 |
| Нарушения функций глазодвигательных нервов | 68,4 | 61,4 | >0.05 |
| ЧМН 7-я пара | 84,2 | 68,2 | >0,05 |
| ЧМН 12-я пара | 84,2 | 68,2 | >0,05 |
| Пирамидные симптомы | 84,2 | 77,3 | >0,05 |
| Нарушения чувствительности | 16,7 | 47,7 | <0,042 |
| Речевые нарушения | 84,2 | 61,4 | <0,079 |
| Нарушения движения | 36,4 | 20,5 | >0,05 |
| Температура ≥37 ºС | 36,4 | 29,5 | >0,05 |
| Нарушение контроля тазовых функций | 57,9 | 45,5 | >0,05 |
| Шкала Глазго, баллы | 6 (3;8) | 12 (9;13) | < 0,001 |
Примечание. АГ - артериальная гипертония, CCЗ – сердечно - сосудистые заболевания, болезни ЖКТ – болезни желудочно-кишечного тракта, ожирение – индекс массы тела ≥30 кг/м2.
В группе выживших пациентов с хорошим восстановлением неврологических функций (1-ая группа) в структуре факторов риска выявлен более низкий процент встречаемости стенозирующего атеросклероза сосудов мозга, сердца и нижних конечностей, ожирения II и III степени, сахарного диабета II и III типа. Вместе с тем, у больных 1-ой группы отмечен статистически достоверно более высокий процент встречаемости хронической обструктивной болезни легких и плохо коррегируемой артериальной гипертонии (p<0,001).
У больных данной подгруппы по сравнению с пациентами 2-ой подгруппы по данным неврологического тестирования отмечалась статистически достоверно более низкая балльная оценка по шкале Глазго и шкале Инсульта (NIHSS). Процент наличия общемозговых и менингеальных симптомов был также статистически достоверно ниже.
Таблица 2
Динамика регресса нарушений сознания по шкале комы Глазго
в зависимости от клинико-визуализационных особенностей
развития геморрагического инсульта у выживших больных.
| ШкалаГлазго | 1 сутки | 3 сутки | 7 сутки | 14 сутки | 21 сутки |
| < 10 куб см | 14,0 ± 0,7 | 14,4 ± 0.7 | 14,8 ± 0,2 | 14,9 ± 0,3 | 15,0 ± 0** |
| 10-30 куб см | 13,3 ± 1,2 | 13,8 ± 0,9 | 13,9 ± 0,6 | 14,5 ± 0++,3 | 15,0 ± 0** |
| >30 куб см | 11,8 ± 2,6 | 12,2 ± 2,0 | 13,4 ± 1,3 | 15,0 ± 0* | 15,0 ± 0* |
| Лобарные | 12,7 ± 1,0 | 14,2 ± 0,7 | 13,8 ± 1,5 | 15,0 ± 0* | 15,0 ± 0* |
| Латеральные | 13,6 ± 1,1 | 13,8 ± 0,9 | 14,4 ± 0,8 | 15,0 ± 0* | 15,0 ± 0* |
| Медиальные | 13,5 ± 1,3 | 13,6 ± 1,2 | 14,2 ± 1,1 | 14,7 ± 0,1 | 15,0 ± 0* |
| Смешанные | 11,9 ± 1,5 | 12,2 ± 1,0 | 13,4 ± 0,8 | 15,0 ± 0* | 15,0 ± 0* |
| Субтентори-альные | 14,7 ± 0,4 | 14,5 ± 0,6 | 14,0 ± 1,1 | 15,0 ± 0* | 15,0 ± 0* |
- - p < 0,01 и ** - p < 0,05 достоверные различия по отношению к исходным данным этой же подгруппы.
Из таблицы 2 видно, что к 21 суткам заболевания восстановление нарушений сознания у выживших пациентов статистически достоверно по всем исследуемым группам.
Динамика регресса неврологического дефицита по балльной оценке шкалы NIHSS у выживших больных за период наблюдения представлен в таблице 3.
Таблица 3
Динамика балльной оценки шкалы NIHSS за три недели наблюдения
| Шкала NIHSS | 1 сутки | 3 сутки | 7 сутки | 14 сутки | 21 сутки |
| < 10 куб см | 9,5± 3,1 | 8,4 ± 2,6 | 6,7 ± 2,8 | 5,3 ± 3,1 | 2,4 ± 1,8** |
| 10-30 куб см | 12,8 ± 3,8 | 12,1 ± 3,6 | 11,4 ± 4,2 | 7,6 ± 3,1 | 5,2 ± 2,5** |
| >30 куб см | 16,7 ± 4,3 | 16,2 ± 3,9 | 11,6 ± 3,7 | 7,1 ± 3,2 | 5,8 ± 2,3** |
| Лобарные | 11,7 ± 3,2 | 9,6 ± 2,9 | 8,3 ± 3,6 | 4,4 ± 2,4 | 2,8 ± 1,2** |
| Латеральные | 12,2 ± 3,0 | 11,6 ± 2,7 | 9,1 ± 3,3 | 6,2 ± 3,6 | 4,3 ± 2,7* |
| Медиальные | 13,1 ± 4,6 | 11,6 ± 4,2 | 10,3 ± 3,9 | 6,9 ± 3,6 | 4,6 ± 3,2* |
| Смешанные | 15,6 ± 4,7 | 15,0 ± 4,8 | 11,8 ± 4,9 | 8,9 ± 4,3 | 4,7 ± 2,9* |
| Субтентори-альные | 5,9 ± 2,2 | 5,5 ± 1,9 | 5,1 ± 1,8 | 3,2 ± 1,1 | 2,4 ± 0,7* |
- - p < 0,01 и ** - p < 0,05 достоверные различия по отношению к исходным данным этой же подгруппы.
Из таблицы 3 видно, что лучшее восстановление отмечалось у пациентов с диагностированным лобарными внутримозговыми гематомами.
Функциональные исходы по индексу социальной адаптации Бартеля к 21 суткам заболевания у больных с геморрагическим инсультом приведены в таблице 4.
Таблица 4
Функциональная активность по индексу социальной адаптации Бартеля
к 21 суткам заболевания
| < 10 куб см | 10-30 куб см | > 30 куб см | Лобарные | Латеральные | Медиальные | Смешанные | Субтенто- риальные |
| 75 | 65,9 | 57,7 | 31,7 | 62,1 | 63,8 | 60,9 | 50,6 |
Проведение данной работы стало возможным после внедрения в практику научных исследований определения спектра МЭ методом атомно-абсорционной спектрофотометрии. Эта методика, по сравнению с ранее существовавшими (до 2000г.), повысила чувствительность и точность анализа спектра МЭ на порядок. Не менее важным, хотя и сложным, является обязательное употребление специализированного набора для забора и анализа крови (иголки, шприцы, наконечники пипеток, пробирки для хранения плазмы), что позволило избежать контаминации образцов.
Анализ полученных показателей проводился на IBM-совместимом компьютере с помощью пакета программы «STATISTICA» 5.0 и «SPSS» 12.0 с обработкой материала по группам с помощью методов вариационной статистики, включающих вычисление медианы (25;75 процентилей) для переменных с интервальной шкалой измерения. Дискретные переменные представлялись в виде частот (процентов). Анализ статистически значимых зависимостей проводили с помощью непараметрического U-критерия по Mann-Whitney (для интервальных переменных), критерия χ2 и точного критерия Фишера (для дискретных переменных). Визуальное представление зависимости переменных с интервальной шкалой измерений проводилось с использованием программной опции Scatterplot и построением регрессионной кривой со сглаживанием. Статистически значимыми являлись результаты с величиной ошибки p<0,05, при уровне ошибки p<0,10 говорили о тенденциях проявления различий.
Результаты исследования и обсуждения
Настоящее исследование показало, что концентрация значительного числа микроэлементов у больных с геморрагическим инсультом существенно отличается от концентраций аналогичных МЭ у больных с ДЭ. Для больных с ДЭ II стадии, составивших контрольную группу, были характерны сравнительно низкие уровни микроэлементов с эссенциальными и условно-эссенциальными свойствами (марганец, железо, медь, олово, кобальт и мышьяк). Исключение составил кадмий, хотя и он является «серьезным кандидатом на эссенциальность» (Aggett et al., 1993г.). Не исключено, что низкие концентрации указанных МЭ предшествовали возникновению инсульта, сопровождая или инициируя те процессы, что и привели к его возникновению. Причем речь может идти не только об их абсолютном дефиците в результате недостаточного поступления с пищей, но и об относительном дефиците, возникшем вследствие дисбаланса поступления других микроэлементов.
Анализ микроэлементного состава плазмы периферической крови в первые сутки с момента возникновения геморрагического инсульта показал, что с риском летального исхода, в той или иной степени, были связаны 19 исследованных микроэлементов. Исходная концентрация 11 микроэлементов (скандий, марганец, железо, медь, германий, мышьяк, иттрий, кадмий, олово, сурьма и цезий), определяемая в первые сутки у больных с летальным исходом геморрагического инсульта (3-я подгруппа) была существенно ниже, чем у пациентов контрольной группы. При этом уровни концентраций селена, брома, молибдена, осмия, иридия, золота, ртути и таллия у больных с летальным исходом были, напротив, существенно выше по сравнению с группой контроля. Проведенное сравнение концентраций микроэлементов у больных с благоприятным и у больных с летальным исходом инсульта позволил выделить МЭ, специфически связанные с фактом смерти (выше или ниже в группе больных с летальным исходом при нормальном уровне у больных с благоприятным исходом). В их числе оказались такие микроэлементы, как скандий, железо, медь, германий, селен, иттрий, олово и цезий. В остальных случаях, концентрация МЭ была выше/ниже как у больных с благоприятным, так и с летальным исходом инсульта, отличаясь лишь величиной изменения.
Так, у больных контрольной группы медиана концентрации марганца составила 1,47 мкмоль/л, в группе больных с благоприятным исходом геморрагического инсульта (1-ая и 2-ая группы) концентрация марганца регистрировалась на уровне – 1,37 мкмоль/л, у пациентов с летальным исходом (3-я подгруппа) уровень концентрации марганца достиг минимальных значений – 0,92 мкмоль/л. Уровни концентраций брома в указанных группах составили 86 - 114 - 119 мкмоль/л, соответственно. Для микроэлементного состава, специфически связанного с летальным исходом инсульта, было выявлено, что концентрация скандия в группе больных контрольной группы и у выживших пациентов (1-ая и 2-ая группы) не различались, составив 64 и 67 мкмоль/л., тогда как в группе больных с летальным исходом геморрагического инсульта (3-я группа) она была значимо ниже и составила 52 мкмоль/л. Уровень концентрации селена у больных с благоприятным исходом инсульта был даже ниже, чем у больных контрольной группы - 1,9 и 2,1 мкмоль/л, соответственно (p<0,001). В группе же больных с летальным исходом геморрагического инсульта (3-я группа) этот показатель был, напротив, в 2,5 раза выше показателей как у пациентов контрольной группы, так и у выживших больных с геморрагическим инсультом, вошедших в 1-ую и 2-ую группы.
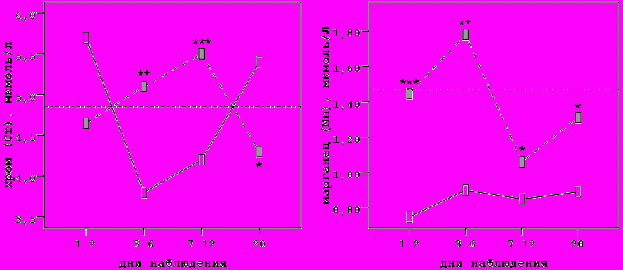
На приведенных ниже графиках динамики концентраций отдельных МЭ в плазме крови у выживших пациентов пунктирной линией представлена динамика больных 1-ой группы, сплошной линией - 2-ой группы, горизонтальная пунктирная линия – значение концентраций МЭ у больных контрольной группы.
Примечание. * p<0,05 ** p<0,01 *** p<0,001. Все значения представлены в виде медианы
В диссертационной работе был проведен анализ динамики спектра микроэлементного состава плазмы крови в динамике в зависимости от изначальных уровней их концентраций и тенденций их изменений.
Проведенное исследование показало, для больных с геморрагическим инсультом характерны исходно высокие концентрации алюминия, скандия, ванадия, циркония, палладия, серебра, теллура, йода, цезия, вольфрама, бария и золота по сравнению с концентрациями аналогичных МЭ у больных, вошедших в группу контроля. Повышенные концентрации перечисленных МЭ (за исключением концентраций золота и бария) у выживших больных в последующем снижались. Причем степень их снижения у больных, входящих в клинические группы, не всегда была одинаковой. В частности, исходно низкие концентрации ванадия, циркония и палладия у больных с летальным исходом (3-я группа) в острейшем периоде геморрагического инсульта превосходили аналогичные значения МЭ у больных контрольной группы, а также у больных, составивших 1-ую и 2-ую группы.
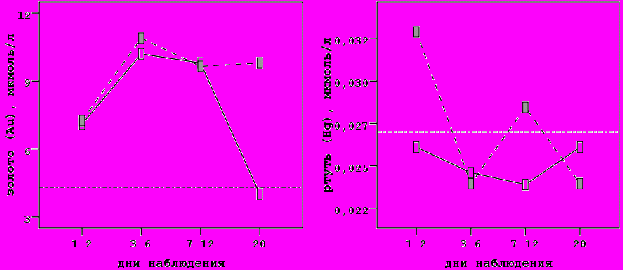
Вместе с тем, необходимо разграничить роль исходного уровня данного МЭ и значение его последующего снижения. Было показано, что исходно концентрация серебра у больных, составивших 1-ую и 2-ую группы была выше, чем у больных с летальным исходом заболевания. И хотя прогностический характер высокой концентрации серебра у части больных с инсультом не вполне ясен, очевидно, что высокий уровень серебра (>0,15 мкмоль/л) в острейшем периоде инсульта, как и его последующее снижение, свидетельствуют о благоприятном прогнозе заболевания.
Если исходно высокая концентрация большинства МЭ в динамике при неблагоприятном исходе геморрагического инсульта (первые две недели) снижалась, то концентрация родия, осмия и бария не менялась, а золота значительно увеличивалась. Выявленные тенденции изменений концентраций золота требуют особого внимания. У больных 3-ей группы концентрация золота продолжала увеличиваться, оставаясь на этом высоком уровне в течение всего срока наблюдения. Причины столь значительного накопления золота в крови у больных с инсультом остаются не выясненными. Вместе с тем, нельзя не отметить, что высокая концентрация золота была также отмечена и у выживших пациентов, которая, однако, снижалась к 20-м суткам течения геморрагического инсульта.
Примечание. * p<0,05 ** p<0,01 *** p<0,001. Все значения представлены в виде медианы
Иными словами, высокий уровень (>10 мкмоль/л) концентрации золота в первые сутки заболевания отражает высокий риск летального исхода инсульта, тогда как его снижение в течение 14-20 суток от начала заболевания предопределяет благоприятный исход геморрагического инсульта с формированием минимального неврологического дефицита, т.е. является фактором нейропротекции.
Другая большая группа МЭ - это микроэлементы с исходно низкими концентрациями (титан, цинк, платина, кадмий, кобальт, никель, мышьяк, селен, рубидий, стронций, лантан и уран), выявленными в острейшем периоде у пациентов основной группы. Их концентрации статистически достоверно отличались от уровней аналогичных МЭ у пациентов контрольной группы. Концентрация титана, цинка и платины в динамике инсульта увеличивалась как у выживших, так и у пациентов с летальным исходом инсульта. Обращает на себя внимание характер изменения концентрации цинка. Так, процент увеличения у больных с летальным исходом заболевания был заметно выше уже на 3-6 сутки наблюдения. В дальнейшем концентрация цинка у больных 3-ей группы снижалась, достигая к 20 дню наблюдения статистически достоверно более низких значений по сравнению с выжившими пациентами. В последнем случае максимум концентрации цинка был отмечен также на 3-6 сутки с последующим ее выходом на плато. Следовательно, можно предположить, что умеренное увеличение концентрации цинка у больных с геморрагическим инсультом в первые сутки заболевания является закономерным и, возможно, определяет нейропротекторное значение данного МЭ. Здесь важно отметить, что по данным Hey с соавт. (2007) влияние цинка на состояние нейронов мозга в условиях ацидоза может быть двояким. По мнению данного автора, протективная роль цинка связана с его высокой внеклеточной концентрацией. Повышение же концентрации цинка внутри клетки лишь усиливает повреждение нервной клетки, особенно в условиях ацидоза (Hey, 2007). Здесь обращает на себя внимание, что именно у выживших больных 1-ой подгруппы повышение концентрации цинка было плавным и небольшим (с 29 до 35 мкмоль/л в течение первой недели), тогда как у пациентов 2-ой подгруппы увеличение концентрации цинка было почти двукратным (с 27 до 45 мкмоль/л). У больных с летальным исходом медиана концентрации цинка вообще была катастрофической (~75 мкмоль/л). Скорее всего, резкое и, главное, значительное увеличение концентрации цинка у этой категории больных приводит к перераспределению цинка из внутриклеточного во внеклеточное пространство, потенцируя, таким образом, массивную гибель клеток мозга, в том числе, и в зоне, окружающей внутримозговую гематому.
Не исключено, что высокая концентрация цинка у больных с летальным исходом инсульта могла наблюдаться и в период, предшествовавший возникновению данного состояния. В пользу этого говорят результаты целого ряда исследований, указывающие на связь высокой концентрации цинка с факторами сердечно-сосудистого риска.

Примечание. * p<0,05 ** p<0,01 *** p<0,001. Все значения представлены в виде медианы
Характер изменения концентрации цинка важно сопоставить с изменением концентрации меди. Было показано, что у больных 2 группы динамика изменения концентрации меди была прямо противоположна той, что была продемонстрирована для цинка. Если исходно концентрация меди у больных с летальным исходом геморрагического инсульта была выше, чем у больных контрольной группы, то в ходе наблюдения, особенно на 7-12 сутки, формировался «провал» концентрации данного микроэлемента, величина которой была уже ниже таковой у выживших больных. У выживших пациентов концентрация меди в динамике инсульта практически не изменялась. И это притом, что исходно концентрация меди у выживших больных была относительно низкой.
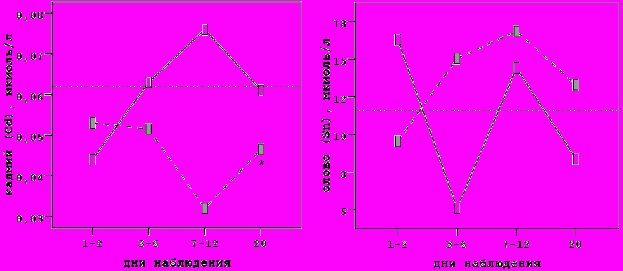
Обращают на себя внимание изменения концентрации кадмия, которая при поступлении неожиданно отрицательно коррелировала с тяжестью заболевания. Так, если у больных контрольной группы концентрация кадмия была равна 62(-103) мкмоль/л, то у больных с инсультом она составила 55(-103) мкмоль/л (благоприятный исход) и 26(-103) мкмоль/л (летальный исход). И хотя в динамике заболевания изменения концентрации кадмия соответствовали представлению о его токсических свойствах (снижалась у выживших пациентов и повышалась у больных с летальным исходом), очевидно, что это лишь частично описывает роль данного МЭ в возникновении и течении геморрагического инсульта.
Интересна характеристика таких микроэлементов как никель, кобальт, мышьяк, селен, рубидий и стронций, исходно низкая концентрация которых повышалась только у больных 1-ой группы, но не у больных с плохим восстановлением после перенесенного геморрагического инсульта – 2-ая группа. Подобная динамика была характерна для кобальта, никеля, мышьяка, селена, рубидия и стронция, что указывает на благоприятное прогностическое значение их повышения при исходно низких значениях. В отношении данных микроэлементов не совсем ясно - предшествовали ли их низкие значения инсульту или их снижение было связано с фактом заболевания. Второе предположение кажется более вероятным, т.к. в противном случае не находит объяснений быстрое изменение их концентрации уже на 3-12 день с момента возникновения инсульта. Источником же повышения концентрации может быть и восстановление уровня белка-переносчика (как в случае с никелем), так и использование МЭ, депонированных в различных органах и тканях организма (как в случае с селеном). Стоит добавить, что подобная динамика указывает на возможные эссенциальные свойства рубидия и стронция, притом, что для кобальта, никеля, мышьяка и селена эта роль является установленной.
Особого внимания заслуживает динамика концентрации селена и его значение в развитии и течении инсульта. Кажется удивительной его высокая концентрация, выявленная у больных с летальным исходом геморрагического инсульта при поступлении. Вместе с тем, необходимо отметить, что данный факт может быть следствием увеличения концентрации селенсодержащих белков, основная часть которых известна своими антистрессорными, антиокислительными свойствами. Иными словами, высокая концентрация селена отражает степень повреждения мозга и тот антиишемический потенциал, который мобилизован для коррекции этих нарушений. Подобная трактовка вполне оправдана, тем более что концентрация селена в постинсультный период увеличивалась как у больных 1-ой, так и у больных 2-ой групп. В то же время, у больных с хорошим регрессом неврологического дефицита увеличение концентрации селена было более значительным, чем у больных 2-ой группы, что вполне соответствует традиционному взгляду на данный МЭ как на нейропротективный фактор. Причем по современным представлениям нейропротекция селена определяется не только его стабилизирующим влиянием на процесс образования активных форм кислорода в ткани мозга. В условиях инсульта селен способен аннулировать миграцию клеток микроглии.
В настоящем же исследовании было выявлено, что селен положительно коррелировал с возрастом, т.е. у больных старшего возраста его концентрация была выше. Можно предположить, что этот факт связан не столько с возрастом больных, сколько с тяжестью инсульта, степень которой у пожилых больных была значительно выше. Так, если при анализе концентрации селена в зависимости от возраста, у больных основной группы коэффициент корреляции с возрастом составил 0,364 (р=0,023), то при исключении больных с летальным исходом инсульта этот показатель становился статистически незначимым – r=0,258 (р=0,147). Вместе с тем, выявленная нами данная статистическая закономерность динамики изменений селена требует дальнейшего изучения.

Примечание. * p<0,05 ** p<0,01 *** p<0,001. Все значения представлены в виде медианы
Таким образом, высокая концентрация селена в острейшую фазу геморрагического инсульта отражает тяжесть состояния больного и является прогностически неблагоприятным признаком. В то же время, контроль концентрации селена в динамике необходим для оценки клинического исхода заболевания. Отсутствие либо незначительная положительная динамика данного параметра сопровождает возникновение грубого неврологического дефицита. Здесь правомерно говорить о необходимости дополнительной коррекции содержания данного МЭ.
В случае с кадмием, лантаном и ураном была установлена прямо противоположная закономерность. В частности, концентрации указанных МЭ к концу наблюдения (кадмий), либо на 3-6 сутки (лантан, уран) повышались только у больных с летальным исходом геморрагического инсульта. У выживших пациентов, напротив, концентрация кадмия продолжала снижаться еще больше (кадмий), а концентрации лантана и урана не изменялись вовсе. В данном случае можно говорить о токсических свойствах указанных МЭ, тем более что относительно кадмия подобные предположения делались и ранее.
Примечание. * p<0,05 ** p<0,01 *** p<0,001. Все значения представлены в виде медианы
В ряде случаев исходно высокая концентрация МЭ наблюдалась только у больных одной из клинических групп – 1-ой или 2-ой. Так, при нормальной (хром, германий, олово, бром) или даже низкой (медь, висмут) концентрации у больных с удовлетворительным восстановлением неврологического дефицита, концентрация указанных МЭ при поступлении была высокой у больных с плохим восстановлением утраченных функций. Напротив, высокая концентрация таллия, молибдена и ртути у больных 1-ой группы сочеталась с нормальной (таллий, ртуть) или низкой (молибден) концентрацией у больных 2-ой группы. В этой ситуации вновь можно говорить, что исходно высокие концентрации МЭ хрома, германия, олова, брома, меди и висмута являются прогностически неблагоприятными признаками и, наоборот, высокие концентрации в плазме крови таллия, молибдена и ртути ассоциированы с формированием минимального неврологического дефицита. В то же время, важно подчеркнуть, что эти утверждения справедливы только для случая, когда анализируются исходные концентрации МЭ. Например, уровень хрома, германия, олова, следуя описанной выше закономерности (снижение высокой либо повышение низкой концентрации), у больных 1 группы в динамике инсульта повышался, а у больных 2-ой, соответственно, снижался так, что уже с 3 дня (германия к концу наблюдения) их максимальный уровень отмечался в группе больных с удовлетворительным восстановлением неврологического дефицита. Аналогичная ситуация наблюдалась и при анализе изменений концентрации меди и висмута. Точно также, исходно высокая концентрация таллия, молибдена и ртути у больных 1 группы снижалась так, что к концу госпитализации максимальные значения были отмечены у больных 2 группы.
Исходная концентрация небольшого числа МЭ у больных с геморрагическим инсультом, вне зависимости от клинического исхода заболевания, была сопоставима с аналогичными показателями у больных контрольной группы. В их числе были выделены такие МЭ, как литий, бор, свинец, сурьма, ниобий, иттрий, галлий, теллур, иридий и цезий. Можно говорить об отсутствии связи данных МЭ с фактом развития инсульта. Вместе с тем, относительно иттрия, цезия и иридия выше была показана их связь с летальным исходом таких больных. Кроме того, концентрации практически всех МЭ с исходно нормальным уровнем (кроме родия и сурьмы) в динамике инсульта изменялись. Следовательно, говорить о биологической инертности МЭ можно лишь в исключительных случаях.
Таким образом, установлена закономерность, связанная с изменением концентрации МЭ у больных с геморрагическим инсультом. Выявлено, что практически во всех случаях высокая концентрация МЭ в дебюте заболевания в последующем снижается, а исходно низкая концентрация, напротив, повышается. Именно интенсивность изменения концентрации МЭ является главной характеристикой, ассоциированной с клиническим прогнозом инсульта – формированием минимального или, напротив, грубого неврологического дефицита. На основании этого большинство МЭ с ранее неопределенной биологической функцией могут быть классифицированы как эссенциальные (стронций, рубидий, германий), токсические (лантан, уран, ниобий, осмий) или биологически инертные (галлий, родий).
Необходимо отметить, что концентрации ртути, свинца и кадмия в биологических образцах (в нашем случае в плазме периферической крови) свидетельствуют об экологическом благополучии региона, в котором проводилось исследование.
Еще одним фрагментом проведенного исследования явился анализ уровня МЭ у больных разных возрастных групп. Данное направление сложилось из теоретических и экспериментальных данных о связи МЭ с продолжительностью жизни, возрастных изменениях структур мозга, развитии атеросклероза, как морфологического маркера ускоренного старения. Анализ показал, что в общей группе больных с инсультом с возрастом увеличивалась концентрация селена, серебра, рубидия, родия, калия и кальция. Напротив, снижалась концентрация олова и висмута. Вместе с тем, очевидно, что отчасти корреляция концентрации МЭ с возрастом может определяться тяжестью инсульта, степень которой у пациентов пожилого и, особенно, старческого возраста, несомненно, выше. Применение корреляционного анализа только в группе больных с благоприятным исходом инсульта выявило более широкий спектр микроэлементов, ассоциированных с возрастом. Теперь уже повышение концентрации с возрастом было характерно для никеля, мышьяка, ванадия, серебра, золота, таллия, скандия, рубидия, ниобия, лантана, платины, стронция и цезия. По-прежнему, положительно коррелировали с возрастом концентрации калия и кальция. Напротив, снижались с возрастом концентрации бора, олова, молибдена, бария и висмута. В целом, закономерно было бы ожидать, что корреляция некоторых МЭ с возрастом может быть опосредована корреляцией с другими МЭ. И, действительно, применение многофакторного регрессионного анализа показало, что независимо от других МЭ с возрастом были ассоциированы только пять из них: рубидий, селен, литий, висмут и цирконий.
Таким образом, у больных с геморрагическим инсультом содержание ряда МЭ в плазме периферической крови зависит от возраста. В ряде случаев, эта ассоциация определяется ролью МЭ как факторов риска летального исхода геморрагического инсульта, частота которых закономерно увеличивается с возрастом. Независимо с возрастом связаны такие МЭ, как рубидий, селен и цирконий (положительная корреляция), а также литий и висмут (отрицательная корреляция).
Настоящее исследование является «пилотной» работой, посвященной изучению изменений микроэлементного состава плазмы крови у больных с геморрагическим инсультом. Данная работа предполагает дальнейшее изучение медикаментозной коррекции концентрации микроэлементов в острейшем периоде инсульта, что может способствовать лучшим результатам реабилитации таких больных в ходе последующего амбулаторного наблюдения и снижению частоты летальных исходов заболевания.
ВЫВОДЫ
- На основе статистического анализа данных динамического кинико-инструментального обследования 63 больных с внутримозговым кровоизлиянием выявлены достоверные изменения концентраций микроэлементов плазмы крови в зависимости от возраста, сроков и исходов заболевания.
- У всех больных с геморрагическим инсультом, вне зависимости от исхода, выявлена прямая корреляция между возрастом пациентов и увеличением содержания селена в сочетании со снижением концентрации лития и висмута.
- Диагностическими признаками благоприятного течения геморрагического инсульта с хорошим восстановлением неврологического дефицита и независимости повседневной жизни (индекс Бартель 95,1 ± 2,3) в динамике, отмечено нарастание пула эссенциальных микроэлементов (цинка, хрома, селена и алюминия) в сочетании со снижением умеренно- и высокотоксичных микроэлементов (кобальта, кадмия, таллия и ртути).
- Диагностическими признаками неблагоприятного течения геморрагического инсульта с плохим восстановлением неврологического дефекта (индекс Бартель = 39,8 ± 9,7) явилось снижение основного пула эссенциальных микроэлементов (йода, хрома, лития и магния) в сочетании с повышением высокотоксичных микроэлементов (таллия, меди и кадмия).
- Выявленное статистически достоверное (p<0,05) повышение высокотоксичных микроэлементов (таллия, ртути, золота) в сочетании с низкими показателями пула малотоксичных микроэлементов (магния и лития) характеризует резкий дисбаланс металлолигандного гомеостаза, присущий пациентам с летальным исходом геморрагического инсульта.
Практические рекомендации
- На основании проведенного исследования, выявленный спектр изменений концентраций отдельных микроэлементов у пациентов с дисциркуляторной энцефалопатией, составивших контрольную группу позволит оптимизировать их лечение и улучшить прогноз течения цереброваскулярной недостаточности.
- Проведенное исследование, определившее концентрации ртути, свинца в биологических образцах (в нашем случае в плазме периферической крови) свидетельствует об экологическом благополучии Прикаспийского региона и предопределит тактику экологической политики региона.
- Выявленные статистически достоверные изменения соотношений микроэлементного состава у больных с развившимся геморрагическим инсультом свидетельствуют о степени тяжести изменений, происходящих в мозге, что дает возможность прогнозировать дальнейшее течение данного заболевания.
- Результаты исследования, описывающие характер изменений концентрации микро- и макроэлементов у больных с геморрагическим инсультом могут способствовать улучшению госпитального ведения данных пациентов, оптимизации их лечения и постгоспитальной реабилитации.
Список работ, опубликованных по теме диссертации
Уллубиев М.М., Маликова А.Г., Никонов А.А. «Изменения микроэлементов при ишемическом инсульте» Журнал неврологии и психиатрии им. Корсакова Инсульт 2007, №20, с. 37-42.
- Маликова А.Г., Уллубиев М.М., Никонов А.А. «Изменение спектра микроэлементов при геморрагическом инсульте» Журнал неврологии и психиатрии им. Корсакова 2008, №3, с. 76-79.
- Маликова А.Г., «Изменение микроэлементного спектра плазмы крови больных с геморрагическим инсультом в разных возрастных группах» Журнал «Фундаментальные исследования» 2008, №6, с. 10-12.
Список сокращений
МЭ – микроэлементы
ДЭ – дисциркуляторная энцефалопатия
АГ – артериальная гипертония
