Эпигенетическая регуляция фотосинтетической ассимиляции со 2 у хлопчатника (03. 00. 12 физиология и биохимия растений)
| Вид материала | Автореферат |
- Культура столонов и регуляция роста растений и клубнеобразования у картофеля in vitro, 342.87kb.
- Рабочая программа дисциплины «физиология» (физиология растений) Код дисциплины по учебному, 269.31kb.
- Регенерационная активность разных генотипов пшеницы и эгилопса в культуре in vitro, 499.46kb.
- «Физиология растений», 308.24kb.
- Программа-минимум кандидатского экзамена по специальности 06. 01. 09 «Растениеводство», 89.8kb.
- Программа-минимум кандидатского экзамена по специальности 06. 01. 09 «Растениеводство», 94.9kb.
- Программа-минимум кандидатского экзамена по специальности 03. 00. 12 «Физиология, 346.18kb.
- 1. Литературный обзор по вопросам исследований, 166.96kb.
- Программа-минимум кандидатского экзамена по специальности 06. 01. 07 «Плодоводство,, 169.32kb.
- Влияние удобрений, способов обработки и пленочной мульчи на питательный режим почвы,, 516.42kb.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследований. Исследования проводились с различными тетраплоидными и диплоидным видами и сортами хлопчатника: Gossypium hirsutum L. (промышленные сорта 108-Ф, Гулистон, инбредные линии хлопчатника Л-3, Л-461, Л-501); Gossypium barbadense L. (сорт 6465-В) и Gossypium arboreum L. (форма 02906). Линии Л-3, Л-461, Л-501 и форма 02906 взяты из коллекции Ташкентского государственного университета, созданной под руководством академика Д.А.Мусаева. Использованные в работе генотипы отличаются широким разнообразием формы листовой пластинки и по продуктивности. Подробное описание использованных генотипов приведено в диссертационной работе.
Растения выращивались на экспериментальном участке Института физиологии растений и генетики АН РТ (Гиссарская долина Республики Таджикистан, 850 м над ур.моря) на открытом воздухе при естественном освещении в вегетационных сосудах в двух вариантах:
1. С использованием метода песчаной гидропоники (Евлаков, Кичитов, Каспарова, 1986), на питательном растворе, рекомендованном для хлопчатника (Хьюит, 1960);
2. В 35-килограммовых сосудах, с соблюдением агротехнических мероприятий, обеспечивающих оптимальные условия выращивания, согласно рекомендациям (Журбицкий, 1968).
Исследование углекислотного газообмена и фотосинтетических параметров проводили на неотделенных листьях главного стебля. Все измерения проводили в период стабильной солнечной радиации (с 11 до 15 ч) – 800-900 вт·м-2.
Условия проведения экспериментов. Эксперименты по изучению адаптации растений хлопчатника к супероптимальной температуре, дефициту азотного питания и корневому анаэробиозу проводили с использованием метода песчаной гидропоники.
При проведении экспериментов по изучению влияния недостатка азота в минеральном питании растения переводили на питательный раствор, содержащий 25% азота от контроля.
В опытах по изучению влияния анаэробиоза в корневой зоне растений сосуды заполнялись питательным раствором на 10 суток, с ежедневной его заменой.
В опытах по изучению влияния повышенных концентраций озона растения хлопчатника помещали в камеру из полиэтиленовой пленки с открытым верхом, в которую подавался воздух, обогащенный озоном. Концентрация озона в камере варьировала от 180 до 200 нл·л-1, при фоновой концентрации- 45-50 нл·л-1. Обработку озоном проводили ежедневно с 9 до 17 ч.
Для выяснения роли донорно-акцепторных отношений в регуляции углекислотного газообмена в некоторых опытах создавался искусственный разбаланс между образованием и потреблением ассимилятов путем удаления 70% листьев (частичная дефолиация), либо потребляющих ассимиляты органов (точки роста, бутоны, цветки, завязи, плоды).
В опытах по изучению влияния разбаланса донорно-акцепторных отношений на фотосинтетическую и дыхательную способность репродуктивных органов удаление плодовых органов проводили за 5 дней до измерений.
Аппаратура. Углекислотный газообмен измерялся с использованием двухканальной газометрической установки, аналогичной описанной А.Х.Лайском и В.М.Оя, Б.Х.Расуловым (Лайск, 1977; Оя, Расулов, 1981). Погрешность измерения интенсивности СО2 –газообмена не превышала 2%, транспирации – 1,5%. Быстродействие установки с включенной в канал листовой камерой не превышало 10-12 с.
При измерении фотосинтеза и транспирации листа использовались: односторонняя, термостатированная листовая камера, с принудительным перемешиванием воздуха и прямоточная, контактная листовая камера, с сопротивлением прилистового слоя ra=0,1 с·см -1. Температура листа в камере контролировалась с помощью константан-манганиновой термопары с точностью до 0,10С. Все измерения проводились при постоянной температуре камеры (+350С).
Углекислотный газообмен целого растения измеряли с использованием ассимиляционной камеры, разработанной и созданной в Институте физиологии растений и генетики АН РТ под руководством ведущего инженера Института В.К.Кичитова, при участии автора, совместно с Институтом почвоведения и фотосинтеза РАН (ИПФС) и Отделом общей генетики хлопчатника АН РТ, при участии: со стороны ИПФС старшего научного сотрудника, к.б.н. Л.Т.Карпушкина и доктора биологических наук Б.Х.Расулова – со стороны Отдела общей генетики хлопчатника АН РТ.
При изучении влияния озона использовали специальную камеру с открытым верхом. Концентрация озона измерялась с точностью до 1 нл·л-1 стандартным анализатором озона «Dasibi» (Dasibi Environmantal Corporation, USA).
Методы определения. Методы измерения и расчета кинетических параметров углекислотного газообмена (концентрация СО2 в жидкой фазе мезофилла (Cw), величина проводимости мезофилла (µm21 и µm1), измеренная при 21% и 1% концентрации кислорода, скорость реакции карбокслирования РБФ - истинный фотосинтез (Fист.), величина фотодыхания (Rp ) и митохондриального дыхания на свету – (Rm)) приведены в работах А.Х.Лайска (1977), и Б.Х.Расулова (1985). Максимальный (потенциальный) фотосинтез измеряли при насыщающей концентрации углекислого газа, которая для хлопчатника составляет 0,25%. «Ассимиляционный заряд» (фонд РБФ) оценивали по послесветовой фиксации СО2 в атмосфере азота (Laisk, Kiirats, 1984; Laisk, Loreto, 1996).
Площадь листьев определяли весовым методом (Ничипорович, Строгонова, Чмора, Власова, 1961), высота растений и общая биомасса - согласно рекомендациям (Бидл, 1989). Содержание хлорофилла определяли по Вернону и Веттштейну (Гавриленко, Ладыгина, Хандобина, 1975).
Все измерения производились в 3-5-ти - кратной повторности. Статистическая обработка проводилась на ЭВМ, с использованием стандартного пакета программ статистической обработки («Statgraf»).
Результаты исследований
Глава3. Эндогенная регуляция СО2-газообмена листа и плодовых органов у хлопчатника
3.1. Дневная динамика СО2-газообмена листьев хлопчатника при разбалансе донорно-акцепторных отношений в системе целого растения
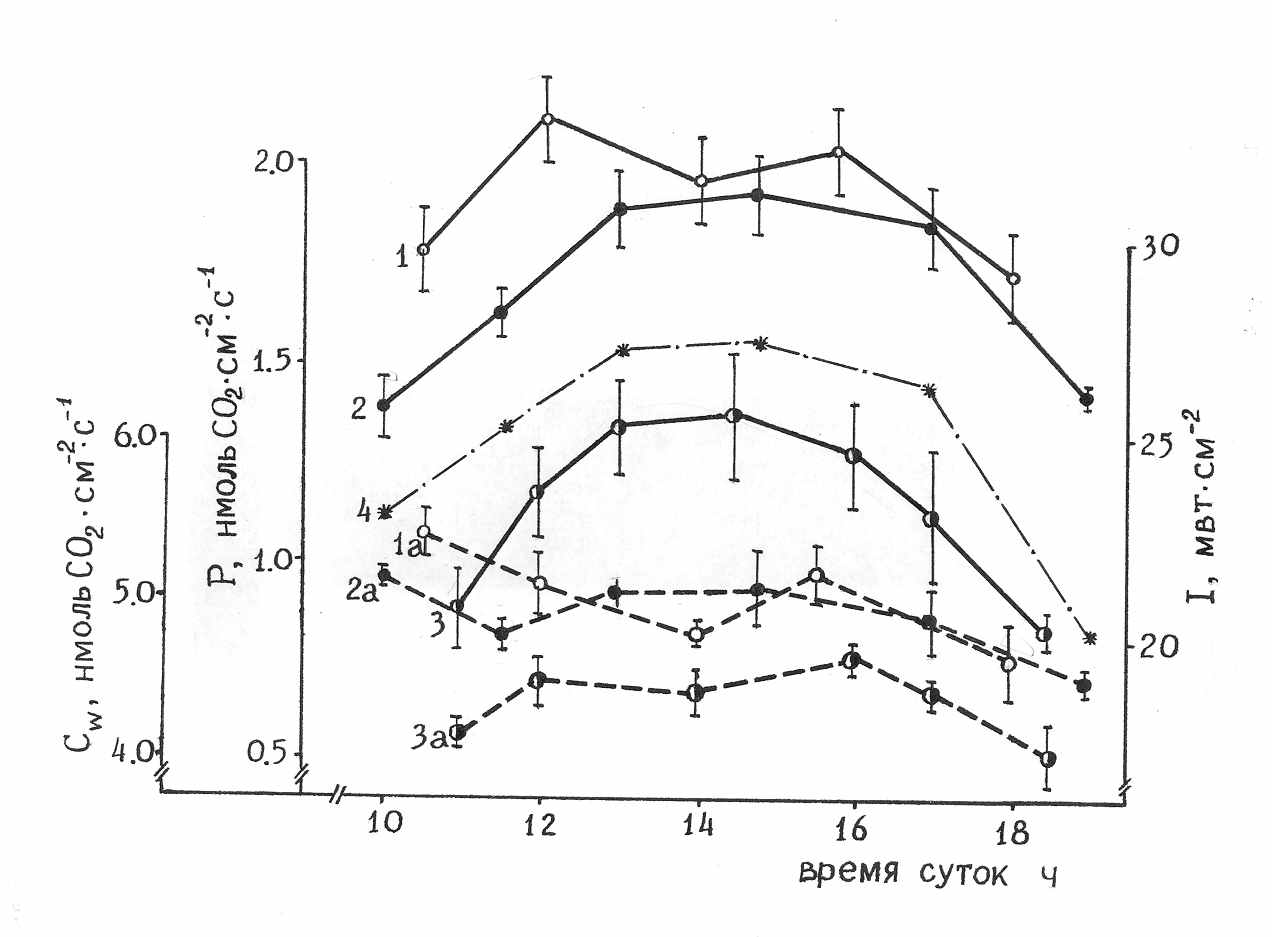
Как видно из данных, приведенных на рис.1 а, у листьев контрольных растений наблюдалась незначительная депрессия фотосинтеза с последующим подъемом к 16 часам. Интенсивность фотосинтеза листьев с увеличенной и уменьшенной нагрузкой на фотосинтетический аппарат (частичная дефолиация – 70%, и удаление потребляющих ассимиляты органов) в течение дня изменялась по плавной одновершинной кривой, близкой по форме к кривой изменения падающей фотосинтетически активной радиации. Анализ дневного хода внутриклеточной концентрации СО2 (Сw ) показал, что изменения Сw совпадали в основном с изменениями видимого газообмена и устьичной проводимости (рис.1 б). Вместе с тем и эффективность реакции карбоксилирования (µm1) также находилась в соответствии с изменениями видимого фотосинтеза, что указывает на дневные изменения фотосинтезирующей способности клеток мезофилла.
Одна из возможных причин возникновения полуденной депрессии СО2-газообмена листьв могла быть связана с уменьшением внутриклеточной концентрации СО2 вследствие увеличения устьичного сопротивления СО2 потоку (рис.1 а, в) за счет развития незначительного водного дефицита в условиях напряженности факторов внешней среды (Насыров, 1956; Болондинский, 1982; Tenhunen, Lange, Gebel, 1984). Однако и накопление избыточного фонда ассимилятов в листе, например за счет снижения скорости флоэмного транспорта при температуре выше +300С (Курсанов, 1976), также могло привести к снижению фотосинтеза (Чиков, Яргунов, Федосеева, 1982) и повлиять на биохимическую компоненту проводимости мезофилла (Расулов, 1994).
а
б

в
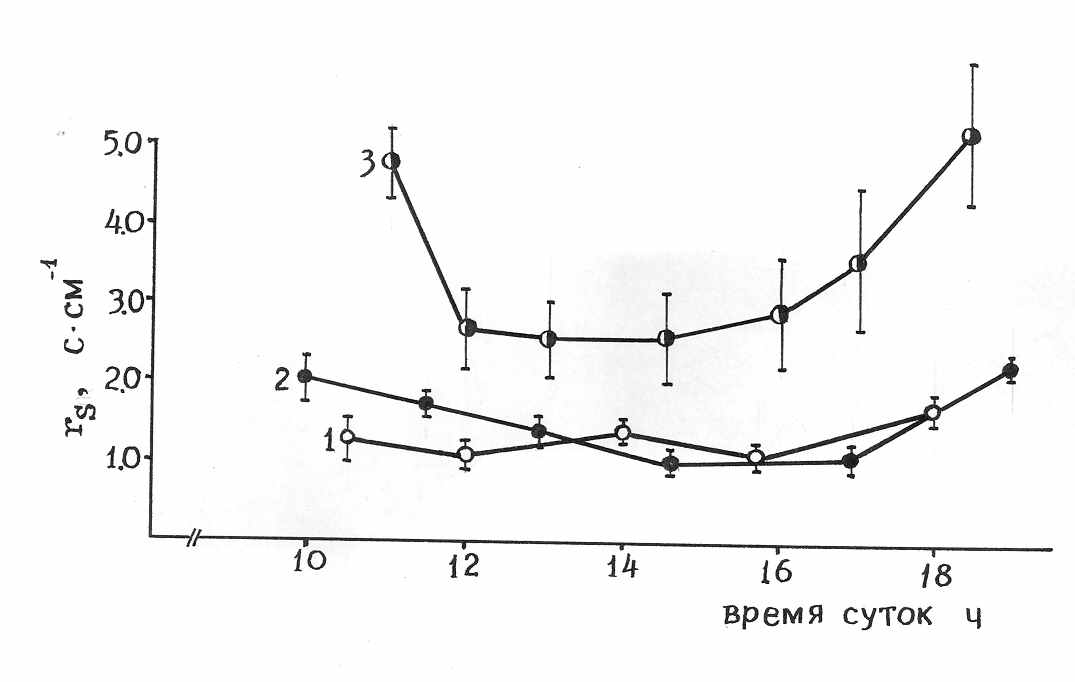
Рис. 1. Дневная динамика интенсивности видимого фотосинтеза листьев хлопчатника (Р) и внутриклеточной концентрации СО2 (Cw) (а), проводимости мезофилла (µm) (б) и устьичного сопротивления (rs) (в). Сорт 108-Ф. Фаза плодообразования. 1 – контроль, 2 – частичная дефолиация, 3 – удаление акцептирующих зон на растении (точек роста, бутонов, цветков, плодоэлементов), 1а-3а – внутриклеточная концентрация углекислого газа, 4 – интенсивность поглощенной фотосинтетически активной радиации (I).
Как видно из полученных результатов, скорости СО2-газообмена, карбоксилирования РБФ и проводимость мезофилла листьев контрольных и дефолиированных растений в послеполуденные часы практически не отличаются по сравнению с контрольными растениями. Отсутствие полуденной депрессии у растений с искусственно увеличенной нагрузкой на фотосинтетический аппарат дает нам основание предположить, что в период дневных экстремальных температур причиной полуденной депрессии в естественных условиях следует считать ограничение скорости ассимиляции СО2 за счет торможения эпигенетических процессов, в частности связанных с выходом транспортных форм сахаров из фотосинтезирующей клетки (Расулов,1994).
В наших экспериментах, на фоне заметных изменений сопротивления устьиц наблюдались не адекватно низкие изменения внутриклеточной концентрации СО2. Это указывает на заметную роль биохимического аппарата в регуляции фотосинтеза при снижении аттрагирующей активности в системе целого растения, вызванной искусственным удалением части плодоэлементов
3.2. Параметры СО2-газообмена листьев различных генотипов хлопчатника в онтогенезе при разбалансе донорно-акцепторных отношений в системе целого растения
Как видно из представленных данных (табл.1), различия интенсивности видимого фотосинтеза единицы поверхности листьев верхнего яруса в фазу бутонизации между изученными генотипами (сорт 108-Ф и линии Л-3, Л-461) невелики. Не установлено существенных различий и по другим параметрам системы фотосинтетической ассимиляции углекислого газа в эту фазу развития растений. Дополнительное, по сравнению с нормой, возрастание эпигенетической нагрузки, обеспечивающее высокую скорость экспорта ассимилятов из листа хлопчатника не вызывало стимуляции скорости фотосинтетического СО2-газообмена оставшихся на растении листьев, т.е. в эту фазу развития растений фотосинтетическая функция не испытывает ограничений со стороны ростовых процессов.
Вместе с тем, торможение экспорта ассимилятов из листа вызвало ингибирование видимого фотосинтеза (Р21), скорости карбоксилирования РБФ (Fист) и адекватное снижение интенсивности фотодыхания в этих условиях.
В ходе онтогенеза растений, в зависимости от генотипа, нами наблюдалось различное по величине снижение скорости результирующего СО2-газообмена листьев верхнего яруса. Это снижение было вызвано аналогичным изменением скорости реакции карбоксилирования.
Усиление эпигенетической нагрузки на фотосинтетический аппарат листа в фазу массового плодообразования привело к незначительному увеличению скорости видимого и истинного фотосинтеза у листьев линии Л-461, которое сопровождалось уменьшением устьичного сопротивления. Однако, как видно из табл.(1), увеличение СО2-газообмена в большей степени было связано с возрастанием эффективности реакции карбоксилирования. У линии Л-3 и сорта 108-Ф реакция на дефолиацию не отличалась от наблюдаемой в фазу бутонизации.
Таблица 1
Параметры системы фотосинтетической ассимиляции СО2 листьев различных генотипов хлопчатника при различном донорно-акцепторном отношении
| Вариант | Р21 | Fист | RP | m | rS | CW | ГФ |
| Сорт 108-Ф | |||||||
| Бутонизация | |||||||
| Контроль | 1,69±0,10 | 2,59±0,08 | 0,84±0,02 | 0,74±0,05 | 1,88±0,14 | 4,89±0,11 | 1,49±0,02 |
| Дефолиация | 1,69±0,05 | 2,61±0,05 | 0,84±0,04 | 0,74±0,05 | 2,15±0,18 | 4,74±0,03 | 1,51±0,02 |
| Удаление плодоэлементов | 1,07±0,10 | 2,20±0,07 | 0,73±0,01 | 0,67±0,07 | 3,74±0,12 | 4,66±0,19 | 1,50±0,05 |
| Массовое плодообразование | |||||||
| Контроль | 1,14±0,06 | 2,25±0,06 | 0,74±0,03 | 0,67±0,01 | 2,61±0,09 | 4,77±0,11 | 1,53±0,01 |
| Дефолиация | 1,02±0,05 | 1,93±0,07 | 0,56±0,02 | 0,64±0,02 | 3,01±0,05 | 4,72±0,08 | 1,55±0,01 |
| Удаление плодоэлементов | 0,60±0,13 | 1,62±0,21 | 0,58±0,07 | 0,50±0,05 | 4,90±0,95 | 4,48±0,17 | 1,53±0,02 |
| Линия Л-3 | |||||||
| Массовое плодообразование | |||||||
| Контроль | 1,23±0,02 | 2,34±0,14 | 0,86±0,15 | 0,91±0,12 | 2,53±0,25 | 5,03±0,14 | 1,52±0,02 |
| Дефолиация | 1,14±0,06 | 2,27±0,22 | 0,73±0,08 | 0,71±0,04 | 2,40±0,23 | 5,41±0,12 | 1,51±0,02 |
| Удаление плодоэлементов | 0,87±0,16 | 1,79±0,13 | 0,62±0,05 | 0,63±0,08 | 3,48±0,21 | 5,10±0,19 | 1,52±0,03 |
| Линия Л-461 | |||||||
| Бутонизация | |||||||
| Контроль | 1,97±0,18 | 3,53±0,33 | 1,18±0,07 | 1,080,12 | 1,08±0,22 | 4,96±0,11 | 1,54±0,04 |
| Дефолиация | 1,60±0,19 | 2,77±0,17 | 0,97±0,04 | 0,98±0,30 | 2,16±0,30 | 4,89±0,07 | 1,59±0,02 |
| Удаление плодоэлементов | 1,42±0,29 | 2,79±0,30 | 1,04±0,01 | 0,840,08 | 2,23±0,37 | 4,55±0,21 | 1,57±0,03 |
| Массовое плодообразование | |||||||
| Контроль | 1,03±0,06 | 2,00±0,09 | 0,67±0,10 | 0,71±0,07 | 3,41±0,16 | 4,92±0,13 | 1,57±0,01 |
| Дефолиация | 1,12±0,10 | 2,20±0,16 | 0,76±0,11 | 0,76±0,12 | 2,99±0,30 | 5,15±0,16 | 1,53±0,01 |
| Удаление плодоэлементов | 0,73±0,12 | 1,74±0,20 | 0,64±0,09 | 0,55±0,02 | 4,92±0,27 | 4,96±0,27 | 1,54±0,14 |
P21 - – интенсивность СО2-газообмена при 21% концентрации О2, нмоль·см-2·с-1;
Fист – скорость карбоксилирования, нмоль·см-2·с-1; RP – фотодыхание, нмоль·см-2·с-1
mm1 – проводимость мезофилла при 1%-ной концентрации О2, см·с-1; ГФ+ - углекислотный фотокомпенсационный пункт, нмоль·см-3; CW – внутриклеточная концентрация СО2,
Удаление потребляющих ассимиляты органов вызвало усиление эффекта ингибирования фотосинтеза (на 48% у сорта 108-Ф и на 30% у линий Л-3 и Л-461).
Анализ результатов измерения результирующего СО2-газообмена и его составляющих показал однотипность воздействия избыточного фонда ассимилятов на компоненты фотосинтетической ассимиляции СО2 в различные фазы развития растений, независимо от генотипа. Эти изменения сопровождались увеличением устьичного сопротивления и снижением эффективности реакции карбоксилирования. Независимо от аттрагирующей способности куста, изменений в соотношении карбоксилирующей и оксигенирующей функций фермента во все наблюдаемые фазы развития растений не наблюдалось. Об этом свидетельствует постоянство значений углекислотного фотокомпенсационного пункта Гф.
Близость параметров, характеризующих процессы ассимиляции и диссимиляции углекислоты листьев контрольных и дефолиированных растений в фазу активного роста хлопчатника, свидетельствует об отсутствии в этот период ограничения скорости фотосинтеза со стороны эпигенетических процессов, связанных с потреблением ассимилятов. В онтогенезе растения, по мере снижения массы, а значит и акцептирующей способности корневой системы (Казарян, 1969), либо при запрограммированном геномом торможении роста происходит подавление скорости фотосинтеза, вызванное угнетением к концу вегетации эпигенетических процессов. Это хорошо иллюстрирует стимуляция фотосинтеза при искусственной дефолиации у Л-461 в фазу массового плодообразования.
3.3. Эндогенная регуляция интенсивности СО2-газообмена
и дыхания плодовых органов
По имеющимся в литературе данным в процессе ассимиляции углекислого газа кроме листьев принимают участие и другие хлорофиллсодержащие органы растения (Пинхасов, 1978; Нальборчик, 1983; Ниязмухамедова, 1990; Эргашев, Абдуллаев, Каримов, 1998). Вклад фотосинтеза репродуктивных органов в общую ассимиляцию растения варьирует в зависимости от вида и сорта, внешних факторов и возраста плодового органа. В связи с этим представлялось интересным изучить, в какой мере фотосинтетическая способность плодовых органов хлопчатника способна обеспечить собственные нужды в пластическом материале и какова их роль в регуляции донорно- акцепторных отношениий в системе целого растения.
Фотосинтез и дыхание репродуктивных органов различных генотипов хлопчатника
Результаты исследования динамики накопления сухой биомассы коробочки и прицветников, а также формирования площади поверхности прицветников различных генотипов хлопчатника приведены в табл.2.
Как видно из приведенных данных, у коробочек сорта Гулистон наблюдались более высокие темпы накопления сухой биомассы, чем у коробочек линии Л-501 (растение с детерминированным ростом). Это могло быть связано с более высокой морфогенетической активностью репродуктивных органов сорта Гулистон, обуславливающей и их повышенную аттрагирующую способность. Более высокая аттрагирующая способность плодовых органов у сорта Гулистон совпадала с более высокими значениями СО2-газообмена листа.
Для оценки вклада фотосинтеза самих коробочек и прицветников в накопление сухого вещества репродуктивных органов нами были проведены измерения фотосинтеза и дыхания коробочек и прицветников (рис.2).
Таблица 2
Динамика накопления сухой биомассы коробочек и прицветников у хлопчатника сорта Гулистон и линии Л-501
| Возраст коробочки, дни | Сухая биомасса коробочки, г | Сухая биомасса прицветника, г | Площадь прицветников, см2 |
| сорт Гулистон | |||
| 10 | 1,27±0,12 | 0,16±0,01 | 32,8±1,9 |
| 20 | 3,89±0,10 | 0,19±0,02 | 37,0±2,9 |
| 30 | 5,28±0,36 | 0,19±0,01 | 36,2±1,6 |
| линия Л-501 | |||
| 10 | 0,77±0,07 | 0,06±0,01 | 9,9±0,8 |
| 20 | 1,38±0,05 | 0,07±0,02 | 10,9±1,0 |
| 30 | 2,60±0,14 | 0,08±0,01 | 14,8±1,9 |
Интенсивность фотосинтеза в расчете на орган на начальных этапах развития коробочек (10-дневные коробочки) у сорта Гулистон была выше в 1,6 раза, чем у линии Л-501. Фотосинтез 30-дневных коробочек сорта Гулистон был в 2,6 раза выше, чем у линии Л-501.
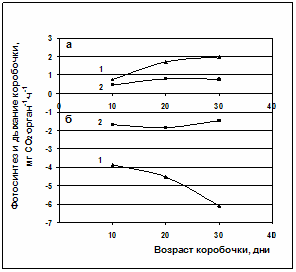
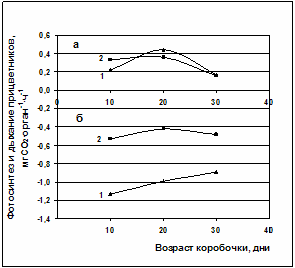
Рис.2. Фотосинтез (а) и дыхание (б) коробочек и прицветников различных генотипов хлопчатника. 1 – сорт Гулистон, 2 – линия Л-501.
По проведенным нами расчетам, за счет фотосинтеза самой коробочки с прицветником, за 20 дней их развития, было создано не более 0,3-0,5 г сухого вещества. Это свидетельствует о том, что фотосинтетическая способность плодовых органов хлопчатника способна обеспечить собственные нужды в пластическом материале не более, чем на 8-10%. Вероятно, собственный фотосинтез плодовых органов направлен только на локальные нужды, частично связанные с обеспечением дыхательными субстратами морфообразовательных процессов за счёт ранних продуктов фотосинтеза.
Фотосинтез коробочек и прицветников при разбалансе донорно-акцепторных отношений
Хлопчатник относится к растениям с высокой аттрагирующей способностью плодовых органов, между которыми существует сильная конкуренция за ассимиляты.
Возникает вопрос, в какой степени фотосинтетическая деятельность коробочек зависит от плодовой нагрузки на фотосинтетический аппарат?
Как видно из данных табл. 3, уменьшение количества коробочек на кусте, т.е. снижение количества акцепторов ассимилятов привело к увеличению сухой биомассы оставленных коробочек и прицветников.
Интересным, на наш взгляд, оказался факт неоднозначного влияния разбаланса донорно-акцепторных отношений на изменение распределения сухой биомассы репродуктивных органов у различных генотипов по отношению к контролю. У сорта Гулистон большая часть дополнительных ассимилятов пошла на накопление сухой биомассы коробочек, а у линии Л-501, с низким коэффициентом аттракции – на формирование прицветников.
Таблица 3
Темпы накопления сухой биомассы коробочек и прицветников у различных генотипов хлопчатника при разбалансе донорно-акцепторных отношений в зависимости от возраста коробочек
| Возраст коробоч- ки, дни | Сорт Гулистон | Линия Л-501 | ||||||
| Сухая биомасса коробочки, г | % от контро- ля | Сухая биомасса прицвет- ников, г | % от контро- ля | Сухая биомасса коробочки, г | % от контро- ля | Сухая биомасса прицвет- ников, г | % от контро- ля | |
| 10 | 1,51±0,14 | 119 | 0,17±0,01 | 107 | 0,66±0,02 | 86 | 0,08±0,01 | 136 |
| 20 | 4,54±0,22 | 117 | 0,19±0,01 | 104 | 1,55±0,08 | 112 | 0,09±0,01 | 126 |
| 30 | 6,89±0,07 | 130 | 0,20±0,01 | 105 | 2,73±0,18 | 105 | 0,11±0,01 | 137 |
Разбаланс донорно-акцепторных отношений оказал влияние не только на темпы накопления сухой биомассы, но и на показатели интенсивности фотосинтеза и дыхания плодовых органов хлопчатника (табл.4, 5).
Таблица 4
Фотосинтез и темновое дыхание плодовых органов у различных генотипов хлопчатника (мг СО2·орган-1·ч-1 ) при разбалансе донорно-акцепторных отношений
| Возраст коро- бочки, дни | Сорт Гулистон | Линия Л-501 | ||||||
| Фотосинтез коробочки | % от контро- ля | Фотосинтез прицвет- ников | % от контро-ля | Фотосинтез коробочки | % от контро- ля | Фотосинтез прицвет- ников | % от контро- ля | |
| 10 | 0,90 ±0,11 | 118 | 0,36 ±0,04 | 164 | 0,42 ±0,01 | 89 | 0,29 ±0,03 | 89 |
| 20 | 1,71 ±0,12 | 99 | 0,44 ±0,04 | 100 | 1,34 ±0,02 | 172 | 0,29 ±0,03 | 81 |
| 30 | 2,34 ±0,11 | 118 | 0,26 ±0,02 | 153 | 0,83 ±0,06 | 190 | 0,14 ±0,03 | 88 |
Таким образом, удаление части потребителей ассимилятов вызывает увеличение сухой биомассы оставшихся репродуктивных органов, усиление фотосинтетической деятельности оставшихся на растении коробочек и прицветников, усилению их дыхания. Частичное снятие конкуренции за ассимиляты привело к перераспределению дополнительных ассимилятов между различными частями репродуктивных органов (коробочек и прицветников). При этом характер перераспределения зависел от генотипически обусловленной аттрагирующей способности коробочек.
Таблица 5
Темновое дыхание коробочек и прицветников у различных генотипов хлопчатника (мг СО2·орган-1·ч-1 ) при разбалансе донорно-акцепторных отношений
| Воз-раст коро-бочки, дни | Сорт Гулистон | Линия Л-501 | ||||||
| Дыхание коробочки | % от контро-ля | Дыхание прицвет- ников | % от контро-ля | Дыхание коробочки | % от контро-ля | Дыхание прицвет- ников | % от контро-ля | |
| 10 | 4,44 ±0,02 | 115 | 1,23 ±0,03 | 109 | 2,59 ±0,06 | 154 | 0,59 ±0,05 | 111 |
| 20 | 6,24 ±0,13 | 138 | 0,98 ±0,10 | 99 | 3,42 ±0,33 | 184 | 0,54 ±0,04 | 129 |
| 30 | 6,92 ±0,22 | 114 | 0,96 ±0,09 | 108 | 3,20 ±0,30 | 219 | 0,72 ±0,01 | 150 |
Проведенный нами корреляционный анализ показал, что наиболее тесная корреляция наблюдалась между массой коробочек и их дыханием (r=0,74), а также между массой коробочек, массой и фотосинтезом прицветников (r=0,68 и 0,58 соответственно).
Глава 4. СО2 –ГАЗОБМЕН КУСТА ХЛОПЧАТНИКА
4.1. Онтогенетические изменения фотосинтетической способности куста хлопчатника
Результаты изменения результирующего СО2 -газообмена целого куста различных генотипов хлопчатника приведены на рис.3.
Анализ онтогенетических изменений интенсивности СО2-газообмена целого куста хлопчатника показал, что в фазу бутонизации существенных различий в абсолютных величинах между линиями не наблюдалось (рис. 4). Не было их и по биометрическим показателям (табл.6).
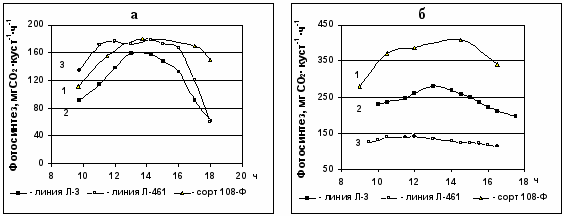
Рис.3. Дневная динамика СО2-газообмена надземной части различных генотипов хлопчатника. Фаза развития: а – бутонизация; б – плодообразования. 1 – сорт 108-Ф,
2 – линия Л-3, 3 – линия Л-461.
В фазу цветения значения максимального (в течение дня) СО2-газообмена целого куста сорта 108-Ф были выше в 2,2 раза, чем у линии Л-461, и в 1,3 раза, чем у линии Л-3. Изменение нетто-фотосинтеза целого куста было связано в первую очередь с увеличением площади ассимилирующей поверхности (табл.6).
В
 фазу плодобразования наблюдалось снижение максимальных и интегральных (за день) значений СО2-газообмена целого куста у линии Л-461. У линии Л-3 они оставались практически неизменными, но продолжали нарастать у сорта 108-Ф. Это сопровождалось нарастанием площади листовой поверхности у сорта 108-Ф.
фазу плодобразования наблюдалось снижение максимальных и интегральных (за день) значений СО2-газообмена целого куста у линии Л-461. У линии Л-3 они оставались практически неизменными, но продолжали нарастать у сорта 108-Ф. Это сопровождалось нарастанием площади листовой поверхности у сорта 108-Ф.Рис. 4. Максимальные значения интенсивности фотосинтеза целого куста различных генотипов хлопчатника в зависимости от фазы развития растения. Фаза развития: I – бутонизация; II – цветение, III – плодоношение. 1 – сорт 108-Ф, 2 – линия Л-3, 3 – линия Л-461.
Таким образом, результаты наших исследований фотосинтетической деятельности целого растения показали, что существенные различия между генотипам проявились начиная с фазы цветения и увеличились по мере развития растений.
Таблица 6
Ассимиляционная поверхность и фотосинтетическая способность различных генотипов хлопчатника в онтогенезе
| Показатель Фаза развития | Бутонизация | Цветение | Плодообразо-вание |
| Сорт108-ф | |||
| Общая ассимиляционная поверхность, дм-2 | 11,4±1,1 | 31,5±1,6 | 52,1±2,1 |
| Фотосинтетическая способность куста, мгСО2·куст-1·день-1 | 1476 | 2914 | 3582 |
| Линия Л-3 | |||
| Общая ассимиляционная поверхность, дм-2 | 8,4±0,8 | 22,7±0,7 | 32,2±0,8 |
| Фотосинтетическая способность куста, мгСО2·куст-1·день-1 | 1161 | 2546 | 2331 |
| Линия Л-461 | |||
| Общая ассимиляционная поверхность, дм-2 | 7,5±0,6 | 11,8±0,9 | 17,1±1,1 |
| Фотосинтетическая способность куста, мгСО2·куст-1·день-1 | 1447 | 1856 | 1200 |
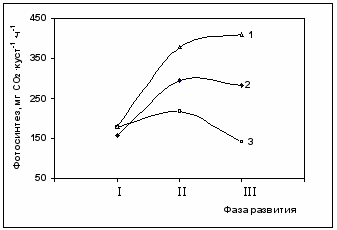
Фотосинтетическая деятельность целого куста хлопчатника коррелировала с сухой биомассой растений (r=0,85) и с темпами нарастания ассимиляционной поверхности у генотипов, характеризующихся активными ростовыми, в частности морфообразовательными процессами (r=0,91). У линии Л-461, с частично подавленным ростом, увеличение площади листовой поверхности не сопровождалось усилением фотосинтетической функции целого растения (r=-0,43). То обстоятельство, что рост ассимиляционной поверхности у линии Л-461 не вызвал повышения нетто-фотосинтеза всего растения, свидетельствует об эпигенетически обусловленном снижении метаболитической нагрузки на единицу фотосинтезирующей площади листа и сопровождалось адекватным уменьшение её активности.
4.2. Влияние дефицита азотного питания на фотосинтетическую способность куста хлопчатника
Как известно дефицит азотного питания приводит к торможению ростовой функции. Однако, до настоящего времени остаётся мало изученным вопрос о том, в какой мере этот стрессовый фактор связан с кооперативным взаимодействием фотосинтетической функции и, как следствие, с элементами продукционного процесса – площадью листовой поверхности и темпами накопления биомассы.
Как видно из приведенных данных (табл.7), в фазу бутонизации существенных отличий между линиями Л-3 и Л-461 не наблюдалось как по показателям сухой биомассы, площади листовой поверхности, так и фотосинтетической деятельности целого куста (рис.5).
Таблица 7
Сухая биомасса, ассимиляционная поверхность и фотосинтетическая способность различных генотипов хлопчатника в онтогенезе при дефиците азотного питания
| Показатель | Бутонизация | Цветение | Плодообразо-вание |
| Линия Л-3 | |||
| Общая ассимиляционная поверхность, дм-2 | 6,4±0,6 | 16,0±0,9 | 13,7±0,8 |
| Сухая биомасса, г | 10,9±0,8 | 38,7±1,4 | 42,3±2,3 |
| Фотосинтетическая деятельность куста, мгСО2·куст-1·день-1 | 869 | 1451 | 720 |
| Линия Л-461 | |||
| Общая ассимиляционная поверхность, дм-2 | 6,5±0,8 | 7,3±0,6 | 8,2±0,7 |
| Сухая биомасса, г | 14,8±0,9 | 28,5±1,6 | 31,0±2,2 |
| Фотосинтетическая способность куста, мгСО2·куст-1·день-1 | 937 | 1006 | 583 |
Сопоставление данных измерения площади листовой поверхности у двух генотипов хлопчатника в фазе цветения показало, что по этому параметру растения линии Л-3 превосходили линию Л-461 на 56%, а по фотосинтетической способности целого куста – на 30%. У растений контрольного варианта в эту же фазу эти величины составляли 51 и 27% соответственно.
В ходе онтогенеза (к фазе плодообразования) наблюдалось снижение площади листовой поверхности у линии Л-3, связанное с опадением части листьев нижнего яруса, в то время как у растений линии Л-461 она оставалась неизменной. Площадь листовой поверхности у линии Л-3 в эту фазу составляла 43% от контроля, а у Л-461 – 48%, а СО2-газообмен целого куста - 33 и 42% соответственно. Таким образом, в фазу массового плодоношения снижение площади листовой поверхности у растений линии Л-3 оказало более существенное влияние на изменение фотосинтетической активности куста, чем у Л-461.
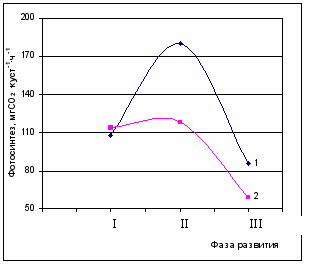
Рис. 5. Онтогентические изменения максимального фотосинтеза надземной части различных генотипов хлопчатника. 1 – линия Л-3, 2 – линия Л-461. Фаза развития: I – бутонизация; II – цветение; III – плодообразование.
Анализ данных по темпам накопления сухой биомассы (табл. 7) куста показал, что несмотря на усиленную ростовую функцию, характерную для линии Л-3, в процентном отношении к контрольным растениям существенных различий с линией Л-461 при дефиците азотного питания не наблюдалось.
Дефицит азотного питания, у обоих линий привел к снижению площади ассимиляционной поверхности, фотосинтетической мощности куста, общей биомассы, количеству и массе коробочек на растении и, как следствие, к уменьшению хозяйственно ценной части урожая. У растений, обладающих более высокой ростовой функцией и испытывающих дефицит азотного питания, снижение по отношению к контролю хозяйственно полезной части урожая оказалось более существенным, чем у менее продуктивных. Вероятно, это произошло вследствие торможения оттока ассимилятов из листьев и изменения направленности распределения фотоассимилятов, большая часть которых использовалась не рационально на формирование в этот период ассимиляционной поверхности и увеличение удельной поверхностной плотности листьев. Коэффициент корреляции между фотосинтетической деятельностью целого куста, площадью листовой поверхности и сухой биомассой составил 0,48 и 0,13, соответственно.
Глава 5. Влияние факторов внешней среды на фотосинтез и ростовые процессы у хлопчатника
5.1. Адаптация фотосинтетического аппарата к воздействию
супероптимальной температуры
Влияние повышенной температуры на некоторые параметры системы ассимиляции углекислого газа
Хлопчатник относится к теплолюбивым мезофитам. Максимальная интенсивность фотосинтеза в начальных фазах развития растений наблюдается при +24…+290С, в период цветения и плодоношения +29…+330С, а в конце вегетации +28…290 С (Насыров, 1960; Мухамеджанов, Закиров, 1968).
Как видно из табл.8 длительное воздействие повышенной температуры в значительной степени подавило фотосинтезирующую способность листьев, главным образом за счет снижения скорости реакции карбоксилирования, т.к. концентрация углекислого газа в жидкой фазе клеток мезофилла, устьичное сопротивление не претерпели существенных изменений. Скорость темнового дыхания не изменялась после действия высоких температур. В некоторой степени уменьшение видимого фотосинтеза может быть объяснено изменением соотношения истинного фотосинтеза и фотодыхания на свету. Однако, хотя нами и наблюдалось изменение соотношения Fист /Rp после 10-дневного воздействия высоких температур, увеличение продолжительности температурного воздействия привело к уменьшению различий по этому показателю между “опытными” и “контрольными” растениями.
Степень ингибирования видимого и истинного фотосинтеза увеличивалась по мере увеличения продолжительности температурного воздействия. Незначительное изменение внутриклеточной концентрации при длительном воздействии повышенной температуры и пропорциональное изменение µm и А позволило нам сделать вывод о том, что основной причиной наблюдаемого ингибирования скорости видимого фотосинтеза явилось снижение количества активных центров РБФК, связанных с рибулозобисфосфатом,. При этом решающим фактором, на наш взгляд, было снижение ресинтеза РБФ, поскольку значения СО2-насыщенного фотосинтеза и фонда ассимиляционного заряда уменьшались от 28 до 42%, в зависимости от фазы развития растений (табл.8). Кроме того, изменение энергетической эффективности фотосинтеза () свидетельствует об уязвимости световых реакций при длительном воздействии супероптимальной температуры.
Таким образом, фонд РБФ, максимальная скорость фотосинтеза и энергетическая эффективность фотосинтеза – параметры, испытывающие наибольшие изменения при действии повышенной температуры.
По имеющимся в литературе данным, повышение температуры выше оптимума для данного вида приводит к торможению процессов роста.
Возникает вопрос: каковы механизмы взаимосвязи установленных нами изменений ассимиляции СО2 с ростовыми процессами.
Биометрические показатели растений хлопчатника при действии высокой температуры
Как видно из рис.6, повышение температуры в период бутонизации и плодоношения ведет к снижению накопления сухой биомассы.
Таблица 8
Параметры системы фотосинтетической ассимиляции углекислого газа листьев хлопчатника сорта 108-Ф после длительной адаптации к супероптимальной температуре
| Вариант | Р21 | Cw | rs | Rp | Fист | Fист/Rp | m | Rm | E | A | |
| Бутонизация | |||||||||||
| Контроль | 2,050,23 | 5,330,24 | 1,880,21 | 1,040,14 | 3,440,36 | 3,280,31 | 0,850,10 | 0,210,04 | 1,020,06 | 41,72,6 | 0,3100,060 |
| Опыт 1 | 1,790,21 | 5,170,16 | 1,850,26 | 1,510,08 | 3,240,36 | 2,550,33 | 0,830,09 | 0,180,05 | 1,080,04 | 34,50,3 | 0,2700,010 |
| Плодоношение | |||||||||||
| Контроль | 1,920,22 | 5,610,35 | 1,360,18 | 0,920,08 | 3,020,36 | 3,280,30 | 0,720,03 | 0,160,08 | 1,400,08 | 34,20,80 | 0,2850,040 |
| Опыт 1 | 1,820,07 | 6,130,30 | 1,330,20 | 0,890,03 | 2,860,30 | 3,210,24 | 0,740,08 | 0,150,03 | 1,070,10 | 25,30,60 | 0,2580,020 |
| Опыт 2 | 1,610,29 | 5,640,16 | 1,590,17 | 0,900,07 | 2,650,27 | 2,940,23 | 0,590,09 | 0,150,02 | 1,700,11 | 27,20,70 | 0,2460,023 |
Р21 - интенсивность видимого фотосинтеза, нмоль СО2 ·см-2 с-1; Cw - внутриклеточная концентрация СО2 в жидкой фазе мезофилла, нмоль СО2 ·см-3; rs - устьичное сопротивление СО2-потоку, сек ·см-1; Rp – фотодыхание, нмоль СО2 ·см-2 с-1; Fист - скорость карбоксилирования, нмоль СО2 ·см-2 с-1; m - проводимость мезофилла, с ·см-1; Rm - митохондриальное дыхание на свету, нмольСО2·см-2с-1 ; Е - интенсивность транспирации, нмоль Н2 О·см-2с-1; А – «ассимиляционный заряд», нмоль ·см-2 ; - энергетическая эффективность фотосинтеза, нмоль ·мДж-1.
Опыт1 – растения подвергались воздействию высокой температуры с фазы бутонизации,
Опыт2 – с фазы цветения-начала плодоношения.
Р
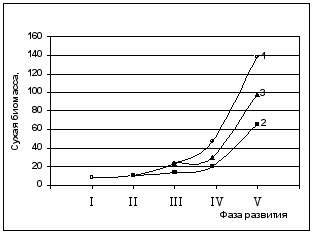 ис.6. Динамика темпов накопления сухой биомассы при длительной адаптации растений хлопчатника к воздействию супероптимальной температуре. 1 – контроль, 2 – растения подвергались воздействию стрессового фактора с фазы бутонизации, 3- с фазы цветения-начала плодоношения. Фаза развития: I –5-6 настоящих листьев; II – бутонизация; III - цветение; IV – плодообразование; V – массовое плодоношение.
ис.6. Динамика темпов накопления сухой биомассы при длительной адаптации растений хлопчатника к воздействию супероптимальной температуре. 1 – контроль, 2 – растения подвергались воздействию стрессового фактора с фазы бутонизации, 3- с фазы цветения-начала плодоношения. Фаза развития: I –5-6 настоящих листьев; II – бутонизация; III - цветение; IV – плодообразование; V – массовое плодоношение.Картина, аналогичная темпам накопления сухой биомассы, наблюдалась и для показателя площади листовой поверхности. Длительное воздействие супероптимальной температуры привело к изменению распределения сухой биомассы по органам растения хлопчатника. На растениях было сформировано меньшее количество плодовых органов, масса сформировавшихся коробочек при этом существенно не изменялась (5,5 г –контроль, 5,1-4,9 г – опыт). «Плодовая нагрузка» в контрольном и опытном вариантах, при воздействии повышенной температуры с фазы бутонизации составляла - 3,7 и 3,8 шт./дм2, соответственно. В опыте 2 этот показатель был существенно ниже – 1,6 шт./дм2. Исходя из полученных нами результатов, можно предположить, что при непродолжительном ( до 10 дней) воздействии повышенной температуры произошел разбаланс донорно-акцепторных отношений, который, при всех прочих равных условиях, влияющих на углекислотный газообмен листьев, явился одной из причин снижения видимого фотосинтеза. Вместе с тем, снижение аттрагирующей способности репродуктивных органов хлопчатника при длительном воздействии супероптимальных температур может являться не только фактором, ограничивающим ассимиляцию СО2, но и пусковым механизмом, вызывающим опадение молодых плодоэлементов.
Таким образом, полученные нами данные свидетельствуют о снижении ростовой функции растений хлопчатника при действии высокой температуры, нарушении донорно-акцепторных отношений при непродолжительном воздействии и восстановлении корреляции между образованием и потреблением ассимилятов при длительной адаптации к воздействию супероптимальных температур.
5.2. Регуляция фотосинтетического СО2-газообмена листьев хлопчатника при дефиците азотного питания
Результаты исследований влияния дефицита азотного питания на параметры фотосинтетической ассимиляции углекислого газа представлены в табл.9. Как видно из приведенных данных, дефицит азотного питания подавлял фотосинтетическую способность листа, главным образом за счет снижения скорости реакции карбоксилирования РБФ. Соотношение карбоксилирующей и оксигенирующей функций фермента при этом оставалось постоянным (постоянтство Гф). Снижение эффективности реакции карбоксилирования сопровождалось уменьшением «ассимиляционного заряда» (А), т.е. фонда РБФ.
Таблица 9
Влияние дефицита азотного питания на параметры системы фотосинтетической
ассмиляции углекислого газа листьев различных генотипов хлопчатника
в фазу плодообразования
| Параметр Вариант опыта | Линия Л-3 | Линия Л-461 | ||||
| 1 | 2 | 3 | 1 | 2 | 3 | |
| Видимый фотосинтез, нмольСО2·см-2с-1 | 1,25±0,06 | 0,77±0,05 | 1,05±0,05 | 1,36±0,11 | 1,05±0,07 | 1,18±0,10 |
| Истинный фотосинтез, нмольСО2·см-2с-1. | 2,96±0,10 | 1,46±0,07 | 1,82±0,03 | 2,76±0,17 | 1,94±0,05 | 2,23±0,11 |
| Проводимость мезофилла, с ·см-1 | 0,98±0,11 | 0,52±0,01 | 0,61±0,03 | 1,03±0,08 | 0,67±0,03 | 0,91±0,15 |
| Устьичное сопротивление, с·см-1 | 3,81±0,07 | 3,94±0,42 | 2,39±0,22 | 2,83±0,54 | 2,97±0,68 | 2,75±0,24 |
| Концентрация СО2 в жидкой фазе мезофилла, нмоль·см-3 | 3,64±0,19 | 4,78±0,12 | 5,09±0,09 | 4,24±0,24 | 4,73±0,23 | 4,31±0,16 |
| Углекислотный фотокомпенсацион-ный пункт, нмоль ·см-3 | 1,57±0,02 | 1,52±0,02 | 1,58±0,03 | 1,58±0,03 | 1,50±0,02 | 1,58±0,04 |
| «Ассимиляционный заряд», нмоль ·см-2 | 23,1±0,84 | 18,6±0,95 | 22,2±1,04 | 24,5±1,05 | 22,2±2,6 | 24,2±1,2 |
Обозначения: 1- контроль, 2 - дефицит азотного питания, 3 - дефицит азотного питания + дефолиация.
Для выяснения роли ростовых процессов в изменении параметров углекислотного газообмена листьев растений нами были проведены опыты по искусственному изменению донорно-акцепторных отношений в системе целого растения.
Как видно из приведенных данных (табл.9), искусственное усиление эпигенетической нагрузки на фотосинтетический аппарат (частичная дефолиация) привело к некоторому увеличению скорости углекислотного газообмена, которое сопровождалось снижением сопротивления устьиц СО2-потоку. Вместе с тем, наблюдалось и увеличение скорости реакции карбоксилирования СО2. Такая реакция на усиление нагрузки на фотосинтетический аппарат растения является прямым доказательством торможения ростовой функции в условиях дефицита азотного питания, приводящего к накоплению избытка метаболитов в листе и оказанию ими репрессорного действия на активность фотосинтетического аппарата. О возможности такого механизма свидетельствуют данные (Семихатова, 1964; Klein, Tsunoda, 1974), указывающие на ослабление оттока ассимилятов из листа «голодающего» по азоту растения, происходящего за счет подавления роста меристем и, вероятно, связанного с ослаблением «запроса» на ассимиляты.
Таким образом, дефицит азотного питания приводит к торможению ростовых процессов, что, в свою очередь, ведет к ослаблению оттока ассимилятов из фотосинтезирующего листа, нарушению донорно-акцепторных отношений и торможению фотосинтеза, происходящего, главным образом, в результате снижения биохимической компоненты ассимиляции СО2. Уменьшение фотосинтезирующей способности клеток мезофилла связано со снижением количества активных центров РБФК, «заряженных» рибулозобисфосфатом, которое происходит вследствие метаболитного ингибирования (Расулов, 1994).
5.3. Влияние длительной гипоксии корней на параметры фотосинтетической ассимиляции растений хлопчатника
Как видно из приведенных результатов (рис.7), затопление корневой зоны уже в первый день приводило к снижению скорости фотосинтеза.
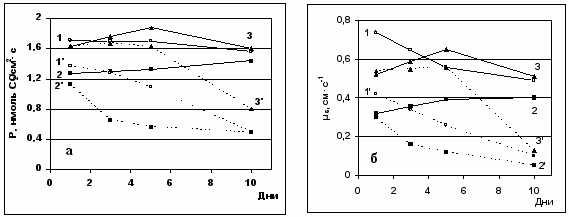
Рис.7. Влияние затопления корневой системы на углекислотный газообмен (а) и проводимость устьиц СО2-потоку (б). Фаза начала плодоношения.
1 – контроль, 2 – удаление точек роста и плодоэлементов, 3 – частичная дефолиация,
1’ – контроль+затопление, 2’ - удаление точек роста и плодоэлементов+ затопление,
3’ - частичная дефолиация+затопление.
Уменьшение скорости СО2-газообмна могло происходить как за счет снижения устьичной проводимости, так и в результате падения фотосинтетической способности клеток мезофилла, а также за счет усиления процессов декарбоксилирования. Реализация этих механизмов могла осуществляться путём непосредственного влияния некоторых факторов, поступающих из затопленной корневой системы, так и опосредованного – через изменение целостной системы растения.
По полученным нами данным (рис.10), наблюдаемые изменения скорости видимого фотосинтеза сопровождались изменением проводимости устьиц СО2-потоку. Снижение эффективности реакции карбоксилирования в условиях затопления корневой системы свидетельствовало о подавлении процесса карбоксилирования в этих условиях. Отсутствие существенных изменений внутриклеточной концентрации СО2 (от 4,88±0,12 до 4,35±0,19 нмоль·см-3) и приведенные на рис.11 данные о зависимости проводимости мезофилла от фонда «ассимиляционного заряда» дает основание предположить, что наиболее вероятной причиной изменения эффективности реакции карбоксилирования в условиях корневого анаэробиоза явилось изменение концентрации активных центров карбоксилазы, связанных с РБФ. Это могло быть обусловлено уменьшением количества белка РБФКО в хлоропластах, либо наличием метаболитного ингибитора, оказывающего влияние на количество активных центов фермента. Другой причиной наблюдаемого нами изменения (µm1) могло быть изменение фонда РБФ, скорость ресинтеза которого в условиях корневого затопления могла быть обусловлена изменением синтеза АТФ.
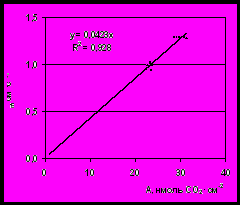
Р
затопление
ис.8. Зависимость проводимости мезофилла (µm) от ассимиляционного заряда (А) при адаптации растений хлопчатника к затоплению корневой системы.
Анализ данных (рис.8) показал, что характер изменения результирующего газообмена и определяющих его параметров существенно зависел от эпигенетической нагрузки на фотосинтетический аппарат. СО2-газообмен листьев контрольных растений, подвергнутых затоплению, был близок к значениям, наблюдаемым у листьев незатопленных растений, но с искусственно уменьшенной нагрузкой на фотосинтетический аппарат. В то же время корневой анаэробиоз не вызвал существенных изменений скорости видимого фотосинтеза у растений с усиленной нагрузкой на фотосинтетический аппарат (частичная дефолиация). При этом СО2-газообмен листьев контрольных растений совпадал со значениями, наблюдаемыми у листьев дефолиированных растений, но подвергнутых затоплению. То есть, усиление ростовой функции растений (частичная дефолиация) нивелировало действие корневого анаэробиоза.
На основании полученных данных можно предположить, что регуляция скорости углекислотного газообмена листьев хлопчатника при затоплении корневой зоны происходило за счет изменения акцептирующей способности куста. При этом инициирующая роль в цепи событий при затоплении корневой системы несомненно принадлежит ростовым процессам.
Как показали результаты наших исследований, 5-ти- суточное затопление корневой системы привело к уменьшению сухой биомассы (127 ± 5 г – контроль, 23±2 г – опыт), площади листовой поверхности (40,9±5,0 дм2 – контроль, 7,1±1,2 дм2 – опыт), общему количеству плодоэлементов (27,8±0,95 шт. – контроль, 5,6±0,6 шт. – опыт).
Таким образом, снижение ростовой функции и уменьшение аттрагирующей способности целого растения хлопчатника в условиях затопления корневой системы привело к накоплению избыточного фонда ассимилятов в листьях, уменьшению скорости регенерации РБФ, снижению количества активных центров фермента и снижению скорости углекислотного газообмена листа. При этом, нарушение донорно-акцепторных отношений на уровне целого растения сопровождалось снижением массы корневой системы и надземной части растения хлопчатника, а также характером перераспределения ассимилятов между органами растения и снижением биологического и хозяйственного урожая.
