Принцип метода полимеразной цепной реакции (пцр, Polymerase chain reaction, pcr) был разработан Кэри Мюллисом (фирма "Cetus", сша) в 1983 г
| Вид материала | Документы |
- Молекулярно-биологические технологии в медицинской практике: проблемы диагностического, 156.62kb.
- Введение в нечеткую логику и системы нечеткого управления, 170.18kb.
- Ядалека от намерения дать историческую картину Египта. Поэтому в книге приводится современная,, 2780.68kb.
- Курсовые работы по менеджменту, 30.17kb.
- Принципы разработки асу, 96.54kb.
- Литература: История США в 4-х тт. Под ред. Г. Н. Севостьянова. М., 1983., 57.83kb.
- Тематика курсовых работ по курсу «основы менеджмента», 29.98kb.
- Справочник профессионала, 3699.74kb.
- "биорезонансная", 669.88kb.
- Лабораторная работа №5 Химическая кинетика и химическое равновесие, 81.86kb.
ПЦР
Принцип метода полимеразной цепной реакции (ПЦР, Polymerase chain reaction, PCR) был разработан Кэри Мюллисом (фирма "Cetus", США) в 1983 г. Открытие ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет. За разработку ПЦР-анализа К.Мюллис в 1993 г. был удостоен Нобелевской премии в области химии. Появление метода ПЦР было обусловлено определенными достижениями молекулярной генетики, прежде всего расшифровкой нуклеотидной последовательности геномов ряда микроорганизмов. Нельзя не сказать, что ПЦР стала возможной благодаря открытию уникального фермента taq-ДНК-полимеразы, содержащегося у бактерий, обитающих в гейзерах. Особенность этой полимеразы заключается в ее исключительной термостойкости (выдерживает нагревание до температуры кипения без потери активности) и высокой рабочей температуре (оптимум работы - 72оС).
Изящность, простота исполнения, непревзойденные показатели чувствительности и специфичности принесли новому методу небывалую популярность. За короткое время ПЦР-анализ распространился по всему миру, быстро выйдя из лабораторий научных институтов в сферу практического клинического использования. Диагностика инфекционных заболеваний, в том числе вызванных агентами, трудно поддающимися культивированию, генотипирование микроорганизмов, оценка их вирулентности, определение устойчивости микрофлоры к антибиотикам, генодиагностика и генетическая дактилоскопия, пренатальная диагностика, биологический контроль препаратов крови - вот далеко не полный перечень направлений медицины, где с успехом применяется ПЦР.
В настоящее время предложены всевозможные модификации ПЦР, разрабатываются новые амплификационные технологии, основанные на клонировании, как ДНК, так и РНК-фрагментов. Из подобных методов, апробированных на клиническом материале, можно назвать лигазную цепную реакцию (ЛЦР, LCR), NASBA (Nucleic Acids Sequence-Based Amplification), метод с использованием QB-репликазы и др. В последних двух методах реакция осуществляется в изотермическом режиме, и для ее проведения не требуется амплификационного оборудования. Тем не менее, на сегодняшний день ПЦР-анализ остается наиболее распространенной и динамично развивающейся технологией. Ежегодно на рынке появляются десятки новых тест-систем для ПЦР-анализа, предназначенных как для выявления нуклеотидных последовательностей различных микроорганизмов - возбудителей заболеваний, так и для исследования генов человека. Себестоимость ПЦР-анализа неуклонно снижается, что способствует все более широкому использованию метода в лечебных и диагностических учреждениях. Количество ПЦР-лабораторий в странах СНГ растет в геометрической прогрессии и, видимо, в ближайшее время ПЦР-анализ станет одним из самых распространенных методов лабораторной диагностики.
Принцип метода ПЦР
Дезоксирибонуклеиновая кислота (ДНК) является универсальным носителем генетической информации у всех существующих на Земле организмов (исключение - РНК-содержащие микроорганизмы). ДНК представляет собой двойную нить, скрученную в спираль. Каждая нить состоит из соединенных последовательно нуклеотидов. Нити ДНК имеют противоположную направленность: 5’-концу одной нити соответствует 3’-конец второй нити. Уникальным свойством ДНК является ее способность удваиваться. В живой клетке этот процесс происходит следующим образом: с помощью специальных ферментов - гираз происходит расплетение спирали в том ее участке, где должна происходить репликация. Далее водородные связи, связывающие нити, разрываются и нити расходятся. Одна из цепей (“+” или смысловая) используется в качестве основной матрицы. Построение новой нити ДНК идет только в одном направлении - от 5’-конца к 3’-концу. Этот процесс осуществляется по принципу комплиментарности ферментом ДНК-полимеразой. Для того чтобы фермент начал свою работу, требуется наличие стартового блока - небольшого начального двухцепочечного фрагмента. Стартовый блок образуется при взаимодействии небольшого одноцепочечного фрагмента ДНК, называемого праймером, с комплиментарным участком соответствующей цепи родительской ДНК. Репликация одновременно идет и на второй нити ДНК (“-” или антисмысловой), только наращивание цепи происходит в обратном направлении. В результате процесса репликации из одной молекулы ДНК образуется две молекулы ДНК, в которых одна нить от материнской молекулы ДНК, а вторая, дочерняя, вновь синтезированная.
Таким образом, цикл репликации ДНК включает в себя три основные стадии:
1) расплетение спирали ДНК и расхождение нитей (денатурация);
2) присоединение праймеров;
3) достраивание цепи дочерней нити.
В ПЦР эти процессы осуществляются в пробирке в циклическом режиме. Переход от одной стадии реакции к другой достигается изменением температуры инкубационной смеси. При нагревании раствора до 93-95оС происходит денатурация ДНК. Для перехода к следующему этапу - присоединению или “отжигу” праймеров - инкубационную смесь охлаждают до 50-65оС. Далее смесь нагревают до 70-72оС - оптимум работы taq-ДНК-полимеразы - на этой стадии происходит достраивание новой нити ДНК. Далее цикл повторяется снова.
Поскольку наращивание дочерних нитей ДНК должно идти одновременно на обеих цепях материнской ДНК, то для репликации второй цепи также требуется свой праймер. Таким образом, в реакционную смесь вносятся два праймера: один для “+”-цепи, второй для “-”-цепи. Присоединившись к противоположным цепям молекулы ДНК, праймеры ограничивают собой тот ее участок, который будет в дальнейшем многократно удвоен или амплифицирован. Длина такого фрагмента, который называется ампликоном, обычно составляет несколько сот нуклеотидов.
Разработка праймеров для ПЦР является самым ответственным звеном в создании диагностикума. Требуется подобрать такой фрагмент молекулы ДНК, который бы отличался генетической консервативностью и присутствовал бы только у интересующего вида микроорганизмов или в исследуемом гене. При этом длина такого фрагмента должна составлять 15-30 нуклеотидов. Проделать эту работу помогают специальные компьютерные программы, использующие информацию о нуклеотидной последовательности известных микроорганизмов или генов человека. Получить подобную информацию можно из международных компьютерных банков данных (Gen bank, EMBL) через сеть Internet. Синтез праймера по заданной последовательности нуклеотидов не представляет технической сложности и осуществляется в автоматических синтезаторах.
Остальные компоненты ПЦР: дезоксинуклеозидтрифосфаты (дАТФ, дТТФ, дГТФ, дЦТФ) в эквивалентных концентрациях 200-500 мкм; магний, необходимый для работы taq-полимеразы (2-3 мМ); трис-HCl-буфер рН 6,8-7,8.
Каждый цикл амплификации включает 3 этапа, протекающие при различных температурных режимах.
1 этап: денатурация ДНК. Протекает при 93-950 в течение 30-40 сек.
2 этап: отжиг праймеров. Присоединение праймеров происходит комплиментарно к соответствующим последовательностям на противоположных цепях ДНК на границах специфического участка. Для каждой пары праймеров существует своя температура отжига, значения которой располагаются в интервале 50-65оС. Время отжига 20-60 сек.
3 этап: достраивание цепей ДНК. Комплиментарное достраивание цепей ДНК происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служат добавляемые в раствор дезоксирибонуклеозидтрифосфаты. Процесс синтеза катализируется ферментом taq-полимеразой и проходит при температуре 70-72оС. Время протекания синтеза - 20-40 сек.
Образовавшиеся в первом цикле амплификации новые цепи ДНК служат матрицами для второго цикла амплификации, в котором происходит образование специфического фрагмента ДНК - ампликона. В последующих циклах амплификации ампликоны служат матрицей для синтеза новых цепей. Таким образом, происходит накопление ампликонов в растворе по формуле 2n, где n - число циклов амплификации. Поэтому, даже если в исходном растворе первоначально находилась только одна двухцепочечная молекула ДНК, то за 30-40 циклов в растворе накапливается около 108 молекул ампликона. Этого количества достаточно для достоверной визуальной детекции этого фрагмента методом электрофореза в агарозном геле.
Преимущества метода ПЦР как метода диагностики инфекционных заболеваний
- Прямое определение наличия возбудителей
Многие традиционные методы диагностики, например иммуноферментный анализ, выявляют белки-маркеры, являющиеся продуктами жизнедеятельности инфекционных агентов, что дает лишь опосредованное свидетельство наличия инфекции. Выявление специфического участка ДНК возбудителя методом ПЦР дает прямое указание на присутствие возбудителя инфекции.
- Высокая специфичность
Высокая специфичность метода ПЦР обусловлена тем, что в исследуемом материале выявляется уникальный, характерный только для данного возбудителя фрагмент ДНК. Специфичность задается нуклеотидной последовательностью праймеров, что исключает возможность получения ложных результатов, в отличие от иммунологических методов анализа, где нередки ошибки в связи с перекрестно-реагирующими антигенами.
- Высокая чувствительность
Метод ПЦР позволяет выявлять даже единичные клетки бактерий или вирусов. ПЦР-анализ обнаруживает наличие возбудителей инфекционных заболеваний в тех случаях, когда другими методами (иммунологическими, бактериологическими, микроскопическими) это сделать невозможно. Чувствительность ПЦР-анализа составляет 10-100 клеток в пробе (чувствительность иммунологических и микроскопических тестов - 103-105 клеток).
- Универсальность процедуры выявления различных возбудителей
Материалом для исследования методом ПЦР служит ДНК возбудителя. Метод основан на выявлении фрагмента ДНК или РНК, являющегося специфичным для конкретного организма. Сходство химического состава всех нуклеиновых кислот позволяет применять унифицированные методы проведения лабораторных исследований. Это дает возможность диагностировать несколько возбудителей из одной биопробы. В качестве исследуемого материала могут использоваться различные биологические выделения (слизь, моча, мокрота), соскобы эпителиальных клеток, кровь, сыворотка.
- Высокая скорость получения результата анализа
Для проведения ПЦР-анализа не требуется выделение и выращивание культуры возбудителя, что занимает большое количество времени. Унифицированный метод обработки биоматериала и детекции продуктов реакции и автоматизация процесса амплификации дают возможность провести полный анализ за 4-5 часов.
- Возможность диагностики не только острых, но и латентных инфекций
Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов.
Следует отметить, что методом ПЦР возможно выявление возбудителей не только в клиническом материале, полученном от больного, но и в материале, получаемом из объектов внешней среды (вода, почва и т.д.).
Ограничения метода ПЦР
- Амплифицируется ДНК как живого, так и погибшего микроорганизма
Это налагает определенные требования при использовании ПЦР для контроля эффективности лечения. В общем случае подобный контроль должен проводиться спустя промежуток времени, в течение которого происходит полная элиминация возбудителя. Обычно этот интервал составляет 4-8 недель.
- Возможность перекрестной реакции
Подбор праймеров происходит на основе существующих знаний о геноме данного и сходных микроорганизмов. Теоретически существует возможность присутствия такого же фрагмента и у других микроорганизмов, геном которых в настоящее время не расшифрован, и которые не были протестированы на возможность перекрестной реакции. Присутствие в пробе таких микроорганизмов может привести к ложноположительному результату анализа.
Изменчивость микроорганизмов
Хотя при конструировании тест-системы фрагмент генома, используемый для амплификации, выбирается из высоко консервативной области, изменчивость микроорганизмов может приводить к тому, что некоторые генотипы или штаммы исследуемого возбудителя могут приобретать мутации в амплифицируемом участке генома, и, таким образом, становиться неуловимыми данной тест-системой.
Проведение полимеразной цепной реакции
Определенное количество образца из обработанной клинической пробы переносится в специальную микроцентрифужную пробирку типа “Eppendorf” объемом 0,2 или 0,5 мл. В эту же пробирку добавляется амплификационная смесь, состоящая из воды, ПЦР-буфера, раствора дНТФ, раствора праймеров и раствора Taq-полимеразы (добавляется в смесь в последнюю очередь). Как правило, объем реакционной смеси составляет 25 мкл. Затем в каждую пробирку добавляется одна капля минерального масла для предотвращения испарения реакционной смеси в процессе амплификации. Пробирки переносятся в программируемый термостат (амплификатор) и проводится амплификация в автоматическом режиме по заданной программе, соответствующей виду определяемой инфекции. Время проведения реакции в зависимости от заданной программы составляет 2-3 часа. Параллельно с опытными пробами ставятся контрольные: положительный контроль включает в себя все компоненты реакции, но вместо материала клинического образца вносится контрольный препарат ДНК исследуемого возбудителя. Отрицательный контроль включает в себя все компоненты реакции, но вместо клинического материала или препарата ДНК вносится соответствующее количество деионизованной воды или экстракта, не содержащего исследуемой ДНК. Отрицательный контроль необходим для проверки компонентов реакции на отсутствие в них ДНК или клеток возбудителя вследствие контаминации и исключить учет ложноположительных результатов.
Применение ПЦР в практическом здравоохранении
Использование метода ПЦР для диагностики инфекционных заболеваний как бактериальной, так и вирусной природы имеет колоссальное значение для решения многих проблем микробиологии и эпидемиологии. Применение этого метода также способствует развитию фундаментальных исследований в области изучения хронических и малоизученных инфекционных заболеваний. Однако следует отметить, что метод ПЦР лишь дополняет спектр традиционных методов, используемых в микробиологической диагностике. Наиболее рационально и эффективно применение ПЦР для обнаружения микроорганизмов трудно культивируемых в лабораторных условиях, атипичных форм бактерий. К ним также относятся внутриклеточные паразиты и микроорганизмы, способные длительно персистировать в организме хозяина. В таблице 2 приведены основные показания к применению метода ПЦР при различных заболеваниях.
Таблица 2. Применение ПЦР в клинической практике
| Показания к проведению ПЦР-исследования | Материал для исследования | Возбудитель | Примечание |
| Цервицит, эндометрит | Цервикальный соскоб, аспират из полости матки | Сhlamydia trachomatis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealiticum, Neisseria gonorrhoeae, Trichomonas vaginalis, Gardnerella vaginalis, Candida albicans Вирус простого герпеса I, II типов | Возможно проведение типирования U.urealiticum (Parvo и T960), определение устойчивосости микрофлоры к антибиотикам тетрациклинового ряда и макролидам |
| Сальпингит, периаппендицит | Цервикальный соскоб, биоптаты, полученные при лапароскопии | ||
| Бактериальный вагиноз, вагинит, вульвовагинит у девочек | Эпителиальный соскоб из влагалища | ||
| Уретрит, простатит | Соскоб из уретры, моча, сок простаты | ||
| Эпидидимит | Сперма | ||
| Проктит | Соскоб из прямой кишки | ||
| Бесплодие, невынашивание беременности, эктопическая беременность | Цервикальный соскоб, | ||
| Синдром Рейтера | Эпителиальный соскоб из уретры и конъюнктивы | ||
| Герпетические поражения гениталий, слизистых оболочек, кожных покровов и др. | Эпителиальный соскоб с пораженного участка, кровь | Вирус простого герпеса I, II, VI типов, вирус Эпштейн-Барра, вирус Варицелла Зостер | |
| Кандиломатоз | Эпителиальный соскоб с пораженного участка | Папилломовирус (HPV) | Возможна идентификация онкогенных (6, 11, 16, 18) типов вируса |
| Пневмония новорожденных, рецидивирующие хронические заболевания верхних отделов дыхательной системы | Эпителиальный соскоб с задней стенки глотки, бронхоальвеолярный лаваж, мокрота | Сhlamydia trachomatis, Сhlamydia pneumoniae, Mycoplasma pneumoniae, Mycoplasma hominis, Mycobacterium tuberculosis | |
| Конъюнктивит (в том числе у новорожденных) | Эпителиальный соскоб из конъюнктивы | Сhlamydia trachomatis, Neisseria gonorrhoeae, Вирус простого герпеса | |
| Цитомегаловирусная инфекция (в том числе внутриутробная и у новорожденных) | Кровь, моча, слюна, амниотическая жидкость, биоптаты | Цитомегаловирус (CMV) | |
| Туберкулез легких | Мокрота, бронхоальвеолярный лаваж, | Mycobacterium tuberculosis, Mycobacterium bovis | Возможно определение устойчивости микобактерий к антибиотикам |
| Туберкулез мочеполовых и др. органов | Моча, соскоб с пораженного участка | ||
| Язва желудка, гастрит, дуоденит | Биоптат слизистой | Helicobacter pylori | |
| Вирусный гепатит | Кровь, биоптаты печени | Вирусы гепатитов В, С, D, G | Возможно генотипирование HBV, HCV. |
| Контроль крови и препаратов из нее в трансфузиологии и трансплантологии | Кровь | Вирусы гепатитов В, С, D, G, ВИЧ, герпеса, ЦМВ | |
ИФА
В основе иммуноферментного анализа (ИФА) лежит иммунная реакция антигена с антителом. Среди различных модификаций ИФА наибольшее распространение получили конкурентный метод, применяемый обычно в анализе гормонов, и метод двойного связывания, обычно используемый в серодиагностике инфекций.
В методе двойного связывания первая реакция происходит между определяемым Ig и очищенным антигеном возбудителя, фиксированным к поверхности лунок иммунологического планшета. После завершения первой реакции планшет отмывается. При этом несвязавшиеся компоненты исследуемой пробы удаляются, а на стенках лунок остается комплекс антиген-антитело. Для выявления образовавшихся иммунных комплексов проводят вторую иммунологичесую реакцию, в которой в качестве антигена выступает связавшийся специфический Ig, а в качестве антител к нему — коньюгат, представляющий собой Ig (например, кроличий) к соответствующему Ig человека, меченный ферментом (обычно пероксидазой). После завершения второй иммунологической реакции следует отмывка лунок планшета от избытка коньюгата и далее – третий этап – ферментативная реакция, катализируемая ферментной частью молекулы коньюгата. Субстратом данной реакции служит бесцветное вещество – хромоген (орто-фенилендиамин, ОФД или тетраметилбензидин, ТМБ), который в ходе реакции образует окрашенное вещество. Интенсивность окраски в лунке определенным образом зависит от количества содержащихся в пробе Ig. После остановки ферментативной реакции проводят фотометрирование лунок. Далее с учетом значений оптической плотности контрольных проб проводят математическую обработку результатов анализа. В общем случае, чем выше оптическая плотность в данной лунке, тем большее количество специфических антител содержалось в соответствующей пробе и, следовательно, выше титр анализируемой сыворотки. При отсутствии в сыворотке исследуемых антител лунки остаются неокрашенными.
В конкурентном анализе антитела к определяемому соединению фиксированы к поверхности лунки планшета. В лунки вносится анализируемая проба и коньюгат, конкурирующий за места связывания с фиксированными антителами и имеющий в своем составе ферментативную метку. Анализ проводится в два этапа: иммунологическая реакция и ферментативня реакция. Зависимость между концентрацией анализируемого вещества и оптической плотностью в лунках имеет обратную зависимость
Для исследования методом ИФА используется кровь из локтевой вены, полученная натощак.
К достоинствам ИФА можно отнести высокие чувствительность, специфичность, воспроизводимость, унифицированность и пригодность для массовых обследований. Возможность инструментальной оценки результатов устраняет фактор субъективности.
Иммуно-ферментный анализ (ИФА) применяется в диагностике урогенитальных инфекций для выявления наличия в сыворотке крови специфических иммуноглобулинов (Ig или антител) - белков, вырабатываемых клетками иммунной системы, направленных на борьбу с внедрившимся в организм инфекционным агентом. Связываясь с микробной клеткой или продуктами ее жизнедеятельности, иммуноглобулины нейтрализуют их и способствуют их элиминации. Таким образом, иммуноглобулины представляют собой суть гуморального иммунитета, то есть иммунитета, обусловленного субстанциями, содержащимися в жидкостях тела, в отличие от клеточного иммунитета, связанного с присутствием специальных клеток иммунной системы. На каждый вид (и даже подвид) возбудителя вырабатываются свои определенные антитела, которые, как правило, не связываются ни с каким другим инфекционным агентом. Благодаря этому определение антимикробных антител обеспечивает достаточно высокую специфичность анализа. Из пяти классов Ig в диагностике инфекционных заболеваний чаще всего используются Ig трех типов А, M и G. В нашей лаборатории производится определение IgM и IgG. Выработка иммуноглобулинов происходит по определенным законам, которые необходимо знать для правильной интерпретации получаемых результатов.
Прежде всего нужно помнить, что существует некоторый промежуток времени с момента внедрения инфекционного агента в организм и до момента появления антител в сыворотке крови - это так называемый серонегативный период. Для различных инфекций и отдельных индивидуумов он может быть неодинаков, в среднем же для возбудителей урогенитальных заболеваний он составляет 1-4 недели. Динамика содержания Ig в сыворотке крови по мере течения инфекции приведена на рис.1.
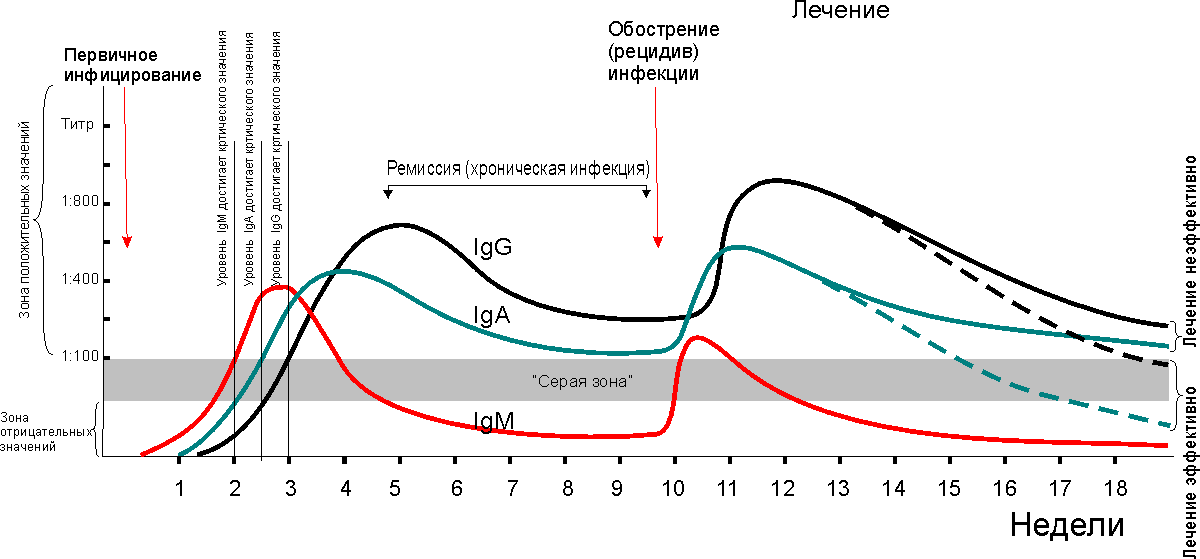
Из рисунка видно, что в первую очередь начинают вырабатываться IgM, пик которых приходится на максимум проявлений клинических признаков острой инфекции. Поэтому IgM принято считать маркером острой фазы заболевания. С отставанием на 1-2 недели начинает увеличиваться титр IgG. В последующем содержание IgM в сыворотке крови снижается, а IgG - продолжает увеличиваться. Этот период соответствует стадии перехода инфекции из острой фазы в хроническую. Если в какой-то момент происходит обострение хронической инфекции, то наблюдается новый всплеск IgM с последующим увеличением титра IgG, соответствующем фазе ремиссии. Если организм справляется с инфекцией (сам или с помощью медикаментов), то IgG могут еще длительное время (а для некоторых инфекций и пожизненно) оставаться повышенными. Для ряда заболеваний, таких как корь, дифтерия, паротит и другие, наличие специфических иммуноглобулинов является надежным барьером против повторного инфицирования. К сожалению, это не относится к урогенитальным заболеваниям (хламидиоз, микоплазмоз, трихомониаз и др.), иммунитет против которых не развивается. Обычно спустя 2 месяца после эффективной терапии уровень IgG опускается ниже критического значения, тем не менее следует с осторожностью использовать данные анализа IgG в качестве показателя излеченности, поскольку, в силу индивидуальных особенностей иммунной системы, данные антитела еще длительное время (3 и более месяцев) могут присутствовать в крови.
Как и любой лабораторный метод диагностики ИФА имеет свои достоинства и недостатки. К преимуществам метода можно отнести его возможность по анализу крови выявлять наличие инфекции любой локализации, а также возможность следить в динамике по уровню титра за ходом заболевания. К недостаткам метода прежде всего относится то, что он является непрямым, то есть определяется не возбудитель, а иммунный ответ на него, который может иметь индивидуальные вариации.
По оценкам ряда авторов чувствительность и специфичность метода ИФА составляет соответственно 90% и 95% соответственно, что является довольно высоким показателем для лабораторного метода. Естественно, что только по наличию тех или иных антител не может быть поставлен достоверный диагноз заболевания. Необходимым и в большинстве случаев достаточным для постановки достоверного диагноза можно считать одновременное выявление антител к возбудителю методом ИФА и прямое выявление возбудителя методом ПЦР или ПИФ.
Электрофорез на полиакриламидном геле (ПААГ,PAGE)
Суть метода- разделение заряженных соединений на основе их подвижности в электрофоретическом поле. При наложении разности потенциалов в какой-то среде положительно заряженные молекулы движутся к отрицательно заряженному электроду, а отрицательно заряженные- к положительному электроду. В качестве среды разделения используется гель полиакриламида в воде. Если в горячей воде растворить определенное количество полиакриламида и затем раствор охладить образуется студень, называемый гелем. Природа любого геля- структура, в которой молекулы воды удерживаются внутри трехмерной сетки, образованной длинными полимерными молекулами. С увеличением концентрации молекул полимера в геле "ячейки" этой сетки становятся все мельче, а с уменьшением- наоборот, диаметр "ячейки" увеличивается. В основу разделения молекул белков гель-электрофорезом положены эти основные характеристики геля.
Наиболее часто разделение осуществляется на пластинах, покрытых слоем геля толщиной 2-3 мм. Размеры пластины 10 х 14 см или иное, в зависимости от конструкции прибора. В процессе электрофореза пластина с гелем разогревается в результате протекания через нее тока. Степень разогрева пластины зависит от величины напряжения, при котором происходит разделение. Чем выше напряжение, тем выше сила протекающего по пластине тока и сильнее ее разогревание, поэтому применение высоких напряжений должно сопровождаться охлаждением пластины, чтобы не допускать тепловую денатурацию разделяемых белков. Величина продвижения белков в геле зависит (в идеале) только от величины наложенного потенциала и времени. В среднем, основная масса разделений требует около 2000 В.часов. Это означает, что при потенциале 500 В разделение может закончиться за 4 часа, а при потенциале 150 В на это потребуется около 14 часов.
Аппаратура для гель-электрофореза может различаться конструктивно при неизменности принципов разделения.
Существуют две основные разновидности электрофореза –на градиентных гелях и с ионным деретгентом (ДСН-ПААГ, SDS-PAGE).
Электрофорез на градиентном полиакриламидном геле.
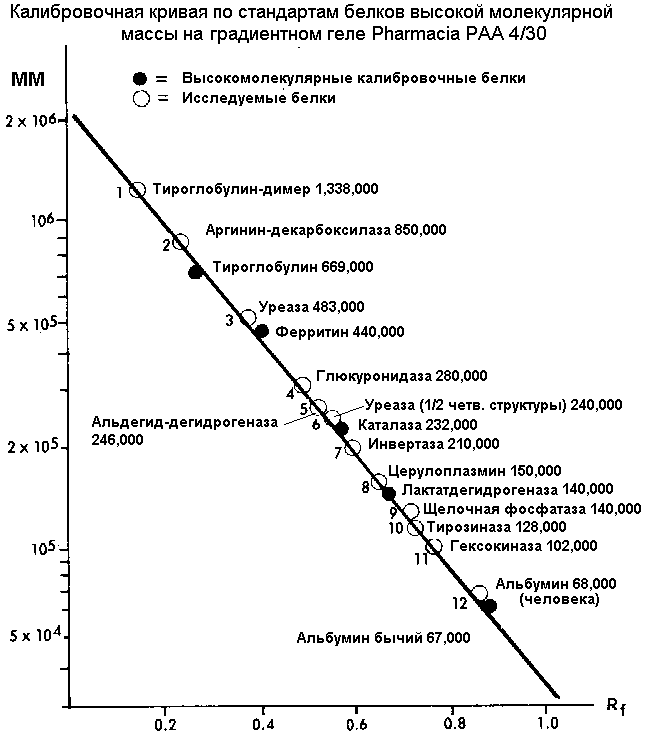
В качестве среды разделения используется пластина с гелем с изменяющейся концентрацией (от 4 до 30 %) полиакриламида. Чаще всего используются ТРИС-боратные буферы (рН=8,4) с добавками динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). Гель уравновешивается с буфером наложением потенциала 70 В в течение 20 мин (без добавления образца). После этого наносятся полосы анализируемых образцов и маркеров (белков с известной ММ) и накладывается потенциал 150 В, разделение продолжается 16 часов. (Или 3 часа при 500 В- если имеется возможность охлаждения пластины).
Фиксирование полос происходит 30 мин в 10 % растворе сульфосалициловой кислоты, после чего пластина окрашивается красителем Кумасси Голубой (0,02% в 7% уксусной кислоте) в течение ночи. Пластина осветляется электрофорезом при 24 В 45 мин в 7% уксусной кислоте, после чего можно наблюдать окрашенные полосы белков.
Разделение осуществляется в результате задерживания (застревания) белковых молекул во все более мелкопористом (рост содержания полиакриламида) геле. При этом происходит накопление белка, за счет постепенного «подтягивания» отстающих молекул. Метод отличается высокой эффективностью разделения и очень узкими полосами разделения. Количество наносимой пробы зависит от способа окрашивания белка, с красителем Кумасси составляет 5 мкл. (С серебряным прокрашиванием- концентрация белка может быть в 50 раз меньше).
Калибровочный график для определения молекулярных масс неизвестных белков представляет собой зависимость:
Электрофорез SDS-PAGE (с додецилсульфонатом натрия).
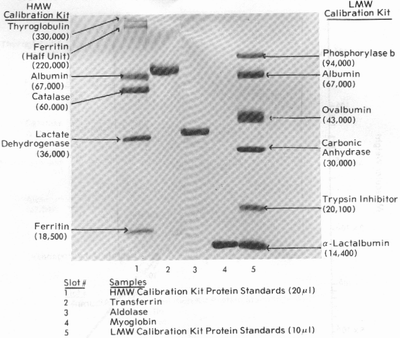
Наиболее распространенным в последнее время является вариант электрофореза в присутствии детергентов, в частности- додецилсульфоната натрия (SDS). Процесс можно осуществлять как на геле постоянной плотности, так и на градиентных гелях. В основе метода лежит способность детергента реагировать и денатурировать широкий спектр белков одинаковым образом. Нативные белки, имеющие различные форму молекулы, заряд и размеры в процессе взаимодействия с SDS превращаются в комплексы с ним, имеющие постоянное соотношение заряда на единицу массы (так как заряд SDS маскирует заряды протеинов) и идентичную конформацию, которая варьирует в размере прямо пропорционально молекулярной массе субъединицы. При неизменных условиях электрофореза (рН, напряжение, время, концентрация геля и т.д.) электрофоретическая подвижность протеина зависит от его плотности заряда, массы и формы. Поскольку большинство комплексов протеин-SDS имеют постоянные соотношения "заряд-масса" и идентичную форму, их подвижность зависит исключительно от размера. Поэтому определение молекулярной массы неизвестного протеина сводится к сравнению подвижности его комплекса с SDS с подвижностью комплексов "SDS-протеин известной молекулярной массы". Обработка образцов осуществляется добавлением SDS до концентрации 2,5% и бетта-меркаптоэтанола до концентрации 5%, после чего смесь тщательно перемешивается и нагревается при 100 С (в кипящей водяной бане) в течение 5-10 минут. Таким образом достигается полная денатурация и диссоциация четвертичной структуры.
Электрофоретическая картина разделения протеинов на геле постоянной концентрации (12,6%) в присутствии детергента (0,1% SDS) выглядит так:
И ее калибровочная зависимость:
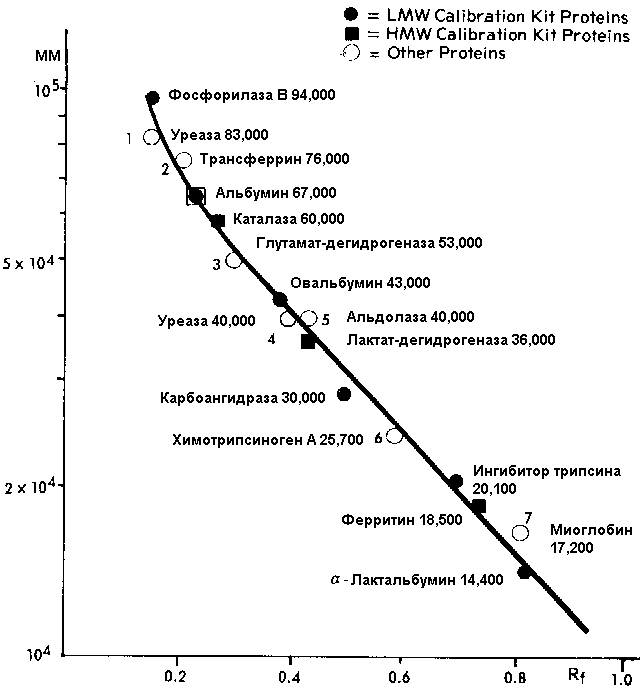
То же разделение, на градиентном геле Pharmacia PAA 4/30 в 0,2% SDS:
и его графическая зависимость для определения молекулярной массы:
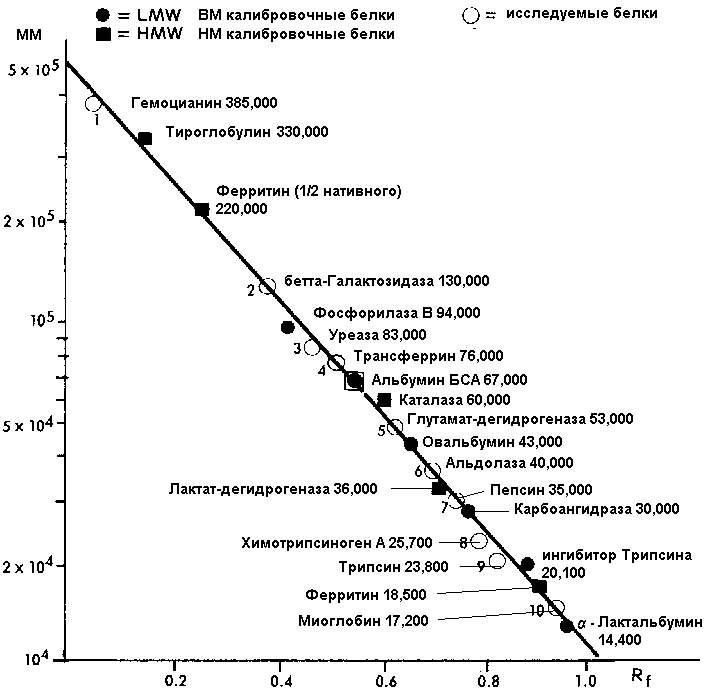
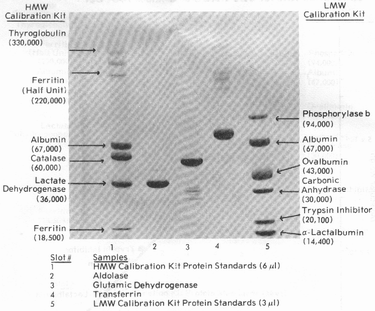
Калибровочные (по молекулярной массе) белки:
Высокомолекулярные белки (HMW):
| Белок | ММ нативного | ММ субъединиц | Источник |
| Тироглобулин | 669,000 | 330,000 | свинья |
| Ферритин | 440,000 | 18,500 (220,000) | селезенка лошади |
| Каталаза | 232,000 | 60,000 | говяжья печень |
| Лактат-дегидрогеназа | 140,000 | 36,000 | говяжье сердце |
| Альбумин | 67,000 | 67,000 | сыворотка быка |
Низкомолекулярные белки (LMW):
| Белок | ММ субъединицы | Источник |
| Фосфорилаза В | 94,000 | мышца кролика |
| Альбумин | 67,000 | сыворотока быка |
| Овальбумин | 43,000 | яичный белок |
| Карбоангидраза | 30,000 | эритроциты быка |
| Ингибитор трипсина | 20,100 | соевые бобы |
| альфа-Лактальбумин | 14,400 | коровье молоко |
При анализах с SDS возможно частичное разрушение белков четвертичной структуры, которое достигается более мягкими условиями денатурации (1% SDS и 1% бетта-меркаптоэтанола, нагревание при 60 С в течение 15 мин). В таких условиях можно обнаружить одновременно полуединицу ферритина (ММ 220,000) и субъединицу (ММ 18,500). Без денатурации нативный ферритин имеет массу 440,000 Да.
Иммуноблотинг
После разделения сложной смеси белков методом электрофореза в полиакриламидном или ага- розном геле их можно перенести из геля на микропористую нитроцеллюлозную мембрану.
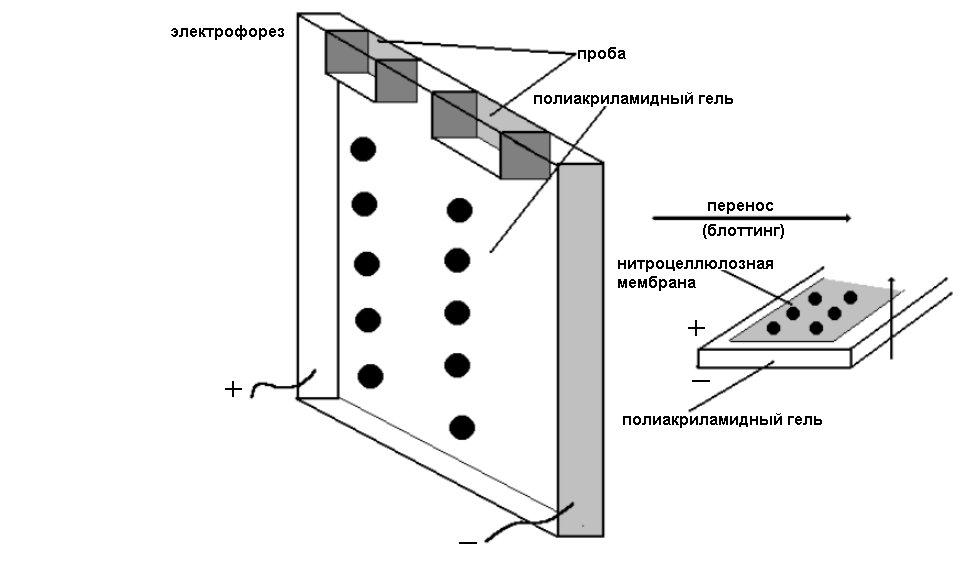 Рис. Схема иммуноблотинга
Рис. Схема иммуноблотингаДалее неспецифически связанные с мембраной антигены могут быть идентифицированы с помощью меченых антител. Данный метод получил широкое распространение. Например, он используется для идентификации компонентов нейрофиламентов, которые предварительно разделяют в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН).
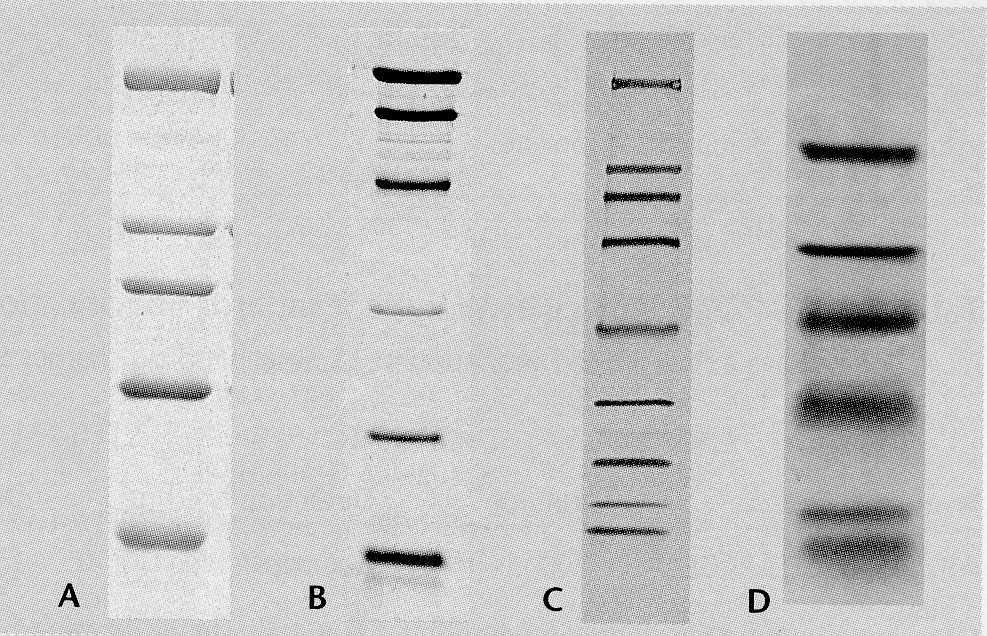
Рис. Пример иммуноблотинга
Разумеется, если антиген необратимо денатурируется ДСН, то такая методика использоваться не может. Если белки антисывороткк разделить изоэлектрофокусированием, а затем перенести (это и называется блоттингом) на мембрану, то с помощью меченого антигена можно установить и так называемый спектротип антисыворотки, т.е. определить изотип антител, взаимодействующих с данным антигеном.
Схема: Основные методы окраски в иммуноблотинге (Western-blot).
Гель с исследуемым образцом после электрофореза
Перенос разделенных белков на мембрану
Определение белков
Определение антигена


Аннионые красители
Биотиновые плашки для блоттинга
Красители из коллоидного золота
Амидо черный или кумаси синий (R-250)
4- хлоро - 1 -нафтол (4CN)
Усиление окраски



Блок неспецифических мест связывания
Инкубация со специфическими антителами
Инкубация с реагентом
Коньюгаты пероксидазы хрена
Коньюгаты золота
Коньюгаты щелочной фосфатазы
Коньюгаты биотина, стрептовидин
4хлоро-1-нафтол, 3,3’-диамино- бензидин (DAB)
Усиление
окраски



Хемилюминесцентное определение
5-бромо-4-хлоро-3-индол фосфат (BCIP),
нитросиний тетразоль (NBT)
Источники:
1. ссылка скрыта
2. ссылка скрыта
3. ссылка скрыта
4. ссылка скрыта
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
НОВГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. ЯРОСЛАВА МУДРОГО
институт медицинского образования
_____________________________________________________________________________________
Кафедра микробиологии и иммунологии
Доклад
на тему:
«Биотехнология. Диагностикумы: ИФА,ПЦР, элекрофорез на полиакриламидном геле, иммуноблотинг»
Выполнил:
студент , гр1452
Шиман В.А.
Проверил:
преподаватель
Шитяков С.В.
Великий Новгород
2005
