Научно-исследовательская работа на тему: Получение коагулянтов из производственных отходов для очистки сточных вод
| Вид материала | Научно-исследовательская работа |
СодержаниеСпособы обращения с железосодержащими отходами, реализованные в Республике Беларусь Порядок выполнения работы Список использованных источников Приложение Введение 3 Порядок выполнения работы |
- Реферат установка для очистки сточных вод, 11.06kb.
- Охрана производственных сточных вод и утилизация осадков, 327.09kb.
- Контроль различных форм азота в процессе очистки сточных вод, 76.68kb.
- Технологическая схема очистки хозяйственно-бытовых сточных вод г. Кыштыма, 49.54kb.
- Методы очистки сточных вод, 28.89kb.
- Физико-химические методы очистки сточных вод Малкова С. В., Машкова С. А., Шапкин, 45.75kb.
- Ном переработка сбросов и бытовых и промышленных отходов в г. Москве, 167.96kb.
- Физико-химические методы очистки сточных вод с применением коагулянтов1, 44.5kb.
- Единый тарифно-квалификационный справочник работ и профессий рабочих, 4712.85kb.
- Зао "дакт-инжиниринг", 28.98kb.
ГУО «Гимназия г. Фаниполя»
Научно-исследовательская работа на тему:
Получение коагулянтов из производственных отходов для очистки сточных вод
Работу выполнили:
ученики 10 класса
Кирейчук Диана
Василенко Андрей
Научный руководитель:
доцент кафедры промышленной экологии БГТУ
Лихачёва Анна Владимировна
Руководитель:
учитель химии
Антоник Лилия Александровна
Фаниполь 2010
Оглавление
Введение
Общие сведения о коагуляции
-
Способы обращения с железосодержащими отходами, реализованные в Республике Беларусь
Порядок выполнения работы
-
Список использованных источников
Приложение
Введение
В последние годы одной из наиболее развиваемых наук является химия окружающей среды как "наука о химических взаимодействиях между живыми организмами или между живой и неживой природой" (Барбье). Химический аспект касается в основном качественного и количественного состава химических загрязнений и их превращений в окружающей среде.
Химию окружающей среды определяют как науку о процессах, определяющих химический состав и свойства объектов окружающей среды. Она базируется на основных законах и понятиях классической химии, однако объекты исследования в этом случае находятся в биосфере.
Человеку необходимо уметь предвидеть последствия внедрения новых технологий, знать особенности поведения различных химических соединений при их попадании в окружающую среду, оценивать их воздействие на биосферные процессы.
Необходимы данные о том, как ведут себя, какие испытывают превращения, к каким последствиям приводят те или иные химические вещества, попадающие в биосферу.
Термин «химия окружающей среды» подчеркивает взаимосвязь химии и экологии. Каждая из этих наук представляет собой систему научных дисциплин. Экология как наука о закономерностях взаимосвязей и взаимодействии организмов и их систем друг с другом и со средой обитания трансформировалась в науку о структуре природы. Химия как наука о веществах, их строении и превращениях описывает состав и свойства компонентов природы на атомно-молекулярном уровне. Обе эти дисциплины, взаимно дополняя друг друга, призваны создать научные основы природопользования и охраны природы, способствовать оптимизации взаимодействия человека с природой.
Химия окружающей среды базируется на основных законах и понятиях классической химии, однако объекты исследования в этом случае находятся в биосфере.
Химия окружающей среды призвана описывать динамику экохимических процессов в объектах окружающей среды, а также в искусственных экосистемах, прогнозировать и регулировать экологические последствия антропогенных воздействий на природную среду.
Известно, что отходы, образующиеся в процессе производства любого вида продукции, являются показателем нерационального использования химического сырья.
Сложившаяся в Республике Беларусь ситуация в области образования, накопления, использования (рециклинга), хранения и утилизации отходов промышленных производств ведет к опасному загрязнению окружающей среды, нерациональному использованию природных ресурсов и, как следствие, к значительному экономическому ущербу.
По данным Министерства природных ресурсов и охраны окружающей среды Республики Беларусь в стране образуется свыше 1,5 тыс. видов отходов с широким спектром морфологических и химических свойств. Если рассматривать структуру образования отходов производства без учета отходов переработки калийных руд, то в общей массе велика доля отходов растительного и животного происхождения (30,8%), отходов неорганического минерального происхождения (51,8), а также отходов промышленности, подобных твердым коммунальным отходам (14%). Оставшиеся 3,4% приходятся на отходы химических производств и медицинские отходы [1].
Уровень использования отходов производства в 2008 г. составил 22,3%, увеличившись за год на 1,3%. Большая часть отходов (51,2%) использована на нужды самих предприятий, свыше 48,2% переданы другим предприятиям, реализованы физическим лицам или экспортированы для дальнейшего использования [1].
На территории страны в отвалах и хранилищах накоплено около 870 млн. тонн твердых отходов металлургического, машиностроительного, горнодобывающего и химического производств, а также отходов топливно-энергетического комплекса [1]. Ежегодно в Республике Беларусь образуется около 38 млн. тонн таких отходов в дополнение к накопленным. Фактически - это рукотворные техногенные месторождения, выведенные из хозяйственного оборота материальные ресурсы, многими видами которых страна практически уже не располагает.
По своим: объёму, составу и содержанию полезных компонентов, находящихся в промышленных отходах, техногенные запасы сравнимы с используемыми месторождениями природных ископаемых.
Особую тревогу вызывает накопление десятилетиями токсичных отходов, в том числе содержащих тяжелые металлы. Такие огромные запасы занимают немалые площади.
Сложившаяся ситуация представляет реальную угрозу здоровью современного и будущих поколений страны.
Одним из путей достижения стратегической цели государственной политики в области охраны окружающей среды является максимально полное использование извлеченных полезных ископаемых и добытых биологических ресурсов, а также минимизация отходов и ущерба, наносимого природной среде. До настоящего времени разработка эффективной государственной политики в сфере обращения с отходами не завершена.
Если проанализировать итоги развития экономики в последние годы, то становится очевидным, что механизм нерационального ресурсопотребления не только не остановлен, но и увеличил обороты, поскольку спад в выпуске продукции опережает сокращение потребления сырья и материалов. Вместе с тем прогресс науки и техники позволяет все более рационально использовать материальные ресурсы. Одним из важнейших направлений ресурсосберегающей деятельности является эффективное использование отходов производства.
Отходы производства – разнообразные по составу и физико-химическим свойствам остатки, образующиеся в процессе производства продукции: рудная мелочь, обрезки, стружка и т.п.; балластная часть минерального сырья и топлива, отделяемая при обогащении; зола и шлаки, образующиеся при сжигании топлива и др. Количество отходов зависит от принятой технологии производства, качества исходного сырья, размерности материала, организации производственных процессов.
Технический прогресс позволяет резко сократить отходы производства, а также использовать значительную их часть в качестве сырья для получения продукции. Уменьшение количества отходов или повторное их использование даёт возможность значительно снизить расход сырья и материалов, стоимость продукции и повысить эффективность производства.
Объектом изучения в данной работе являются железосодержащие отходы, образующиеся в Республике Беларусь.
Актуальность данной темы объясняется с одной стороны тем, что запасы железосодержащих сырьевых материалов неуклонно сокращаются, их цена постоянно растет, уменьшается добыча природного железорудного сырья, увеличиваются затраты на его обогащение. С другой стороны – накопленные десятилетиями отходы металлургического, машиностроительного, горнодобывающего и химического производств, топливно-энергетического комплекса на сегодняшний день не уменьшаются, а продолжают расти. Расположены эти отходы вблизи металлургических и химических производств, при их переработке не требуется огромных затрат на их разведку и освоение.
Таким образом, переработка и утилизация отходов, использование их в виде относительно дешевого сырья даст значительное снижение затрат на сырье, повышение качества и конкурентоспособности, а главное, снижение себестоимости готовой продукции. Это также будет способствовать решению экологической проблемы очистки целых регионов, где скопились огромные техногенные месторождения отходов, а так же утилизации текущих накоплений отходов от вышеперечисленных производств.
Решить данную проблему можно с использованием химических методов переработки отходов. В нашем случае, предлагается получать коагулянты для очистки сточных вод.
1 Общие сведения о коагуляции
Исследование процесса коагуляции является областью интересов коллоидной химии.
Слово <коагуляция> происходит от латинского <coagulare>, означающего <собирать вместе>. Коагуляция играет важную роль в процессах водоочистки для удаления взвешенных коллоидных частиц, которые могут придавать воде неприятные вкус, цвет, запах или мутность. Это делается путем добавления к неочищенной воде специальных химических реагентов (коагулянтов). Под действием коагулянтов очень маленькие, чрезвычайно дисперсные коллоидные частички объединяются вместе в большие массы (хлопья), которые затем можно удалить такими методами разделения твердой и жидкой фазы, как осаждение, флотация и фильтрация.
1.1 Основные принципы коагуляции. Если бы в неочищенной воде все взвешенные твердые частицы были достаточно велики, чтобы их можно было легко удалить с помощью известных методов очистки, то обработка химическими коагулянтами не требовалась бы. Однако большая часть взвешенного вещества состоит из очень мелких, чрезвычайно дисперсных твердых частиц, в значительной степени коллоидных. Ввиду малого размера они не поддаются осаждению, флотации или фильтрации, и их приходится предварительно подвергать коагуляции.
Коллоидные частицы. Коллоидные частицы присутствуют практически в любой неочищенной воде. Они являются главной причиной неприятного вкуса, цвета, запаха и мутности воды. Эти частицы могут быть:
- минеральными: осадочные породы, коллоидные глины, гидроокиси и соли металлов
- органическими: гуминовые и фульвиновые кислоты, образующиеся при разложении растительных и животных остатков, красители, поверхностно-активные вещества и т.д.
- биологическими: микроорганизмы (болезнетворные или нет), включая бактерии, планктон, водоросли и вирусы.
Каково бы ни было их происхождение, эти коллоидные частицы очень малы - менее 1 микрона в диаметре. Вследствие этого отношение их поверхности к массе становится настолько большим, что суммарный отрицательный электрический заряд на их поверхности вызывает взаимное отталкивание частиц. Электростатические силы отталкивания препятствуют самопроизвольному слиянию коллоидных частиц и образованию больших масс, легко удаляемых в процессе очистки.
1
 .2 Механизмы коагуляции. Коагуляция представляет собой комплекс химических и физических взаимодействий между отрицательно заряженными коллоидными частицами и катионами, т.е. положительно заряженными химическими реагентами. Она использует различные силы отталкивания и притяжения, которые обеспечивают устойчивость или, наоборот, неустойчивость коллоидной взвеси, а именно:
.2 Механизмы коагуляции. Коагуляция представляет собой комплекс химических и физических взаимодействий между отрицательно заряженными коллоидными частицами и катионами, т.е. положительно заряженными химическими реагентами. Она использует различные силы отталкивания и притяжения, которые обеспечивают устойчивость или, наоборот, неустойчивость коллоидной взвеси, а именно: - силы электростатического отталкивания
- броуновское движение
- силы притяжения Ван дер Ваальса
- силу всемирного тяготения
Коагуляция дестабилизирует коллоидную взвесь посредством двух различных механизмов:
1
 . Нейтрализация заряда. Положительно заряженные коагулянты нейтрализуют отрицательный заряд, окружающий коллоидные частицы. Когда заряд вокруг каждой частицы нейтрализован, они постепенно сближаются, уменьшая свой эффективный радиус, становятся в конце концов неустойчивыми и могут сталкиваться друг с другом. При столкновении частицы соединяются друг с другом за счет водородных связей или, например, сил Ван-дер-Ваальса, образуя большие массы, или хлопья. Энергия перемешивания, применяемая в процессе очистки, увеличивает количество и частоту этих столкновений частиц, усиливая агломерацию твердого вещества и способствуя образованию хлопьев.
. Нейтрализация заряда. Положительно заряженные коагулянты нейтрализуют отрицательный заряд, окружающий коллоидные частицы. Когда заряд вокруг каждой частицы нейтрализован, они постепенно сближаются, уменьшая свой эффективный радиус, становятся в конце концов неустойчивыми и могут сталкиваться друг с другом. При столкновении частицы соединяются друг с другом за счет водородных связей или, например, сил Ван-дер-Ваальса, образуя большие массы, или хлопья. Энергия перемешивания, применяемая в процессе очистки, увеличивает количество и частоту этих столкновений частиц, усиливая агломерацию твердого вещества и способствуя образованию хлопьев.2. Химическое связывание. Образованию хлопьев способствует полимерная природа коагулянтов. Их длинные молекулярные цепочки подхватывают агломерированные частицы, образуют мостики от одной поверхности к другой, связывая вместе отдельные хлопья в крупные, легко удаляемые массы.

Из двух механизмов, участвующих в процессе коагуляции, нейтрализация заряда играет гораздо более важную роль, чем химическое связывание.
Таким образом, коагулянты – вещества, способные вызывать или ускорять коагуляцию. Эффективными коагулянтами для систем с водной дисперсионной средой являются соли поливалентных металлов (алюминия, железа и др.). К числу наиболее распространенных железосодержащих коагулянтов относятся: хлорид железа FeCl3·6H2O, железный купорос FeSO4·7H2O, сульфат железа (III) Fe2(SO4)3·2H2O, хлорированный железный купорос Fe2(SO4)3+FeCl3 и др. Все эти коагулянты получают в химической промышленности с использованием целевых химических соединений. Уменьшить затраты на производство коагулянтов можно используя в качестве сырья отходы производства.
2 Способы обращения с железосодержащими отходами, реализованные в Республике Беларусь
К железосодержащим отходам, образующимся в Республике Беларусь относятся:
- Металлургические шлаки, съемы и пыль
- Шлаки электросталеплавильные
- Шлаки доменные
- Лом огнеупорных изделий
- Бой железобетонных изделий
- Лом и отходы стальные
- Лом и отходы чугунные
- Отходы штамповки и резки, металлическая стружка
- Шлам железосодержащий
- Гальванические шламы
- Кислые травильные растворы отработанные
- Изношенные шины с металлокордом и др.
На рисунке 1 представлена диаграмма, отражающая количество отходов, которое перерабатывается на данный момент в Республике Беларусь. Из диаграммы видно, что 53,9 % от всех перерабатываемых отходов приходится на технологию, предусматривающую одновременную переработку целого ряда отходов: печной бой, металлургический и литейный щебень (брак), металлургические шлаки, съемы и пыль шлаки электропечей лом огнеупорных изделий бетонные обломки, отходы бетона, железобетона отходы от разборки зданий.
Разработанные технологии для переработки индивидуальных отходов, предусматривают переработку (в % от общего количества перерабатываемых отходов):

Рисунок 1 – Количество железосодержащих отходов, перерабатываемых в Республике Беларусь
- Шлаки электросталеплавильные – 40,5 %
- Шлаки доменные – 1,4 %
- Отходы штамповки и резки, металлическая стружка – 1,1 %
- Гальванические шламы – 1,1 %
- Шлам железосодержащий – 0,5 %
- Бой железобетонных изделий – 0,4 %
- Кислые травильные растворы отработанные – 0,4 %
- Лом и отходы стальные – 0,3 %
- Лом и отходы чугунные – 0,2 %
- Металлургические шлаки, съемы и пыль – 0,06 %
- Отходы обрезиненного металлокорда – 0,002 %
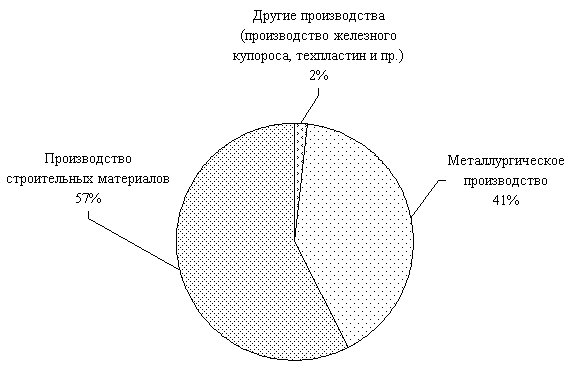
Рисунок 2 – Основные направления применения железосодержащих отходов в Республике Беларусь
Из рисунка 2 видно, что наибольшее количество отходов (1021,8 тыс. т/год – 57%) используется в производстве строительных материалов. На втором месте – использование отходов в металлургическом производстве (730,15 тыс.т/год – 41 %), в других производствах используется всего лишь 2 % отходов (27,54 тыс.т/год).
3 Порядок выполнения работы
Цель работы – получение коагулянтов из железосодержащих отходов для очистки сточных вод.
Железосодержащие отходы, использованные в работе, это отходы, которые образовались в процессах металлообработки, заточки инструмента и пр.
Все механические методы подготовки и обработки поверхности металлических изделий обеспечивают хорошую степень очистки от ржавчины, окалины и механических загрязнений, но неэкономичны и не всегда дают нужный эффект. Поэтому они находят ограниченное применение.
Физические свойства или описание отхода:
Окалина представляет собой пластинки различного размера, твердые, неправильной формы, коричневого цвета с металлическим блеском, без запаха, не растворимые в воде.
Химический состав, мас.%: железо общее 60 - 74, закись железа 5 - 67, окись железа 20-90, кремнезем 0,2 - 5,0, оксид марганца 0,1 - 1,2, оксид кальция 0,1 - 1,5, оксид магния 0,1 - 1,0, глинозем 0,1 - 1,3, углерод 0,05 - 1,5, п.п.п. 0,15 - 2,5.
Шлифовальная пыль представляет собой мелкодисперсный порошок очень мелкого размера. Агрегатное состояние – твердая. Серый цвет с металлическим блеском, без запаха, не растворима в воде.
Химический состав отхода: железо - 29,5548; фосфор - 0,0075; мышьяк - 0,000003; сера природная - 0,009; медь - 0,045; кремний - 0,009; марганец - 0,135; никель - 0,03; хром - 0,03; ржавчина - 0,15; алюминий оксид-глинозём - 48,99969; углерод - 0,03; железо оксид - 21,0001
Железная стружка представляет собой скрученные или ровные пластинки различного размера, твердые, неправильной формы, без запаха, не растворимые в воде.
Химический состав отхода: железо - 96,0565; сера природная - 0,0185; хром - 0,5; марганец - 0,15; фосфор - 0,525; кремний - 0,9; углерод - 1,85.
План эксперимента представлен на рисунке 3.
На 1 этапе получали коагулянты из железосодержащих отходов, собранных на различных предприятиях г.Дзержинска и г.Фаниполь.
Для получения коагулянта использовали соляную кислоту разной концентрации.
Варку коагулянта проводили при повышенной температуре в течение 20 мин.
Полученный коагулянт отфильтровывали на полимерном фильтре.
При обработке отхода соляной кислотой в растворе образуются хлориды железа и растворимая кремниевая кислота:
2FeO·SiO2 + 4HCl → 2FeCl2 + H4SiO4
(Mg, Fe)·SiO4 + 4HCl → MgCl2 + FeCl2 + H4SiO4.
Таким образом, образующийся хлорид железа выступает в качестве коагулирующего агента, а кремниевая кислота – флоккулирующим агентом. Основным свойством растворов кремниевой кислоты является стремление к полимеризации и поликонденсации, что и обуславливает их флокуляционные свойства. Поэтому можно сказать, что полученный нами коагулянт обладает комплексным действием, что увеличивает эффективность его использования при очистке сточных вод.
В полученных коагулянтах фотоколориметрическим методом определяли содержание железа. Фотоколориметрическое определение содержания железа основано на образовании окрашенных комплексов железа с сульфосалициловой кислотой. В слабокислой среде (рН > 4) сульфосалициловая кислота взаимодействует только с ионами Fe3+, образуя комплекс красного цвета, устойчивый при рН 4 – 8. В щелочной среде (рН 8 – 11,5) сульфосалициловая кислота реагирует с ионами Fe3+ и Fe2+, образуя комплекс жёлтого цвета.
Концентрация железа в полученных коагулянтах составляла 12-18 мг/л.
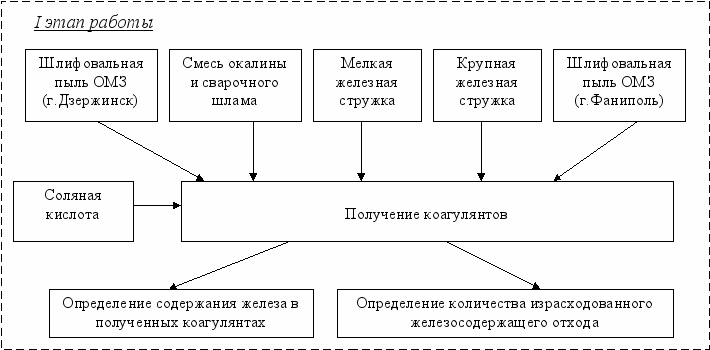
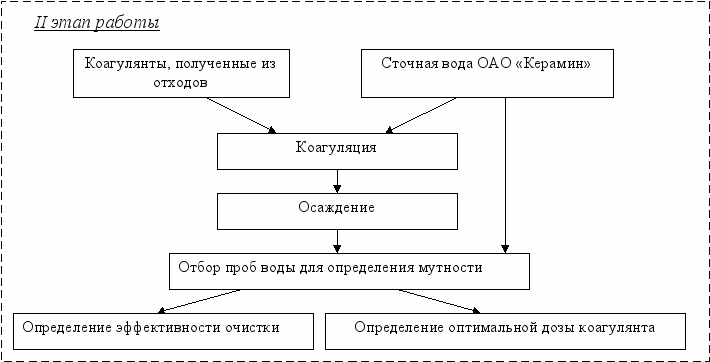
Рисунок 3 – План эксперимента
Количество израсходованного железосодержащего отхода определяли гравиметрическим методом путем взвешивания, высушенного до постоянной массы, отхода до реакции с кислотой и после.
Результаты процентного соотношения потерь отходов после варки коагулянта показали, что потери отходов составляли около 10%.
На втором этапе проводили исследование полученных коагулянтов при очистке сточных вод ОАО «Керамин». Как указывалось выше, коагулянты используются в процессах очистки воды от взвешенных и коллоидных примесей. Одним из источником образования сточных вод, содержащих большое количество взвешенных примесей являются предприятия строительной индустрии. Поэтому для моделирования процессов очистки сточных вод полученными коагулянтами были выбраны сточные воды ОАО «Керамин» – крупнейшего в Европе предприятия по производству керамической плитки и керамического гранита.
Последовательность проведения работы следующая:
1 – измерение мутности неочищенной воды, подлежащей обработке
2 – наполнение измерительных цилиндров неочищенной водой, подлежащей обработке, в количестве 100 мл.
3 – добавление в каждый цилиндр в неразбавленном виде различных, предварительно измеренных количеств коагулянта, полученного из отходов
4 – фаза быстрого перемешивания: гидролиз
5 – фаза медленного перемешивания: образование хлопьев
6 – фаза без перемешивания: осаждение (40 мин.)
7 – взятие проб и оценка надосадочного слоя через 10, 20, 30 и 40 мин.
В качестве критериев оценки использовали:
- размер хлопьев: визуальная оценка размера и роста хлопьев в фазах перемешивания
- мутность надосадочного слоя в течение всей фазы осаждения (построение зависимостей: мутность = f[доза коагулянта] и мутность = f [время осаждения])
- эффективность очистки (построение зависимостей: эффективность = f[доза коагулянта] и эффективность = f [время осаждения] и т.д.
Методики контрольного анализа в стаканах, описанные выше, приведены только для примера. Программа реального проведения контрольного анализа в стаканах должна основываться на специфических условиях каждого конкретного водоочистного сооружения. При применении конкретной продолжительности и скорости перемешивания и конкретной продолжительности осаждения метод контрольного анализа в стаканах позволяет очень точно определить типы и дозировку коагулянта, необходимые для наиболее эффективного и экономичного получения очищенной воды желаемого качества. Поэтому в ходе проведенных исследований было обосновано:
- какой из полученных коагулянтов наиболее целесообразно использовать для очистки сточных вод ОАО «Керамин»
- какая доза введения коагулянта в очищаемую воду
- время, требуемое для отстаивания с коагулировавших примесей.
Результаты проведенных исследований, представлены на графиках (см. приложение 1-5) и в таблице (см. приложение 6).
На основании полученных результатов можно сделать вывод, что для получения коагулянтов для очистки сточных вод можно использовать все отходы, которые использовали в ходе проведенных исследований. Полученные результаты показывают, что эффективность очистки воды полученными коагулянтами отличается незначительно: от 94 до 98 %. Однако, наиболее целесообразно использовать отходы ОМЗ (г.Фаниполь) – шлифовальную пыль. При этом оптимальная доза коагулянта составляет 1 мл, а время отстаивания обработанной воды – 20 минут.
Таким образом, результаты, полученные в работе, свидетельствуют о целесообразности химической переработки железосодержащих производственных отходов. Полученные при этом коагулянты эффективно применять в процессах физико-химической очистки сточных вод от взвешенных и коллоидных примесей.
Список использованных источников
1 Скурлатов Ю.И. Введение в экологическую химию. – М.: Высшая школа, 1999. – 410 с.
2 Состояние природной среды Республики Беларусь. Экологический бюллетень за 2008 г. // Официальный сайт Министерства природных ресурсов и охраны окружающей среды Республики Беларусь. minpriroda.by
3 Большая Советская энциклопедия: на 3 CD. – Научное издательство «Большая Российская энциклопедия», 2002. – CD № 2.
4 Химическая энциклопедия: в 5 т. – М.: Советская энциклопедия, 1990, 2 т. – 671 с.
5 Хомченко, Г.П. Химия: учебник / Г.П. Хомченко. – М.: Высшая школа, 1998. – 368 с.
6 Орлов, Д.С. Экология и охрана биосферы при химическом загрязнении / Д.С. Орлов, Л.К. Садовникова, И.Н. Лозановская – М.: Высшая школа, 2002. – 334 с.
7 Кашковский, В. И. Способ получения алюминий-железосодержащих коагулянтов из шламовых отходов глиноземного производства / В.И. Кашковский, В.В. Войновский, Л.П. Матяш // Сталь, № 1, 2001. – С. 9-11.
8 Голдаевич, Е.Л. Очистка промышленных стоков при помощи электрогенерированного коагулянта, получаемого из отходов железа / Е.Л. Голдаевич, Ю.С. Савинкин // Экономика, экология и общество России в 21-м столетии. С-Петербург. – СП-б: ТГУ, 2003. – С.273-274.
9. Методические рекомендации по разработке проекта нормативов предельного размещения отходов для теплоэлектростанций, теплоэлектроцентралей, промышленных и отопительных котельных. Санкт-Петербург 1998 г
10 Корте Ф., Бахадир М., Клайн В. и др. Экологическая химия / Под ред. Ф. Корте. – М.: Мир, 1997. – 396 с.
