Практикум по экологическому мониторингу окружающей среды Учебное пособие
| Вид материала | Практикум |
- Г. В. Плеханова (технический университет) М. А. Пашкевич, В. Ф. Шуйский экологический, 1176.09kb.
- В. Н. Масляев охрана окружающей среды учебное пособие, 1544.73kb.
- Черноморец Альберт Евгеньевич доктор юридических наук, профессор Алексеев Алексей Павлович, 1348.21kb.
- 1. 13. Федеральная служба по гидрометеорологии и мониторингу окружающей среды, 60.92kb.
- Мониторинг загрязнения окружающей среды на сети наблюдений гу «Алтайский цгмс», 65.15kb.
- Практикум для вузов Москва владос губарева Л. И., Мизирева О. М., Чурилова Т. М., Практикум, 2037.65kb.
- Учебное пособие санкт-петербург 2 004 удк 669. 2/8; 669. 4 (075. 80) Ббк 34., 990.55kb.
- Учебное пособие Санкт-Петербург 2000 удк 681, 344.56kb.
- Учебное пособие содержит лекции по методологии истории экономики, по развитию экономических, 90.36kb.
- Учебное пособие Миронова Т. Л., Подсолонко Е. А. Менеджмент окружающей среды. Симферополь,, 1405.95kb.
- запахи искусственного происхождения, вызываемые примесями некоторых промышленных сточных вод. Их называют по соответствующим веществам: фенольный, хлорфенольный, камфорный, бензинный, хлорный и т.д.
Интенсивность запаха оценивают по 5-бальной шкале, приведенной в табл. 3 (ГОСТ 3351).
Таблица 3
Шкала интенсивности запахов в воде
Оценка интенсивностизапаха | Интенсивность запаха | Характер проявлениязапаха |
| 0 | никакого запаха | отсутствие ощутимого запаха |
| I | очень слабая | запах не замечаемый потребителем, но об-наруживаемый при тщательном исследовании (при нагревании воды) |
| II | слабый | запах, обнаруживаемый потребителем, если обратить на это внимание |
| III | заметная | запах,легко обнаруживаемый; вода неприятна для питья |
| IV | отчетливая | запах, обращающий на себя внимание, может заставить воздержаться от питья |
| V | очень сильная | запах, настолько сильный что делает воду непригодной для питья |
Чистые природные воды запахов не имеют.
Вкус и привкус также определяют органолептически по 5-бальной шкале (ГОСТ 3351 ). Различают 4 вида вкуса: соленый, горький, сладкий, кислый. Остальные виды вкусовых ощущений называют привкусами ( щелочной, железистый, металлический, вяжущий и др.)
Вкус и запах воды, предназначенной для питьевых целей при 200С не должны быть более 2 баллов.
Аппаратура: коническая колба 150 – 250 мл; часовое стекло; электроплитка.
Материал: вода водоема.
Ход определения. Исследуемой водой наполняют 2/3 объема колбы емкостью 150 – 250 мл, накрывают часовым стеклом и встряхивают вращательными движениями. Затем открывают колбу и определяют запах. Оценку интенсивности запаха проводят при 600С, для чего воду в колбе нагревают.
Определение вкусов и привкусов ведется с заведомо безопасной в эпидемиологическом отношении водой при 200С. Воду набирают в рот малыми порциями и задерживают на 3 – 5 сек, не проглатывая. Отмечают наличие вкуса ( соленый, горький, кислый, сладкий ) или привкуса и их интенсивность в баллах по шкале, аналогично определению интенсивности запаха.
- . Определение цветности и окраски воды
Цветность – показатель качества воды, характеризующий интенсивность ее окраски и обусловленный содержанием окрашенных соединений.
Цветность природных вод обусловлена наличием в воде гуминовых и фульвокислот, их солей и соединений железа. Ее определяют после предварительного отстаивания пробы.
Можно определять цветность качественно ( ГОСТ 1030 ), характеризуя цвет воды в пробирке высотой 10 – 12 см, рассматривая ее сверху на белом фоне при достаточном боковом освещении. Например, слабо-желтая, желтая, интенсивно-желтая, коричневая, красно-коричневая и т.д.
Однако, чаще используют метод количественного определения цветности (ГОСТ 3351).
Измерение проводят визуально- колориметрическим сравниванием цвета пробы со стандартным раствором, имитирующим природную цветность и приготовленным из бихромата калия и сульфата кобальта в разных соотношениях (табл. 4 ).
Прямого соответствия между цветностью и количеством веществ, вызывающих окраску нет, поэтому степень цветности выражают не в мг/л , а в градусах хромово-кобальтовой шкалы.
Предельно допустимая величина цветности в питьевых водах 200 по хромово- кобальтовой шкале цветности.
В отдельных случаях, по согласованию с органами санитарного надзора, допускается цветность до 350.
Материал: вода водоема.
Ход определения. Приготавливают шкалу цветности, для чего смешивают раствор №1
( 0,0875 г K2Cr2O7 + 2 г CoSO4•7H2O + 1мл H2SO4конц + дистиллированная вода до 1 л ), который соответствует цветности 500 и раствор №2 ( 1 мл H2SO4конц, доведенный дистиллированной водой до объема 1 л ).
Таблица 4
Соотношение растворов для приготовления шкалы цветности.
-
Раствор №1, мл
0
1
2
3
4
5
6
8
10
12
14
Раствор №2, мл
100
99
98
97
96
95
94
92
90
88
86
Цветность
0
5
10
15
20
25
30
40
50
60
70
Растворы наливают в цилиндры емкостью 100 мл. и получают шкалу цветности.
Шкалу хранят в темном месте и через 1 – 2 месяца ее заменяют.
В цилиндр наливают 100 мл профильтрованной воды и сравнивают со шкалой цветности (рис.1), просматривая цилиндры сверху на белом фоне.
У сточных вод определяют окраску, которая обусловлена, в основном, красителями, используемыми особенно широко на предприятиях легкой промышленности.
Окраска определяется визуально в фильтрованных пробах в цилиндрах из бесцветного стекла ( розовая, слабо- желтая , буроватая и т.д. ), интенсивность окраски характеризуют степенью разбавления исследуемой воды дистиллированной , при которой окраска исчезает. Цилиндры, в которые наливают исследуемую и дистиллированную воду просматривают сверху на белом фоне. Результат записывают отношением, например, 1 : 500 ( 1 часть исследуемой пробы, 500 - сумма 499 частей разбавляющей воды и 1 части исследуемой ).
Рис. 1. Цилиндры для колориметрирования
Цветность можно более точно определить на фотоколориметре. Для этого строят градуировочный график по хромово-кобальтовой шкале цветности. Растворы с различной цветностью фотометрируют в кювете на 5 см в синей части спектра относительно профильтрованной дистиллированной воды.
- Определение мутности воды
Мутность природных вод обусловлена присутствием нерастворимых и коллоидных веществ неорганического ( глина, песок, гидроксид железа ) и органического ( илы, микроорганизмы, планктон, нефтепродукты ) происхождения.
Качественное определение степени мутности проводят визуально- по степени мутности столба высотой 10 – 12 см в мутномерной пробирке. Пробу описывают следующим образом: прозрачная; слабо опалесцирующая; опалесцирующая; слабо мутная; мутная; очень мутная (ГОСТ 1030)
Количественно мутность определяют фотометрически: турбидиметрически- по ослаблению проходящего света или нефелометрически – по светорассеянию в отраженном свете (ИСО 7027). Для этого сравнивают пробу со стандартным раствором, мутность которого создается внесением в дистиллированную воду стандартной суспензии диоксида кремния SiO2 или каолина
( тонкодисперсной породы продуктов выветривания полевых шпатов ) . Результаты выражают в мг/л.
Мутность питьевой воды согласно санитарным нормам, действующим в нашей стране не должна превышать 1,5 мг/л по каолину.
Аппаратура, реактивы: фотоэлектроколориметр; цилиндр на 100 мл; стандартные суспензии каолина.
Материал: вода водоема.
Ход определения. Мутность воды определяют турбидиметрически путем сравнения проб исследуемой воды со стандартными суспензиями ( 0,1; 0,2; 0,3; 0,4; 0,5; 1,0; 1,5, 5,0 мг/л каолина ). По оптическим плотностям стандартных суспензий и соответствующим им концентрациям строят калибровочный график. Для измерений используют ФЭК с зеленым светофильтром.
- Определение прозрачности воды
Прозрачность, или светопропускание воды обусловлена ее цветом и мутностью, т.е. содержанием в ней различных окрашенных и минеральных веществ. Прозрачность определяют наряду с мутностью, особенно в тех случаях, когда вода имеет незначительную окраску и мутность, которые затруднительно обнаружить.
Прозрачность определяют в цилиндрах из бесцветного стекла высотой 30 – 50 см с плоским дном (рис.2). Мерой прозрачности служит высота столба воды, через который можно прочитать текст, напечатанный специальным шрифтом (средней жирности, высотой 3,5 мм ) или же четко видеть крест, нанесенный черными линиями толщиной 1 мм ( ИСО 7027 ).Результаты выражают в сантиметрах с указанием способа измерения ( “по шрифту Снеллена» или “по кресту”). Воды, подаваемые для питьевого водоснабжения должны иметь прозрачность не менее 30 см.
Аппаратура: цилиндр с плоским дном; шрифт, высота букв которого составляет 3,5 мм, а ширина линий букв – 0,35 мм.
Материал: вода водоема.
Ход определения. Исследуемую воду наливают в цилиндр, который устанавливают на высоте 4см над штифтом и через краник сливают воду до тех пор, пока можно будет прочитать отдельные слова текста.
Рис. 2 Цилиндр для определения прозрачности воды
Таблица 5
Взаимосвязь прозрачности с содержанием взвешенных веществ
| Прозрачность | По шрифту Снеллена | Содержание взвеси, мг/дм3 |
| Прозрачная Слабомутная Среднемутная Мутная Очень мутная |
25 – 30 20 – 25 10 – 20 < 10 | < 5 5 – 20 20 – 50 50 – 300 > 300 |
При содержании взвешенных веществ менее 3мг/л определение прозрачности становится затруднительным из-за применения цилиндра большой высоты. В этом случае определяют величину, обратную прозрачности – мутность воды (см. раздел 1.3).
Прозрачность природных вод также определяют по опускаемой в водоем белой пластине определенных размеров, известной как диск Секки (ИСО 7027). Диск Секки представляет собой диск, отлитый из бронзы, покрытый белой краской и прикрепленный к цепи ( шнуру ).диск обычно имеет диаметр 200 мм с шестью отверстиями, каждое диаметром 55 мм, расположенными по кругу диаметром 120 мм. Его опускают в воду настолько, чтобы он был едва заметен. Измерения проводят с моста, обрывистого берега или наклонных над водой деревьев.
Контрольные вопросы
Как производится определение физических и органолептических свойств воды? Что такое балльная система оценки вкуса и запаха?
- Как определяются прозрачность, мутность и цветность воды?
- При определении цветности воды ее окраска совпала с 5-м цилиндром хромовокобальтовой шкалы. Какова цветность воды и соответствует ли она нормам?
- Какой из показателей качества воды определяют с помощью текста, напечатанного специальным шрифтом?
- Какому баллу соответствует заметная интенсивность запаха питьевой воды?
- Какая цветность и прозрачность допускается нормативами для питьевой воды?
- Дайте гигиеническую оценку органолептическим свойствам воды из шахтного колодца: прозрачность – более 30 см, цветность – 300, запах и вкус – землистые, 2 балла.
- Для чего при определении показателей качества воды используется каолин?
- Какой из показателей качества воды характеризуется степенью разбавления исследуемой воды дистиллированной?
Работа №2. Определение в воде взвешенных и оседающих веществ и сухого остатка
- Определение в воде взвешенных веществ
Взвешенные вещества ( грубодисперсные примеси ) – количество загрязнений, которые задерживаются на бумажном фильтре при фильтрации пробы. Они представляют частицы глины, песка, ила, планктона и различных микроорганизмов.
Для фильтрования загрязненных вод используют фильтры типа
“ белая лента” или “синяя лента”, а при исследовании воды с загрязнением не более 25 мг/л – тонкие мембранные фильтры.
Аппаратура: аналитические весы; сушильный шкаф; фильтры.
Материал: вода водоема.
Ход определения. Фильтр со взвешенными веществами высушивается при 1050С до постоянной массы, количество примесей определяют гравиметрическим методом по разнице массы фильтра до и после фильтрации. Этот показатель используют для расчета отстойников и определения количества образующихся осадков. В городских сточных водах концентрация взвешенных веществ достигает 100 - 500 мг/л.
- Определение в воде оседающих веществ
Оседающие вещества – часть взвешенных веществ, которые оседают на дно отстойного цилиндра за 2 часа отстаивания. Время отстаивания определено экспериментально и является оптимальным.
Осадок характеризуют по следующим параметрам:
- нет, незначительный, заметный, большой с указанием толщины слоя в мм;
- хлопьевидный, илистый, песчаный;
- по цвету: серый, бурый, черный и т.д.
Аппаратура: цилиндры Лысенко (рис. 3) объемом 0,5 или 1 л, нижняя часть их представляет пробирку с тонкой градуировкой до 0,1 мл.
Материал: вода водоема.
Ход определения. Исследуемую воду наливают в цилиндр Лысенко и через 2 часа отстаивания характеризуют осадок по внешнему виду и указывают толщину слоя в мм. Затем осадок переносят в стакан и определяют оседающие вещества по массе также как и взвешенные вещества. В городских сточных водах оседающие вещества составляют 65-75% взвешенных веществ по массе.
Рис. 3. Цилиндр Лысенко
2.3. Определение сухого остатка
Сухой остаток характеризует общее содержание в воде растворенных минеральных и частично органических веществ, температура кипения которых превышает 105 - 1100С, нелетучих с водяным паром и не разлагающихся при этой температуре.
В водоемах - источниках водоснабжения сухой остаток не должен превышать 1000 мг/л. Употребление человеком воды с повышенным солесодержанием вызывает различные заболевания.
Лишь в отдельных случаях, по согласованию с органами санитарно-эпидемиологической службы допускается его содержание до 1500 мг/л.
Сухой остаток определяют гравиметрическим методом, основанном на определении веса высушенного остатка, полученного после выпаривании пробы. Перед определением пробу необходимо фильтровать либо отстаивать для отделения от взвешенных веществ.
Аппаратура: муфельная печь; тигли; мерный цилиндр; аналитические весы.
Материал: вода водоема.
Ход определения. Пробы воды выпаривают и высушивают остаток при 1100С до постоянной массы. Величину сухого остатка ( в мг/л ) вычисляют по формуле:
МСО =
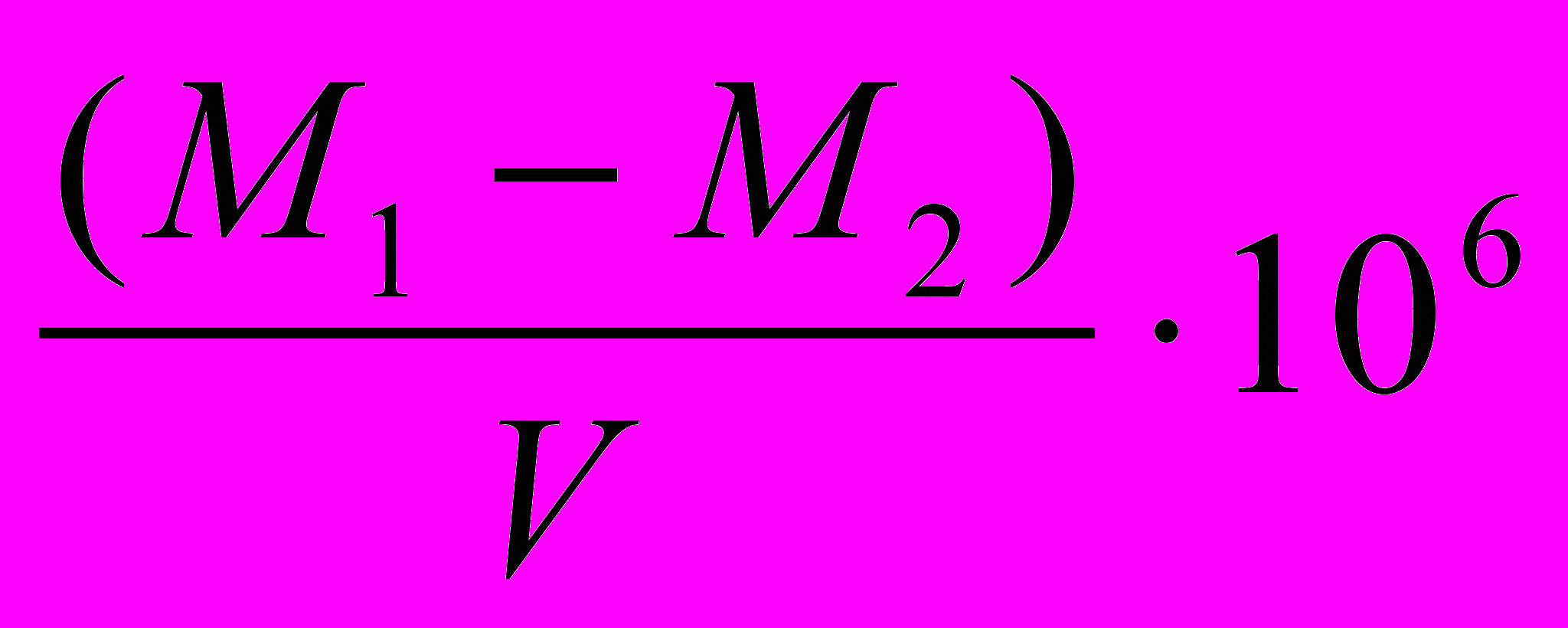 ,
,где : М1, М2 – масса тигля с сухим остатком и пустого тигля, мг
V – объем воды, взятой для определения, мл
106 – коэффициент пересчета единиц измерения из г/мл в мг/л.
Для многих технологических целей определяют потери при прокаливании и зольность ( %). Зольность характеризует содержание примесей, не улетучивающихся при температуре «красного каления». Для этого проводят прокаливание при температуре 500 – 6000С . Выгорают, т.е. улетучиваются в виде оксидов, углерод, водород, азот, сера и другие примеси. Остаток, называемый золой, после охлаждения взвешивают. Потери при прокаливании - это абсолютное количество улетучившихся примесей (мг/л).
Контрольные вопросы
- Как определяется сухой остаток и каково гигиеническое значение этого показателя?
- Для определения какого показателя качества воды проводят ее отстаивание?
- Для определения каких показателей качества воды используют выпаривание пробы?
- Что такое зольность и как она определяется?
Работа №3. Определение показателей, характеризующих химический состав воды
Вода хозяйственно-питьевого назначения отвечает гигиеническим требованиям, если она имеет постоянный химический состав, концентрации минеральных и органических веществ не превышают предельно допустимых, нет косвенных показателей ее загрязнения, отсутствуют ядовитые вещества.
К химическим показателям качества воды относят следующие: содержание ионов водорода, кислотность, щелочность, содержание растворенных газов, солей, обусловливающих жесткость, химическая потребность в кислороде ( ХПК ), биохимическая потребность в кислороде ( БПК ), а также содержание железа, хлоридов, сульфатов, фосфатов и ионов металлов, определение которых проводят по стандартным химическим методикам.
3.1. Определение активной реакции среды ( рН )
Водородный показатель рН представляет собой отрицательный логарифм концентрации водородных ионов в растворе: рН = - lg [H+]
Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины рН зависят развитие и жизнедеятельность водных растений, устойчивость различных форм элементов, агрессивное действие воды на металлы и бетон.
Источником ионов Н+ являются:
- соли тяжелых металлов, попадающих в воду и подвергающиеся в ней гидролизу;
- гумусовые кислоты, присутствующие в почвах;
- кислые сточные воды и др.
Величина рН в природных водах варьирует от 4,6 до 8,5; в речных водах она составляет 6,5 – 8,5; в атмосферных осадках 4,6 – 6,1; в болотах 5,5 – 6,0; в морской воде 7,9 – 8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой для большинства речных вод рН = 6,8 – 7,4, а летом 7,4 – 8,2.
Для всего живого в воде (за исключением некоторых кислотоустойчивых бактерий) минимально возможная величина рН = 5.
В питьевой воде допускается рН = 6,0 – 9,0; в воде водоемов хозяйственно-питьевого и культурно-бытового назначения - 6,5 – 8,5.
Для определения рН используют потенциометрию и визуальную колориметрию. Потенциометрия предполагает измерение водородного показателя с помощью рН-метров, имеющих достаточно высокую точность (до 0,1 единиц рН и менее ).
В визуальной колориметрии для измерений используют тест-комплекты, основанные на реакции индикатора с водородными ионами с изменением окраски раствора. Точность тест-комплектов около 0,5 единиц рН.
В некоторых случаях (для быстрого анализа неизвестных растворов ) используют индикаторную бумагу, имеющую точность определения рН не более ±1, что недостаточно для анализа питьевой и природной воды.
Аппаратура: рН-метр; эталонные растворы; дистиллированная вода; стаканчики на 200мл – 4 шт.; фильтровальная бумага.
Материал: воды грунтовые, поверхностные и сточные.
Ход определения. Потенциометрический метод основан на измерении разности потенциалов на границах между внешней поверхностью стеклянной мембраны электрода и исследуемым раствором с одной стороны и внутренней поверхностью мембраны и стандартным раствором - с другой стороны. Стандартный раствор имеет постоянную активность ионов водорода, поэтому потенциал на внутренней поверхности мембраны не меняется . Сдвиг рН на единицу вызывает изменение потенциала электрода на 58,1 мВ при 200С. Метод отличается высокой точностью до 0,02. Результат определения не зависит от окраски, мутности, присутствия окислителей или восстановителей. Для измерения рН можно пользоваться рН-метрами различных марок. Перед началом работы ознакомиться с инструкцией на прибор. Определить рН поверхностной, грунтовой и сточной воды.
Контрольные вопросы
- Что такое рН?
- На каком принципе основано определение рН?
- Какие требования по величине рН предъявляются к воде хозяйственно-питьевого назначения?
3.2. Определение биохимического потребления кислорода
В природной воде водоемов всегда присутствуют органические вещества, которые разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием двуокиси углерода. На окисление расходуется растворенный в воде кислород и его убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
БПК – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1л воды органических веществ в аэробных условиях, без доступа света, при 200С, за определенный период в результате протекающих в воде биохимических процессов.
Методом биохимического потребления кислорода определяют количество растворенного кислорода (в миллиграммах на 1 л воды), которое требуется для окисления органического вещества аэробными бактериями.
Время, нужное для полной минерализации органического вещества, зависит при прочих равных условиях от природы органических веществ, содержащихся в испытуемой жидкости. К легкоокисляющимся («биологически мягким») веществам относятся формальдегид, сахара, спирты, фенолы; к тяжело окисляющимся («биологически жестким») – неионогенные ПАВ, гидрохинон; к нормально окисляющимся – нафтолы, крезолы, анионогенные ПАВ, гидрохинон и др.
Обычно определяют БПК за 5 суток инкубации ( БПК5 ), однако содержание некоторых соединений более нормативно характеризуется величиной БПК за 10 суток
( БПК10 ) или за период полного окисления ( БПКполн.).
В поверхностных водах величина БПК5 колеблется в пределах от 0,5 – 5,0 мг/л; она подвержена сезонным и суточным изменениям, что связано с изменением температуры и биохимической активности микроорганизмов.
Норматив на БПКполн. не должен превышать: для водоемов хозяйственно-питьевого водопользования- 3мг/л, для водоемов культурно-бытового водопользования – 6 мг/л, а БПК5 для тех же водоемов 2 мг/л и 4 мг/л соответственно.
Определить истинное значение полного БПК сложно, так как при малом содержании в пробе органических веществ одновременно с их окислением идет процесс нитрификации.
Нитрификация протекает под воздействием особых нитрифицирующих бактерий. Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно присутствуют в загрязненных природных и некоторых сточных водах, и тем самым способствуют превращению азота сначала из аммонийной в нитритную, а затем и нитратную формы по уравнениям:
2NH4+ + 3O2 = 2HNO2 + 2H2O + 2H+ + Q
2HNO2 + O2 = 2HNO3 + Q
Количество кислорода, пошедшее на нитрификацию, может в несколько раз превышать количество кислорода, требуемое для биохимического окисления органических веществ. Нитрификация начинается примерно на седьмые сутки инкубации, поэтому при определении БПК за 10 и более суток необходимо вводить в пробу ингибиторы, подавляющие жизнедеятельность нитрифицирующих бактерий. Для этих целей используют тиомочевину, которую вводят в пробу или в разбавляющую воду в количестве 0,5 мг/мл.
Предлагаемый метод определения БПК до появления азота нитритов в количестве 0,1 мг/л с достаточной полнотой характеризует ход процесса биохимического окисления ( ИСО 5815 ).
Определение БПК производится в натуральной или в разбавленной пробе воды по разнице между содержанием растворенного кислорода в склянке в момент постановки опыта и после определенного периода инкубации. Разбавляющую воду добавляют в том случае, если в пробе очень много органических веществ. Пробы воды для определения БПК не консервируют, а анализируют сразу после отбора.
3.2.1.Определение БПК в натуральной пробе воды (без разбавления)
Для определения БПК воды с предполагаемым потреблением кислорода до 6 мг/л пробу воды отбирают в бутыль емкостью 2 л. Температура воды должна быть 20±1°С; если температура иная, то в лаборатории воду подогревают на водяной бане или
охлаждают до требуемой температуры и сильно встряхивают в течение 10 мин для насыщения кислородом воздуха. Если при 20°С содержание растворенного кислорода выше 9 мг/л, что наблюдается во время цветения воды в водоеме (т. е. во время сильного развития водорослей), то жидкость перед анализом фильтруют через планктонную сеть), а избыток кислорода удаляют, так как при инкубации возможно выделение газообразного кислорода и выбрасывание пробки. Для удаления избытка кислорода применяется один из следующих приемов: 1) отсасывание воздуха из бутыли, заполненной жидкостью наполовину (после того как вода примет температуру 20°С), встряхивание склянки ускоряет выделение кислорода;
2) пропускание через воду сжатого воздуха. При наличии в речной воде взвеси БПК определяется как без отстаивания, так и в пробе, предварительно отстоенной в течение 30 мин непосредственно на месте отбора проб.
Аппаратура, реактивы: кислородные калиброванные склянки для инкубирования проб; чашки Петри; термостат-инкубатор, обеспечивающий поддержание температуры (20±1)0С; оксиметр.
Материал: поверхностная вода водоема.
Из бутыли с помощью сифона воду наливают в 5 калиброванных склянок с притертыми пробками емкостью 200—250 мл, предварительно дважды ополоснутые испытуемой водой; затем стеклянную трубку сифона опускают на дно склянки и после вытеснения воды (в трехкратном объеме) наполняют склянки водой доверху и немедленно закрывают стеклянной пробкой, чтобы не оставалось пузырька воздуха. Затем эту же воду наливают в колпачки от склянок и, перевернув последние вверх дном, вставляют их в колпачки, вытесняя из последних воду, чтобы пузырьки воздуха из них попали в колпачки).
В одной из склянок с исследуемой водой тотчас же определяют растворенный кислород. Ход определения см. работу 3.4. Все остальные склянки помещают в нормальном положении в термостаты и хранят при 20°С (с колебаниями ±1°) в течение определенного времени (2, 5, 7, 10 суток).
Время между заполнением склянок и фиксированием кислорода при определений его концентрации в нулевых пробах не должно превышать 16 мин.
3.2.2. Определение БПК с разбавлением исследуемой воды
При определении БПК загрязненных вод растворенного кислорода может не хватить для покрытия потребности воды в нем, в этом случае воду перед началом определения разбавляют дистиллированной водой, содержащей биогенные элементы.
Степень разбавления должна обеспечить остаточное содержание растворенного кислорода в конце инкубации не менее 3—4 мг/л и убыль кислорода 4—5 мг/л. Когда величина БПК неизвестна, необходимо делать несколько разбавлений, например: 1:1, 1:2, 1:4, потребность в больших разбавлениях может иметь место для очень сильно загрязненных речных вод. В таких случаях разбавление приблизительно можно установить по окисляемости; кратность разбавления составляет 3/4 величины содержания кислорода, определенного по перманганатной окисляемости.
Аппаратура: см. работу 3.4.1.
Реактивы. Разбавляющая вода готовится из дистиллированной воды, которая не должна содержать медь и свинец более 0,01 мг/л, цинк свыше 1 мг/л (ионы этих металлов могут попасть в дистиллированную воду из материала перегонного куба). Вода не должна так же содержать едкие щелочи, кислоты, активный хлор, хлорамины и другие бактерицидные вещества. Дистиллированную воду выдерживают в бутылях, закрытых марлей в течение нескольких дней, при комнатной температуре (целесообразно, чтобы температура воды была 20°С). Сосуды, применяемые для этой воды, использовать для других целей нельзя (даже для приготовления разбавляющей воды). Перед применением разбавляющей воды в нее добавляют по 1 мл на 1 л следующие растворы:
а) фосфатный буферный раствор (запасной раствор). В 500 мл дистиллированной воды растворяют 8,5 г КН2РО4; 21,75 г К2НРО4; 33,4 г Na2HPО4∙7H2O; 11,7 г NH4C1 и затем объем доводят до 1 л. Величина рН этого раствора должна быть 7,2;
б) раствор сульфата магния. В дистиллированной воде растворяют 22,5 г MgSO4∙7H2O и разбавляют до 1 л;
в) раствор хлорида кальция. В дистиллированной воде растворяют 27,5 г хлорида кальция и разбавляют до 1 л;
г) раствор хлорида железа (III). В дистиллированной воде растворяют 0,25 г FeCl3∙6H2O и разбавляют до 1 л.
После прибавления солей воду хорошо перемешивают, но не аэрируют.
Материал: вода водоема. В случае транспортировки проб летом вода должна иметь температуру, близкую к нулю, для чего бутыль с водой помещается в экскурсионный ледник, а зимой воду предохраняют от замерзания, накладывая на бутыль пузырь с теплой водой. При наличии взвешенных веществ содержимое бутыли перемешивают перед каждым заполнением легким вращательным движением.
Ход определения. Мерную колбу посредством сифона заполняют до половины разбавляющей водой, прибавляют точно отмеренное (пипеткой, мерной колбой или мерным цилиндром) количество исследуемой воды и доливают до метки разбавляющей водой. Колбу закрывают и содержимое тщательно перемешивают, переворачивая колбу 15 - 16 раз.
В связи с тем, что исследуемая вода может содержать небольшое количество бактерий, для интенсификации процесса можно сконцентрировать бактериальную биомассу на мембранном фильтре № 3, предварительно профильтровав воду через бумажный фильтр для удаления планктонных организмов. На 1 л разбавляющей воды достаточно обычно профильтровать 100 мл исследуемой воды. Сконцентрированную на фильтре биомассу смывают в стаканчик небольшим количеством воды и переливают в колбу с разбавляющей водой. Воду, обогащенную бактериями, описанным выше способом разливают в 5 калиброванных склянок (таким же способом, как при определении БПК в натуральной воде без разбавления). Одновременно наполняют разбавляющей водой 5 калиброванных склянок. Каждой пробе испытуемой воды должна соответствовать одна склянка с разбавляющей водой.
В одной из склянок с испытуемой водой и в одной из склянок с разбавляющей водой (нулевые пробы) тотчас же определяют растворенный кислород.
Все остальные склянки помещают в термостат и хранят при температуре 20±10С.
Через 2, 5, 7, 10 суток от начала инкубации из термостата вынимают по одной склянке с испытуемой и с разбавляющей водой и определяют в них растворенный кислород и содержание нитритов. Нитриты определяют в воде, налитой в колпачок склянки, который снимают так же, как надевали (т. е. перевернув склянку вверх дном). Если в пробе начался
процесс нитрификации, что обнаруживается по появлению в воде нитритов в концентрации, превышающей 0,1 мг/л, то дальнейшее определение БПК не проводят. Если следы нитритов появляются на вторые или пятые сутки, то следующее определение производится через 4 и 7 суток соответственно. Если в лаборатории нет склянок с пришлифованными стеклянными колпачками, то для контроля за процессом нитрификации в термостат можно поставить дополнительно 8 неградуированных склянок любого размера, наполненных той же водой (испытуемой и разбавляющей), и в них определять содержание нитритов после каждого срока инкубации. Все склянки ставятся в термостате в сосуд, наполненный небольшим количеством дистиллированной воды, пробками вниз, так, чтобы горлышко склянок было погружено в воду, которая образует водяной затвор. Дистиллированную воду в сосуде обновляют при каждом определении. Если содержание азота нитритов в склянке будет больше 0,1 мг/л, определение растворенного кислорода производится с азидом натрия, либо по одному из следующих методов: 1) с сульфаминовой кислотой или с раствором мочевины (вариант А);
2) с бикарбонатом натрия (вариант Б).
Вариант А. В кислородную склянку, заполненную доверху пробой, добавляют 2 мл раствора сульфата марганца (40%), при этом наполненную пипетку погружают до самого дна кислородной склянки. Затем открывают верхний конец пипетки и ее медленно вынимают. Другой пипеткой прибавляют к пробе 2 мл раствора едкого кали (70%). Кончик пипетки при этом опускают только под уровень воды в горлышке кислородной склянки. Склянку осторожно закрывают, чтобы под пробкой не образовались пузырьки воздуха. Содержимое хорошо перемешивают (переворачиванием склянки) до образования хлопьевидного хорошо выпадающего осадка. Осадку дают отстояться и затем жидкость над осадком сифонируют, а к осадку добавляют 5 мл разбавленной серной кислоты. Полученный раствор переливают в колбу, склянку ополаскивают 3 раза небольшими порциями дистиллированной воды, которые вливают в ту же колбу. Затем в колбу добавляют 0,3 мл 40%-ного раствора сульфаминовой кислоты или 0,3 мл 40%-ного раствора мочевины и после этого 2 мл 15%-ного раствора KJ. Через 5 мин раствор титруют 0,05Н раствором тиосульфата натрия с индикатором крахмалом.
Вариант Б. После растворения осадка гидроокиси марганца в колбу для титрования прибавляют 1 г бикарбоната натрия и оттитровывают выделившийся йод тиосульфатом натрия.
Надежным должно считаться определение БПК в тех пробах, где нитрификация только началась. Для большей достоверности получаемых результатов рекомендуется на инкубацию ставить параллельно 2 склянки; из найденных величин вычисляют среднюю.
Определение и расчет количества растворенного кислорода в пробе.
Расчет.
БПКполн вычисляют по формуле
БПКполн =
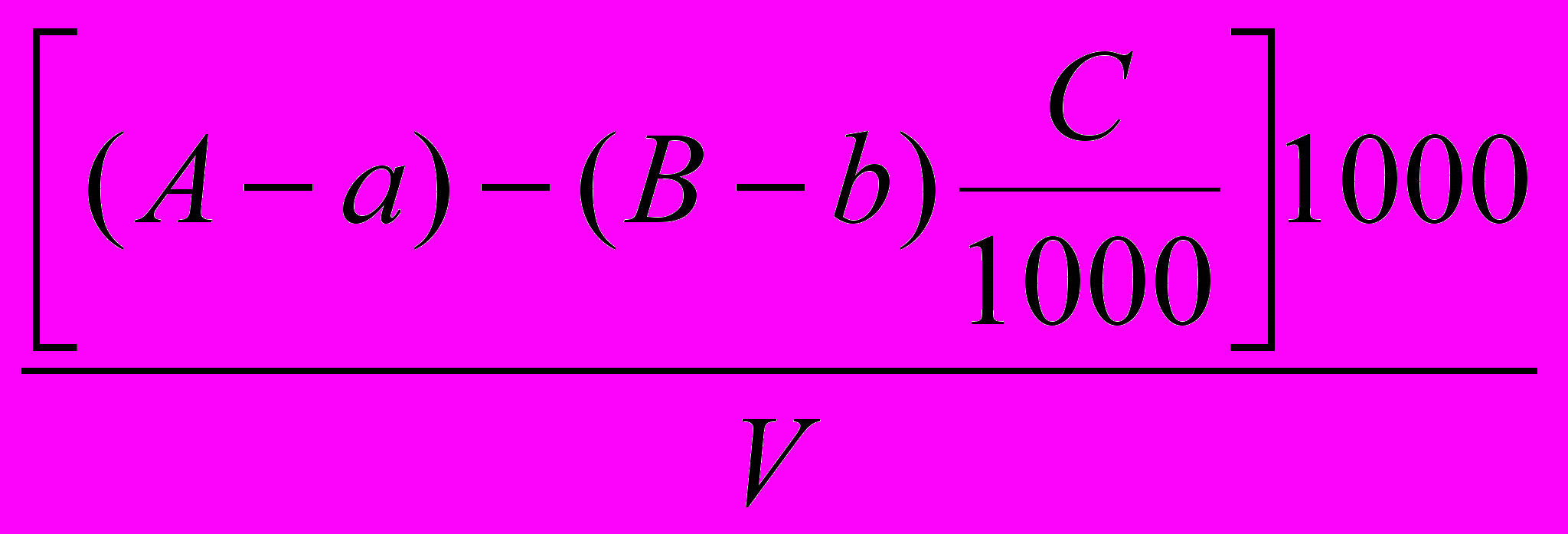 ,
,где А - начальное количество растворенного кислорода в воде, мг/л;
α — количество растворенного кислорода в воде после n суток инкубации, мг/л;
В — начальное количество растворенного кислорода в разбавляющей воде, мг/л;
b —количество растворенного кислорода в разбавляющей воде спустя n суток
инкубации, мг/л;
С — количество разбавляющей воды, мл;
V — объем исследуемой воды, взятый для анализа, мл.
3.2.3.Определение БПК в воде, содержащей свободный хлор
Вода, содержащая свободный хлор, перед определением должна быть освобождена от активного хлора, для чего ее обрабатывают сульфитом натрия или тиосульфатом натрия. Для установления требующегося количества сульфита натрия отбирают отдельную порцию воды, подкисляют 0,02 Н соляной кислотой, прибавляют 10 мл 10%-ного раствора химически чистого йодида калия и раствор крахмала и оттитровывают выделившийся йод раствором сульфита натрия до исчезновения синего окрашивания.
Количество тиосульфата натрия, необходимое для восстановления свободного хлора, определяют также титрованием отдельной пробы. К 100 мл исследуемой воды прибавляют 10 мл 10%-ного раствора йодида калия и титруют 0,025Н раствором тиосульфата натрия с применением раствора крахмала в качестве индикатора.
На 100 мл пробы, предназначенной для определения БПК, прибавляют раствор сульфита натрия или тиосульфита натрия в количестве, рассчитанном по результатам вышеописанного титрования, после чего пробу перемешивают.
Аппаратура: кислородные склянки с хорошо притертой косо срезанной пробкой, емкостью 200—250 мл со стеклянным пришлифованным колпачком, калиброванные с точностью до 0,1 мл; мерные колбы и пипетки; сифон; бутыль; термостат на 20°С с колебаниями не более ±1°С; склянки и мерная посуда для разведения должны быть очень тщательно вымыты, так как даже небольшое загрязнение дает увеличение БПК.
Склянки должны быть обезжирены хромовой смесью, тщательно отмыты от хромовой смеси и высушены.
Реактивы: сульфаминовая кислота, 40% -ный раствор; мочевина, 40%-ный раствор; бикарбонат натрия; тиосульфат натрия, 0,16 г безводного Na2S203 растворяют в 100 мл дистиллированной воды непосредственно перед применением. Раствор неустойчив.
Сульфит натрия: 3,5 г кристаллического сульфита натрия Na2S03*7H20 растворяют в 1 л воды.
Ход определения. После добавления растворов сульфита натрия или тиосульфата натрия определение ведут так, как описано на в работе 3.2.2.
Контрольные вопросы
1. Что такое БПК? С какой целью ее определяют?
2. Как влияют на величину БПК процессы нитрификации?
3. С какой целью определяют БПК5 и БПКполн.?
4. Как определяют БПК в натуральной пробе без разбавления?
5. Как определяют БПК с разбавлением испытуемой воды?
- Каковы особенности определения БПК в воде, содержащей свободный хлор?
- Определение жесткости воды
Жесткость воды отражает содержание в ней ионов кальция и магния. Различают общую Жо, карбонатную Жк и некарбонатную Жнк жесткость.
Жо = Жк + Жнк
Карбонатная жесткость Жк обусловлена присутствием в воде гидрокарбонатов кальция и магния ( Са(НСО3)2, Mg(HCO3)2 ), а некарбонатная жесткость Жнк - хлористыми, сернокислыми и другими некарбонатными солями кальция и магния.
Различают также постоянную и временную (устранимую) жесткость. Устранимая жесткость определяется экспериментально и показывает на сколько уменьшилась жесткость воды за 1 час кипячения. За это время бикарбонаты переходят в малорастворимые карбонаты, что приводит к образованию накипи и уменьшению жесткости воды.
Жпост = Жо - Жвр
Общую Жо и карбонатную Жк жесткость воды определяют методом титрования.
Основным рабочим раствором является трилон Б – двунатриевая соль этилендиамин-тетрауксусной кислоты:
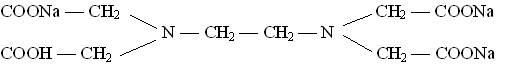
Определение суммарного содержания ионов кальция и магния основано на способности трилона Б образовывать с этими ионами прочные комплексные соединения в щелочной среде, замещая свободные ионы водорода на катионы Са2+ и Mg2+:
Ca2+ + Na2H2R → Na2CaR + 2H+, где
R – радикал этилендиаминтетрауксусной кислоты.
В качестве индикатора используется хромоген черный, дающий с Mg2+ соединение винно-красного цвета; при исчезновении Mg2+ он приобретает голубую окраску. Реакция идет при рН ~ 10, что достигается добавлением в пробу аммиачного буферного раствора
(NH4OH + NH4Cl). В первую очередь связываются ионы кальция, а затем магния.
Определению мешают ионы меди (> 0,002 мг/л), марганца (> 0,05 мг/л), железа (> 1,0 мг/л), алюминия (> 2,0 мг/л).
Оборудование, реактивы: бюретка; пипетки: 15 мл и 100 мл; колба коническая 250 мл; капельница; мерный цилиндр 100 мл; раствор трилона Б ~0,05 Н; раствор MgSO4 0,05Н; аммиачный буферный раствор ((NH4OH + NH4Cl)); индикатор хромоген черный.
Материал: вода водоема.
Ход работы:
- Определение нормальности трилона Б производится по стандартному 0,05 Н раствору MgSO4.
В коническую колбу отмеряют пипеткой 15 мл 0,05Н раствор MgSO4, добавляют 85 мл дистиллированной воды (до 100 мл мерным цилиндром), приливают 5 мл аммиачного буферного раствора и 5 капель индикатора хромогена черного, после чего проводят титрование раствором трилона Б (~0,05 Н).
Пробу титруют до появления голубой окраски от одной прилитой капли трилона Б, что свидетельствует об исчезновении ионов Mg2+.
Дальнейшее прибавление трилона Б не изменяет голубой окраски раствора, поэтому следует внимательно следить за постепенным изменением окраски от винно-красной через переходные окраски (фиолетовую, грязно-синюю) до голубой.
Титрование проводится дважды. Поправочный коэффициент к нормальности трилона Б рассчитывают по формуле:
К =
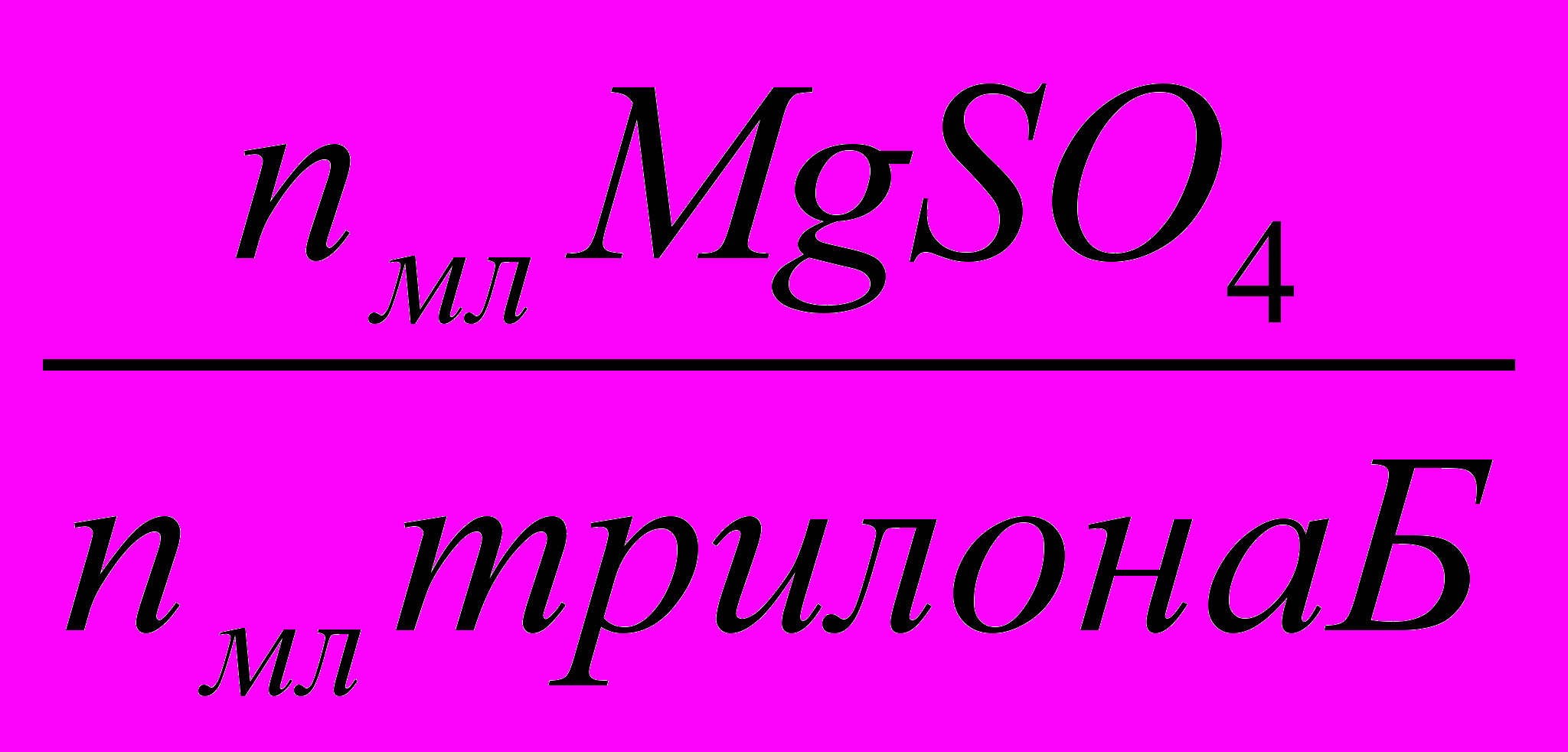
2. Определение общей жесткости пробы.
Пипеткой Мора отмеряют 100 мл испытуемой воды в коническую колбу, добавляют буферный раствор и индикатор (в том же количестве, что и при определении поправочного коэффициента), и титруют раствором трилона Б. определение повторяют и берут средний результат.
Вычисление общей жесткости в мг-экв/л производят по формуле:
Жо =
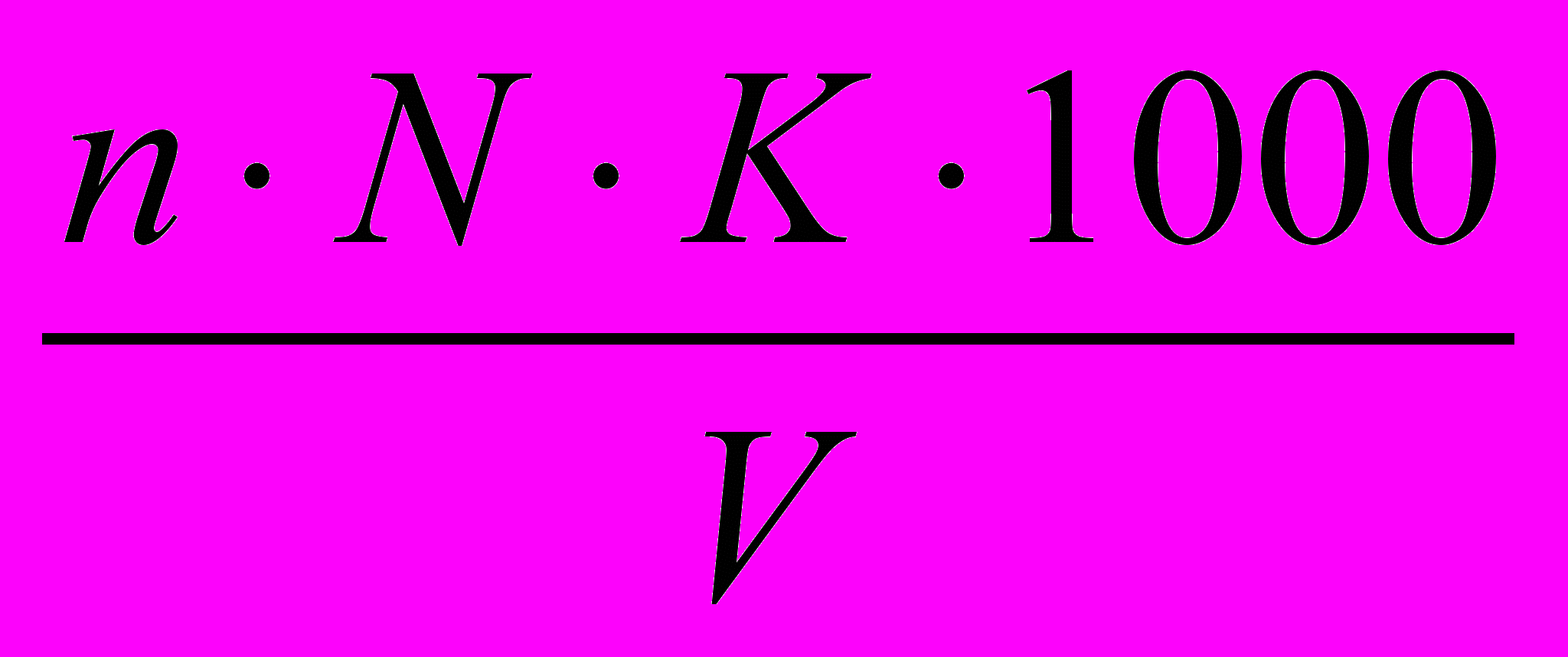 ,
,где:
n- количество трилона Б, израсходованное на титрование, в мл;
К – поправочный коэффициент к нормальности трилона Б;
V – объем пробы, в мл;
N – нормальность трилона Б.
Для питьевых целей предпочитают воду средней жесткости, для промышленных и хозяйственных целей – мягкую.
