Методические указания по отдельным видам занятий лабораторная работа №1
| Вид материала | Методические указания |
- Методические указания к лабораторным работам Лабораторная работа, 357.24kb.
- Рабочая программа дисциплины/модуля (рпд/рпм) Программа учебной практики по дисциплине/модулю, 56.9kb.
- Методические возможности стенда Особенности работы на стендах уилс-1 Ознакомительное, 1487.3kb.
- Методические указания к курсовым (семестровым) и выпускным квалификационным работам, 1017.9kb.
- Методические указания к выполнению курсового проекта Красноярск 2002, 2057.27kb.
- Методические указания к лабораторной работе по курсу "Металорежущие станки" для студентов, 275.32kb.
- Методические указания к выполнению лабораторных работ Лабораторная работа 1 исследование, 605.01kb.
- Методические указания методические указания для выполнения курсовых работ, 153.95kb.
- Н. Э. Баумана Методические указания для лабораторной работы по курсам апбс ч. 3, «Биотелеметрия», 520.54kb.
- Методические указания для семинарских занятий Для студентов по специальности, 449.35kb.
3.5.9.6. МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ОТДЕЛЬНЫМ ВИДАМ ЗАНЯТИЙ
ЛАБОРАТОРНАЯ РАБОТА № 1
ФИЗИЧЕСКИЙ И ХИМИЧЕСКИЙ АНАЛИЗЫ ВОДЫ
Цель работы: знакомство с видами анализа природных вод.
Природная вода характеризуется физическими, химическими, технологическими и санитарно-бактериологическими показателями (параметрами), которым соответствуют определенные виды анализа.
При физическом анализе воды производят измерение ее температуры (в момент отбора пробы), цветности, прозрачности, мутности, а также определяют вкус и запах.
Цветность может быть определена путем сравнения окраски воды с окраской стандартных эталонных растворов, в качестве которых применяют растворы хлорплатината калия K2[PtCl6] и хлорида кобальта (II) различной концентрации. Для изготовления шкалы цветности вместо хлорплатината калия применяют сульфат кобальта (П) и бихромат калия.
Для изготовления шкалы стандартных цветных растворов приготавливают два раствора:
а) раствор, содержащий в 1 л 0,0875 г бихромата калия K2Cr2O7, 2 г CoSO4 7H2O и 1 мл концентрированного раствора серной кислоты d = 1,84 г/см3. Этот раствор отвечает цветности 500°;
б) раствор серной кислоты, содержащий 1 мл концентрированной серной кислоты в 1 л раствора.
Смешивая растворы а) и б) в определенных соотношениях, получают приведенную в табл. 1.1 шкалу цветности.
Таблица 1.1
Шкала цветности
| Растворы, мл | Градусы цветности | Растворы, мл | Градусы цветности | ||
| а | б | а | б | ||
| 0 | 100 | 0 | 10 | 90 | 50 |
| 1 | 99 | 5 | 12 | 88 | 60 |
| 2 | 98 | 10 | 16 | 84 | 80 |
| 3 | 97 | 15 | 20 | 80 | 100 |
| 4 | 96 | 20 | 25 | 75 | 125 |
| 5 | 95 | 25 | 30 | 70 | 150 |
| 6 | 94 | 30 | 40 | 60 | 200 |
| 8 | 92 | 40 | 50 | 50 | 250 |
Мутность определяют с помощью нефелометров (при концентрации взвешенных веществ менее 3 мг/л).
Вкус и запах определяют органолептически (с помощью органов чувств).
При химическом анализе воды определяют следующие показатели (параметры): рН (активную реакцию среды), щелочность (общую, гидратную, бикарбонатную и карбонатную), жесткость (общую, карбонатную, некарбонатную), наличие ионов кальция, магния, бария, железа (П) и (III), меди, cвинца, цинка, аммония, сульфат-ионов хлор-ионов, окисляемость, растворенный кислород, биологическое и химическое потребление кислорода и некоторые другие.
При технологическом анализе определяют фильтруемость, осаждаемость воды и ее стабильность.
При санитарно-бактериологическом анализе определяют коли-титр количество воды, мл, в которой находится одна кишечная палочка Coli, общее количество бактерий а 1 мл, количество кишечных палочек в в 1 л.
Экспериментальная часть
Взять у преподавателя пробу воды. Измерить температуру, а затем определить ее цветность. Для этого налить в цилиндр Несслера 100 мл исследуемой воды и сравнить ее окраску с окраской одного из стандартных растворов, налитых в такой же цилиндр. Сопоставление окрасок растворов производят путем просмотра их сверху вниз на белом фоне. Если цветность эталона не совпадает с цветностью воды, то, выливая либо воду, либо стандартный раствор из цилиндра, добиваются выравнивания окрасок. В этом случае цветность воды определяют по следующей формуле:
 ,
,
где
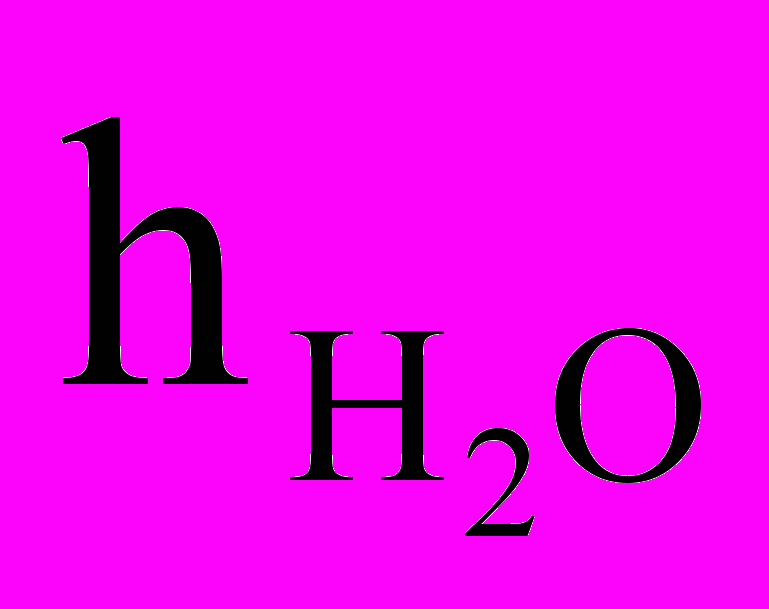 и
и 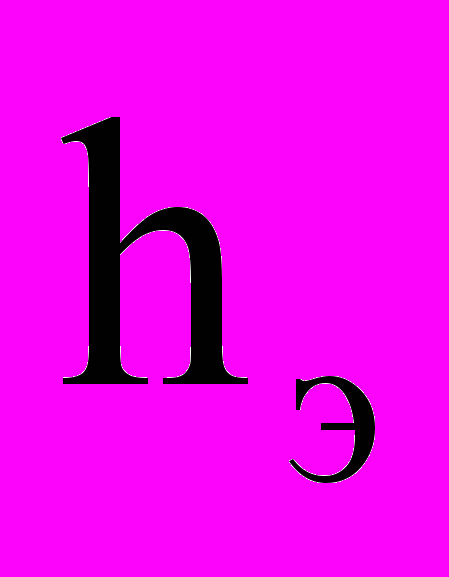 - высота столба исследуемой воды и стандартного (эталонного) раствора, см;
- высота столба исследуемой воды и стандартного (эталонного) раствора, см;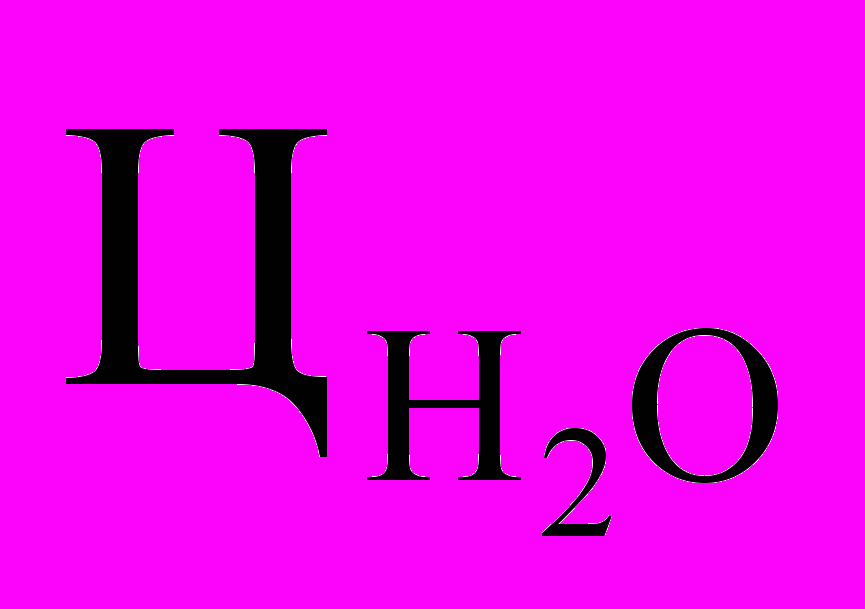 и Цэ – цветность исследуемой воды и стандартного (эталонного) раствора, градус.
и Цэ – цветность исследуемой воды и стандартного (эталонного) раствора, градус.Определить активную реакцию среды, пользуясь табл. 1.2, с помощью индикаторов (фенолфталеина, метилоранжа, смешенного).
Таблица 1.2
Окраска индикаторов в различных средах
| Индикатор | Окраска индикаторов в среде | ||
| кислой | щелочной | нейтральной | |
| Фенолфталеин Метилоранж Смешанный | Бесцветная Розовая Фиолетовая | Малиновая Желтая Зеленая | Бесцветная Оранжевая Серая |
При помощи универсального индикатора определить примерное значение рН, а затем с помощью рН-метра определить точное значение- рН исследуемой воды.
Определить наличие в воде следующих ионов Cl- (по образованию белого осадка хлорида серебра),
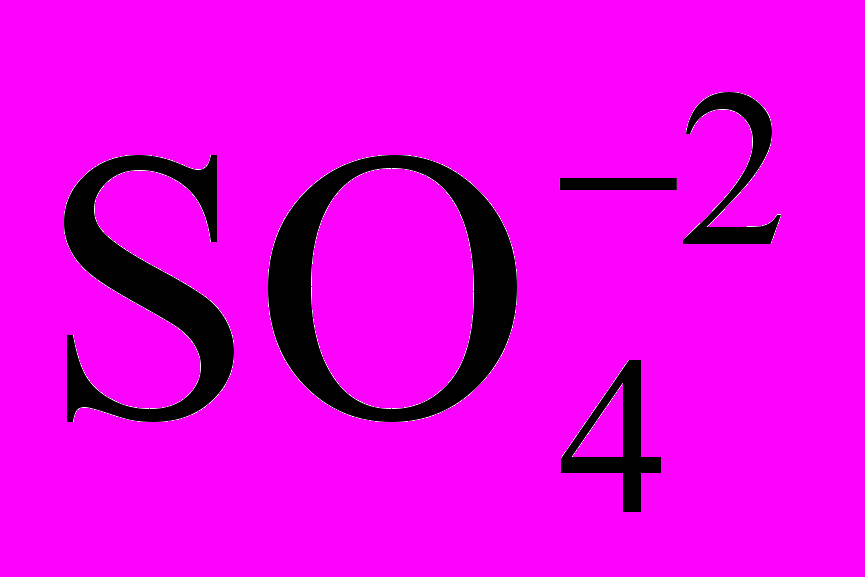 (по образованию белого осадка сульфата бария), Fe+3 (по образованию кроваво-красного раствора родонита железа Fe(CNS)3), Mg+2, Ca+2, Sr+2 (по образованию белого осадка карбонатов этих металлов), Pb+2 (по образованию желтого осадка иодида свинца), Fe+2 (по образованию раствора ферроцианида железа синего цвета), Cu+2 (по образованию аммиаката меди). Реакция образования аммиаката меди идет по следующим уравнениям:
(по образованию белого осадка сульфата бария), Fe+3 (по образованию кроваво-красного раствора родонита железа Fe(CNS)3), Mg+2, Ca+2, Sr+2 (по образованию белого осадка карбонатов этих металлов), Pb+2 (по образованию желтого осадка иодида свинца), Fe+2 (по образованию раствора ферроцианида железа синего цвета), Cu+2 (по образованию аммиаката меди). Реакция образования аммиаката меди идет по следующим уравнениям:Cu+2 + 2OH → Cu(OH)2
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
фиолетовое окрашивание
Определить наличие аммиака или ионов аммония по посинению лакмусовой бумажки, помещенной в пары подогретой и подщелоченной исследуемой воды. Наличие аммиака можно определять и по запаху.
Определить наличие в воде сероводорода по образованию черного осадка сульфида свинца. Для этого смоченную нитратом свинца фильтровальную бумагу поместить в пары подогретой и подкисленной исследуемой воды.
Написать уравнения соответствующих процессов.
Список литературы
1. Возная Н. Ф. Химия воды и микробиология. М.: Высшая школа, I979.
2. Вехотко Т. И.. Ильменкова Л. И. Химия и микробиология природных и сточных вод. Ч. 1. Общие свойства воды и водных растворов: Учебное пособие. – Л.: ЛИИЖТ, 1977.
ЛАБОРАТОРНАЯ РАБОТА № 2
ГИДРОЛИЗ СОЛЕЙ
Цель работы: ознакомление с процессом гидролиза различных типов солей, измерение рН растворов солей, изучение влияния разбавления раствора соли на смещение равновесия процесса гидролиза.
В водных растворах осуществляется реакция взаимодействия между ионами соли и водой. В результате этого взаимодействия один из ионов воды (Н+ или ОН-) связывается ионом соли в слабодиссоциирующую частицу или труднорастворимое вещество, а другой ион воды накапливается в растворе, сообщая ему кислую или щелочную реакцию. Процесс обменного взаимодействия ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды (изменяется рН среды) называется гидролизом (от греческих слов «гидро» – вода и «лизис» – разложение).
Смещение равновесия в реакции гидролиза обнаруживается как с помощью индикаторов – веществ, приобретающих окраску в определенной среде, так и электрометрическим методом (с помощью рН-метра).
Если среда нейтральная, значит, в растворе данной соли равновесие диссоциации воды не смещено, т.е. соль гидролизу не подвергается.
Если среда кислая, значит, в растворе соли образуется избыток ионов водорода, т.е. протекает гидролиз по катиону. Катион связывает гидроксид-ионы воды, а ионы Н+ накапливаются в растворе, придавая среде кислый характер.
Если среда щелочная, значит, в растворе соли образуется избыток гидроксид-ионов ОН-, т.е. протекает гидролиз по аниону. Анион связывает ионы Н+, а ионы ОН- накапливаются в растворе, придавая среде щелочной характер.
На интенсивность процесса гидролиза влияют сила кислоты или основания, образующих соль, процесс разбавления раствора, температура.
Гидролиз является обратимым процессом, на смещение равновесия которого влияют изменение концентрации соли, температура, изменение концентрации продуктов гидролиза, подкисление или подщелачивание раствора соли. Так, уменьшение концентрации несвязанных ионов Н+ или ОН- приводит к смещению равновесия в сторону их накопления, т.е. усилению гидролиза.
Лабораторная работа включает в себя следующие разделы:
- Предварительную расчетную часть, которая выполняется заранее и является допуском к работе.
- Экспериментальную часть, включающую приготовление раствора требуемой концентрации, инструментальные замеры соответствующих показателей на приборе.
- Сравнение результатов эксперимента с предварительными теоретическими расчетами.
- Отчет о работе.
1. РАСЧЕТНАЯ ЧАСТЬ
До выполнения экспериментальной части работы необходимо ознакомиться с теорией процессов гидролиза и выполнить расчетные задания по теме по номеру варианта таблицы 1. Результаты расчетов сравниваются с результатами экспериментальных данных.
