«Лабораторная диагностика России» 2008/2009 Стандартизация в лабораторной медицине: цели, средства, внедрение
| Вид материала | Документы |
- Лабораторные маркеры сердечно-сосудистых заболеваний. Значение в оценке эффективности, 667.27kb.
- В. И. Агалаков // Главврач. 2008. N c. 89-92, 36.79kb.
- Учебной литературы Литература для обучения по клинической лабораторной диагностике, 61.23kb.
- Типовая программа дополнительного профессионального образования врачей клиническая, 6412.19kb.
- Программа «Основы сестринского дела» для специальности: «Лабораторная диагностика», 272.46kb.
- И. Г. Ахапкина // клиническая лабораторная диагностика. 2008. №11. С. 45-46. Библиогр.:, 169.16kb.
- Программа для подготовки к выпускному экзамену по специальности "Клиническая лабораторная, 170.74kb.
- Программа юбилейной конференции «новые технологии в лабораторной медицине», 25.51kb.
- 5 Наименование курсов Клиническая лабораторная диагностика, 4025.2kb.
- Программа IV съезда Научного общества специалистов клинической лабораторной диагностики, 371.24kb.
«Лабораторная диагностика России» 2008/2009
Стандартизация в лабораторной медицине:
цели, средства, внедрение
В. В. Меньшиков
Лаборатория проблем клинико-лабораторной диагностики
Московской медицинской академии им. И.М. Сеченова
1. Цели стандартизации
Основная задача клинической лаборатории состоит в том, чтобы на основании результатов исследования проб биожидкостей, экскретов или тканей человека дать объективную оценку состояния и содержания определенных компонентов его внутренней среды, способных отразить наличие возможной патологии. Успешное решение этой задачи зависит от нескольких групп факторов, главными среди которых можно считать следующие:
- правильное осуществление аналитических процессов лабораторным персоналом;
- взаимодействие с медицинской средой – клиническим персоналом, пациентами на преаналитическом и постаналитическом этапах лабораторных исследований;
- взаимодействие с производителями и поставщиками средств лабораторного анализа.
Во всех этих секторах деятельности успех дела в значительной мере зависит от соблюдения определенных «правил игры», которые должны быть ясно обоснованы и четко сформулированы в нормативных документах. Учитывая возможное наличие в каждом случае столкновения разнородных интересов и подходов, арбитром должно быть государство как представитель доминирующих общественных интересов, а формой установления «правил игры» – официально признанные государственные документы: законы, технические регламенты, национальные стандарты.
Наиболее гибкой формой регламентации являются национальные стандарты, поскольку они могут быть нацелены на упорядочение как конкретных, так и более общих взаимодействий и процессов, а применение их носит добровольный характер. Новые аналитические технологии, новые лабораторные приборы, все возрастающее разнообразие диагностических лабораторных тестов, новые варианты организации лабораторного обеспечения медицинской помощи – эти новации повседневно ставят заведующего клинико-диагностической лабораторией перед необходимостью выбора.
Для того чтобы правильно ориентироваться в этом разнообразии возможностей и принять решение в соответствии с медицинской и экономической целесообразностью, полезно обратиться к продуманным и успешно опробованным способам решения этих проблем, сформулированным в виде стандартов.
Несмотря на некоторое предубеждение медиков по отношению к понятию «стандартизация», внедрение рациональных принципов и способов стандартизации - необходимый элемент современного этапа развития постоянно развивающейся сферы лабораторной медицины.
Целями стандартизации в лабораторной медицине являются:
обеспечение получения достоверной и сопоставимой информации о состоянии внутренней среды/содержании клинически значимых компонентов биологических жидкостей, экскретов, тканей человека на основе:
- обоснованного выбора и точного выполнения наиболее чувствительных, специфичных и устойчивых методик лабораторных исследований, обладающих оптимальной правильностью и прецизионностью;
- соблюдения всеми участниками выполнения лабораторных тестов, включая клинический персонал, условий, обеспечивающих максимально возможное сохранение в образце биоматериала свойств и состава, присущих ему in vivo;
- соблюдения изготовителями средств лабораторного анализа при их разработке, производстве, транспортировке наибольшего соответствия свойств изделий требованиям чувствительности, специфичности, правильности и прецизионности выполняемых с их применением методик исследований.
2. Средства стандартизации
В лабораторной медицине разработка нормативных документов прошла два этапа. На первом этапе стандартизация заключалась в применении документов, которые были разработаны применительно к наиболее общим метрологическим закономерностям:
- оценке методов измерения (ГОСТ Р ИСО 5725:2001 «Точность (правильность и прецизионность) методов и результатов измерений». Части 1-6);
- менеджменту качества (ГОСТ Р ИСО 9001:2000 «Системы менеджмента качества. Требования»);
- качеству деятельности и компетентности лабораторий (ГОСТ Р ИСО/МЭК 17025:2006 «Общие требования к компетентности испытательных и калибровочных лабораторий»).
Опыт лабораторий ряда стран, в том числе и отдельных российских лабораторий (например «Юнимед лабораториз» в Медицинском центре Управления по обслуживанию дипломатического корпуса), показал определенный положительный эффект применения этих документов к совершенствованию внутрилабораторной сферы деятельности медицинских лабораторий.
Однако при этом оставались вне зоны стандартизации многие специфические стороны лабораторной медицины:
- условия деятельности лабораторий в медицинской среде;
- особенности исследуемых биологических проб;
- своеобразие свойств изучаемых аналитов.
На фоне активного восприятия лабораторной медициной все новых достижений фундаментальных наук, беспрецедентного расширения ассортимента лабораторных исследований биологических материалов человека, существенного повышения клинической значимости их результатов стала очевидной необходимость разработки стандартов, устанавливающих специальные требования к медицинским лабораториям, применяемым ими методикам и стандартным образцам. Этим потребностям удовлетворяет серия стандартов, принятых Международной организацией по стандартизации в начале текущего столетия. Значение этих стандартов для лабораторной медицины состоит в том, что они устанавливают:
- правила организации всех сторон деятельности клинических лабораторий и обеспечения безопасных условий этой деятельности;
- ИСО 15189:2003 «Медицинские лаборатории – Специальные требования к качеству и компетентности»;
- ИСО 15190:2003 «Медицинские лаборатории – Требования к безопасности»;
- ИСО 15189:2003 «Медицинские лаборатории – Специальные требования к качеству и компетентности»;
- правила взаимодействия с клинической средой и пациентами;
- ИСО 15189, ИСО 15196:2003 «Лабораторная медицина – Определение аналитических целей в соответствии с медицинскими потребностями»;
- ИСО 15189, ИСО 15196:2003 «Лабораторная медицина – Определение аналитических целей в соответствии с медицинскими потребностями»;
- требования к референтной системе в лабораторной медицине (референтные методики, стандартные образцы, лаборатории референтных измерений), обеспечивающей высший уровень точности измерений, на который могут ориентироваться практические клинические лаборатории, применяя методики и стандартные образцы, аттестованные в референтной системе;
- ИСО 15193:2002 «Медицинские изделия для диагностики in vitro – Измерение величин в пробах биологического происхождения - Описание референтных методик выполнения измерений»;
- ИСО 15194:2002 «Медицинские изделия для диагностики in vitro – Измерение величин в пробах биологического происхождения - Описание референтных материалов»;
- ИСО 15195:2003 «Лабораторная медицина – Требования к лабораториям референтных измерений»;
- ИСО 15193:2002 «Медицинские изделия для диагностики in vitro – Измерение величин в пробах биологического происхождения - Описание референтных методик выполнения измерений»;
- метрологически приемлемые варианты подтверждения правильности измерений всего разнообразия биологических аналитов, исследуемых на практике клинико-диагностическими лабораториями, на основе прослеживаемости значений калибраторов и контрольных материалов правильности, выполняемой производителями этих материалов
- ИСО 17511:2003 «Медицинские изделия для диагностики in vitro. Измерение величин в биологических пробах – Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам»;
- ИСО 18153:2003 «Медицинские изделия для диагностики in vitro – Измерение величин в биологических пробах – Метрологическая прослеживаемость значений каталитической концентрации ферментов, приписанных калибраторам и контрольным материалам».
- ИСО 17511:2003 «Медицинские изделия для диагностики in vitro. Измерение величин в биологических пробах – Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам»;
На протяжении ряда лет Лаборатория проблем клинико-лабораторной диагностики ММА им. И.М. Сеченова изучала международный опыт разработки нормативных документов, регламентирующих деятельность клинико-диагностических лабораторий, и на их основе разрабатывала документы для отечественной лабораторной службы. (В изданиях справочника «Лабораторная диагностика России» в 2005, 2006 и 2007 гг. публиковались проекты этих стандартов в целях информирования лабораторной общественности и организации общественного обсуждения, как это предусмотрено положениями Федерального Закона «О техническом регулировании»). Эта работа уже дала определенный эффект в виде утверждения в 2006-2007 гг. ряда национальных стандартов Российской Федерации, подготовленных на основе упомянутых выше международных стандартов. Они вводятся в действие в 2008 г. (кроме ИСО 15196, окончательный текст английского оригинала которого оказался пока не доступен) (1-7).
Наряду с этим направлением стандартизации в течение 2007 г. были переданы на рассмотрение в Ростехрегулирование разработанные в предшествующие годы группой специалистов научных, образовательных и практических учреждений, прошедшие установленную процедуру обсуждения и одобренные Техническим Комитетом по стандартизации № 466 «Медицинские технологии», 3 проекта национальных стандартов системы управления качеством клинических лабораторных исследований, состоящие каждый из 4 частей (Таблица 1). Проекты этих документов были опубликованы в справочнике «Лабораторная диагностика России» за 2004 г.
Таблица 1. Стандарты системы управления качеством
| Наименование документа | Учреждение | Разработчики |
| ГОСТ Р «Технологии медицинские лабораторные. Требования к качеству клинических лабо-раторных исследований» | ||
| Часть 1. Менеджмент качества клинических лабораторных исследований | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков, О.Г. Кадашева, Л.М. Пименова |
| ГОУ ДПО РМАПО Росздрава | В.В. Долгов | |
| ФГУ ГНИЦ профилактической медицины Росмедтехнологий | В.Н. Малахов | |
| ГОУ ВПО РГМУ Росздрава | Р.Т. Тогузов | |
| Часть 2. Оценка аналитической надежности методов исследования (точность, чувстви-тельность, специфичность) | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков, Т.И. Лукичева |
| ФГУ ГНИЦ профилактической медицины Росмедтехнологий | Е.В. Заикин | |
| Часть 3. Оценка клинической информатив-ности лабораторных тестов | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков Т.И. Лукичева, Л.М. Пименова |
| ГОУ ДПО РМАПО Росздрава | А.А. Кишкун | |
| ФГУ ГНИЦ профилактической медицины Росмедтехнологий | Е.В. Заикин | |
| Часть 4. Правила разработки требований к своевременности предоставления лабо-раторной информации | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков Л.М. Пименова |
| ГОУ ДПО РМАПО Росздрава | А.А. Кишкун | |
| ГУН РНЦ хирургии РАМН | И.И. Дементьева | |
| ГОСТ Р «Технологии медицинские лабораторные. Обеспечение качества клинических лабо-раторных исследований» | ||
| Часть 1. Правила описания методов исследования | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков, О.Г. Кадашева, Т.И. Лукичева, В.С. Михайлова, Л.М. Пименова |
| ГОУ ДПО РМАПО Росздрава | С.А. Луговская | |
| ФГУ ГНИЦ профилактической медицины Росмедтехнологий | М.Г. Творогова | |
| ГУН НИИ биомедицинской химии РАМН | В.К. Городецкий | |
| Часть 2. Руководство по качеству иссле-дований в клинико-диагностической ла-боратории. Типовая модель | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | О.Г. Кадашева, В.В. Меньшиков, Л.М. Пименова |
| ОАО «Юнимед Лабораториз», Москва | Л.В. Тельминова | |
| Часть 3. Правила взаимодействия персонала клинических подразделений и клинико-диаг-ностических лабораторий медицинских ор-ганизаций при выполнении лабораторных тестов | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков Л.М. Пименова |
| ГОУ ДПО РМАПО Росздрава | А.А. Кишкун | |
| ФГУ Лечебно-реабилитационный центр Росздрава | К.В. Лядов | |
| Часть 4. Правила ведения преаналитического этапа | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков Л.М. Пименова |
| ГОУ ДПО РМАПО Росздрава | А.А. Кишкун | |
| ГОСТ Р «Технологии медицинские лабораторные. Контроль качества клинических лабо-раторных исследований» | ||
| Часть 1. Пределы допускаемых погрешностей результатов измерения аналитов в клинико-диагностических лабораториях | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | Т.И. Лукичева, О.Г. Кадашева, В.В. Меньшиков |
| ФГУ ГНИЦ профилактической медицины Росмедтехнологий | В.Н. Малахов, Е.В. Заикин | |
| Часть 2. Правила проведения внутрилабора-торного контроля качества количественных методов клинических лабораторных иссле-дований с использованием контрольных материалов | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | О.Г. Кадашева, В.В. Меньшиков |
| ФГУ ГНИЦ профилактической медицины Росмедтехнологий | В.Н. Малахов, Е.В. Заикин | |
| ГУН НИИ нейрохирургии РАМН | А.В. Мошкин | |
| ЗАО «Аналитика», Москва | Е.С. Новикова | |
| Часть 3. Описание материалов для контроля качества клинических лабораторных иссле-дований | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков |
| Часть 4. Правила проведения клинического аудита эффективности лабораторного обеспечения деятельности медицинских организаций | ГОУ ВПО ММА им. И.М. Сеченова Росздрава | В.В. Меньшиков |
| ГОУ ДПО РМАПО Росздрава | А.А. Кишкун | |
Входящие в эти стандарты документы способствуют конкретизации требований к различным аспектам упомянутых выше сфер стандартизации в лабораторной медицине.
Вопросам регламентации внутрилабораторной сферы посвящены следующие документы:
-
- Правила менеджмента качества клинических лабораторных исследований;
- Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность).
- Правила менеджмента качества клинических лабораторных исследований;
-
- Правила описания методов исследования;
- Руководство по качеству исследований в клинико-диагностической лаборатории. Типовая модель.
- Правила описания методов исследования;
-
- Пределы допускаемых погрешностей результатов измерения аналитов в клинико-диагностических лабораториях;
- Правила проведения внутрилабораторного контроля качества количественных методов клинических лабораторных исследований с использованием контрольных материалов.
- Пределы допускаемых погрешностей результатов измерения аналитов в клинико-диагностических лабораториях;
Правилам взаимодействия с клинической средой посвящены следующие документы:
-
- Правила оценки клинической информативности лабораторных тестов;
- Правила разработки требований к своевременности предоставления лабораторной информации.
- Правила оценки клинической информативности лабораторных тестов;
-
- Правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций при выполнении лабораторных тестов»;
- Правила ведения преаналитического этапа.
- Правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций при выполнении лабораторных тестов»;
-
- Описание материалов для контроля качества клинических лабораторных исследований.
- Правила проведения клинического аудита эффективности лабораторного обеспечения деятельности медицинских организаций.
- Описание материалов для контроля качества клинических лабораторных исследований.
Эти документы конкретизируют требования к отдельным характеристикам и сторонам деятельности клинических лабораторий, исходя из ее клинического предназначения и условий ее проведения в среде медицинского учреждения.
Так, в них изложены требования к качеству лабораторных исследований не только с аналитической стороны, но и в отношении клинической информативности и оперативности получения и предоставления лабораторной информации; подробно рассматриваются факторы преаналитического этапа, влияющие на достоверность результатов исследований, приводятся правила взаимодействия клинического и лабораторного персонала в процессе выполнения лабораторных исследований и проведения клинико-лабораторного аудита использования лабораторной информации.
Один из документов затрагивает сферу отношений лаборатории с изготовителями средств лабораторного анализа:
-
- Описание материалов для контроля качества клинических лабораторных исследований.
- Описание материалов для контроля качества клинических лабораторных исследований.
Следует отметить, что обсуждаемые стандарты коррелируют с соответствующими разделами международного стандарта ИСО 15189, требования которого в форме ГОСТ Р ИСО 15189:2006 (1) введены в действие с 1 января 2008 г.
Таким образом, в результате многолетней работы, с учетом международного и собственного опыта, сформирована нормативная основа деятельности клинико-диагностических лабораторий медицинских учреждений, которая при ее внедрении в практику призвана сыграть существенную роль в совершенствовании лабораторного обеспечения медицинской помощи.
Таблица 2 Корреляция стандартов системы управления качеством клинических лабораторных исследований с международным стандартом ИСО 15189
| Отечественные стандарты | Разделы ИСО 15189 |
| Правила менеджмента качества клинических лаборатор-ных исследований | 4.1; 4.2; 4.3; 4.6; 4.9; 4.10; 4.11; 4.12; 4.14; |
| Правила оценки аналитической надежности | 5.5; 5.6 |
| Правила описания методов клинических лабораторных исследований | 4.3 |
| Типовая модель «Руководства по качеству» | 4.1; 4.2; 4.3; 4.9; 4.10; 4.11; 4.12; 4.13; 4.14; 5.1; 5.2; 5.3; 5.5; 5.6; |
| Правила проведения внутрилабораторного контроля ка-чества | 4.2; 5.6 |
| Правила применения пределов допускаемых погрешностей измерений | 4.2; 5.6 |
| Правила оценки клинической информативности | 4.7; 5.7 |
| Правила разработки требований к своевременности предо-ставления лабораторной информации | 5.8 |
| Правила ведения преаналитического этапа | 5.4 |
| Правила взаимодействия клинического и лабораторного персонала при выполнении клинических лабораторных исследований | 4.7; 4.8; 5.4; 5.7; 5.8; |
| Правила проведения клинического аудита | 4.7; 4.8; 4.14 |
Несомненно, нельзя считать работу по стандартизации в клинической лабораторной диагностике на этом завершенной. Прежде всего предстоит разработка нормативных документов по многочисленным технологиям выполнения лабораторных исследований. Так, уже имеется определенный задел по созданию стандартов выполнения ряда цитологических исследований (пунктата костного мозга, аспирата из полости матки, синовиальной жидкости). Текст проекта стандарта по исследованию пунктата костного мозга, подготовленный рабочей группой в составе сотрудников ММА им. И. М. Сеченова, РМАПО, РГМУ, РОНЦ им. Н.Н. Блохина, Городской клинической больницы им. Боткина (Москва), приводится в справочнике «Лабораторная диагностика России» 2008/2009 .
Круг лабораторных технологий, применяемых клиническими лабораториями, весьма широк, и поэтому представители всех направлений лабораторной медицины приглашаются принять участие в разработке проектов стандартов по своим сферам деятельности. При разработке проектов стандартов следует ориентироваться на требования стандарта «Технологии выполнения простых медицинских услуг. Общие положения» (8).
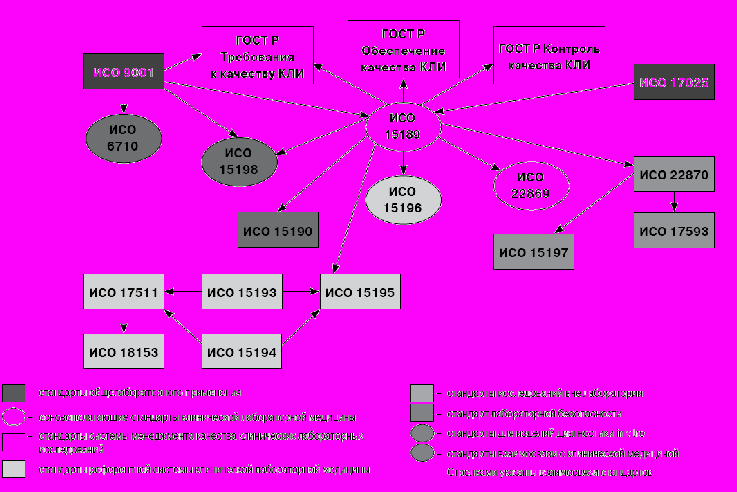
Далее, представленные в настоящее время на общественное обсуждение проекты 6 национальных стандартов, разработанные на основе аутентичных переводов международных стандартов, существенно дополняют принятые ранее документы (рис. 1).
Проект стандарта ГОСТ Р ИСО 22869 «Лаборатории медицинские. Руководство по внедрению ИСО 15189:2003» содержит рекомендации, которые будут полезны при систематическом внедрении во все стороны деятельности клинико-диагностических лабораторий ранее утвержденного стандарта ГОСТ Р ИСО 15189:2006 «Лаборатории медицинские. Специальные требования к качеству и компетентности».
Проект ГОСТ Р ИСО 6710 «Контейнеры одноразовые для сбора образцов венозной крови» содержит единые требования к одноразовым контейнерам для сбора венозной крови, которые представляют собой современные средства рационализации преаналитического этапа лабораторных исследований, которые также существенно повышают безопасность для персонала.
Проект ГОСТ Р ИСО 15198 «Клиническая лабораторная медицина. Валидация методик контроля качества, рекомендуемых изготовителями пользователям» устанавливает требования к тем рекомендациям для пользователей по методикам контроля качества, которыми изготовители сопровождают свои изделия для клинической лабораторной диагностики. Этот документ вносит необходимую определенность во взаимоотношения между пользователями – работниками лабораторий и изготовителями средств лабораторного анализа.
Проекты стандартов ГОСТ Р ИСО 22870 «Исследования по месту лечения. Требования к качеству и компетентности», ГОСТ Р ИСО 15197 «Системы диагностические in vitro. Требования к системам мониторного наблюдения за концентрацией глюкозы в крови для самоконтроля при лечении сахарного диабета», ГОСТ Р ИСО 17593 «Клинические лабораторные исследования и изделия медицинские для диагностики in vitro. Требования к системам мониторинга in vitro для самотестирования пероральной терапии антикоагулянтами» впервые вносят регламентацию в обещающий значительный медико-экономический эффект способ выполнения исследований по месту лечения пациента – вне лаборатории.
Осуществление требований, устанавливаемых данными стандартами, позволит беспечить необходимую надежность информации, получаемой при этом способе выполнения исследований как за счет проведения необходимого контроля качества со стороны стационарной клинико-диагностической лаборатории, так и путем соблюдения необходимых мер менеджмента качества при конструировании и производстве изделий для исследования концентрации глюкозы в крови и для проведения тестов оценки свертываемости крови.
Примером весьма серьезного подхода разработчиков этих стандартов к обеспечению качества и надежности средств анализа, передаваемых в руки пациентов, могут служить требования стандарта ИСО 17593 к обеспечению качества устройства для самотестирования протромбинового времени на всех этапах жизненного цикла этого изделия (таблица 3).
В целом, внедрение представленных на обсуждение проектов национальных стандартов позволит рационализировать многие стороны практической клинико – лабораторной диагностики.
Публикация проектов стандартов имеет целью не только информирование лабораторной общественности об их содержании, но и приглашение к общественному обсуждению.
Таблица 3. Элементы обеспечения качества системы мониторинга пероральной терапии антикоагулянтами (ИСО 17593)
| Элементы обеспечения качества | Ответственные | Условия проведения |
| Прослеживаемость калибровки системы | Изготовитель | Перед выпуском на рынок. Пробы пациентов. Сравнение с референтной методикой с ис-пользованием международного референтного препарата |
| Верификация системы | Изготовитель | Перед выпуском на рынок. Пробы пациентов со значительными изменениями. Сравнение с методикой, выбранной изготовителем |
| Калибровка и верификация реагента | Изготовитель | Каждый лот перед выпуском. Контроли, пробы пациентов |
| Верификация инструмента | Изготовитель | Испытание инструмента перед выпуском, контроли |
| Верификация измерения | Самоконтроль системы | Перед каждым измерением, внутренний физический контроль и критерии процесса |
| Контроль рабочих характеристик системы | Пользователь | Новая упаковка реагента. При появлении неожиданных результатов, контроли, интег-рированный контроль |
| Верификация характеристик выполнения пользователем | Медицинский работник | Каждые 6 мес., капиллярная кровь, сравнение результатов пользователя и медицинского ра-ботника или сравнение с методикой лабора-тории |
Рис. 1. Схема взаимосвязей стандартов клинической лабораторной медицины
Читатели приглашаются выступить в качестве рецензентов этих проектов. Хотелось бы, по крайней мере, получить ответ на следующие вопросы:
- Оценка значимости (аналитической, клинической) проблемы, требования по решению которой устанавливает данный проект стандарта (с соответствующей аргументацией).
- Оценка актуальности внедрения требований данного стандарта (отсутствие или неполнота решения проблемы в отечественной лабораторно-диагностической практике).
- Целесообразность принятия данного документа в качестве национального стандарта РФ.
- Возможные замечания по тексту проекта и предложения в связи с его требованиями (разработка дополнительного документа, переработка действующих документов и т.п.).
Подготовленные отзывы следует направлять в адрес: Лаборатория проблем клинико-лабораторной диагностики ММА им. И.М. Сеченова 119992, Трубецкая ул., д. 8, Москва ).
4. Другие направления работы по стандартизации
Наряду со стандартами, выполнение требований которых является добровольным, началась разработка технических регламентов, устанавливающих обязательные требования. В составе авторского коллектива, включающего сотрудников ГУН НИИ эпидемиологии Роспотребнадзора, ГУН НИИ вакцин и сывороток им. Тарасевича Роспотребнадзора, ФГУ ГНИЦ профилактической медицины Росмедтехнологий, сотрудники Лаборатории проблем клинико-лабораторной диагностики ММА им. И.М. Сеченова Росздрава приняли участие в разработке проекта технического регламента № 169 «О требованиях к безопасности медицинских изделий для диагностики in vitro». Проект регламента предусматривает требования к изделиям, предназначенным для лабораторной диагностики, на всех этапах их жизненного цикла, начиная с конструирования и производства и включая послепродажный мониторинг. Основными положениями этого проекта являются определение понятий прямого и косвенного риска, введение классификации изделий в соответствии с категориями риска для отдельных лиц и для общества, установление правил отнесения изделий к определенным классам риска и порядка оценки соответствия требованиям данного регламента изделий, относящихся к разным классам риска.
Содержание регламента в значительной мере гармонизировано с требованиями международных нормативных документов (Директивы Европейского Совета от 1998 г., Рекомендаций Рабочей группы по глобальной гармонизации и др.). Учтен опыт разработки нормативных документов США, Канады.
Первая редакция проекта была опубликована на сайте ГУН НИИ эпидемиологии Роспотребнадзора в мае 2007 г. Поступило около 100 замечаний и предложений, которые были в значительной части приняты, и с их учетом проект был существенно переработан. Обсуждение проекта технического регламента в Общественном совете по медицинской промышленности при Минпромэнерго Российской Федерации состоялось в сентябре и декабре 2007 г. Доработанный в соответствии с заключением Общественного совета проект технического регламента представлен в справочнике «Лабораторная диагностика России»2008/2009 . Поскольку в соответствии с Федеральным Законом № 64 от 1 мая 2007 г. (9) соответствие требованиям технического регламента может быть подтверждено выполнением требований национальных стандартов, предстоит разработать ряд новых стандартов, которые, наряду с уже действующими документами, позволят детализировать конкретные аспекты требований технического регламента.
В сотрудничестве с ВНИИМТ Росздравнадзора сотрудниками Лаборатории проблем клинико-лабораторной диагностики ММА им. И. М Сеченова Росздрава проведена работа по гармонизации отечественной номенклатуры клинических лабораторных исследований с разделом «Медицинские изделия для диагностики in vitro» Всемирной номенклатуры медицинских изделий (Т. И. Лукичева, Л.М. Прудник, В.С. Михайлова, Л.М. Пименова, О.Г. Кадашева). Проведена научная редакция перевода свыше 4400 наименований изделий для диагностики in vitro (Т.И. Лукичева). Разработан пилотный проект классификатора медицинских изделий для диагностики in vitro (В. В. Меньшиков), которому предстоит пройти апробацию на практике в течение 2008 г. Интенсивно осуществляется разработка стандартов медицинской помощи для амбулаторно-поликлинических учреждений, стационарного и санаторно-курортного лечения, для педиатрической и скорой медицинской помощи, в составе которых значительное место занимают лабораторные услуги.
За 2005-2007 гг. Министерством здравоохранения и социального развития РФ утверждено свыше 600 стандартов медицинской помощи для различных нозологических форм. Ряд стандартов за эти годы уже прошел актуализацию с учетом развития науки и практики. В связи со значительным объемом информации относительно лабораторных диагностических исследований в стандартах медицинской помощи эти материалы будут опубликованы в отдельном справочном издании.
5. Внедрение стандартов в практику
Приведенные выше сведения позволяют представить основные направления проводимой в нашей стране работы по стандартизации в лабораторной медицине. Однако нужно четко понимать, что внедрение в практику тысяч клинико-диагностических лабораторий нашей страны, разработанных и утвержденных документов потребует немалых усилий и информационного и организационного характера – публикаций, докладов на совещаниях по обмену опытом, включения материалов стандартов в программы последипломного образования. Предстоит организовать проведение сертификации процессов выполнения исследований в клинико-диагностических лабораториях в соответствии с сертификационными требованиями (10), разработанными на основе положений стандарта ГОСТ РИСО 15189. Как уже отмечено выше, систематизировать работу по внедрению требований этого основополагающего стандарта могут помочь рекомендации, содержащиеся в стандарте ИСО 22869 (проект русской версии стандарта публикуется в справочнике «Лабораторная диагностика России» 2008/2009). Но одним из важнейших условий является осознание каждым руководителем клинико-диагностической лаборатории, каждым сотрудником лаборатории, что следование требованиям стандартов это не какое-то надуманное осложнение их деятельности, а то условие, которое обеспечивает наиболее надежное и эффективное выполнение лабораторией ее основного предназначения – помощи больному человеку. Справедливость этого утверждения доказывает, в частности, опыт Независимой лаборатории «In vitro» (Москва), в которой уже в течение нескольких лет внедрен менеджмент качества в соответствии с требованиями стандарта ИСО 15189.
Словом, стандартизация в лабораторной диагностике такое же живое дело, как и сама лабораторная медицина.
Литература
1. ГОСТ Р ИСО 15189:2006 «Лаборатории медицинские. Специальные требования к качеству и компетентности». М., Стандартинформ, 2007.
2. ГОСТ Р ИСО 15195:2006 «Лабораторная медицина. Требования к лабораториям референтных измерений». М., Стандартинформ, 2007.
3. ГОСТ Р ИСО 17511:2006 «Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам». М., Стандартинформ, 2007.
4. ГОСТ Р ИСО 18153:2006 «Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений каталитической концентрации ферментов, приписанных калибраторам и контрольным материалам». М., Стандартинформ, 2007.
5. ГОСТ Р ИСО 15193:2007 «Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание референтных методик выполнения измерений». М., Стандартинформ, 2008.
6. ГОСТ Р ИСО 15193:2007 «Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание стандартных образцов».М., Стандартинформ, 2008.
7. ГОСТ Р ИСО 15190:2007 «Лаборатории медицинские. Требования к безопасности». М., Стандартинформ, 2008.
8. ГОСТ Р 52623:2006 «Технологии выполнения простых медицинских услуг. Общие положения». «Проблемы стандартизации в здравоохранении», 2007, 5, с. 77-85.
9. Федеральный Закон № 64 от 1 мая 2007 г. «О внесении изменений в Федеральный Закон «О техническом регулировании».
10. Заикин Е.В., Кадашева О.Г., Лукичева Т.И., Малахов В.Н., Меньшиков В.В., Михайлова В.С., Пименова Л.М., Творогова М.Г., Шульгина М.В. Сертификационные требования к процессам выполнения лабораторных исследований в медицинских организациях, общие требования». «Клиническая лабораторная диагностика», 2006, 9, с. 14-17.
