В. М. Бунтукова Е. К. Клеточная селекция
| Вид материала | Лекция |
- Сущность клеточной теории. Клеточная теория, 37.11kb.
- Темы практических и реферативных работ студентов в рамках физиологического кружка кафедры, 27.13kb.
- Селекция баклажана для аридной зоны нижнего поволжья 06. 01. 05 Селекция и семеноводство, 336.5kb.
- Методические рекомендации по преподаванию биологии в 11 классе. Планы уроков «Селекция, 216.83kb.
- Селекция на повышение требований к ростовым веществам, 52.08kb.
- План: Что такое селекция? Из истории развития селекции, 53.14kb.
- Князев Андрей Николаевич, кандидат биол наук, доцент; биотехнология растений Калашникова, 92.43kb.
- Рабочая программа генетика и селекция Код дисциплины по учебному плану опд ф 1 для, 292.62kb.
- Генетика, селекция, гибридизация рыб. Тезисы докладов, 21.08kb.
- Задачи селекции : повышение урожайности сортов культурных растений, увеличение продуктивности, 105.58kb.
Пахомова В.М. Бунтукова Е.К.
Клеточная селекция
Методическое пособие для студентов обучающихся по специальности 110200 «Агрономия»
Казань
Содержание
ВВЕДЕНИЕ . . . . . . . . . . . . . . . . . . . . . . 2
- МЕТОДЫ ПОЛУЧЕНИЯ МУТАНТОВ РАСТЕНИЙ
in vitro И ИХ ОЦЕНКА
- Исходный материал в клеточной селекции . . . . . . . . 3
- Характеристика изменчивости культур in vitro . . . . . 4
- Мутагенез in vitro . . . . . . . . . . . . . . . . . 6
- Доказательство генетической природы изменений . . . . 9
2. ПРИМЕРЫ ПОЛУЧЕНИЯ МУТАНТОВ in vitro
- Устойчивость высших растений к аминокислотам и
их аналогам – селекция на качество . . . . . . . . . . 10
- Устойчивость высших растений к гербицидам . . . . . . 13
- Устойчивость высших растений к болезням растений . . . 18
- Устойчивость высших растений к засолению . . . . . . . 27
- Устойчивость высших растений к ионному стрессу . . . . 29
- Устойчивость высших растений к засухе . . . . . . . . 30
- Устойчивость высших растений к экстремальным
температурам . . . . . . . . . . . . . . . . . . . . 30
- Устойчивость высших растений к радиационному
стрессу . . . . . . . . . . . . . . . . . . . . . . . 32
СПИСОК ЛИТЕРАТУРЫ . . . . . . . . . . . . . . 33
Введение
Технологии клеточной и генной инженерии растений имеют огромные перспективы для растениеводства и селекционного процесса. Одним из методов сельскохозяйственной биотехнологии является клеточная селекция, при которой отбор клеточных линий и растений с новыми наследственными признаками производится на уровне культивируемых in vitro клеток. Получение растений из отобранных в селективных условиях мутантных клеток возможно благодаря уникальному свойству растительной клетки – ее тотипотентности. Приемы культивирования растительных клеток и регенерации из них растений, разработанные для многих важных сельскохозяйственных культур, уже сейчас позволяют экспериментально реализовать возможности клеточной селекции, т.е. применять ее для создания новых сортов растений. Перечень мутантов с важными сельскохозяйственными признаками, селекция которых осуществима на клеточном уровне, довольно большой. К ним относятся мутанты устойчивости к стрессовым факторам, гербицидам, различным заболеваниям, сверхпродуценты незаменимых аминокислот. Значительный прогресс в области клеточной селекции достигнут благодаря разработке техники культивирования голых растительных клеток – изолированных протопластов.
Этапным периодом для развития метода культуры клеток можно считать 70-е годы, когда были сделаны успехи в разработке способа получения изолированных протопластов растений, а также открытие гибридизации соматических клеток. Изолированные протопласты высших растений стали объектом клеточного конструирования путем гибридизации или введения в них чужеродного генетического материала (клеточных органелл). Применение методов клеточного конструирования служит задачам получения растений с новыми свойствами (в силу тотипотентности растительной клетки).
Современные агрономы, работающие в сельском хозяйстве, в сфере АПК должны в совершенстве владеть методами биотехнологии, уметь использовать их для увеличения производства сельскохозяйственной продукции, улучшения ее качества и повышения устойчивости.
1. Методы получения мутантов растений in vitro
и их оценка
Культивирование растительных клеток in vitro представляет универсальную экспериментальную модель для получения и изучения биохимических растительных мутантов. Преимуществами системы in vitro являются: 1) возможность работы с миллионами клеток; 2) использование селективных систем; 3) получение растений-регенерантов. Клеточную селекцию можно проводить на разном исходном материале – каллусе, стеблевых меристемах, однако чаще используют суспензионную культуру и протопласты (Лутова Л.А., 2003).
Для успешного получения мутантов на клеточном уровне требуется решение ряда методических проблем, в том числе: 1) разработка селективных систем; 2) разработка методов индуцированного мутагенеза; 3) доказательство генетической природы изменений на уровне соматических клеток.
1.1. Исходный материал в клеточной селекции
В настоящее время в качестве исходного материала чаще используют протопласты. Преимущества использования изолированных протопластов заключаются в следующем.
Во-первых, культивирование изолированных протопластов позволяет получать огромное число жизнеспособных единиц, что увеличивает исследуемую выборку.
Во-вторых, за счет специальных приемов культивирования можно свести до минимума возможность перекрестного питания (когда мутантные клетки поддерживают немутантные, или когда немутантные клетки инактивируют всю колонию, включая мутантов). Это практически исключает выделение химер.
В-третьих, свежевыделенные мезофильные протопласты почти генетически однородны (до 90% их находится в G0-периоде).
В-четвертых, все это открывает возможность внедрения методик микробиальной генетики, клеточной и генной инженерии.
К модельным объектам, которые используются для выделения протопластов, предъявляется ряд важных требований:
1) быстрый рост в культуре in vitro;
2) сохранение регенерационной способности;
3) короткий жизненный цикл;
4) существование истинных гаплоидов;
5) небольшое число хромосом;
6) наличие высокоэффективных методик выделения и культивирования протопластов;
7) наличие генетической карты.
Примерами модельных объектов, в той или иной мере удовлетворяющих вышеуказанным требованиям, являются Nicotiana plumbaginifolia, N.tabacum, N.sylvestris, Datura innoxia, Petunia hybrida, Hyoscyamus muticus, Arabidopsis thaliana.
В качестве исходного материала можно использовать семена и зародыши растений, побеги и черенки, различные меристемные культуры (например, сегменты листьев).
1.2. Характеристика изменчивости культур in vitro
Производя отбор интересующих его вариантов, исследователь использует для идентификации разные критерии (визуальное отличие искомых объектов от остальных по какому-либо признаку, способность существовать в селективных условиях и т.д.), т.е. отбор основан на изменчивости, возникающей в исходной совокупности клеток.
Очевидно, что для практических задач интерес представляют лишь те культуры, у которых изменения носят мутационный характер. Как известно, изменчивость не обязательно обусловлена мутациями; во многих случаях она связана с физиологическими изменениями, т.е. является модификационной.
У высших растений в норме имеет место естественное генетическое разнообразие клеток, которое возникает в результате дифференцировки и, как следствие, накопления соматических мутаций. Так, у части видов покрытосеменных большинство дифференцированных клеток находятся в эуплоидном состоянии. Почти у 80% покрытосеменных на разных этапах онтогенеза в соматических клетках возможна эндоредупликация хромосом и возникновение клеток различного уровня плоидности; иногда встречаются анеуплоидные клетки. Наиболее часто химеризм и миксоплоидия с высокой частотой анеуплоидных клеток отмечаются у апомиктичных и вегетативно размножающихся растений. Известно также, что при возникновении стрессовых ситуаций (повышение температуры, засоление, ранения, изменение условий прорастания и т.д.) у растений наблюдается увеличение частоты хромосомных перестроек, что приводит к химерности. Стресс, в этих случаях, видимо, вызывает физиологические нарушения, одним из результатов которых являются аномальные митозы, и как следствие – возникновение клеток с измененным числом хромосом.
Другой, не индуцированный мутагенами и широко применяемый при работе с клеточными культурами тип изменчивости – самоклональный, который возникает в процессе культивирования клеток in vitro. Известно, что после регенерации растений из недифференцированной каллусной культуры или протопластов растения-регенеранты могут характеризоваться фенотипическими и генетическими изменениями со значимой частотой. Причина подобных изменений кроется в процессах, происходящих на стадии недифференцированного роста в культуре in vitro. Многочисленные исследования показали, что в большинстве случаев эта изменчивость имеет генетическую природу. Сомаклональная изменчивость нашла широкое применение в селекции и может быть использована для «улучшения» некоторых сортов и линий по отдельным признакам.
При культивировании клеток in vitro выявлены также фенотипические изменения, стабильно передающиеся дочерним клеткам, но не проявляющиеся в растениях-регенерантах и их половом потомстве. Подобные изменения названы эпигенетическими. Установлено, что причиной таких изменений служат изменения экспрессии генов, вызванные ненормальной для растительных клеток ситуацией – культивированием в недифференцированном состоянии in vitro.
Помимо перечисленных выше типов изменчивости возможны также недлительные модификационные изменения. Модификации могут быть адаптивными, способствующими выживанию организма в изменившихся условиях. В культуре in vitro при интенсивном воздействии каких-либо факторов часто появляются морфозы, при этом степень выражения морфоза усиливается прямо пропорционально интенсивности воздействия (подобного не наблюдается при мутагенезе).
Таким образом, процесс культивирования клеток in vitro является богатым источником разного типа изменений. Наибольший интерес представляют наследственные изменения, которые являются источником новых форм растений. Однако длительные модификации также представляют интерес в случае использования каллусных культур как культур-продуцентов.
1.3. Мутагенез in vitro
Условно мутагенез делят на индуцированный и спонтанный. Подразумевается, что в первом случае мутации обусловлены действием известных и осознанно применяемых мутагенных факторов, а во втором случае природа мутаций случайна и не поддается конкретизации.
Индуцируемый мутагенез широко и давно применяется в генетике и селекции для получения истинных мутантов. Установлено, что вызвать мутации могут некоторые химические соединения, определенные электромагнитные излучения, а также некоторые вирусы и плазмиды. В клеточной селекции используются прежде всего химические и физические мутагены (табл.)
Таблица
Основные мутагены, используемые в клеточной селекции,
и некоторые аспекты их применения (по Лутовой Л.А., 2003)
| Химические | Физические |
| 1. Этилметансульфонат (ЭМС). 2.N-метил-N-нитро-N-нитрозогуани -дин (НГ). Применяется для получе-ния мутантов устойчивости к анало-гам аминокислот, к аналогам нуклеи-новых кислот; для получения некото-рых ауксотрофов. 3.N-этил-N-нитрозомочевина (НЭМ). Используется для получения мутан-тов устойчивости к хлорату, аналогам аминокислот; для получения мутан-тов, дефектных по нитратредуктазе. | 1. γ-излучение. Используется для получения ауксотрофов, мутантов устойчивости к гербицидам и вали-ну. 2. УФ-излучение. Хорошо заре-комендовало себя при получении некоторых ауксотрофов и мутантов устойчивости к Валину. 3. Рентгеновское излучение. При-меняется для получения пигменто-дефектных мутантов. |
Еще одним типом мутагенов, к которым можно отнести некоторые генетические элементы, способные встраиваться в геном реципиента и функционировать там нормально, чаще всего применяемая на растительных объектах является трансформация с использованием Тi-плазмид либо векторнезависимый перенос генов путем поглощения их через цитоплазматическую мембрану клеток.
Мутационные изменения в популяции растительных клеток – события редкие. Определение уровня спонтанных мутаций у разных культур в разных селективных системах дает величину порядка 1.10-7, что сопоставимо с уровнем мутаций в клетках животных и микроорганизмов. Поэтому для повышения частоты мутаций используют индуцированный мутагенез.
Выживаемость растительных клеток после обработки мутагеном. При обработке исходного материала мутагеном значение имеет зависимость выживаемости клеток от дозы мутагена. В общем виде выживаемость после воздействия мутагеном является функцией от репродуктивного потенциала единичной клетки (способности к образованию колоний). Наиболее удобным объектом для изучения выживаемости являются изолированные протопласты. В случае культивирования протопластов можно получить количественную оценку выживаемости. Для этого вводится понятие эффективности высева (ЭВ), которая определяется так:
число выживших клеток
Э
 В =
В =общее число высеянных клеток
Для модельных объектов ЭВ может достигать 70-90%, при этом контрольная, без мутагена, выживаемость принята за 100%.
Выживаемость может зависеть также от того, на какой стадии развития культуры применяется обработка мутагеном. Например, известно, что у Nicotiana plumbaginifolia до 90% свежевыделенных мезофильных протопластов находятся в G0-периоде; через 20 ч культивирования протопласты вступают в S-стадию (max = 36 ч) и затем в G2-стадию. При этом чувствительность протопластов к мутагену (в данном случае – радиочувствительность) с начала их культивирования возрастает и достигает максимума в G1-периоде клеточного цикла. Отсюда очевидно, что мутагенез нужно проводить либо сразу после выделения протопластов, либо на следующий день.
Обладают токсическими свойствами и физические, и химические мутагены, но токсичность химических мутагенов несравнимо выше. Так, если даже высокие дозы облучения подавляют только репродуктивную и регенерационную способность клетки, сохраняя ее метаболическую активность, то при работе с химическими мутагенами наблюдается высокий процент летальности клеток, а иногда и гибель всей клеточной популяции. Поэтому, применяя химические мутагены, используют невысокие их дозы.
В общем случае наблюдается обратная зависимость выживаемости от дозы мутагена, но в то же время частота возникновения измененных клонов прямо пропорциональна дозе мутагена. Поэтому большие дозы мутагенов могут быть использованы для получения редких мутантов. Выживаемость зависит и от плоидности клеток. Так, гаплоидные протопласты более чувствительны к мутагенам, чем диплоидные.
При изучении мутагенеза в культурах растительных клеток используются фенотипические маркеры, которыми могут служить устойчивость к антибиотикам, основаниям нуклеиновых кислот, аминокислотам и их аналогам, хлорофиллдефектность. Например, при использовании в качестве универсального маркера устойчивость к валину показано, что γ-облучение дозой 500 рад приводит к 10-кратному увеличению частоты возникновения val-устойчивых мутантов Nicotiana plumbaginifolia по сравнению с контролем. В качестве модельных маркеров используют также устойчивость к лизину + треонину, ядерные мутации пигментодефектности.
Методы селекции мутантов клеток in vitro. В литературе описано несколько методов селекции (выделения) мутантов в культуре клеток высших растений. Лутовой Л.А. (2003) предлагается следующая схема:

 селекция на регенерация экспрессия изменений
селекция на регенерация экспрессия изменений клеточном уровне в R0 (R0 – первичный
регенерант)
При классическом подходе селекция производится в поколениях М2, … Мn. К селекции мутантов можно приступать не сразу после обработки мутагеном, а после некоторого периода культивирования, необходимого для экспрессии мутационных изменений:
о


 бъект мутагенез неселективное селекция на
бъект мутагенез неселективное селекция накультивирование селективных
в течение средах
продолжительного
времени
К основным методам селекции относятся:
1. Позитивная селекция (прямая) – в этом случае выживает лишь определенный мутантный тип.
2. Тотальная селекция – индивидуальное тестирование всех клеточных клонов.
3. Негативная селекция (непрямая) – в этом случае происходит избирательная гибель делящихся клеток дикого типа и выживание метаболически неактивных клеток (долее требуется дополнительная идентификация у них мутаций).
4. Визуальная селекция и неселективный отбор – вариантная линия отбирается среди клеток визуально или биохимически.
Прямая селекция используется для выделения мутантов устойчивости к антиметаболитам (антибиотикам, токсинам, гербицидам). При этом концентрация токсических веществ не должна значительно превышать пороговую величину, когда полностью ингибируется рост тканей. Возможен ступенчатый вариант прямой селекции, при котором концентрация токсина в среде увеличивается. Негативная селекция широко применяется для получения условно-летальных мутантов (ауксотрофных, температуро-чувствительных). Тотальная селекция может быть использована для получения любого типа мутантов.
1.4. Доказательство генетической природы изменений
Обработка суспензии мутагенами, высев в селективных условиях и получение измененных колоний не завершают работу по селекции на клеточном уровне, необходимо еще доказательство генетической природы полученных изменений. Среди выделенных клонов могут быть адаптированные клеточные линии, рост которых в селективных условиях не связан с мутациями. Они являются результатом отбора в популяции более устойчивых клеток в пределах нормы реакции данного генотипа.
Большую группу измененных клонов или вариантных линий составляют такие, образование которых связано с изменениями на эпигенетическом уровне. Это в первую очередь относится к прототрофным по фитогормонам клонам. Для деления клеток in vitro необходимо внесение экзогенных ауксинов и цитокининов, которые в норме синтезируются в меристемах растений, но не в дифференцированных тканях. Возможно, что при получении прототрофных клонов на основе дифференцированных тканей происходит дерепрессирование блокированных генов, т.е. при использовании селективной системы in vitro возникает не мутация, а эпигенетические изменения, которые наследуются только в ряду клеточных поколений, но не сохраняются в системе клетка – растение-регенерант – клетка. Так, для соматических клеток табака было показано, что возникновение прототрофности по фитогормонам происходит постепенно и теряется при вторичном введении в культуру тканей растений-регенерантов, полученных в прототрофных линиях.
Для определения природы изменений на уровне соматических клеток существует ряд критериев, каждый из которых в отдельности не может служить доказательством мутации:
- Частота измененных клеток должна быть очень низкой (1.10-6-10-7).
- Она значительно повышается при использовании мутагенов (1.10-4-10-5).
- Измененные клетки способны к стабильному длительному росту.
- Стабильность измененного признака сохраняется при отсутствии селективного давления.
- Обнаруживается продукт измененного гена.
Так как растительные ткани in vitro обладают тотипотентностью, т.е. способностью при определенных условиях регенерировать растения, то для
доказательства природы изменений на соматическом уровне возможен генетический анализ растений-регенерантов.
2. Примеры получения мутантов in vitro
2.1. Устойчивость к аминокислотам и их аналогам –
селекция на качество
Значение растительных белков в пище человека и животных невозможно переоценить, поскольку именно белки содержат незаменимые аминокислоты, которых нет в животных продуктах и которые люди неспособны синтезировать. Такими аминокислотами являются триптофан, лизин, треонин, метионин. Однако и у растений их недостаточно. Например, злаки имеют низкий уровень лизина, кукуруза – триптофана, бобовые – метионина. Поэтому данный признак в настоящее время включен во многие селекционные программы. Одним из подходов к решению этой задачи является получение мутантов с нарушенной регуляцией биосинтеза аминокислот. Отбор таких мутантов проводят in vitro на средах с повышенным содержанием аминокислот или их аналогов.
Почему это возможно? Как правило, устойчивость к повышенному уровню аминокислот и их аналогов связана с нарушением регуляции в их биосинтезе. Установлено, что регуляция синтеза большинства аминокислот у растений осуществляется по принципу обратного ингибирования, т.е. уровень аминокислоты находится под контролем биосинтеза. Например, такая система регуляции описана для аминокислот, которые синтезируются из аспартата (по Лутовой Л.А., 2003). Причем наличие одной аминокислоты в среде может ингибировать биосинтез других, имеющих общий путь биосинтеза. В средах с повышенной концентрацией какой-то одной аминокислоты клетки дикого типа гибнут, так как для нормального роста им необходимы те аминокислоты, которых нет в среде и биосинтез которых ингибирован избыточным количеством присутствующей:
а
 спартат
спартат
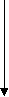
аспарагин

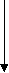 гомосерин лизин
гомосерин лизинметионин
т
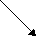
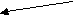 реонин
реонин
 валин
валин изолейцин
лейцин
У устойчивых клеток изменена регуляция биосинтеза, связанная с чувствительностью ферментов к обратной регуляции. Снижение чувствительности ферментов к обратной регуляции аминокислотами ведет к повышенному синтезу аминокислот или определенной аминокислоты. Этот подход является основой для получения растений-сверхпродуцентов по незаменимым аминокислотам.
Другой подход – селекция с применением аналогов, которые также влияют на активность ферментов в системе биосинтеза соответствующих аминокислот. Поскольку клетки дикого типа чувствительны к аналогам, то это позволяет вести селекцию in vitro.
Однако часто аналоги обладают токсичным действием, которое связано:
1) с замещением аминокислоты аналогом в белке, что приводит к формированию нефункционального белка;
2) с ингибированием ключевого фермента и соответственно вообще синтеза аминокислот.
Устойчивость к аналогам аминокислот может быть обусловлена разложением аналога, изменением проницаемости мембраны. Но наибольший интерес представляет случай, когда нарушение чувствительности к аналогу связано с мутацией по гену, контролирующему один из ферментов биосинтеза.
Устойчивость к лизину и треонину. Обе аминокислоты являются аминокислотами аспартатного пути синтеза. Селекция проводилась на уровне протопластов кукурузы (Лутова Л.А., 2003). Протопласты помещали на среду с 1 мМ лизина + треонина. Быстрорастущие клоны переносили на среду с более высокой концентрацией этих аминокислот. Были выделены линии, которые активно росли на среде с 2,5 мМ лизина + траонина, а уровень свободных лизина, треонина и метионина у них был в 2-9 раз выше, чем у исходной линии. У регенерантов отмечено шестикратное увеличение уровня треонина и двукратное – изолейцина. Генетический анализ выявил доминантный характер признака устойчивости, а ген был обозначен как LTK-19. В потомстве от скрещивания у гетерозигот обнаружено 33-кратное, а у гомозигот – 77-кратное повышение свободного треонина. Следовательно, устойчивость наследовалась как ядерный доминантный или полудоминантный признак.
У Nicotiana plumbaginifolia были также получены устойчивые клоны и растения со сверхпродукцией треонина и изолейцина. Генетический анализ свидетельствовал о моногенном и доминантном характере наследования признака устойчивости. Мутацией был затронут ген, контролирующий синтез лизинчувствительной аспартаткиназы.
Таким образом, селекция на устойчивость к аминокислотам может способствовать улучшению аминокислотного баланса белков.
Устойчивость к аналогам пролина. Способность растений к синтезу пролина важна потому, что пролин является неспецифическим протектором, позволяющим получать растения, устойчивые к стрессам – засолению и экстремальным температурам.
Для селекции используют следующие аналоги пролина: гидроксипролин, тиопролин, 3,4-дегидропролин. Например, подавление роста in vitro клеток моркови наблюдали при концентрации 1 мМ гидроксипролина, устойчивые же клетки продолжали расти при его содержании 100 мМ. Устойчивые клеточные линии содержали в 15-30 раз больше свободного пролина по сравнению с контрольными. Кроме пролина было обнаружено 5-кратное повышение содержания аланина, 2,5-кратное повышение содержания серина по сравнению с диким типом. Попытки оценить корреляцию между устойчивостью к пролину, его сверхпродукцией и устойчивостью к стрессовым факторам – хлориду натрия – выявили такую связь для клеток моркови и табака, но растения-регенеранты получить не удалось.
Много работ было проведено на картофеле, при этом использовались среды, содержащие гидроксипролин в концентрации 5-10 мМ. В результате были получены клеточные клоны со сверхуровнем пролина в 2-25 раз выше по сравнению с исходной формой. Из одного клеточного клона были получены растения-регенеранты, у которых анализировалась устойчивость к низким температурам. У разных растений устойчивость варьировала, но была значительно выше, чем у исходных контрольных форм. Генетический анализ признака «устойчивости к низким температурам» показал, что он контролируется полудоминантным ядерным геном.
Следовательно, эксперименты in vitro подтвердили связь между сверхуровнем пролина и устойчивостью к стрессовым факторам.
Итак, у высших растений можно получать мутации устойчивости к аминокислотам и их аналогам, чаще это мутации доминантные и моногенные, на биохимическом уровне они связаны с нарушением регуляции биосинтеза, а именно с изменением чувствительности отдельных ферментов биосинтеза к аминокислотам и их аналогам.
Такие клеточные культуры и растения можно использовать:
- для изучения метаболизма аминокислот у высших растений;
- как маркеры в работах по трансформации и соматической гибридизации;
- как исходный материал для селекции на качество;
- как исходный материал для селекции на устойчивость к стрессам.
