Совершенствование метода получения клонированных эмбрионов крупного рогатого скота при использовании в качестве доноров ядер соматических клеток
| Вид материала | Автореферат |
- Реферат внедрение технологии по трансплантации эмбрионов крупного рогатого скота, 16.54kb.
- Программа развития сельского хозяйства и регулирования рынков сельскохозяйственной, 16.63kb.
- Откорм крупного рогатого скота, 305.74kb.
- Комплексная Программа нпо нарвак по диагностике, профилактике и лечению инфекционных, 72.94kb.
- Доклад на коллегии Управления ветеринарии по теме: «Эпизоотическое состояние Ульяновской, 67.74kb.
- Ветеринарно-санитарные правила по профилактике и ликвидации хламидиоза крупного рогатого, 202.68kb.
- На базе научно-практического центра эндоваскулярной нейрорентгенохирургии амн украины, 491.31kb.
- современного фермерского хозяйства, на базе существующего крестьянского хозяйства,, 72.62kb.
- Реферат совершенствование схемы профилактики и лечения инфекционного керато-конъюнктивита, 38.16kb.
- Совершенствование системы ветеринарно-профилактических мероприятий и её влияние, 471.82kb.
На правах рукописи
КОМИССАРОВ Андрей Владимирович
Совершенствование метода получения
клонированных эмбрионов крупного рогатого скота при использовании в качестве доноров ядер соматических клеток
03.01.06 – биотехнология (в том числе бионанотехнологии)
А в т о р е ф е р а т
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2010
Работа выполнена в лаборатории клонирования животных отдела «Биотехцентр» ГНУ Научно-исследовательский институт пушного звероводства и кролиководства имени В.А. Афанасьева РАСХН (ГНУ НИИПЗК)
Научный руководитель: доктор биологических наук
Маленко Галина Петровна
Официальные оппоненты: доктор ветеринарных наук, профессор
Петров Алексей Михайлович;
доктор биологических наук, профессор
Курило Любовь Федоровна
Ведущая организация – ГНУ Всероссийский научно-исследовательский институт животноводства РАСХН
Защита диссертации состоится «__»________2010 г. в «__» часов на заседании диссертационного совета Д.220.042.01 в ФГОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина» по адресу: 109472, г. Москва, ул. Академика Скрябина, 23.
тел. (495) 377-93-83, факс (495) 377-49-39.
С диссертацией можно ознакомиться в библиотеке ФГОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина».
Автореферат разослан «____» _____________2010 г. и размещен на сайте
Ученый секретарь
диссертационного совета,
профессор Грязнева Т.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Научные разработки в области клонирования животных имеют как фундаментальное, так и прикладное значение. С помощью метода клонирования можно получить ответы на некоторые фундаментальные вопросы биологии развития, ядерно-цитоплазматического взаимодействия, репрограммирования ядра. Путем клонирования можно увеличить поголовье животных с высоким генетическим потенциалом, в частности, элитных быков-производителей (Wilmut et al., 2000), а так же решить проблему сохранения видов животных, находящихся под угрозой исчезновения, и даже восстановления уже исчезнувших (Lanza et al., 2000; Loi et al., 2001). Метод клонирования позволяет существенно увеличить эффективность получения трансгенных животных, что особенно важно в отношении крупного рогатого скота и свиней (Melo et al., 2005). Идея клонирования воплощена в методе переноса ядра (nuclear transfer, NT) клетки-донора в энуклеированную яйцеклетку, находящуюся в метафазе второго деления мейоза (Wilmut et al., 1997). Изначально источниками ядер для подобных исследований служили бластомеры (Willadsen, 1986). В настоящее время достигнуты успехи при переносе ядер соматических клеток (somatic cell nuclear transfer, SCNT) при клонировании овец, крупного рогатого скота, мышей, коз, свиней, кроликов, лошадей, крыс и других видов. Сущность технологии SCNT заключается в том, что в предварительно энуклеированную яйцеклетку (цитопласт) вводится ядро соматической клетки. Классическая технология получения клонированных животных, предложенная 25 лет назад (Willadsen, 1986) и применяемая до настоящего времени, остается сложной. Альтернативой традиционному методу является zona-free метод, когда ооциты перед энуклеацией освобождаются от zona pellucida, что значительно упрощает большинство последующих этапов (Peura et al., 1998).
Одно из центральных мест в SCNT занимает получение культур клеток, их соответствующая подготовка, а так же культивирование реконструированных эмбрионов in vitro до стадии бластоцисты, что позволяет проводить трансплантацию эмбрионов крупного рогатого скота реципиентам нехирургическим способом. Большой интерес метод клонирования представляет для получения генетически модифицированных свиней для целей ксенотрансплантации. Поэтому часть этапов технологии клонирования мы провели с ооцитами свиней.
Цель и задачи исследований. Цель настоящих исследований – совершенствование метода получения клонированных эмбрионов крупного рогатого скота путем реконструкции ооцитов без zona pellucida при использовании в качестве доноров ядер соматических клеток и последующего культивирования их in vitro до стадии бластоцисты.
Для достижения поставленной цели необходимо было решить следующие задачи:
- Подготовить качественные цитопласты на основе ооцитов крупного рогатого скота, дозревших in vitro.
- Получить линии фетальных фибробластов и линии фибробластоподобных клеток кожи от взрослых животных.
- Разработать метод подготовки соматических клеток для использования их в качестве доноров ядер.
- Изучить влияние сроков активирования на эффективность развития реконструированных эмбрионов крупного рогатого скота in vitro.
- Усовершенствовать условия культивирования in vitro реконструированных эмбрионов крупного рогатого скота без zona pellucida.
- Отработанные методы подготовки цитопластов апробировать на ооцитах свиней.
Научная новизна. Впервые было показано, что первое полярное тельце на поверхности ооцитов свиней без zona pellucida является точным указателем расположения материнских хромосом.
Показано, что при использовании среды электрослияния без солей кальция снижается вероятность преждевременного активирования ооцитов крупного рогатого скота под воздействием электроимпульса. При этом эффективность электрослияния конструкций цитопласт-соматическая клетка, подготовленных с применением фитогемагглютинина, составляет 95%.
Показано, что увеличение продолжительности пребывания трансплантированного ядра соматической клетки в неактивированной цитоплазме энуклеированного ооцита до 4–5 ч не снижает уровень развития реконструированных эмбрионов крупного рогатого скота in vitro до стадии бластоцисты.
Практическая значимость. Энуклеация ооцитов без zona pellucida путем апсирации PBI с небольшим участком прилегающей цитоплазмы позволяет получить качественные цитопласты без применения ядерных красителей и УФ лучей.
Применение в качестве доноров ядер соматических клеток, криоконсервированных по достижении 80–100%-ного монослоя, без дополнительного культивирования после размораживания позволяет использовать однородную популяцию соматических клеток на протяжении серии экспериментов. Система WOW может быть использована для культивирования эмбрионов крупного рогатого скота без zona pellucida, совмещая в себе достоинства как индивидуального, так и группового культивирования. Полученные результаты могут найти применение в экспериментальной эмбриологии, в изучении процессов раннего эмбриогенеза млекопитающих, при практической работе с эмбрионами крупного рогатого скота.
Результаты проведенных исследований вошли в состав 5 отчетов о научно исследовательской работе лаборатории клонирования животных отдела «Биотехцентр» по теме: «Разработать эффективные способы, направленные на создание новых типов животных, тканей и культур клеток на основе методов клеточной инженерии» и были утверждены на заседаниях ученого совета ГНУ НИИПЗК в период с 2006 по 2010 г., а также в состав готовящихся методических рекомендаций: «Методические положения по получению клонированных эмбрионов крупного рогатого скота и их культивированию in vitro, обеспечивающие выход бластоцист на уровне 40–45%», предназначенных для научных сотрудников, преподавателей, аспирантов и студентов научно-исследовательских институтов, ветеринарных и биологических факультетов ВУЗов.
Личный вклад соискателя. Автор принимал непосредственное участие во всех этапах работы, в т.ч. при приготовлении инструментов и микроинструментов для выделения ооцитов, для работы с ооцитами, цитопластами и реконструированными эмбрионами, при приготовлении питательных сред и рабочих растворов, эстральной сыворотки крови крупного рогатого скота (ЭСК). Автор обеспечивал получение и доставку яичников животных в лабораторию, проводил выделение ооцитов, их дозревание, освобождение от клеток кумулюса и zona pellucida, энуклеацию, приготовление пар цитопласт-соматическая клетка, электрослияние, активирование и культивирование реконструированных эмбрионов in vitro. Осуществлял выделение линий соматических клеток от взрослого животного и плода, их культивирование и криоконсервацию. Автор участвовал при проведении анализа и обобщении полученных результатов исследований, написании статей, отчетов и докладов.
В работе использованы материалы, полученные автором лично, а также в соавторстве с зав. отделом «Биотехцентр», д.б.н. Маленко Г.П., научным сотрудником отдела «Биотехцентр» Степановым О.И. и другими сотрудниками отдела, которым выражаю глубокую благодарность за помощь и поддержку.
Апробация результатов диссертации. Основные материалы диссертации вошли в состав 5 научных отчетов, которые доложены и обсуждены на ежегодных отчётных сессиях ГНУ НИИПЗК в период с 2006 по 2010 гг., а также на международных научных конференциях: IV Международная конференция "Актуальные проблемы биологии в животноводстве" (г. Боровск, 2006); The 33rd Annual Conference of the International Embryo Transfer Society (Kyoto, Japan, 2007); 7-я Международная научная конференция-школа "Современные достижения и проблемы биотехнологии сельскохозяйственных животных: роль нанотехнологий в реализации приоритетных задач биотехнологии" (п. Дубровицы, 2008); 2-й Международный конгресс-партнеринг и выставка по биотехнологии и биоэнергетике "ЕвразияБио-2010" (г. Москва, 2010); V Международная научная конференция "Актуальные проблемы биологии в животноводстве" (г. Боровск, 2010).
Публикации. По результатам диссертации опубликовано 4 статьи, в т.ч. 3 - в журналах, входящих в перечень ведущих рецензируемых научных журналов и изданий ВАК (Сельскохозяйственная биология, Доклады РАСХН, Известия РАН. Серия биологическая) и 1 статья в международном журнале (Cloning and Stem Cells).
Объем и структура диссертации. Материалы диссертации изложены на 164 страницах машинописного текста и включают введение, обзор литературы, собственные исследования, обсуждение полученных результатов, практическое использование полученных научных результатов, рекомендации по использованию научных выводов, список использованной литературы (333 источника, в т.ч. 326 – иностранных авторов). Работа содержит 13 таблиц, 8 рисунков и 9 страниц приложений.
На защиту выносятся следующие положения и результаты:
- Первое полярное тельце на поверхности ооцитов свиней без zona pellucida является точным указателем расположения материнских хромосом. Энуклеация ооцитов свиней без zona pellucida путем аспирации PBI с небольшим количеством прилегающей цитоплазмы позволяет эффективно удалять материнский хроматин при минимальном снижении объема цитопласта, без применения ядерных красителей и воздействия УФ светом.
- Пары цитопласт-соматическая клетка, приготовленные с использованием фитогемагглютинина, могут быть эффективно слиты под воздействием электрического импульса в среде без солей кальция. Отсутствие солей кальция в среде снижает вероятность преждевременного активирования цитопластов на этапе электрослияния.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работа была выполнена в период с 2005 по 2010 годы в лаборатории клонирования животных отдела «Биотехцентр» ГНУ НИИПЗК в рамках тематического плана НИР института на 2006–2010 г. по теме: «Разработать эффективные способы, направленные на создание новых типов животных, тканей и культур клеток на основе методов клеточной инженерии», № госрегистрации 15070.7815014664.06.8.002.1.
Для получения линий фетальных фибробластов использовали 45-днев-ные плоды крупного рогатого скота. Для получения фибробластоподобных клеток кожи использовали уши взрослого крупного рогатого скота и свиней. Весь материал получали в убойном цехе мясокомбината.
Комплексы ооцит – клетки cumulus oophorus (КОК) выделяли из яичников убитых животных. Основу сред для работы с ооцитами, эмбрионами и соматическими клетками на воздухе составляла среда TLP-HEPES (Bavister, Yanagimachi, 1977) c добавлением 1 мМ L-глутамина. Для культивирования эмбрионов готовили среду SOF (Tervit et al., 1972). Все манипуляции по подготовке ооцитов, цитопластов и получению реконструированных эмбрионов проводили в условиях лаборатории без применения нагревательных столиков.
Ооциты выделяли из фолликулов диаметром 2–8 мм с помощью устройства для разрезания фолликулов (Маленко, 2001). Среду для дозревания КОК готовили на основе среды 199 с солями Эрла (НПП «ПанЭко», Россия) с добавлением натрия пирувата 0,66 мM, цистеамина 0,1 мM, глутамина 2 мM, гонадотропина хорионического 5 Ед/мл, гормона фолликулостимулирующего 5 мкг/мл, эстрадиола 1 мкг/мл и 10% ЭСК. Дозревание ооцитов проводили при 39ºС в атмосфере воздуха с 5% СО2. Клетки кумулюса удаляли в 0,1%-ном растворе гиалуронидазы, zona pellucida в растворе проназы 2 мг/мл. Ооциты с выделившимся первыми полярными тельцами (PBI) считали дозревшим до стадии метафаза II (MII) и отбирали для энуклеации. Остальные ооциты помещали в подготовленные заранее капли из среды дозревания и просматривали с интервалом 30 мин.
Энуклеацию ооцитов проводили в масляной камере Фонбрюна (Фонбрюн, 1951), на инвертированном микроскопе (Axiovert M35, OPTON, Германия) при помощи микроманипулятора (КМ-2, Россия) путем аспирации РВI с небольшим участком прилегающей цитоплазмы стеклянной микропипеткой с наружным диаметром 20–25 мкм. Полученные цитопласты возвращали в среду дозревания ооцитов и инкубировали при тех же условиях до использования. Подготовку пар цитопласт-соматическая клетка проводили вручную под стереомикроскопом (Nikon, Япония) в микрокаплях раствора фитогемагглютинина (PHA) 50 мкг/мл. Для проведения электрослияния конструкции подвергали одиночному импульсу постоянного тока 1800 В/cм длительностью 20 мкс в камере с параллельными проволочными электродами (ИБП РАН, Россия) в растворе маннитола. Реконструированные эмбрионы активировали химическим методом с использованием иономицина и 6-DMAP (Susko-Parrish et al., 1994).
Культивирование реконструированных эмбрионов проводили в специально подготовленных четырехлуночных планшетах (Vajta et al., 2000) в атмосфере 5% СО2, 5% О2, 90% N2 при температуре 39ºС. Дробление эмбрионов оценивали через 42–48 ч после активирования, развитие до стадии бластоцисты через 8,5 суток культивирования.
Результаты представлены как средняя арифметическая±стандартная ошибка средней арифметической. Данные были проанализированы при помощи метода Стьюдента (Лакин, 1980).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Дозревание in vitro ооцитов крупного рогатого скота и свиней
В используемой нами системе к 24 ч дозревания in vitro стадии MII достигли 88,2% ооцитов крупного рогатого скота. При этом по времени дозревания выделялись две относительно компактные группы ооцитов. Группа «рано дозревших» ооцитов, составляющая 47,9%, завершала ядерное дозревание к 17,5 часам от начала дозревания (hours postinitiation of maturation, hpm), в период 18–20 hpm ядерное дозревание завершало еще 28,3% ооцитов (Malenko et al., 2009).
Получение ооцитов свиней проводили аналогично получению ооцитов крупного рогатого скота. Однако, дозревание ооцитов свиней оказывается растянутым почти на сутки (Miyoshi et al., 2002). Для синхронизации дозревания ооцитов свиней мы применили двушаговую систему с использованием неспецифического ингибитора синтеза белка циклогексимида. Освобождение ооцитов свиней от клеток кумулюса и zona pellucida заканчивали к 40 hpm, в это время первое полярное тельце было обнаружено у 24% ооцитов. Через час, в 41 hpm, PBI обнаружили еще у 23% ооцитов. В дальнейшем наблюдали резкий спад в уровне дозревания ооцитов (рис. 1).
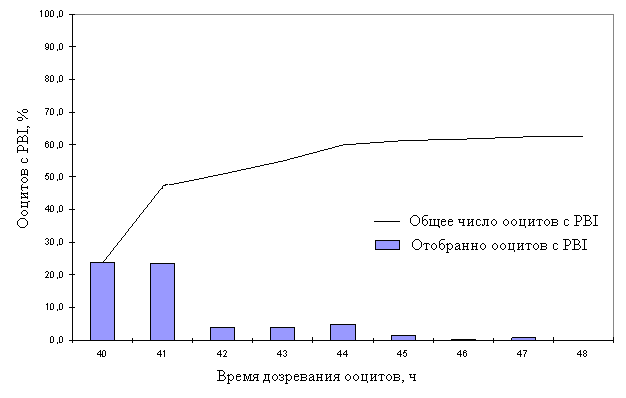
Рис.1. Динамика созревания ооцитов свиней in vitro (3 повтора; n=598)
К 48 hpm уровень дозревания ооцитов свиней in vitro составил 62,4%. Таким образом, в использованной системе 75% от всех дозревших in vitro ооцитов свиней завершили ядерное дозревание к 41 hpm от начала культивирования.
Эффективность «слепой» энуклеации ооцитов
крупного рогатого скота и свиней без zona pellucida
Для определения эффективности выбранного метода энуклеации часть предполагаемых цитопластов и аспирированных с РВI фрагментов ооцитов окрашивали флуоресцентным ядерным красителем Hoechst 33342, локализацию хроматина выявляли под микроскопом в УФ свете. Первые полярные тельца ооцитов крупного рогатого скота и свиней хорошо различимы как под стереомикроскопом, так и под микроскопом в проходящем свете. В отсутствии zona pellucida РВI удерживаются на поверхности ооцитов благодаря связи с материнскими хромосомами и поэтому четко указывают на их расположение. Предварительная обработка ооцитов, связанная с удалением клеток кумулюса и zona pellucida, в ранние сроки дозревания не нарушает связи между PBI и поверхностью ооцита. В нашей работе была показана высокая эффективность метода «слепой» энуклеации ооцитов крупного рогатого скота без zona pellucida – около 97% (Prokofiev et al., 2007). Уровень эффективности «слепой» энуклеации ооцитов свиней без zona pellucida составил 97,3 % (табл. 1).
Таблица 1. Эффективность «слепой» энуклеации ооцитов
крупного рогатого скота и свиней без zona pellucida
| Вид животного | Число энуклеированных ооцитов, n | Получено цитопластов, n | Эффективность энуклеации, % |
| Крупный рогатый скот | 227 | 220 | 96,9 |
| Свиньи | 75 | 73 | 97,3 |
Таким образом, «слепая» энуклеация ооцитов крупного рогато скота и свиней без zona pellucida является эффективным методом подготовки цитопластов.
Получение и криоконсервация линий фетальных фибробластов
и фибробластоподобных клеток кожи взрослого животного
Для получения линий фетальных фибробластов нами были использованы метод классической «теплой» трипсинизация и «холодной» трипсинизации. При «холодной» трипсинизации подготовленную ткань оставиляли в 0,25%-ном растворе трипсина при 4ºС на 15 ч, а затем раствор трипсина удаляли. Флакон с тканью помещали в термостат при 39ºС, через 30 мин добавляли 3 мл ростовой среды и пипетировали для получения суспензии клеток. При культивировании клеток, полученных методом «холодной» трипсинизации, на вторые сутки наблюдалось относительно небольшое количество клеток, не прикрепившихся к культуральной поверхности. Сомкнутый монослой был достигнут на 3 сутки. После «тёплой» трисинизации монослой достигался в более поздние сроки, хотя при последующем субкультивировании различий не наблюдалось. Таким образом, «холодная» трипсинизация является щадящим методом дезагрегации тканей плода.
Для получения линии фибробластоподобных клеток кожи взрослого животного был успешно применен метод эксплантатов. Использование на начальном этапе культивирования небольшого количества питательной среды, содержащей 50% сыворотки крови, способствует с одной стороны улучшению питания эксплантатов, а с другой способствует фиксированию кусочков на культуральной поверхности, что является обязательным условием выселения клеток из эксплантатов. Полученные линии клеток криоконсервировали на 2–3 пассаже по достижении 80–100% монослоя с использованием программного замораживателя.
Получение фетальных фибробластов крупного рогатого скота
в G1 фазе клеточного цикла
Выбор стадии клеточного цикла клетки-донора ядра имеет решающее значение для успеха всей технологии переноса ядра в целом. Чаще всего в качестве доноров ядер используют клетки в G0 фазе клеточного цикла, синхронизированные контактным ингибированием или сывороточным голоданием. Однако в последнее время в литературе появились сообщения о преимуществе клеток-доноров ядер, находящихся в G1 фазе клеточного цикла, по уровню развития до рождения после переноса реконструированных эмбрионов самкам реципиентам.
Для выделения клеток в G1 фазе испытали «sake-off» метод (Kasinathan et al., 2001). Идея метода заключается в том, чтобы отобрать из популяции клетки на стадии митоза во время цитокинеза. В это время клетка отделяется от субстрата и оказывается разделенной бороздой деления на две части сферической формы.
Сосуд с пролиферирующей культурой клеток встряхивали на Vortex. Среду собирали и центрифугировали для концентрации клеток. Клетки на стадии цитокинеза отбирали вручную под стереомикроскопом. При помощи микроманипулятора кончиком стеклянной иглы диаметром 2–5 мкм надавливали в месте соединения дочерних клеток между собой. Механически разделенные клетки, находящиеся в G1 фазе, в пределах 40 мин после переноса в ростовую среду прикрепляются к подложке, распластываются и возобновляют клеточный цикл, что свидетельствует о высокой жизнеспособности полученных клеток.
Воздействие электроимпульса на ооциты крупного рогатого скота
в зависимости от наличия кальция в среде
Предполагается, что репрограммирование ядра соматической клетки осуществляется под воздействием цитоплазмы зрелой не активированной яйцеклетки. Основным пусковым механизмом, вызывающим активирование ооцита, является подъем концентрации внутриклеточного кальция. Электрический импульс, используемый для электрослияния цитопласта и соматической клетки, может вызвать проникновение ионов кальция из окружающей среды в цитоплазму ооцитов. В наших экспериментах около половины ооцитов крупного рогатого скота в возрасте 20–22 hpm были активированы в результате проведения электрического импульса в случае присутствия 0,05 мМ CaCl2 в растворе маннитола. Но если в раствор маннитола соли кальция не включали, то этот показатель резко снизился и составил 26,7% (табл. 2).
Таблица 2. Активирование ооцитов крупного рогатого скота
под воздействием различных факторов
| Способ активирования | Количество экспериментов, n | Всего ооцитов, n | Активировано, n (%) |
| Спермием (in vitro оплодотворение) | 1 | 12 | 8 (66,7) |
| Химическое активирование (иономицин + 6-DMAP) | 3 | 52 | 42 (80,8) |
| Электроимпульс в среде с кальцием | 2 | 34 | 16 (47,1) |
| Электроимпульс в среде без кальция | 1 | 15 | 4 (26,7) |
Таким образом, отсутствие солей кальция в среде электрослияния позволяет снизить возможность преждевременного активирования цитоплазмы ооцита. В то же время, в результате электрослияния в растворе маннитола без солей кальция большинство конструкций цитопласт-соматическая клетка, подготовленных с использованием PHA, сливались в течение 10–15 мин. Эффективность электрослияния цитопластов с соматическими клетками как крупного рогатого скота, так и свиней, составляет около 95% (табл.3).
Таблица 3. Эффективность электрослияния пар цитопласт-соматическая клетка в среде без солей кальция
| Вид животного | Количество опытов, n | Сливали пар, n | Слилось пар, n (%) |
| Крупный рогатый скот | 12 | 538 | 510 (94,8) |
| Свиньи | 3 | 300 | 289 (96,3) |
Таким образом, отсутствие солей кальция в среде электрослияния не оказало негативного влияния на эффективность электрослияния цитопласта и соматической клетки.
Использование криоконсервированных соматических клеток
в качестве доноров ядер сразу после оттаивания
и после дополнительного культивирования
Работа по клонированию животных предполагает ведение культуры соматических клеток для использования их в качестве доноров ядер. Обычно замороженные и хранящиеся в жидком азоте соматические клетки оттаивают и культивируют до достижения монослоя 2–3 суток, а затем дополнительно еще 3–4 суток для синхронизации в G0 фазе. Мы попытались использовать соматические клетки в качестве доноров ядер непосредственно после их размораживания. По уровню дробления реконструированных эмбрионов при использовании в качестве доноров ядер клеток сразу после размораживания и после дополнительного культивирования были получены близкие результаты, до стадии бластоцисты в обоих случаях развивалось около 30% реконструированных эмбрионов (табл. 4).
Таблица 4. Развитие реконструированных эмбрионов крупного
рогатого скота в зависимости от метода подготовки
соматических клеток-доноров ядер
| Фибробласты | Реконструирован-ных эмбрионов n | Число дробив-шихся эмбрионов, n (%) | Число бластоцист n (%) |
| Сразу после размораживания (4 повтора) | 179 | 97 (54,2) | 52 (29,1) |
| После предварительного культивирования (6 повторов) | 203 | 128 (63,1) | 61 (30,1) |
Таким образом, фетальные фибробласты, замороженные по достижении монослоя, могут использоваться в качестве доноров ядер непосредственно после оттаивания без дополнительного культивирования.
Влияние режима элекрослияни-активирование на эффективность развития реконструированных эмбрионов in vitro
Для определения влияния продолжительности периода от слияния до активирования на эффективность развития реконструированных эмбрионов до стадии бластоцисты проведена серия экспериментов. В первой серии экспериментов период от электрослияния до активирования реконструированных эмбрионов составлял от 1 до 2 ч или свыше 3 ч. Достоверно больше реконструированных эмбрионов дробилось и развивалось до стадии бластоцисты при активировании в период от 3 до 5,5 ч после электрослияния (табл. 5).
Таблица 5. Развитие реконструированных эмбрионов крупного
рогатого скота in vitro при разной продолжительности периода
от электрослияния до активирования
| Группа | Число эмбрионов. n | Дозрева- ние ооцитов, ч | Интервал до активи-рования, ч | Развитие эмбрионов | ||
| ≥2 бластомера, n (%) | ≥4 бластомера, n (%) | Бластоциста, n (%) | ||||
| 1 | 104 | 19–22 | 1 – 2 | 41 (42,3±8,7) a | 20 (20,4±4,0) a | 15 (14,7±4,5)a |
| 2 | 152 | ≤18 | 3 – 5,5 | 112 (80,0±8,0) b | 93 (69,6±10,1) b | 59 (43,8±7,5) b |
Для обеих групп в каждый день проведения экспериментов (6 повторов) выделенные из яичников и дозревшие in vitro ооциты были из одной и той же партии. Возраст цитопластов ко времени активирования в обеих группах составлял от 23 до 25 hpm, активирование конструкций обеих групп проводилось одновременно. Однако для получения цитопластов в группе 2 были использованы ооциты, завершившие дозревание менее чем за 18 hpm, считая от начала дозревания in vitro, а в группе 1 в период от 19 до 22 hpm. Таким образом, такой фактор как динамика дозревания ооцитов in vitro мог оказать влияние на полученные результаты.
В следующем эксперименте в группе 2 цитопласты вновь были получены из ооцитов, выделивших PBI к 18 hpm, а в группе 1 в более поздние сроки. В отличие от первого эксперимента продолжительность периода от электрослияния до активирования конструкций в обеих группах была примерно одинакова и составляла от 3 до 3,7 ч (табл. 6).
Таблица 6. Развитие реконструированных эмбрионов крупного
рогатого скота in vitro в зависимости от сроков дозревания
ооцитов-реципиентов и времени активирования конструкций
| Группа | Число эмбри-онов, n | Дозрева-ние ооцитов, ч | Интервал до активи-рования, ч | Развитие эмбрионов | ||
| ≥2 бластомера, n (%) | ≥4 бластомера, n (%) | Бластоцис- та, n (%) | ||||
| 1 | 109 | 18–20 | 3–3.7 | 73 (67,7±4,7) | 54 (49,1±3,9) | 34 (31,0±5,1) |
| 2 | 340 | ≤18 | 3–3.2 | 255 (74,6±4,2) | 201 (61,2±4,5) | 130 (40,2±4,0) |
| 3 | 313 | ≤18 | 4–5 | 222 (72,9±4,8) | 186 (62,8±5,6) | 136 (46,4±5,0) |
Показатели дробления и развития до стадии бластоцисты были выше в группе 2, чем в группе 1, хотя эти различия статистически не достоверны. Группу 3 составляли эмбрионы, реконструированные на основе дозревших in vitro к 18 ч ооцитов, но активированные через 4–5 ч после электрослияния. До стадии бластоцисты в этом случае развивалось 46,4% эмбрионов.
ВЫВОДЫ
- Использование на начальном этапе культивирования эксплантатов небольшого количества питательной среды, содержащей 50% сыворотки крови, способствует их фиксации на субстрате и последующему выселению из них клеток. Для выделения линий фетальных фибробластов эффективным является «холодный» метод трипсинизации.
- Фетальные фибробласты крупного рогатого скота, криоконсервированные по достижении 80–100%-ного монослоя, могут использоваться в качестве доноров ядер сразу после оттаивания без дополнительного культивирования.
- Соматические клетки в G1 фазе клеточного цикла можно получить путем механического разделения на микроманипуляторе клеток, находящихся в цитокинезе М фазы.
- Первые полярные тельца на поверхности ооцитов свиней располагаются в непосредственной близости от материнских хромосом. Метод «слепой» энуклеации ооцитов свиней без zona pellucida является эффективным методом подготовки цитопластов без использования ядерных красителей и применения УФ света.
- Уровень активации ооцитов крупного рогатого скота под воздействием электроимпульса в среде с 0,05 мМ CaCl2 составляет 47,1% и резко снижается (до 26,7%) при отсутствии солей кальция.
- Эффективность электрослияния пар цитопласт-соматическая клетка, подготовленных с использованием фитогемагглютинина, в растворе маннитола без включения солей кальция составляет 95%.
- Для получения реконструированных эмбрионов крупного рогатого скота без zona pellucida на стадии бластоцисты эффективной является система WOW, которая позволяет совместить достоинства как группового, так и индивидуального культивирования эмбрионов in vitro.
- При интервале между электрослиянием и активированием 4–5 ч уровень развития реконструированных эмбрионов до стадии бластоцисты составил 46% при использовании в качестве цитопластов энуклеированных ооцитов крупного рогатого скота, дозревших in vitro к 18 ч от начала дозревания.
Практическое использование полученных научных результатов
- Результаты проведенных экспериментов вошли в состав 5 отчетов лаборатории клонирования животных отдела «Биотехцентр» ГНУ НИИПЗК: «Изучить возможность клонирования особей крупного рогатого скота путем пересадки ядер соматических клеток» (промежуточный, утв. в 2006 г), «Разработать методику получения первичной линии соматических клеток от взрослого животного для получения клонированных эмбрионов крупного рогатого скота» (промежуточный, утв. в 2007 г), «Изучить эффективность использования ооцитов-реципиентов разного срока дозревания при получении клонированных эмбрионов крупного рогатого скота» (промежуточный, утв. в 2008 г), «Изучить влияние режима электрослияния – активирования конструкций на развитие клонированных эмбрионов крупного рогатого скота in vitro» (промежуточный, утв. в 2009 г), «Разработать методические положения по получению клонированных эмбрионов крупного рогатого скота при использовании соматических клеток-доноров ядер и дозревших in vitro энуклеированных ооцитов-реципиентов» (заключительный, утв. в 2010 г).
- Результаты экспериментов вошли в состав методических рекомендаций «Методические положения по получению клонированных эмбрионов крупного рогатого скота и их культивированию in vitro, обеспечивающие выход бластоцист на уровне 40–45%», предназначенных для научных сотрудников, преподавателей, аспирантов и студентов научно-исследовательских институтов, ветеринарных и биологических факультетов ВУЗов.
рекомендации по использованию научных выводов
- Соматические клетки, криоконсервированные по достижении 80–100%-ного монослоя, могут быть использованы в качестве клеток-доноров ядер сразу после размораживания без дополнительного культивирования.
- Для выделения линии фибробластоподобных клеток кожи взрослого животного рекомендуется метод эксплантатов. Для лучшей фиксации фрагментов ткани на культуральной поверхности в первые сутки рекомендуется использование питательной среды с 50% сыворотки крови.
- Для электрослияния конструкций цитопласт-соматическая клетка крупного рогатого скота, подготовленных с применением фитогемагглютинина, рекомендуется использовать среду без включения солей кальция.
- Для культивирования эмбрионов крупного рогатого скота без zona pellucida рекомендуется система WOW. Размещение эмбрионов в микроячейках позволяет избежать агрегации их друг с другом и обеспечивает создание микросреды в непосредственной близости к эмбриону, а достаточно большой общий объем среды в лунке планшета позволяет исключить необходимость ее замены во время культивирования эмбрионов in vitro до стадии бластоцисты.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Получение клонированных эмбрионов крупного рогатого скота при использовании в качестве доноров ядер фетальных фибробластов непосредственно после хранения в жидком азоте / Маленко Г.П., Комиссаров А.В., Степанов О.И. и др. // Актуальные проблемы биологии в животноводстве: материалы V международной конференции. – Боровск: ВНИИФБиП. – 2006. – С. 256–257.
- Blind enucleation of oocytes is highly efficient in zona-free bovine cloning / Prokofiev M.I., Stepanov O.I., Komissarov A.V. et al. // Reprod. Fertil. Dev. – 2007. – V. 19. – P. 156–157.
- Эффективность развития клонированных эмбрионов крупного рогатого скота в зависимости от сроков дозревания in vitro ооцитов-реципиентов / Комиссаров А.В., Степанов О.И., Антипова Т.А. и др. // Современные достижения и проблемы биотехнологии сельскохозяйственных животных: роль нанотехнологий в реализации приоритетных задач биотехнологии: сборник трудов. – Дубровицы: ГНУ ВНИИЖ. – 2008. – С. 58–64.
- Подготовка ооцитов-реципиентов при клонировании крупного рогатого скота / Степанов О.И., Комиссаров А.В., Антипова Т.А. и др. // Современные достижения и проблемы биотехнологии сельскохозяйственных животных: роль нанотехнологий в реализации приоритетных задач биотехнологии: сборник трудов. – Дубровицы: ГНУ ВНИИЖ. – 2008 – С. 223–226.
- Реконструирование эмбрионов крупного рогатого скота с использованием в качестве доноров ядер свежеразмороженных фетальных фибробластов / Прокофьев М.И., Степанов О.И., Комиссаров А.В. и др. // Сельскохозяйственная биология. – 2008. – № 4. – С. 53–57.
- Совершенствование этапов клонирования крупного рогатого скота при использовании ооцитов без zona pellucida / Прокофьев М.И., Комиссаров А.В., Степанов О.И. и др. // Доклады РАСХН. – 2008. – № 5. – С.48–50.
- Efficiency of asynchronously in vitro-matured oocytes as recipients for nuclear transfer and of blind enucleation in zona-free bovine cloning / Malenko G.P., Stepanov O.I., Komissarov A.V. et al. // Cloning Stem Cells. – 2009. – V. 11. – P. 287–292.
- Маленко Г.П., Степанов О.И., Комиссаров А.В. Подготовка цитопластов высокого качества для реконструкции эмбрионов крупного рогатого скота / Второй международный конгресс «ЕвразияБио-2010»: сборник тезисов. – М.: «Издательство «Копиринг». – 2010. – С. 121–123.
- Маленко Г.П., Комиссаров А.В., Степанов О.И. Развитие in vitro реконструированных эмбрионов крупного рогатого скота, активированных в разные сроки после активирования // Известия РАН. Серия биологическая. – 2010. – № 5. – С. 527–534.
- Malenko G.P., Komissarov A.V., Stepanov O.I. In vitro development of the reconstructed bovine embryos activated at various time after electrofusion // Biology bulletin. – 2010. – V. 37. – P. 446–452.
