Культивирование эфедры односемянной ( ephedra monosperma ) в условиях in vitro и получение биологически активных веществ на ее основе 03. 00. 23- биотехнология
| Вид материала | Автореферат диссертации |
- Производство и применение биологических средств защиты растений на основе энтомофагов,, 37.05kb.
- Учет влияния экстремальных условий, 87.45kb.
- Совершенствование технологии производства природно-полусладких вин в условиях российской, 313.28kb.
- Комплексной терапии некоторых заболеваний, 49.14kb.
- Технология выгонки новых сортов тюльпанов с использованием различных субстратов и биологически, 1125.77kb.
- Биотехнология белковых лекарственных веществ. Рекомбинантные белки, принадлежащие, 79.62kb.
- А. Курдынко pr бадов (2009) часть 1 Анализ рынка и потребителей бад, 196.55kb.
- Разработка технологии дрожжевых обогатителей пищи на базе молочной сыворотки и растительного, 627.15kb.
- Определение некоторых биологически-активных веществ, основанное на эффекте сенсибилизированной, 343.94kb.
- Фундаментально-прикладные исследования на кафедре проводятся по направлению поиск, 198.77kb.
На правах рукописи
ПЛЫНСКАЯ Жанна Александровна
КУЛЬТИВИРОВАНИЕ ЭФЕДРЫ ОДНОСЕМЯННОЙ
(ePHEDRA MONOSPERMA) В УСЛОВИЯХ IN VITRO И ПОЛУЧЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ НА ЕЕ ОСНОВЕ
03.00.23– Биотехнология
Автореферат диссертации на соискание ученой степени
кандидата технических наук
Красноярск – 2009
Р
 абота выполнена в ГОУ ВПО «Сибирском государственном технологическом университете» на кафедре химической технологии древесины и биотехнологии.
абота выполнена в ГОУ ВПО «Сибирском государственном технологическом университете» на кафедре химической технологии древесины и биотехнологии.Научный руководитель:
доктор технических наук, профессор Величко Надежда Александровна
Официальные оппоненты:
доктор технических наук, профессор Войнов Николай Александрович
кандидат биологических наук, доцент Хижняк Сергей Витальевич
Ведущая организация: ГОУ ВПО «Восточно-Сибирский государственный технологический университет»
Защита диссертации состоится «26» июня 2009 г. в 10.00 часов на заседании диссертационного совета Д 212.253.01 при ГОУ ВПО «Сибирский государственный технологический университет», по адресу:
660049, г. Красноярск, пр. Мира, 82.
Отзыв (в двух экземплярах с заверенными подписями) просим направить ученому секретарю диссертационного совета по адресу:
660049, г. Красноярск, пр. Мира, 82.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Сибирский государственный технологический университет»
Автореферат разослан «____» _________2009 г.
Ученый секретарь
диссертационного совета
кандидат химических наук, доцент Исаева Е.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы
Нерациональное использование природных ресурсов, техногенное воздействие человека на окружающую среду отрицательно влияет на сохранность генофонда лекарственных растений.
Эфедра односемянная ( Ephedra monosperma) - двудомный густоветвистый кустарник, источник ценных биологически активных веществ, в том числе фармакологически значимых алкалоидов. Растение занесено в Красную книгу.
В народной медицине Ephedra monosperma используется при кашле и высокой температуре, бронхиальной астме, крапивнице, гипотонии, ринитах. Алкалоиды эфедры - антагонисты наркотиков, снотворных и употребляется при отравлении ими.
Культура клеток и тканей растений в условиях in vitro является не только одним из альтернативных источников получения необходимых биологически активных веществ, но и может служить нетрадиционным методом охраны и восстановления популяции Ephedra monosperma.
Цель и задачи исследования
Введение в культуру in vitro Ephedra monosperma, изучение синтеза алкалоидов в зависимости от гормонального состава среды и способов культивирования, влияющих на накопление биологически активных веществ в каллусной ткани. В связи с целью были поставлены следующие задачи:
- подобрать условия для введения в культуру in vitro и получить стабильно растущие каллусные ткани Ephedra monosperma;
- установить влияние гормонального состава среды и способа культивирования на рост клеточной биомассы и накопление алкалоидов в каллусной ткани Ephedra monosperma;
- провести сравнительную оценку состава биологически активных веществ интактного растения и каллусной ткани Ephedra monosperma;
- разработать технологическую схему получения алкалоидов из клеточной культуры Ephedra monosperma и провести оценку экономической эффективности данного производства.
Научная новизна работы
Впервые введена в культуру in vitro Ephedra monosperma. Проведена модификация питательной среды Murashige and Skoog по гормональному составу, обеспечивающая высокие темпы накопления продуктов вторичного метаболизма в каллусной ткани Ephedra monosperma. Предложена технологическая схема получения алкалоидов из клеточной культуры Ephedra monosperma.
Практическая значимость работы
Впервые предлагается использовать клеточную биомассу Ephedra monosperma в качестве источника алкалоидов.
На основе представленных научных и экспериментальных исследований разработана технологическая схема получения алкалоидов из каллусной ткани Ephedra monosperma. Получена опытная партия продукта и его качество подтверждено актом получения.
Апробация работы: основные результаты исследований докладывались и обсуждались на международных конференциях: «Биотехнология, нанотехнология и физико-химическая биология» (Казахстан, 2008); «Пищевые технологии и биотехнология» (Казань, 2008); «Биология клеток растений in vitro и биотехнология» (Москва, 2008). Во всероссийских конференциях: «Лесной и химический комплексы – проблемы и решения» (Красноярск, 2007); «Новые достижения в химии и химической технологии растительного сырья» (Барнаул. 2009); «Химия и жизнь» (Новосибирск. 2009).
Структура и объём работы
Диссертационная работа изложена на 116 страницах машинописного текста, содержит 12 рисунков и 14 таблиц.
Работа состоит из введения, литературного обзора, методической экспериментальной и технологической частей, выводов, библиографического списка, состоящего из 113 наименований.
Публикации
Материалы диссертации изложены в 8 публикациях (из них 2 статьи в журналах, рекомендованных ВАК). Экспериментальные результаты, представленные в диссертации, получены лично соискателем и опубликованы в соавторстве с руководителем.
Содержание работы
Во введении обоснована актуальность темы, сформулирована цель и задачи исследований, показана научная новизна и практическая ценность результатов работы.
Аналитический обзор
В аналитическом обзоре проведен анализ отечественной и зарубежной литературы по изучению химического состава растений рода Ephedra. Рассмотрены методы культивирования хвойных растений в условиях in vitro и влияние различных групп фитогормонов на физические и морфогенетические программы растений. Большое развитие получил метод культуры клеток для синтеза продуктов вторичного метаболизма, производство которых является дорогостоящим, либо вообще невозможным. Одними из таких веществ являются алкалоиды эфедры, химический синтез которых трудно выполним и экономически невыгоден. Поэтому имеет большое практическое значение получение алкалоидов из клеточной ткани Ephedra monosperma.
Объекты и методы исследований
При выполнении работы объектами исследования служили интактное растение Ephedra monosperma, собранное в окрестностях г. Красноярска, и инициированная из него каллусная ткань, выращенная на модифицированной питательной среде Murashige and Skoog.
В этом разделе дана характеристика объекта исследования. Приведены описания методик, используемых для изучения химического состава интактного растения и каллусной ткани Ephedra monosperma. Описаны условия введения в культуру эксплантов и получения каллусной культуры Ephedra monosperma.
Экспериментальная часть
Получение стерильных интактных растений и введение их в культуру in vitro
На начальном этапе исследования важно было подобрать условия для стерилизации эксплантов Ephedra monosperma. Необходимость введения в культуру in vitro стерильных растений эфедры односемянной была обусловлена трудностями, связанными с инициацией образования и развитие стерильной недифференцированной ткани (каллуса), и разработки условий её культивирования. Получение стерильных растений in vitro являлось одним из первых этапов исследования.
Наиболее часто применяемыми для стерилизации эксплантов являются растворы диацида, KMnO4, гипохлорита натрия, пероксида водорода и этилового спирта (таблица 1).
Наиболее приемлемой оказалась двухступенчатая стерилизация:
- первая ступень: 0,1 %-й раствор KMnO4, в течение 20 мин;
- вторая ступень: 0,1 % -й раствор диацида + Твин-80, (10:0,01) в течение 1 мин.
При этом достигался наиболее высокий процент живых, незараженных эксплантов. При проведении дальнейших экспериментов использовали эти условия стерилизации.
Таблица 1– Эффективность различных схем стерилизации эксплантов Ephedra monosperma
| Вариант | Состав стерилизующего раствора | Экспозиция, мин | Отмывка | Эффектив-ность стерили-зации, % |
| 1 | 0,1 % -й раствор диацида + Твин-80 (10:0,01) | 1 | Вода дистиллированная, 3×15 мин | 45 |
| 2 | 0,1 %-й раствор KMnO4 | 20 | Вода дистиллированная, 3×15 мин | 55 |
| 3 | 96 %-й этиловый спирт | 0,5 | Вода дистиллированная, 3×15 мин | 15 |
| 4 | Двухступенчатая стерилизация: 1) 0,1 %-й раствор KMnO4 2) 0,1 %-й раствор Диацид + Твин-80 (10:0,01) | 1) 20 2) 1 | Вода дистиллированная, 3×15 мин | 92 |
| 5 | 70 %-й раствор этанола + 10 %-й раствор гипохлорита натрия (1:1) | 30 | Вода дистиллированная, 3×15 мин | 11 |
| 6 | 10 %-й раствор пероксида водорода | 5 | Вода дистиллированная, 3×15 мин | 10 |
| 7 | 10 %-й раствор пероксида водорода | 15 | Вода дистиллированная, 3×15 мин | 5 |
| 8 | 70 %-й раствор этанола + Твин-80 (10:0,02) | 4 | Вода дистиллированная, 3×15 мин | 28 |
Введение в культуру in vitro Ephedra monosperma
Введение в культуру in vitro осуществлялось на безгормональные питательные среды со стандартным минеральным составом по Murashige and Skoog, Uata, Кnop и Гамборга.
В результате проведенных экспериментов по введению в культуру растений Ephedra monosperma было установлено, что минеральный состав среды, при одних и тех же фото- и температурном режимах и одинаковом органическом фоне, влияет на процессы жизнеспособности, роста и регенерации введенных in vitro эксплантов (таблица 2).
Таблица 2 - Влияние минерального состава питательных сред на жизнеспособность и качественные характеристики растений в условиях in vitro
| Название среды | Количество жизнеспособных растений, % | Качественная характеристика растений |
| Murashige and Skoog | 97,50 | состояние отличное, растения зеленого цвета, наблюдается рост |
| Uata | 66,60 | состояние хорошее, растения зеленого цвета, рост не наблюдается |
| Кnop | 29,30 | состояние удовлетворительное, растения бледно-зеленого цвета, рост не наблюдается |
| Гамборга | 88,00 | состояние отличное, растения зеленого цвета, наблюдается рост |
Минеральная низкосолевая среда по макро- и микроэлементам Knop вызывала этиолированность - потерю хлоропластов растений Ephedra monosperma в течение 20-ти суток культивирования.
На низкосолевой среде Uata, в состав которой входят только макроэлементы, этиолированности тканей не отмечалось, однако рост и развитие экспланта происходило медленнее, чем на высокосолевых средах Гамборга и Murashige and Skoog (MS).
Среды Гамборга и MS отличаются между собой только по наличию солей, таких как KNO3 и KH2PO4. В среде Гамборга данные компоненты отсутствуют. Отмечено, что наличие этих солей влияет на рост и приживаемость эксплантов.
Растения, культивируемые на среде с минеральным составом по MS, показали высокий процент жизнеспособности (97,50 %) и сравнительно низкое содержание алкалоидов (0,17 %).
В дальнейших исследованиях по подбору условий для роста и инициирования каллусной ткани из Ephedra monosperma была проведена модификация питательной среды Murashige and Skoog.
Влияние регуляторов роста на каллусогенез Ephedra monosperma
Считается, что наиболее важными компонентами питательной среды, определяющими каллусогенез, являются регуляторы роста. Модификации подвергается в первую очередь фитогормональная составляющая питательной среды, в связи с этим основной целью этого этапа исследования было изучение влияния экзогенных регуляторов роста на рост культуры клеток Ephedra monosperma.
В качестве эксплантов для получения изолированных культур были использованы верхушки молодых побегов Ephedra monosperma размером от 7 до 20 мм. Экспланты стерилизовали по схеме, приведенной выше, и помещали в пробирки базальным срезом на агаризованые питательные среды, вследствие чего образовывалась каллусная ткань.
Одним из способов регуляции процессов дифференциации и метаболизма в культурах клеток и тканей растений является подбор питательных сред с использованием различных концентраций гормонов, т.е. модификация сред.
Исследовали влияние модифицированных сред с различной концентрацией гормонов 2,4-Д, кинетина, а-НУК, 6-БАП на развитие и накопления каллусной ткани и алкалоидов.
Гормональный состав сред и характеристика тканей, полученных на данных средах, приведены в таблице 3.
Таблица 3 - Характеристика каллусной ткани эфедры односемянной в зависимости от уровня гормонов
| Код среды | Соотношение гормонов | Качественная характеристика ткани | Прирост каллусной ткани в пассажах, г/л | |||
| I | II | III | IV | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Е1 | НУК-0,1 БАП-0,1 2,4-Д-0,1 | бурая, неоднородная; ярко-зеленая и бледно-желтая | 1,5 | 0,7 | - | - |
| Е2 | НУК-0,2 Кинетин- 0,1 | желто-коричневая, неоднородная; светло-зеленая, рыхлая, дифференцированная | 2,3 | 1,9 | 2,6 | - |
| Продолжение таблицы 3 | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Е3 | НУК-2,5 БАП-0,15 | водянистая, прозрачная, желтая | 7,5 | 7,1 | 10,2 | 11,4 |
| Е4 | БАП-0,1 | буро-зеленая, плотная | 2,5 | 1,3 | - | - |
| Е5 | ИУК-8 Кинетин-0,8 | бурая, светлоохристая, местами структурированная | 1,7 | 0,3 | - | - |
| Е6 | НУК-1 БАП-0,3 | водянистая, бледно-зеленая и желтая, с глобулами | 3,9 | 4,2 | 5,8 | 7,4 |
| Е7 | НУК-0,3 БАП-0,5 2,4-Д-0,1 | водянистая, прозрачная, с ярко-зелеными глобулами | 2,3 | 5,4 | 6,7 | 5,9 |
| Е8 | БАП-1 Кинетин-1 2,4-Д-0,4 | бурая, красноватая с переходом в коричневую | 3,2 | 2,9 | 5,4 | 6,2 |
В результате после первого пассажа наибольший прирост биомассы наблюдали на средах Е3 и Е6 – 7,5 и 3,9 г/л, соответственно. Длительность одного субкультивирования составляла 30 сут.
В втором пассаже наилучшими показателями прироста биомассы и стабильности обладали каллусы на тех же средах Е3 и Е6. Экспонирование на среде Е7 позволило выделить еще два быстрорастущих клона. Во всех остальных вариантах гормонального состава сред наблюдали постепенное угнетение и остановку роста.
В третьем пассаже наблюдали угнетение роста на среде Е3, а на среде Е8 в то же самое время, было отмечено развитие каллусной ткани со складчатой поверхностью, красноватого цвета, отличавшейся мелкозернистой однородной структурой, быстрым ростом и высокими показателями прироста биомассы.
В результате проведенных модификаций к четвертому пассажу были выделены четыре клона, проявляющие стабильные качественные и количественные характеристики (цвет, структура, скорость роста, прирост биомассы) на средах по гормональному составу: Е3, Е6, Е8 и Е7 (таблица 3).
Динамика роста каллусной ткани в зависимости от вида среды и продолжительности культивирования приведена на рисунке 1.
Из рисунка 1 видно, что на среде Е3 масса каллусной ткани вне зависимости от продолжительности культивирования превышает в два раза по сравнению с массой каллусной ткани получаемой на средах Е6 и Е8, и в три раза по сравнению со средой Е7.
На 18-е сутки масса каллусной ткани составляла более 9 г/л, тогда как на средах Е6 и Е8 биомасса клеток не достигала и 5 г/л, а на среде Е7 – 4 г/л.
Полученные результаты по влиянию гормонального состава сред на накопление каллусной ткани Ephedra monosperma показали, что в целом динамика роста ткани имеет одинаковый характер.
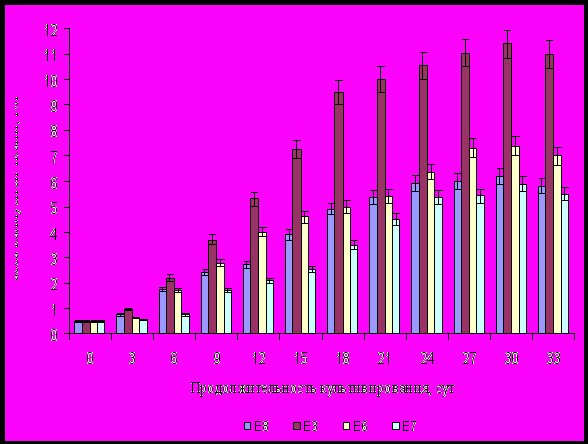
Рисунок 1 – Динамика роста каллусной ткани Ephedra monosperma в
зависимости от вида среды и продолжительности культивирования
На рисунке 2 приведено содержание алкалоидов в каллусной ткани Ephedra monosperma на 30-е сутки культивирования.
Из рисунка 2 видно, что каллусная ткань отличалась по содержанию алкалоидов. На среде Е3 содержание алкалоидов превышает в 1,5 раза по сравнению со средой Е8, в 2,5 раза со средой Е6 и в 4,3 раза со средой Е7. Разница с контролем (стандартной питательной средой MS) по содержанию алкалоидов в каллусной ткани полученной на среде Е3 превосходит в 13 раз.
Из результатов проведенных экспериментов следует, что включение в состав питательной среды регуляторов роста модифицированной питательной среды Е3 (НУК-2,5 и БАП-0,15) позволяет не только накапливать биомассу клеток, но и увеличивать содержание алкалоидов в ней.
Дальнейшие исследования проводились с каллусной тканью, полученной на среде Е3.
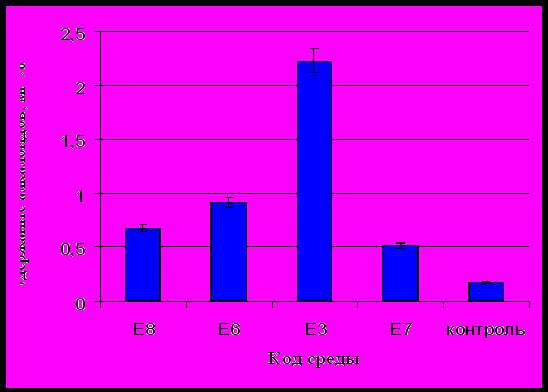
Рисунок 2 - Содержание алкалоидов в каллусной ткани
Ephedra monosperma
Способы получения клеточной культуры Ephedra monosperma
Известно, что большое влияние на накопление продуктов вторичного метаболизма в условиях in vitro оказывает способ культивирования растительной ткани. Для выяснения влияния способов культивирования на процессы роста клеточной ткани Ephedra monosperma была исследована динамика роста при поверхностном культивировании на агаре и инертном носителе с периодическим омыванием ткани питательной средой (Е3).
Выбор пенополиуретана в качестве инертного носителя для выращивания тканей Ephedra monosperma был обусловлен существенными преимуществами этого материала. Это дешевизна, удобство манипулирования, возможность многократного использования носителя. Пористость этого материала обусловливает хороший доступ веществ питательной среды к клеткам.
На рисунке 3 приведена динамика роста каллусной ткани Ephedra monosperma при культивировании на пенополиуретановых подложках и агаре.
По структуре каллусная ткань на пенополиуретане не отличалась от каллусной ткани получаемой на агаре. На пенополиуретане наблюдался более интенсивный рост, чем на агаре. и масса каллусной ткани на пенополиуретане превышала в два раза по сравнению с агаром, уже начиная на 12-е сутки культивирования.
На 30-е сутки масса каллусной ткани полученной на пенополиуретане составила более 11 г/л, тогда как на агаре масса каллуса за этот же период культивирования достигала более 7 г/л.
Пенополиуретановые пластины можно рассматривать как химически нейтральную поддерживающую основу, позволяющую отказаться от использования агара, что удешевляет процесс.
На рисунке 4 представлена динамика накопления алкалоидов в культуре клеток Ephedra monosperma в зависимости от способа культивирования.
Установлено, что при выращивании каллусной ткани на пенополиуретановых подложках накопление алкалоидов происходило раньше, чем при культивировании на агаре. На 30-е сутки содержание алкалоидов в каллусной ткани культивированной на пенополиуретане составляло 1,2 раза больше, чем на агаре.
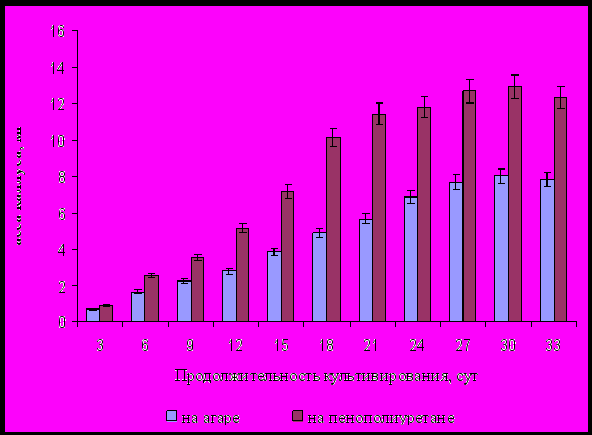
Рисунок 3 - Динамика роста каллусной ткани Ephedra monosperma в
зависимости от способа культивирования.
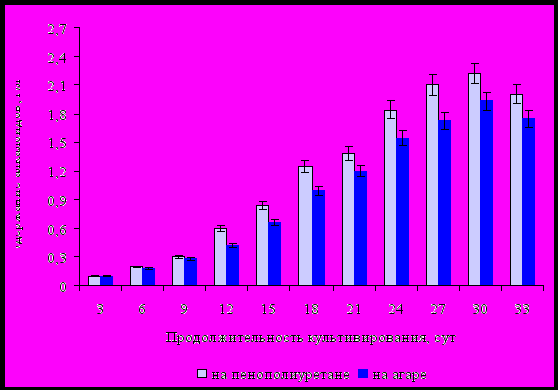
Рисунок 4 - Динамика накопления алкалоидов в культуре клеток Ephedra monosperma в зависимости от способа культивирования
Для применения в фармацевтической промышленности с практической точки зрения представляет интерес каллусная ткань, культивируемая на пенополиуретане, с использованием модифицированной питательной среды Е3.
Содержание биологически активных веществ в интактном растении и каллусной ткани Ephedra monosperma, приведено в таблице 4.
Таблица 4 – Содержание биологически активных веществ в Ephedra monosperma
| Наименование компонента | Содержание | |
| Каллусная ткань культивированная на среде Е3 | Молодые побеги | |
| Алкалоиды, % а.с.м | 2,20±0,03 | 1,31±0,08 |
| Флавоноиды, % а.с.м | 0,10±0,04 | 0,09±0,04 |
| Сапонины, % а.с.м | 4,41±0,05 | 5,32±0,04 |
| Витамин С, мг % | 15,65±0,02 | 13,65±0,07 |
| Витамин Р, мг % | 1,61±0,03 | 4,80±0,06 |
| Витамин В1 мг % | 2,89±0,04 | 2,57±0,03 |
| Хлорофилл А мг % | 0,13±0,03 | 0,25±0,04 |
| Хлорофилл В мг % | 0,21±0,05 | 0,47±0,06 |
Из результатов, приведенных в таблице 4, следует что, каллусная ткань по сравнению с молодыми побегами интактного растения содержит большее количество алкалоидов, практически в два раза превышающее таковое в интактном растении, а также витамина С и В1 (в 1,2 раза).
Следующий этап работы был посвящен выявлению закономерностей влияния основных технологических параметров (температура, продолжительность, гидромодуль, концентрация экстрагента) на выход алкалоидов.
На основании литературных данных и серии предварительных экспериментов в качестве основных факторов были выбраны: температура, гидромодуль и концентрация экстрагента, которые были застабилизированны на следующих уровнях: температура (25 0С); гидромодуль (1:1); концентрация экстрагента (2 %-я уксусная кислота).
В качестве переменного фактора условий экстрагирования нами была выбрана продолжительность экстрагирования алкалоидов (от 1 до 3,5 ч). Основной уровень и граница варьирования выбраны на основании предварительно проведенных исследований.
В качестве выходного параметра был выбран выход суммарного количества алкалоидов У, мг %. Результаты эксперимента приведены в таблице 5.
Таблица 5 – Зависимость выхода алкалоидов (У) от продолжительности экстрагирования (t)
| Вариант | t | У |
| | 0 | 0 |
| 1 | 1 | 1,01 |
| 2 | 1,5 | 2,20 |
| 3 | 2 | 1,90 |
| 4 | 2,5 | 1,81 |
| 5 | 3 | 1,71 |
| 6 | 3,5 | 1,69 |
На рисунке 5 представлена полученная зависимость между продолжительностью экстрагирования и выходом алкалоидов. Данная зависимость описывается уравнением следующего вида:
y= 3,51 ( e –0,168t - e –0,998t)
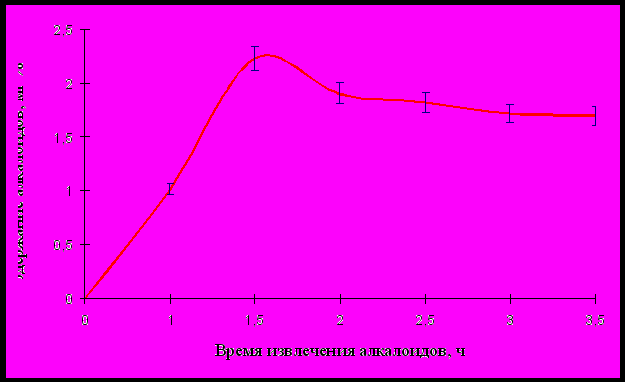
Р
исунок 5 – Влияние продолжительности экстракции на выход алкалоидов в клеточной культуре Ephedra monosperma
У
становлено, что выход алкалоидов максимален (2,20 %) при продолжительности экстрагирования в течение 1,5 ч.
Результаты проведенных экспериментов положены в основу технологической схемы получения алкалоидов из каллусной ткани Ephedra monosperma (рисунок 6).
Процесс получения алкалоидов из каллусной ткани Ephedra monosperma на инертном носителе состоит из ряда последовательных стадий. На первой стадии осуществляется введение растений Ephedra monosperma в культуру in vitro и получение каллусной ткани на инертном носителе в растильной камере (1). Выращивание ткани производится в биореакторе (5), в течение 30 суток при 28-32 0С. Далее полученная биомасса из растильного биореактора (5) подается в экстрактор (8), в качестве экстрагента использована 2 %-я уксусная кислота в соотношении 1:1 (по объему). Экстрагирование осуществляется при умеренном перемешивании в течение 1,5 ч и температуре 25 0С. Полученный экстракт фильтруется для отделения послеэкстракционного остатка каллусной ткани (шрота) и направляется в испаритель (11) для упаривания экстракта и отгонки уксусной кислоты. Уксусная кислота через конденсатор направляется в сбор- ник (14), а упаренный экстракт направляется в сборник (12), в который подается 15 %-я щавелевая кислота и 2 %-я уксусная кислота в соотношении (1:1). Далее экстракт направляется в испаритель (19), где упаривается до 1/5 объема при температуре 55 0С. Затем упаренный экстракт направляют на ионообменную колонну (21) на очистку алкалоидов от полисахаридов, белков, фенольных соединений. Колонну промывают хлороформом. На выходе из колонны получают очищенную фракцию, содержащую алкалоиды. Хлороформный экстракт алкалоидов следует на стадию упаривания в испаритель (23) до образования сухого остатка. После чего в вакуум-испаритель (23) подают горячую воду для перехода оксалатов алкалоидов в алкалоиды. Процесс перекристаллизации осуществляется в кристаллизаторе (25). Промытые кристаллы сушат при комнатной температуре в течение от 3 до 5 ч. Таким образом, получают алкалоиды с содержанием основного вещества не менее 85 %.
Проведенные технико-экономические расчеты, показали эффективность получения алкалоидов из каллусной ткани Ephedra monosperma (таблица 6).
Таблица 6 – Основные технико-экономические показатели производства
| Наименование показателя | Величина |
| 1 Объем производства, т | 1 |
| 2 Объем реализации, тыс. руб. | 6676,00 |
| 3 Численность рабочих: -основных -вспомогательных -руководителей и специалистов | 3 2 1 |
| 4 Фонд заработной платы, руб: -основных -вспомогательных -руководителей и специалистов | 142433,10 21251,00 82368,00 |
| 5 Полная себестоимость годового выпуска, тыс. руб. | 1381,42 |
| 6 Прибыль от реализации, тыс. руб. | 5294,58 |
| 7 Чистая прибыль, тыс. руб. | 3490,82 |
| 8 Рентабельность производства, % | 39,57 |
| 9 Срок окупаемости, лет | 2,5 |
Как видно из таблицы 6, производство алкалоидов является рентабельным. Чистая прибыль данного производства составляет 3490,82 тыс.руб. Данное предприятие окупит вложенные в него затраты в течение – 2,5 лет.

 1,10 - растильная камера; 2,6 – транспортер; 3 – выдерживатель питательной среды при температуре стерилизации; 4 – теплообменник для охлаждения питательной среды; 5 – биореактор; 7,15 – бак для уксусной кислоты; 8 – экстрактор; 9 – фильтр; 11,19,23 – вакуум-испаритель; 12,20 - сборник упаренного экстракта; 13,16,24 – конденсатор; 15 –сборник уксусной кислоты; 17 - бак для щавелевой кислоты; 18 - сборник щавелевой кислоты; 21 – ионообменная колонна; 22 – бак для хлороформа; 25 – кристаллизатор; 26 – сборник готового продукта.
1,10 - растильная камера; 2,6 – транспортер; 3 – выдерживатель питательной среды при температуре стерилизации; 4 – теплообменник для охлаждения питательной среды; 5 – биореактор; 7,15 – бак для уксусной кислоты; 8 – экстрактор; 9 – фильтр; 11,19,23 – вакуум-испаритель; 12,20 - сборник упаренного экстракта; 13,16,24 – конденсатор; 15 –сборник уксусной кислоты; 17 - бак для щавелевой кислоты; 18 - сборник щавелевой кислоты; 21 – ионообменная колонна; 22 – бак для хлороформа; 25 – кристаллизатор; 26 – сборник готового продукта.Рисунок 6 - Технологическая схема получения алкалоидов из каллусной ткани Ephedra monosperma
Основные результаты работы
1 Впервые подобраны условия для введения в культуру in vitro Ephedra monosperma и получена высокопродуктивная каллусная культура Ephedra monosperma из дикорастущего растения-донора, характеризующаяся стабильностью роста. Установлено, что модифицированная питательная среда с минеральной основой по Murashige and Skoog наилучшим образом обеспечивает процессы жизнедеятельности эксплантов Ephedra monosperma и накопление биологически активных веществ в каллусной ткани.
2 Установлено, что гормональный состав среды влияет на накопление клеточной биомассы Ephedra monosperma и количество алкалоидов в ней.
3 Определено, что каллусная ткань по сравнению с молодыми побегами интактного растения содержит большее количество алкалоидов, практически в 2 раза превышающее таковое в интактном растении, а также витамина С и В1 (в 1,2 раза).
4 Установлено, что наибольшее количество алкалоидов (2,20 %) содержится в каллусной ткани, выращенной на пенополиуретановых подложках.
5 Предложена технологическая схема получения алкалоидов из каллусной ткани Ephedra monosperma и проведена оценка экономической эффективности получения алкалоидов из клеточной культуры Ephedra monosperma.
Предприятие является рентабельным, чистая прибыль составляет 3490,82 тыс.руб. Срок окупаемости - 2,5 года.
Основные материалы диссертации изложены в следующих работах:
1 Плынская, Ж.А. Культивирование хвойных в условиях in vitro/ Ж.А Плынская, Н.А. Величко, Е.Н. Аёшина // Хвойные бореальной зоны.- 2008. - № 1-2. – С. 68-70.
2 Плынская, Ж.А. Влияние регуляторов роста на процессы синтеза вторичных веществ в культуре in vitro Ephedra monosperma/ Ж.А. Плынская, Н.А. Величко // Химия растительного сырья. - 2008. -№ 4. – С. 125-127.
3 Плынская, Ж.А. Кормовые добавки на основе послеэкстракционного остатка Ephedra monosperma / Ж.А. Плынская, Н.А. Величко // Биотехнология, нанотехнология и физико-химическая биология: сб. материалов междунар. конф. - Казахстан, 2008. – С. 110 – 111.
4 Плынская, Ж.А. Культура клеток Ephedra monosperma как источник алкалоидов / Ж.А. Плынская, Н.А. Величко // Пищевые технологии и биотехнология: сб. материалов IX междунар. конф. молодых ученых. - Казань, 2008. – С. 173.
5 Плынская, Ж.А. Повышение содержания алкалоидов в клеточной культуре эфедры односемянной (Ephedra monosperma) / Ж.А. Плынская // Биология клеток растений in vitro и биотехнология: сб. материалов IX междунар. конф. - М., – 2008. – С. 304-305.
6 Плынская, Ж.А. Химический состав эфедры односемянной (Ephedra monosperma)/ Ж.А. Плынская // Лесной и химический комплексы – проблемы и решения: сб. материалов регион. науч.-практич. конф. – Красноярск, 2007. – С. 129-130.
7 Плынская, Ж.А. Экстрактивные вещества Ephedra monosperma/ Ж.А. Плынская, Н.А. Величко // Новые достижения в химии и химической технологии растительного сырья: сб. материалов IV Всерос. конф. - Барнаул: Изд-во Алт. ун-та, 2009. – Кн.2. – С. 43-44.
8 Плынская Ж.А. Элементный состав интактного растения и каллусной ткани Ephedra monosperma/ Ж.А. Плынская // Химия и жизнь: сб. материалов VIII регион. науч.-практич. конф. – Новосибирск, 2009. – С. 108-109.
Сдано в производство .05.2009.
Формат 60х84 1/16. Усл. печ. л. 1.
Изд. № 5/1. Заказ № . Тираж 80 экз.
Редакционно-издательский центр СибГТУ
660049. г. Красноярск, пр. Мира, 82
