Коррозия металлов
| Вид материала | Документы |
- Коррозия металлов, 40.27kb.
- Лекция коррозия металлов. Способы борьбы с нею, 54.35kb.
- Реферат На тему: Коррозия металлов, 45.45kb.
- Аннотация дисциплины «коррозия и защита металлов», 13.74kb.
- Коррозия металлов, 201.83kb.
- Урок в 9-м классе по теме "Коррозия", 149.58kb.
- Коррозия это разрушение металлов в результате его физико-химического взаимодействия, 375.69kb.
- Темы: Коррозия металлов. Современные методы защиты металлов от коррозии. Основные виды, 135.67kb.
- Национальная металлургическая академия украины, 1301.13kb.
- 18 Коррозия электрохимическая и химическая, 45.45kb.
КОРРОЗИЯ МЕТАЛЛОВ –
Это разрушение металлов и сплавов в результате воздействия окружающей среды.
КОРРОЗИЯ

ХИМИЧЕСКАЯ коррозия
– разрушение металлов при их взаимодействии с сухими газами или жидкостями, которые не проводят электрический ток (бензин, керосин и др.).
наиболее опасны для металлов O2, пары H2O, CO2, SO2 и др.
ЭЛЕКТРОХИМИЧЕСКАЯ коррозия
– разрушение металла в присутствии воды или раствора электролита.

Контактная коррозия
– разрушение металла, который находится в контакте с другим металлом в присутствии воды или раствора электролита. Часто сопровождается возникновением электрического ток
Химическая коррозия.
Этой коррозии подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химической коррозии подвергаются металлы в процессе их обработки при высоких температурах, металлические стенки промышленных химических реакторов и т. д.
Эти процессы являются окислительно-восстановительными реакциями между восстановителем металлом и окислителем, например, кислородом.
Примеры реакций:
4Fe0 + 3O20 2Fe2+3O3-2 – образование железной окалины при
получении железа и его обработке.
2Fe0 + 2H2S + O20 2Fe+2S + 2H2O-2 – эти процессы
возможны в атмосфере,
2Fe0 + 3SO2 + 3O20
 2Fe2+3(SO4-2)3 загрязненной
2Fe2+3(SO4-2)3 загрязненной соединениями серы
4Al0 + 3O20 2Al2+3O3-2 – на поверхности большинства металлов образуются оксидные пленки. У некоторых металлов эти пленки очень прочные, они защищают металл от дальнейшего окисления (Al, Cr, Ni, Zn и др.).
Электрохимическая коррозия.
В этом случае наряду с химическими процессами (окисление и восстановление, то есть отдача и присоединение электронов) протекают электрические (перенос электронов от одного участка к другому).
Пример электрохимической коррозии – образование ржавчины на железе под действием растворенного в воде кислорода:
2Fe0 + 2H2O + O20 2Fe+2(OH)2
– образование ржавчины
4Fe+2(OH)2 + 2H2O + 3O20 à 4Fe+3(OH)3 на железных предметах
Контактная электрохимическая коррозия.
Электрохимическая коррозия при контакте меди с железом:
Электрохимическая коррозия может быть усилена, если металл находится в контакте с другим металлом, или если металл содержит различные примеси.
Пример контактной коррозии – разрушение железного образца, находящегося в контакте с медью:
Железо (Fe)
Медь (Cu)
Раствор электролита
-
активнее
пассивнее
=> легко отдает электроны
=> не отдает электроны,
=> легко окисляется, переходит в раствор
=> не окисляется (хорошо сохраняется)

Железо, как более активный металл, при соприкосновении с электролитом начинает окисляться, отдавать электроны, а его ионы Fe+2 переходят в раствор:
Fe0 – 2ē Fe+2 – процесс окисления
Ионы железа переходят в раствор, а электроны перемещаются к менее активному металлу – меди:
Железо (Fe)
ē
ē
Медь (Cu)
Раствор электролита
Раствор электролита



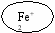
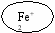
Раствор электролита
В результате на железе возникает положительный заряд, поэтому железо в данном примере служит анодом, а на меди возникает заряд отрицательный, в данном примере медь является катодом.
Медь (Cu)
– (катод)
Железо (Fe)
+ (анод)
Раствор электролита


Мы выяснили, что в нашем примере железо окисляется.
А какой элемент восстанавливается?
Это зависит от состава электролита. В зависимости от кислотности электролита на катоде может восстанавливаться или растворенный в воде кислород, или ионы водорода:
В кислой среде (рН<7)
2Н+ + 2ē Н2 – коррозия с водородной деполяризацией
Железо (Fe)
+ (анод)
Медь (Cu)
– (катод)
Раствор электролита
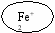
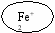

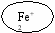


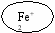
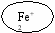



Раствор электролита
Раствор электролита
В нейтральной и щелочной среде (рН≥7)
О2 + 2Н2О + 4ē 4ОН– – коррозия с кислородной деполяризацией
Железо (Fe)
+ (анод)
Медь (Cu)
– (катод)

Электролит
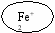




Далее в растворе образовавшиеся ионы взаимодействуют друг с другом, в результате чего образуется смесь оксидов и гидроксидов железа.
Запись реакции электрохимической коррозии железа, находящегося в контакте с медью:
Анод (+):
Fe0 – 2ē à Fe+2 – окисление
Катод (–): – восстановление
В кислой среде
2Н+ + 2ē Н2
В нейтральной и щелочной среде
О2 + 2Н2О + 4ē à 4ОН–
Электрохимическая коррозия при контакте цинка с железом:
Сначала определим, какой из элементов более активный – именно он будет окисляться в результате коррозии. Это цинк.
Запись реакции электрохимической коррозии при контакте цинка с железом:
Анод (+):
Zn0 – 2ē à Zn+2 – окисление
Катод (–): – восстановление
В кислой среде
2Н+ + 2ē à Н2
В нейтральной и щелочной среде
О2 + 2Н2О + 4ē à 4ОН–
