В школьном курсе физики § значение, место и особенности раздела
| Вид материала | Задача |
- Методика изучения электродинамики в школьном курсе физики раздел «электродинамика», 808.93kb.
- Методические рекомендации по формированию научных понятий в школьном курсе физики Составители, 972.27kb.
- Методика преподавания механики в школьном курсе физики значение механики в системе, 604.92kb.
- Еще раз об истории физики в школьном курсе физики в. Е. Фрадкин, зам директора рцокоиИТ, 129.69kb.
- Тольяттинский Государственный Университет Кафедра методики преподавания физики и физической, 381.94kb.
- Выступление Макаренко Н. Н. на педсовете 10., 52.03kb.
- Конспект урока химии в 10 классе Тема урока, 54.04kb.
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Пояснительная записка (профильный уровень X-XI класс), 272.28kb.
- Методика обучения решению прикладных задач в школьном курсе математики примерное содержание, 14.61kb.
РАЗДЕЛ «МОЛЕКУЛЯРНАЯ ФИЗИКА»
В ШКОЛЬНОМ КУРСЕ ФИЗИКИ
§ 1. ЗНАЧЕНИЕ, МЕСТО И ОСОБЕННОСТИ РАЗДЕЛА
«МОЛЕКУЛЯРНАЯ ФИЗИКА»
В разделе «Молекулярная физика» учащиеся изучают поведение качественно нового материального объекта: системы, состоящей из большого числа частиц (молекул и атомов), новую, присущую именно этому объекту форму движения (тепловую) и соответствующий ей вид энергии, (внутреннюю). Здесь учащихся впервые знакомят со статистическими закономерностями, которые используют для описания поведения большого числа частиц. Формирование статистических представлений позволяет помять смысл необратимости тепловых процессов. Именно необратимость является отличительным свойством тепловых процессов и позволяет говорить о тепловом равновесии, температуре, понять принцип работы тепловых машин.
Задача учителя — рассмотреть в единстве два метода описания тепловых явлений и процессов: термодинамический (феноменологический), основанный на понятии энергии, и статистический, основанный на молекулярно-кинетических представлениях о строении вещества. При рассмотрении статистического и термодинамического методов необходимо четко разграничить знания, полученные эмпирически, и знания, полученные в результате моделирования внутреннего строения вещества и происходящих с ним явлений и процессов.
Важно показать, что эти два подхода, по сути, описывают с разных точек зрения состояние одного и того же объекта и потому дополняют друг друга. В связи с этим, формируя такие понятия, как температура, внутренняя энергия, идеальный газ и т. д., учитель должен раскрыть их содержание как с термодинамической, так и с молекулярно-кинетической точки зрения.
В разделе «Молекулярная физика» изучают молекулярно-кинетическую теорию строения вещества, основные положения которой рассматривали еще в VII классе. Изучая физику в VII и VIII классах, учащиеся научились объяснять целый ряд физических явлений, свойств веществ (свойства жидкостей и газов, давление, тепловые явления и пр.) с точки зрения внутренней структуры вещества. Однако понятия, составляющие содержание соответствующих тем, изучали на уровне представлений, а все явления описывали качественно. Поэтому при преподавании молекулярной физики в X классе знания, имеющиеся у учащихся, нужно актуализировать, углубить и расширить, довести их до уровня понятий и количественного описания явлений. В частности, в курсе физики X класса изучают основное уравнение молекулярно-кинетической теории газов; значительно глубже, чем в VII классе, рассматривают свойства газов, жидкостей и твердых тел.
В разделе получают дальнейшее развитие энергетические представления, происходит обобщение закона сохранения энергии на тепловые процессы, вводят формулу первого закона термодинамики и рассматривают применение этого закона к анализу конкретных процессов. Изучение одного из основных принципов термодинамики имеет огромное познавательное и мировоззренческое значение для десятиклассников.
Раздел «Молекулярная физика» дает возможность продолжить знакомство учащихся с экспериментальным методом исследования, который находит отражение в фундаментальных опытах (броуновское движение, опыт Штерна) и опытах, иллюстрирующих газовые законы (опыт Бойля, Шарля и пр.).
Мировоззренческое значение раздела «Молекулярная физика» трудно переоценить. При его изучении происходит углубление понятия материи. Молекулы и атомы являются вещественной формой материи, объективно существующей в окружающем мире. Они обладают массой, импульсом, энергией. Являясь видом материи, молекулы и атомы имеют присущие материи свойства, одно из которых — движение. Молекулы и атомы участвуют в особом движении, называемом тепловым, которое отличается от простейшего механического движения большой совокупностью участвующих в нем частиц и хаотичностью. Тепловое движение описывается статистическими законами. В связи с этим важно показать школьникам различие между статистическими и динамическими закономерностями, соотношение между ними и обратить внимание учащихся на отражение в этих закономерностях категорий необходимого и случайного.
Раздел «Молекулярная физика» дает прекрасную возможность для демонстрации дедуктивного метода изучения явлений природы. Применение дедукции в преподавании вносит свой вклад в развитие абстрактного мышления учащихся.
Велико политехническое значение этого раздела курса физики. Достижения молекулярной физики являются научной основой такой отрасли промышленности, как материаловедение. Знание внутреннего строения тел позволяет создавать материалы с заранее заданными свойствами, целенаправленно работать над повышением твердости, термостойкости, теплопроводности металлов и сплавов.
Изучение тепловых явлений дает возможность ознакомить учащихся c основами теплоэнергетики, отрасли, занимающей в нашей стране первое место в обеспечении энергией нужд промышленности и быта.
Раздел «Молекулярная физика» изучается в старших классах после раздела «Механика». Такое расположение материала, с одной стороны, соответствует методическому принципу рассмотрения физических явлений в порядке усложнения форм движения Материи, а с другой — позволяет изучать микроявления на количественном уровне и использовать известные из курса механики величины: масса, скорость, сила, импульс, энергия и т. д.
§ 2. СТРУКТУРА И СОДЕРЖАНИЕ РАЗДЕЛА
«МОЛЕКУЛЯРНАЯ ФИЗИКА»
Структуру раздела «Молекулярная физика» определяют два обстоятельства: избранный метод изучения газовых законов (индуктивный или дедуктивный) и метод введения понятия температуры.
При индуктивном изучении газовых законов вначале на качественном уровне рассматривают основные положения молекулярно-кинетической теории, затем некоторые вопросы термодинамики, газовые законы вводят эмпирически и объясняют с точки зрения молекулярных представлений и на основе термодинамического подхода. Методическая идея в этом случае заключается в совместном изучении тепловых явлений и молекулярной физики, в опытном изучении свойств веществ и их объяснении на основе теории. В этом случае раздел имеет следующую структуру: основные положения молекулярно-кинетической теории - основы термодинамики (тепловое равновесие, параметры состояния, температура, газовые законы, абсолютная температура, первый закон термодинамики) - молекулярно-кинетическая теория идеального газа (основное уравнение молекулярно-кинетической теории газов, температура - мера средней кинетической энергии молекул) — свойства газов, жидкостей и твердых тел и их взаимные превращения.
Эмпирический подход к изучению газовых законов вполне доступен для учащихся, при его использовании представления и понятия формируют на чувственно-конкретной основе, он не требует высокого уровня абстрактного мышления, соответствует истории открытия газовых законов и позволяет знакомить учащихся с путями развития физики. Недостатком этого подхода является то, что он не позволяет полностью использовать молекулярно-кинетическую теорию для описания свойств идеального газа.
При дедуктивном подходе вначале изучают молекулярно-кинетическую теорию идеального газа: выводят основное уравнение

уравнения состояния идеального газа и подтверждают экспериментально. Далее можно изучать законы термодинамики и рассматривать применение первого закона термодинамики к изопроцессам.
Такой подход имеет целый ряд достоинств по сравнению с индуктивным, одно из которых заключается в соответствии его основной идее современного школьного курса — усилению роли научных теорий. Кроме того, он позволяет наглядно продемонстрировать тот факт, что фундаментальных законов в физике не так много, большинство же могут быть получены как частные случаи из более общих законов. Применение здесь дедуктивного метода играет большую роль в формировании научного мировоззрения и развитии мышления школьников. Он также позволяет получить выигрыш во времени.
При дедуктивном подходе к изучению газовых законов возможна и иная структура раздела, при которой школьников сначала знакомят с основными понятиями и законами молекулярно- кинетической теории и термодинамики, а затем применяют в единстве аппарат этих теорий для изучения свойств макроскопических систем. В этом случае раздел имеет следующую структуру: основные положения молекулярно-кинетической теории — основы термодинамики — строение и свойства газов, жидкостей и твердых тел - агрегатные превращения.
Что касается введения понятия температуры, то при индуктивном изучении газовых законов последовательность его раскрытия такова: температура как параметр состояния макроскопической системы — абсолютная температура (из закона Шарля или Гей-Люссака) — температура — мера средней кинетической энергии молекул (из основного уравнения молекулярно-кинетической теории газов и эмпирически полученного уравнения состояния идеального газа).
При дедуктивном изучении газовых законов понятие температуры вводят следующим образом: температура как параметр состояния макроскопической системы — абсолютная температура — температура — мера средней кинетической энергии молекул (из основного уравнения молекулярно-кинетической теории газов и

для всех газов в состоянии теплового равновесия показывают, что абсолютная температура пропорциональна средней кинетической энергии молекул).
При дедуктивном изучении газовых законов можно ввести понятие температуры и по следующей схеме: температура как параметр состояния макроскопической системы - температура — мера средней кинетической энергии молекул (по определению после рассмотрения основного уравнения молекулярно-кинетической теории газов) — абсолютная температура.
В соответствии с программой одиннадцатилетней школы раздел «Молекулярная физика» включает две темы: «Основы молекулярно-кинетической теории» и «Основы термодинамики», т. е. изучение материала начинают с основных положений молекулярно-кинетической теории и их опытного обоснования. Это вполне оправдано, так как глубокое понимание термодинамики возможно лишь после изучения механизма, лежащего в основе того или иного процесса. Кроме того, изучение основных положений молекулярно-кинетической теории сразу же позволяет установить связь рассматриваемого материала с тем, что уже известно учащимся из курса физики VП—VIП классов и из курса химии VПI— IX классов.
Вопросы молекулярно-кинетической теории изучают здесь более глубоко, особое внимание уделяют опытным обоснованиям молекулярно-кинетической теории: рассматривают броуновское движение, достаточно детально изучают характеристики молекул, методы их теоретического и экспериментального определения, при объяснении взаимодействия между молекулами проводят анализ графика сил взаимодействия.
Затем в этой же теме изучают основное уравнение молекулярно-кинетической теории идеального газа, понятие температуры, уравнение Менделеева-Клапейрона и изопроцессы. Знания, полученные школьниками при изучении этого материала, используют для объяснения свойств паров, жидкостей и твердых тел.
В теме «Основы термодинамики» повторяют и углубляют понятия, изученные учащимися в VIII классе: внутренняя энергия, способы изменения внутренней энергии, количество теплоты и работа как меры изменения внутренней энергии, обсуждают зависимость внутренней энергии от параметров состояния системы. Затем изучают первый закон термодинамики, дают понятие о втором законе термодинамики (невозможности полного превращения внутренней энергии в работу). Важный вопрос темы - вопрос о принципах действия тепловых двигателей, рассмотрение которого позволяет показать применение законов термодинамики в конкретных технических устройствах и тем самым ознакомить десятиклассников с физическими основами теплоэнергетики.
§ 3. СТАТИСТИЧЕСКИЙ И ТЕРМОДИНАМИЧЕСКИЙ МЕТОДЫ ИЗУЧЕНИЯ ТЕПЛОВЫХ ЯВЛЕНИЙ
Сущность статистического метода изучения явлений соответствует положению диалектического материализма о соотношении необходимого и случайного. Движение каждой молекулы тела или системы подчиняется законам классической механики, однако ее поведение в каждый момент времени случайно, оно зависит от множества причин, которые невозможно учесть. Например, скорость, энергия, импульс каждой молекулы зависят от столкновений ее с другими молекулами, и предсказать значения этих величин в каждый момент времени невозможно.
С другой стороны, поведение всей совокупности частиц подчиняется определенным закономерностям, которые называют статистическими и которые проявляются при изучении поведения большого числа частиц. Например, если скорость каждой молекулы в данный момент времени - величина случайная, то большинство молекул имеет скорость, которая близка к некоторому определенному при данных условиях значению, называемому наиболее вероятным.
Математическую основу статистической физики составляет теория вероятностей, важными понятиями которой являются: «случайное событие», «вероятность», «статистическое распределение», «среднее значение случайной величины».
Под случайным понимают событие, которое может наступить, а может не наступить в данных условиях. Случайное событие характеризуется следующими признаками: а) невозможностью однозначного предсказания случайного события; б) наличием большого числа причин, обусловливающих случайное событие; в) предсказуемостью хода процесса в массовом коллективе случайных событий; г) вероятностью события как математического выражения возможности предсказания процесса.
Эти признаки можно рассмотреть на примере совокупности большого числа молекул. В частности, невозможно однозначно предсказать движение каждой отдельной молекулы, так как оно зависит от поведения множества других молекул. Это можно сделать лишь с определенной вероятностью.
Вероятность — это числовая характеристика возможности появления события в тех или иных условиях. Чем больше вероятность, тем чаще происходит данное событие. Если число всех проведенных испытаний N, ΔN—число испытаний, в которых происходит данное событие, то вероятность этого события вычисляют по формуле: ω=
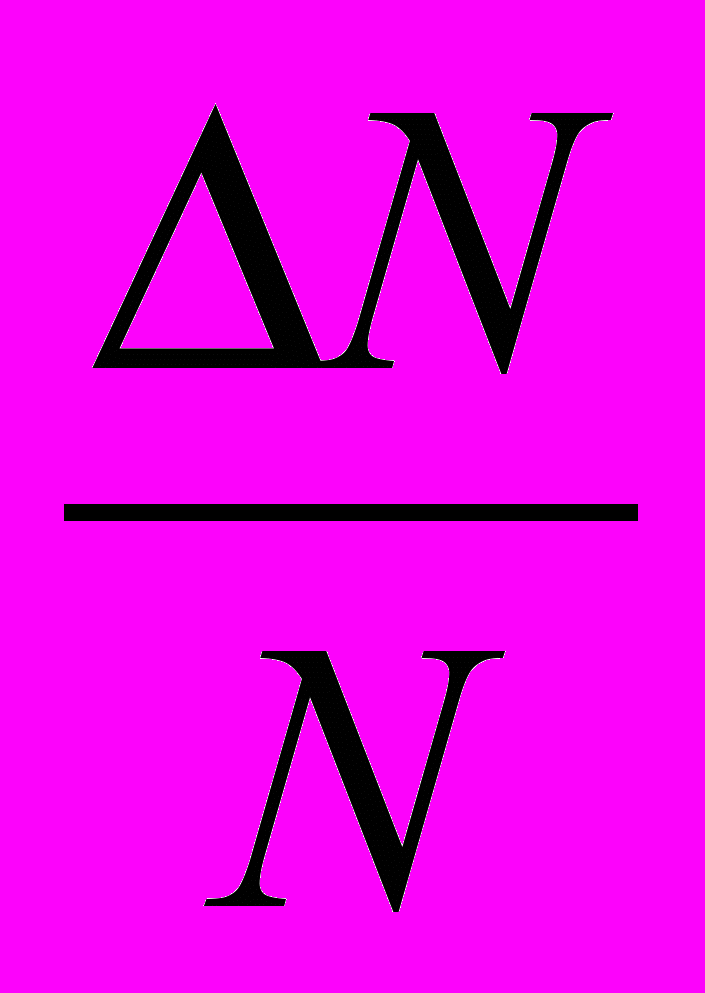 .
.Можно под N понимать общее число частиц в системе, а под ΔN — число частиц, находящихся в определенном состоянии. В этом случае ω — вероятность существования частицы в данном состоянии.
В
 теоретических расчетах бывает сложно вычислить вероятность, так как не представляется возможным предсказать число испытаний, в которых событие произойдет. Задача упрощается, если изучают равновероятные события, т. е. события, происходящие с равной частотой. Именно с равновероятными событиями имеют дело при рассмотрении хаотического движения молекул: вдоль любых выделенных направлений движется одинаковое число частиц. Следует пояснить учащимся, что понятие вероятности имеет смысл лишь для массовых событий. В противном случае частота наступления события может существенно отличаться от значения вероятности.
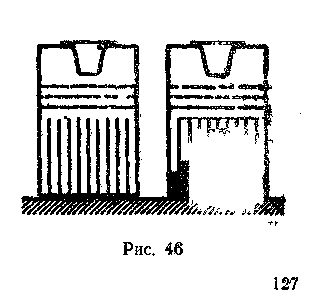
теоретических расчетах бывает сложно вычислить вероятность, так как не представляется возможным предсказать число испытаний, в которых событие произойдет. Задача упрощается, если изучают равновероятные события, т. е. события, происходящие с равной частотой. Именно с равновероятными событиями имеют дело при рассмотрении хаотического движения молекул: вдоль любых выделенных направлений движется одинаковое число частиц. Следует пояснить учащимся, что понятие вероятности имеет смысл лишь для массовых событий. В противном случае частота наступления события может существенно отличаться от значения вероятности.Понятие о статистическом распределении вводят, используя опыт с доской Гальтона (рис. 46), который достаточно наглядно иллюстрирует распределение молекул по координатам. С вопросом о распределении десятиклассники сталкиваются при выводе основного уравнения молекулярно-кинетической теории газов, рассматривая равновероятное распределение молекул по объему и по направлениям движения. Изучая вопрос о скоростях молекул, школьники знакомятся с максвелловским распределением.
При изучении молекулярно-кинетической теории учащиеся широко используют среднее значение случайных величин. Важно подчеркнуть, что среднее значение случайной величины - характеристика статистического распределения. Именно для большого числа частиц среднее значение случайной величины постоянно. К таким величинам относится, например, скорость движения молекул. Не имея возможности определить скорость каждой отдельной молекулы, для расчетов используют значение скорости, равное среднему квадрату:

При выводе основного уравнения кинетической теории газов рассчитывают давление газа на стенки сосуда. Речь идет о среднем значении давления, так как в разные моменты времени о стенку ударяется разное число молекул, имеющих различные скорости. Но при большом числе молекул можно считать давление постоянным, а флуктуацию давления достаточно малой.
У учащихся может сложиться впечатление, что статистический метод был введен в науку как некий искусственный прием, позволивший описать поведение молекул, и что динамические законы являются основными по сравнению со статистическими. Следует предупредить эту ошибку и объяснить, что статистические законы существуют объективно. Классическая статистика возникла в XIX в. Этот факт выражал прогрессивное направление науки и был связан с изучением внутреннего строения вещества. В настоящее время известно, что поведение всех микрообъектов подчиняется статистическим законам, причем в квантовой физике в отличие от классической статистические законы проявляются не только вследствие массовости и хаотичности движения, но и в связи с самой природой квантовых объектов (с невозможностью одновременного точного определения координаты и скорости частицы). Целесообразно подчеркнуть, что статистический метод является основой современной физики. В частности, вероятностные, статистические законы господствуют в мире элементарных частиц.
Термодинамический метод описания явлений и процессов опирается на непосредственные данные наблюдений и опытов и на основные термодинамические принципы (законы термодинамики).
Термодинамика - феноменологическая теория, которая изучает явления и свойства макроскопических тел, связанные с превращением энергии, и не рассматривает их внутреннее строение. Начало термодинамики как науки было положено в работе С. Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (1824 г.), в которой рассматривались тепловые процессы, в частности вопросы изменения внутренней энергии при совершении работы и вопросы теории тепловых машин. В настоящее время термодинамика изучает превращения энергии не только в тепловых процессах, но и в электрических, магнитных, химических и др.
В основе термодинамического метода лежат следующие понятия: «термодинамическая система», «состояние термодинамической системы», «термодинамические параметры состояния» и «равновесное состояние».
Термодинамической системой называют тело или совокупность тел, обменивающихся энергией между собой и с внешними телами. Если обмена энергией с внешними телами нет, то система является изолированной. Понятие изолированной системы — абстракция, все реальные системы можно считать изолированными лишь с той или иной степенью точности.
С понятием состояния школьники уже знакомы из курса механики. Они знают, что механическое состояние системы определяется совокупностью величин, характеризующих свойства системы и называемых параметрами состояния. К ним в механике относят координату, импульс и т. д. Состояние термодинамической системы также определяется рядом параметров (термодинамических). Термодинамическими параметрами состояния являются температура, объем, давление и т. д.
Число параметров, характеризующих состояние системы, зависит от свойств системы и от условий, в которых она находится. Трех названных выше параметров достаточно для описания изолированной системы «идеальный газ», но если рассматривать, например, неоднородный газ, то необходимо учитывать еще и концентрацию.
Параметры могут быть внешними и внутренними. Температура и давление, например, зависят только от состояния самой системы и не связаны с внешними условиями. Объем же зависит от внешних условий. Некоторые параметры состояния, например, объем, обладают свойством аддитивности, другие, такие, как давление и температура, не обладают.
При изменении состояния системы меняются и ее параметры. Однако для целого ряда термодинамических систем между параметрами можно установить функциональную зависимость. Уравнение, выражающее эту зависимость, называют уравнением состояния (для системы «идеальный газ» это уравнение pV=NkT).
Состояние системы может быть равновесным и неравновесным. Равновесное состояние характеризуется неизменностью всех термодинамических параметров системы во времени и одинаковостью в пространстве в отсутствие внешних воздействий. Термодинамика изучает в основном равновесные состояния. Если система находится в неравновесном состоянии (т. е. параметры ее с течением времени меняются), то постепенно она придет в состояние равновесия и ее параметры выровняются во всех частях системы.
Изолированная термодинамическая система с течением времени всегда приходит в равновесное состояние, из которого не может самопроизвольно выйти. Это утверждение составляет сущность закона термодинамического равновесия, являющегося одним из важнейших опытных законов термодинамики. Именно закон термодинамического равновесия делает возможным измерение температуры системы.
Целесообразно подчеркнуть, что уравнение состояния идеального газа и частные газовые законы справедливы лишь для равновесных процессов. К неравновесным процессам они неприменимы, так как в этом случае параметры состояния различны для разных частей системы. Из одного равновесного состояния в другое система может перейти под влиянием внешнего воздействия.
Такой переход в термодинамике называют процессом. Если во время процесса система остается равновесной, то и процесс называют равновесным. Равновесный процесс осуществляется тогда, когда время релаксации (время перехода системы из неравновесного состояния в равновесное) много меньше времени осуществления процесса. В этом случае систему в каждый момент времени с той или иной степенью точности считают равновесной, или статической. Поскольку в действительности отклонения от статичности имеются (иначе нельзя было бы осуществить процесс), то состояние системы называют квазистатическим, а процесс — квазистатическим процессом. Следует иметь в виду, что на графике можно изобразить только равновесное (квазистатическое) состояние или равновесный (квазистатический) процесс.

При изучении раздела «Молекулярная физика» учителю следует постоянно подчеркивать единство статистического и термодинамического методов. В этом отношении полезно обобщать и систематизировать знания школьников о статистическом и термодинамическом подходах к описанию тепловых явлений. Обобщение знаний проводят в конце изучения всего раздела, а связь между этими подходами представляют в виде схемы, изображенной на рисунке 47.
