Ответы к экзамену по радиационной медицине и экологии. 1
| Вид материала | Ответы к экзамену |
- Вопросы для подготовки к курсовому экзамену по радиационной гигиене, 32.25kb.
- Ю. А. Александров Основы радиационной экологии Учебное пособие, 5090.11kb.
- Методические рекомендации к занятиям по радиационной и экологической медицине раздел, 454.5kb.
- Тематический план занятий по радиационной и экологической медицине раздел «Радиационная, 33.77kb.
- Тематический план занятий по радиационной и экологической медицине раздел «Экологическая, 49.21kb.
- Методические указания по выполнению лабораторной работы по дисциплине «Основы радиационной, 237.73kb.
- Лениях областных больниц, «Республиканском центре детской офтальмологии» и«Республиканском, 148.24kb.
- Электрофизиологические показатели у детей, больных сахарным диабетом Бобр, 70.07kb.
- Экология как научная, 94.09kb.
- Серия «подготовка к экзамену», 1831.32kb.
в
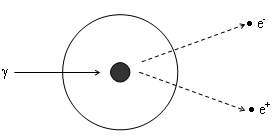 ) образовании пары "электрон-позитрон" - при значительной энергии -кванта (>1 МэВ) он взаимодействует с атомным ядром и в его поле преобразуется в пару частиц - электрон и позитрон, которые и производят в дальнейшем ионизацию. Позитрон, встречая на своем пути электрон, может соединиться с ним и превратиться в 2 фотона (эффект аннигиляции). Образующиеся фотоны поглощаются средой в результате эффекта Комптона или фотоэффекта.
) образовании пары "электрон-позитрон" - при значительной энергии -кванта (>1 МэВ) он взаимодействует с атомным ядром и в его поле преобразуется в пару частиц - электрон и позитрон, которые и производят в дальнейшем ионизацию. Позитрон, встречая на своем пути электрон, может соединиться с ним и превратиться в 2 фотона (эффект аннигиляции). Образующиеся фотоны поглощаются средой в результате эффекта Комптона или фотоэффекта.2) рентгеновское излучение:
- имеет длину волны 10-9-10-12 м; чем меньше длина волны, тем выше энергия излучения и больше его проникающая способность
- образуется за счет изменения энергетического состояния электрона при его переходе на энергетически более выгодную орбиталь (характеристическое рентгеновское излучение) или при столкновении заряженных частиц с частицами вещества, через которое они проходят (тормозное рентгеновское излучение)
Защитные материалы для электромагнитных видов излучения - тяжелые металлы, бетон, грунт.
7. Стадии формирования лучевого поражения. Прямое и косвенное действие ионизирующих излучений на биомолекулы. Кислородный эффект.
Принципиальная особенность действия ионизирующих излучений - дистанционность воздействия источника на организм, т.е. способность проникать в биологические ткани, клетки, субклеточные структуры и повреждать их, вызывая одномоментную ионизацию атомов и молекул за счет физических взаимодействий и радиационно-химических реакций.
Под воздействием ионизирующего излучения изменяется электронная оболочка атомов. Вследствие этого меняются их химические свойства и возникают химические реакции, приводящие в некоторых случаях к тяжелым повреждениям органов и тканей.
Стадии формирования ионизирующих излучений:
1. Физическая стадия - поглощение энергии излучения облучаемой средой с возбуждением и ионизацией её молекул (длительность около 1*10-16 сек). Данный процесс практически не зависит от условий окружающей среды.
2. Физико-химическая стадия - возникновение активных в химическом отношении свободных радикалов, которые взаимодействуют между собой и с органическими молекулами клетки (длительность около 1*10-7 сек). Данный процесс слабо зависит от условий окружающей среды.
Свободные радикалы - это электрически нейтральные атомы или молекулы с неспаренным электроном на внешней орбитали; они являются весьма реакционноспособными, т.к. имеют тенденцию спаривать свой электрон с аналогичным электроном в другом свободном радикале (окислители, акцепторы), либо удалять его из атома путём электронного излучения (восстановители, доноры).
3. Химическая стадия - появление биохимических повреждений биологически важных макромолекул - белков, нуклеиновых кислот, липидов, углеводов (длительность порядка нескольких секунд). Данный процесс существенно зависит от условий окружающей среды: температуры, фазового состояния и т.д.
4. Биологическая стадия - формирование повреждений на клеточном, тканевом, органном и организменном уровнях и отдаленных последствий облучения (длительность сильно варьирует - часы, недели, годы - и определяется особенностями протекания патофизиологических процессов в различных органах и тканях; например, для развития опухоли или лучевой катаракты требуется значительно больше времени, чем для развития острой лучевой болезни).
Прямое и косвенное действие ионизирующих излучений на биомолекулы:
В основе первичных радиационно-химических изменений могут лежать 2 механизма действия ионизирующих излучений:
1) прямое действие - молекулы претерпевают изменения непосредственно при взаимодействии с ионизирующим излучением.
2) косвенное действие - молекулы претерпевают изменения не непосредственно поглощая энергию от ионизирующих излучений, а получая её от других молекул.
Кислородный эффект - усиление лучевого повреждения в присутствии кислорода по сравнению с анаэробными условиями. Эффект объясняется тем, что в присутствии кислорода образуются дополнительные реакционноспособные радикалы, обладающие выраженным поражающим действием; кроме того, молекула кислорода обладает электроноакцепторными свойствами, активно взаимодействует с образующимися при действии излучения радикалами биологических молекул, фиксирует возникшие в них потенциальные повреждения и делает их труднодоступными для репарации.
Количественная мера кислородного эффекта - коэффициент кислородного усиления. При облучении отдельных клеток он равен 3, т.е. в присутствии кислорода лучевое повреждение усиливается втрое. Для проявления такого действия кислород должен присутствовать в клетке в момент облучения.
В дальнейшем кислород играет положительную роль: он необходим для нормальной работы системы репарации ДНК.
NB! Кислород в формировании лучевого повреждения ведёт себя двояко: усиливая первичные процессы повреждения в момент воздействия излучения он одновременно стимулирует процессы внутриклеточного восстановления после облучения.
Кислородный эффект зависит от ЛПЭ: с увеличением ЛПЭ он уменьшается и при действии, например, альфа-излучения исчезает.
На кислородном эффекте основаны методы управления тканевой радиочувствительностью, используемые в лучевой терапии опухолей:
1) оксигенорадиотерапия (оксибарорадиотерапия) - во время сеанса лучевой терапии больной дышит чистым кислородом при нормальном или увеличенном в 2-3 раза атмосферном давлении, при этом напряжение кислорода в здоровых тканях увеличивается незначительно (есть предел насыщения), а в опухоли давление кислорода поднимается до такого же уровня, но, по сравнению с исходным уровнем его содержание возрастает во много раз, следовательно, повышается и радиочувствительность опухолевой ткани.
2) гипооксирадиотерапия - во время сеанса лучевой терапии больной дышит гипоксической газовой смесью (содержание кислорода 7-10% вместо 21%). Напряжение кислорода в здоровой ткани уменьшается, а в опухоли останется прежним, что позволяет повысить дозу облучения на опухоль.
8. Радиационная биохимия нуклеиновых кислот. Основные типы репарации ДНК.
На ядерную ДНК приходится около 7% поглощенной дозы.
Механизм повреждения нуклеиновых кислот:
а) при прямом действии ионизирующих излучений на нуклеиновые кислоты: выбивание электрона и последующая миграция дефектного участка по полинуклеотидной цепи (несколько сотен азотистых оснований) до участка с повышенными электрон-донорными свойствами (чаще всего до участка локализации тимина или цитозина, где и образуются свободные радикалы этих оснований).
б) при косвенном действии ионизирующих излучений на нуклеиновые кислоты: взаимодействие с продуктами радиолиза воды приводит к образованию свободных радикалов, что ведет к нарушению структуры ДНК, в основе которого лежат следующие механизмы:
- одно- и двунитевые разрывы;
- модификация азотистых оснований;
- образование тиминовых димеров;
- сшивки ДНК–ДНК, ДНК-белок.
При дозе 1 Гр в каждой клетке человека повреждаются около 5000 азотистых оснований, возникают примерно 1000 одиночных и от 10 до 100 двойных разрывов. Определенное число одиночных разрывов образуется даже при малых дозах излучения, но они не приводят к поломкам молекулы ДНК, т.к. куски поврежденной молекулы прочно удерживаются на месте водородными связями с комплементарной нитью ДНК и хорошо поддаются восстановлению.
Репарация повреждений в ДНК.
Все механизмы репарации в клетке многократно продублированы и могут идти разными путями, находящимися под генетическим контролем. Репарация может быть как практически безошибочной (фотореактивация и эксцизионная репарация коротких участков), так и зачастую ошибочной (SOS-репарация, т.к. она является попыткой восстановить структуру ДНК любой ценой при серьезных массивных повреждениях).
Репарация генетических повреждений обеспечивается десятками ферментов, многие из которых участвуют также в процессах репликации и рекомбинации.
Основные группы ферментов репарации:
1. нуклеозидазы - производят выщепление оснований по N-гликозидной связи с образованием АП-сайтов - апуриновых или апиримидиновых участков;
2. инсертазы - производят встраивание оснований в АП-сайты;
3. лиазы - производят расщепление пиримидиновых димеров;
4. эндонуклеазы - проводят инцизию - разрез ДНК возле повреждения;
5. экзонуклеазы - проводят эксцизию - удаление поврежденного участка;
6. ДНК-полимеразы - проводят синтез ДНК по комплементарной матрице;
7. ДНК-лигазы - производят сшивку нуклеотидов.
Основные типы репарации ДНК:
I. Прямая репарация:
а) фотореверсия - происходит за счет работы фотолиаз, причем начальный этап - образование фермент-субстратного комплекса - может идти и в темноте: E + S ES + h E + P , где Е – фермент (энзим), S – субстрат, P - продукт реакции. Для работы фотолиазы требуется свет с длиной волны 350 нм.
Этапы фотореверсии:
1. Повреждение ДНК с образованием димера под действием УФ-излучения

2. Образование фермент-субстратного комплекса с фотолиазой:

3. Восстановление структуры ДНК:

б) восстановление одиночных разрывов - происходит с участием ДНК-лигаз, характерна при действии ионизирующих излучений, вызывающих образование большого числа однонитевых разрывов ДНК.
Этапы восстановления одиночных разрывов:
1. Повреждение ДНК с образованием одиночного разрыва:
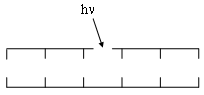
2. Образование фермент-субстратного комплекса с ДНК-лигазой:

3. Восстановление структуры ДНК:

в) восстановление структуры азотистых оснований - удаление лишних метильных групп, восстановление разрывов циклических структур;
г) замена азотистых оснований - протекает с участием ДНК-гликозидаз.
II. Репарация с использованием комплементарной цепи (эксцизионная репарация).
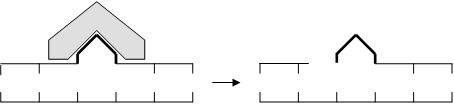
Наиболее изученный вид эксцизионной репарации - “темновая репарация”. Ее основные этапы:
1. Incisio (разрезание) - эндонуклеаза "узнает" поврежденный участок и производит разрез:
2. Excisio (вычленение) - экзонуклеаза удаляет поврежденный участок:
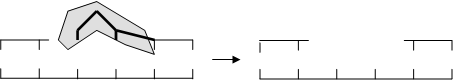
3. Sintesis - репаративный синтез с помощью ДНК-полимеразы:

4. Сшивка восстановленных участков ДНК-лигазой:
III. Репарация с использованием межмолекулярной информации:
а) восстановление двойных разрывов - возможно в том случае, когда имеется копия генетической информации (например, при диплоидном наборе хромосом). В основе данной репарации - сложный процесс рекомбинации с реципрокным обменом нитей ДНК и последующим восстановлением повреждений. При этом образуются так называемые "структуры Холидея", которые в дальнейшем подвергаются разделению с образованием 2 нормальных нитей ДНК.
б) репарация поперечных сшивок внутри ДНК - происходит по схеме “выщепление-рекомбинация-синтез”. Ее основные этапы:
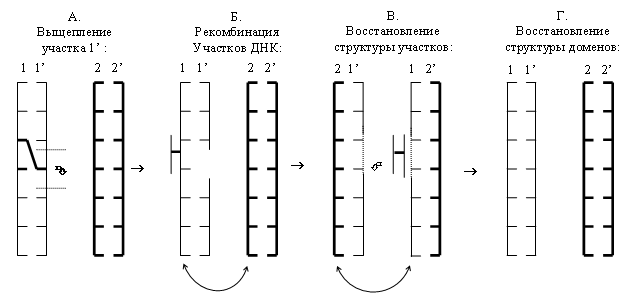
IV. Индуцибельная репарация.
а) SOS-репарация - запускается в клетке при наличии сигнала бедствия - появления свободных фрагментов полинуклеотидной цепи, что указывает на серьезные повреждения ДНК. При этом клетка пытается восстановить структуру ДНК, невзирая на степень ее повреждения. Достигается это снижением 3’-5’ - корректорской функции ДНК-полимеразы, что помогает быстро, но не всегда безошибочно восстанавливать структуру.
б) постадаптационная репарация - механизм до конца не известен; впервые описана при исследовании культуры лимфоцитов, которые обладают повышенной чувствительностью к воздействию ионизирующих излучений: после предварительного облучения культуры лимфоцитов при суммарной дозе около 30 сГр с низкой интенсивностью в течение 4 часов развивалась повышенная устойчивость к повреждению ДНК, длившаяся около 66 часов (3 клеточных цикла).
Механизмы репарации генетических повреждений - сложная продублированная система защиты генетической информации клетки, основа обеспечения надежности биологических систем. Большинство одиночных разрывов репарируются даже в летально облученных клетках и не являются причиной, определяющей гибель клетки. Однако нерепарированные одиночные разрывы могут в последующем привести к образованию двойных разрывов, плохо поддающихся восстановлению. Двойные разрывы могут возникнуть в результате единичного акта ионизации либо при совпадении одиночных разрывов на комплементарных нитях, они опасны для клетки, т.к. они не всегда поддаются репарации и служат непосредственной причиной возникновения хромосомных аберраций.
Виды хромосомных аберраций:
1. фрагментация хромосом
2. образование хромосомных мостов, дицентриков, кольцевых хромосом
3. появление внутри- и межхромосомных обменов
Часть аберраций (хромосомные мосты и др.) механически препятствуют делению клетки, некоторые аберрации (внутри- и межхромосомные обмены, ацентрические фрагменты) приводят к неравномерному разделению хромосом и утрате генетического материала, что вызывает гибель клеток из-за недостатка метаболитов, синтез которых кодировался утраченной частью ДНК.
9. Радиолиз воды. Общая схема окислительного стресса. Радиационная биохимия белков, липидов, углеводов. Действие ионизирующих излучений на мембранные структуры клетки.
Т.к. живая материя на 70-90% состоит из воды, то большая часть энергии ионизирующего излучения первично поглощается именно молекулами воды. Воздействие продуктов радиолиза воды на биомолекулы лежит в основе косвенного действия ионизирующего излучения.
Механизм радиолиза воды (общая схема окислительного стресса):
1. При воздействии ионизирующего излучения в воде идут процессы ионизации или возбуждения.
а) ионизация - из молекулы воды выбивается электрон и образуется положительно заряженная молекула воды:
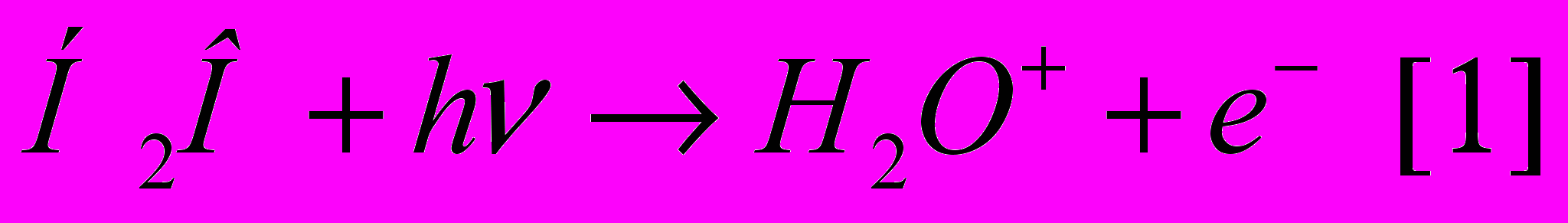
б) возбуждение - если энергии для ионизации недостаточно, образуется возбужденная молекула воды:
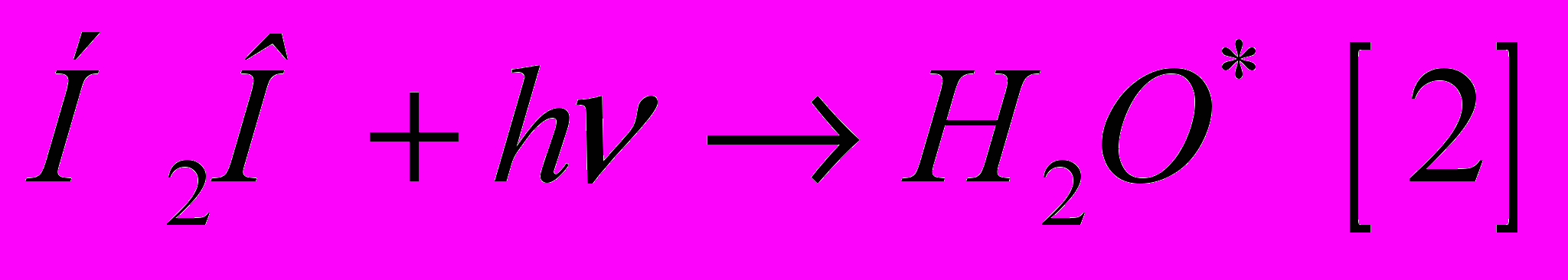
2. Освободившийся при ионизации молекулы воды электрон [1] постепенно теряет свою энергию и может быть захвачен другой молекулой воды, которая превращается в отрицательно заряженную молекулу воды:
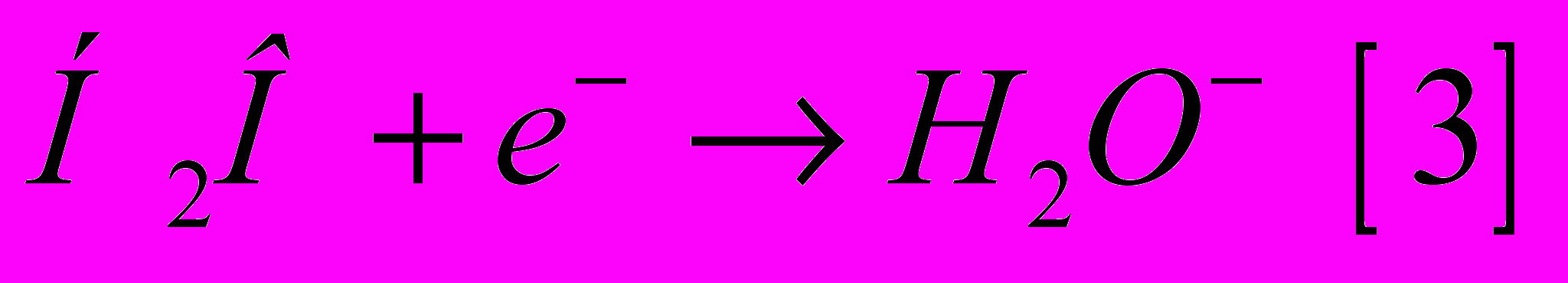
3. Все перечисленные первичные продукты взаимодействия молекулы воды с излучением (H2O+,H2O-,H2O*) являются нестабильными и могут распадаться с образованием ионов и свободных радикалов:

4. Выбитый электрон может окружить себя четырьмя молекулами воды и превратиться в гидратированный электрон e-aq, а затем может быть захвачен молекулой H2O+ с образованием возбужденной молекулы воды:

Возбуждённая молекула воды распадается на атомарный водород H и гидроксильный радикал OH, которые далее могут реагировать друг с другом. Это, в первую очередь, касается радикалов H и OH, образующихся при распаде H2O*, после реакции [2]:
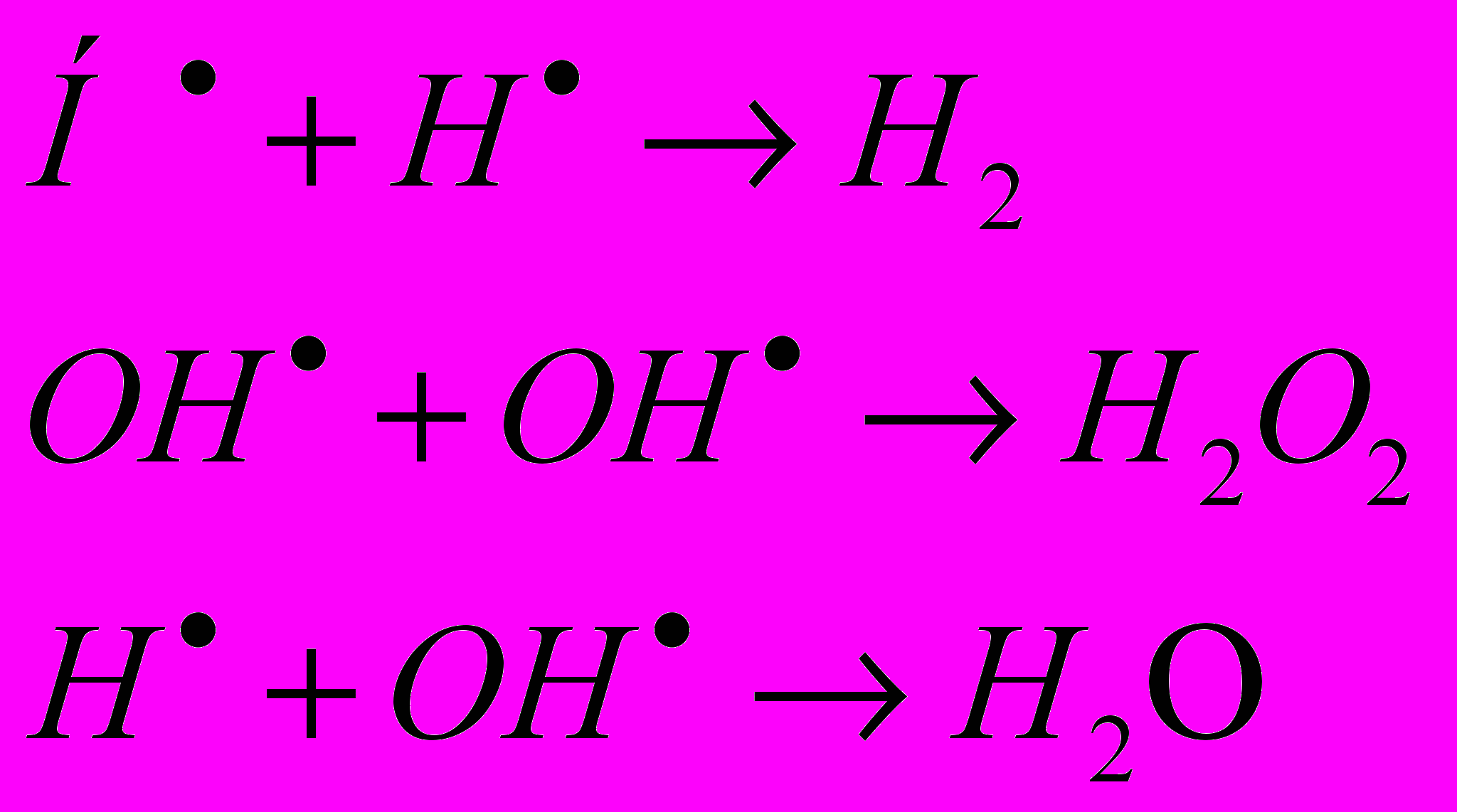
5. Образовавшиеся радикалы могут:
а) вступать в реакцию с другими молекулами воды:
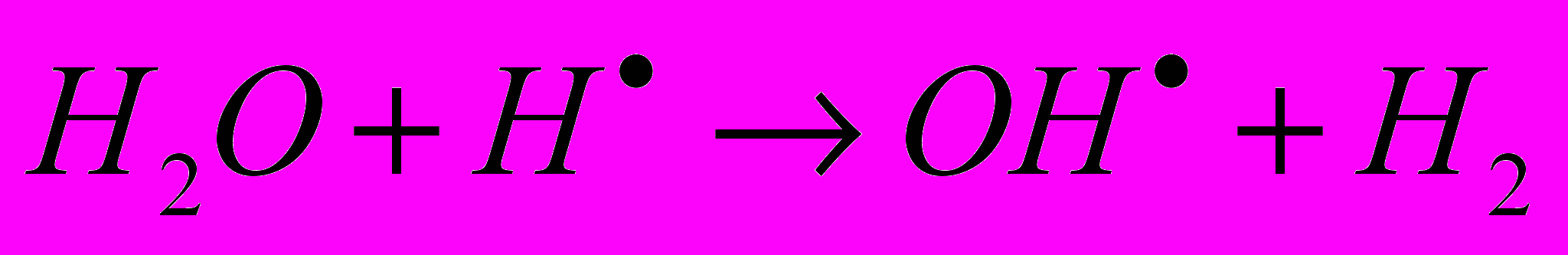
б) вырывать атом водорода из органических молекул, превращая их в радикалы:
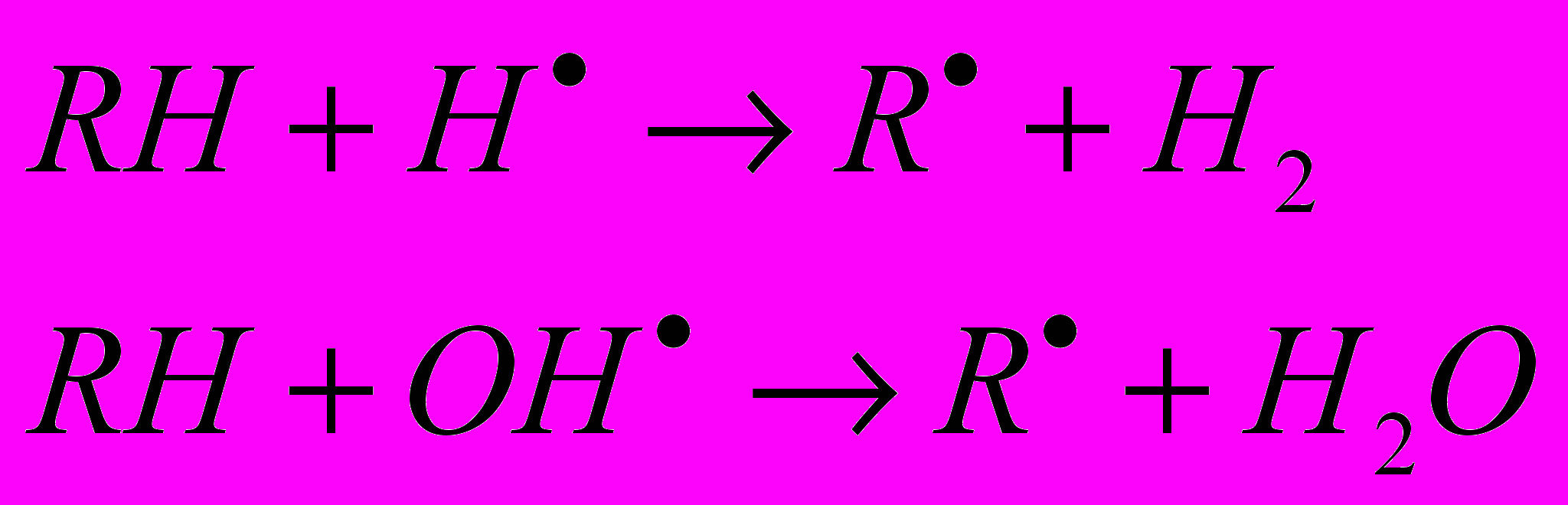
в) реагировать с молекулами растворенного кислорода с образованием перекисных радикалов, обладающих высокой реакционной способностью:
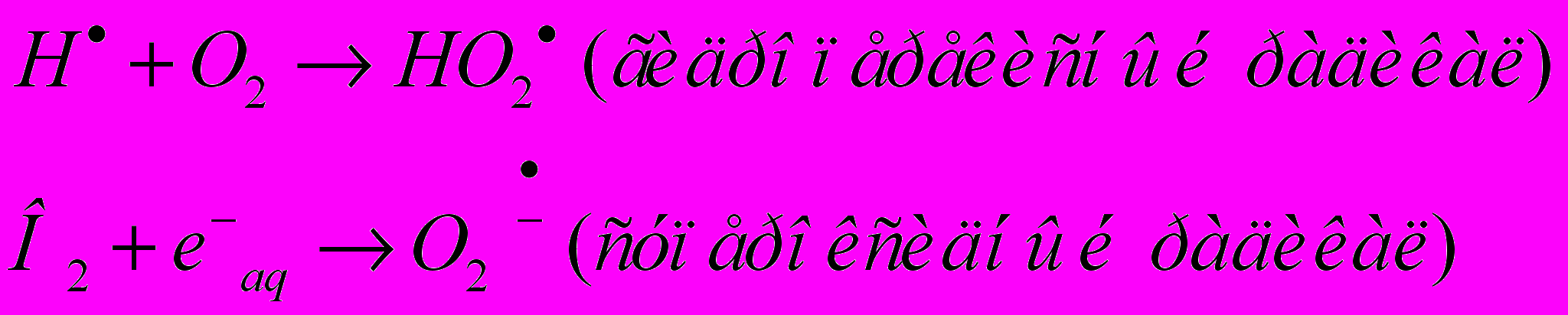
В целом для продуктов радиолиза воды наиболее характерны реакции окисления или восстановления субстрата, образования радиотоксинов. К окислителям относят следующие продукты радиолиза воды: ОН, Н2О2 , НО2 , О2 , к восстановителям: Н , e-aq . Образование радиотоксинов происходит в результате реакции с хиноном и убихиноном.
Действие ионизирующих излучений на белки.
До 20% поглощенной энергии связано с повреждением белков.
Механизм повреждения белков:
а) при прямом действии ионизирующих излучений: из молекулы белка выбивается электрон и образуется дефектный участок, который мигрирует по полипептидной цепи за счет переброски соседних электронов до тех пор, пока не достигнет участка с повышенными электрон-донорными свойствами. В этом месте в боковых цепях аминокислот возникают свободные радикалы.
б) при косвенном действии ионизирующих излучений: образование свободных радикалов происходит при взаимодействии белковых молекул с продуктами радиолиза воды, что влечет за собой изменение структуры белка:
- разрыв водородных, гидрофобных, дисульфидных связей;
- модификация аминокислот в цепи;
- образование сшивок и агрегатов;
- нарушение вторичной и третичной структуры белка.
Такие нарушения в структуре белка приводят к нарушению его функций (ферментативной, гормональной, рецепторной и др.).
Действие ионизирующих излучений на липиды.
Под влиянием облучения происходит процесс перекисного окисления липидов - образование свободных радикалов ненасыщенных жирных кислот, которые при взаимодействии с кислородом образуют перекисные радикалы, а они, в свою очередь, реагируют с нативными жирными кислотами.
Действие ионизирующих излучений на мембранные структуры клетки.
Так как липиды - основа биомембран, то перекисное окисление повлечет за собой изменение их свойств. Клетка - система взаимосвязанных мембран и многие процессы клеточного метаболизма проходят именно на мембранах, поэтому при повреждении мембран в клетке нарушаются биохимические процессы и энергетический обмен (из-за повреждения митохондрий), происходит сдвиг ионного баланса клетки (выравнивание концентраций натрия и калия вследствие сдвига ионного баланса клетки).
Действие ионизирующего излучения на углеводы.
Углеводы в целом достаточно устойчивы к действию ионизирующего излучения: окислительный распад, укорочение цепи и отщепление альдегидов от простых сахаров наблюдаются при дозах порядка 1000 Гр. Из продукта распада углеводов - глицеринового альдегида - синтезируется метилглиоксаль - вещество, ингибирующее синтез ДНК и белка, и подавляющее деление клеток. Чувствительна к облучению и гиалуроновая кислота, являющаяся составным элементом соединительной ткани: уже при дозе облучения около 10 Гр наблюдается значительное снижение ее вязкости, а при больших дозах – изменение структуры, связанное с отщеплением гексозамина и гексуроновых кислот.
10. Реакция клеток на облучение. Современные представления о механизмах интерфазной и митотической гибели клетки. Последовательность реакций, ведущих к лизису клетки.
Три основных типа реакции клетки на облучение:
а) радиационный блок митозов (временная задержка деления) - наиболее универсальная реакция клетки на воздействие ионизирующих излучений, ее длительность зависит от дозы: на каждый Грей дозы клетка отвечает задержкой митоза в 1 час. Проявляется данный эффект независимо от того, выживет ли клетка в дальнейшем, причем с увеличением дозы облучения увеличивается не число реагирующих клеток, а именно время задержки деления каждой облученной клетки. Эта реакция имеет огромное приспособительное значение: увеличивается длительность интерфазы, оттягивается вступление клетки в митоз, создаются благоприятные условия для нормальной работы системы репарации ДНК.
б) митотическая (репродуктивная) гибель клетки - полная потеря клеткой способности к размножению; развивается при больших дозах ионизирующего излучения. Данный тип реакции не относится к клеткам, не делящимся или делящимся редко. В клетке не выражены дегенеративные процессы. Основная причина митотической гибели клетки - повреждение хромосомного аппарата клетки, приводящее к дефициту синтеза ДНК.
Показателем выживаемости клетки является ее способность проходить 5 и более делений.
Варианты митотической гибели:
1) клетка гибнет в процессе одного из первых четырех пострадиационных митозов, невзирая на отсутствие видимых изменений;
2) облученные клетки после первого пострадиационного митоза формируют так называемые "гигантские" клетки (чаще в результате слияния "дочерних" клеток), которые способны делиться не более 2-3 раз, после чего погибают.
в) интерфазная гибель клетки - гибель клетки, которая наступает до ее вступления в митоз. Для большинства соматических клеток человека она регистрируется после облучения в дозах в десятки и сотни Гр (лимфоциты, как радиочувствительные клетки, гибнут по этому механизму даже при небольших дозах). В клетке наблюдаются различные дегенеративные процессы вплоть до её лизиса.
Механизм интерфазной гибели (последовательность реакций, приводящих к лизису клетки):
1. За счёт разрывов в молекуле ДНК нарушается структура хроматина. В свою очередь, в мембранах идёт процесс перекисного окисления липидов.
2. Изменения ДНК-мембранного комплекса вызывают остановку синтеза ДНК.
3. Повреждение мембраны лизосом приводит к выходу из них ферментов - протеаз и ДНК-аз
4. ДНК-азы разрушают ДНК, что ведет к пикнозу ядра. Повреждение мембран митохондрий ведёт к выходу из них кальция, который активирует протеазы.
Вышеперечисленные процессы приводят к гибели (аутолизу) клетки.
11. Методы регистрации ионизирующих излучений, их характеристика, используемые детекторы и приборы.
Радиоактивные излучения невидимы, не имеют цвета, запаха или других признаков, на основании которых человек мог бы заподозрить их наличие, поэтому обнаружение и измерение излучений производят косвенным путем на основании какого-либо их свойства.
В результате взаимодействия радиоактивного излучения с внешней средой происходит ионизация и возбуждение ее нейтральных атомов и молекул. Эти процессы изменяют физико-химические свойства облучаемой среды, в том числе и биологических объектов. Взяв за основу эти явления, для регистрации и измерения ионизирующих излучений используют следующие методы:
а) физические:
1. ионизационный - под воздействием ионизирующих излучений в среде (газовом объеме) происходит ионизация молекул, в результате чего электропроводность этой среды увеличивается. Если в данную среду поместить два электрода, к которым приложено постоянное напряжение электрического тока, то между электродами создается электрическое поле, в котором возникает направленное движение заряженных частиц: отрицательно заряженных - к аноду, положительно заряженных - к катоду, т.е. проходит так называемый ионизационный ток. Измеряя его величину, получают представление об интенсивности радиоактивных излучений. В качестве детекторов, работающих на ионизационном методе регистрации, чаще всего используются:
- газоразрядные счетчики Гейгера—Мюллера - цилиндрический катод, вдоль оси, которого натянута проволока - анод. Система заполнена газовой смесью. При прохождении через детектор заряженная частица ионизирует газ. Образующиеся электроны, двигаясь к положительному электроду - нити, попадая в область сильного электрического поля, ускоряются и в свою очередь ионизуют молекулы газа, что приводит к образованию коронного разряда. Амплитуда сигнала достигает нескольких вольт и регистрируется. Счётчик Гейгера регистрирует факт прохождения частицы через счётчик, но не позволяет измерить энергию частицы.
- ионизационные камеры - в них, как и в счетчике Гейгера, используется газовая смесь, однако напряжение питания в ионизационной камере меньше и усиления ионизации в ней не происходит.
- пропорциональные (газоразрядные) счетчики различных типов - имеют такую же конструкцию, как и счетчик Гейгера, но за счёт подбора напряжения питания и состава газовой смеси при ионизации газа пролетевшей заряженной частицей не происходит коронного разряда. Под действием электрического поля создаваемого вблизи положительного электрода первичные частицы производят вторичную ионизацию и создают электрические лавины, что приводит к усилению первичной ионизации созданной пролетевшей через счётчик частицы в тысячу-миллион раз. Пропорциональный счетчик позволяет регистрировать энергию частиц.
- полупроводниковый счетчик (твердотельная ионизационная камера) - устройство похоже на ионизационную камеру, но роль газа играет чувствительная область, в которой в обычном состоянии нет свободных носителей заряда. Попав в эту область заряженная частица вызывает ионизацию, соответственно в зоне проводимости появляются электроны, а в валентной зоне - дырки. Под действием приложенного к напыленным на поверхность чувствительной зоны электродам напряжения, возникает движение электронов и дырок, формируется импульс тока. Заряд импульса тока несет информацию о количестве электронов и дырок и соответственно об энергии, которую заряженная частица потеряла в чувствительной области. Если частица полностью потеряла энергию в чувствительной области, проинтегрировав токовый импульс получают информацию об энергии частицы. Полупроводниковые счётчики обладают высоким энергетическим разрешением.
- другие счетчики: камера Вильсона, пузырьковая камера, искровая камера, стриммерная камера, пропорциональная камера, дрейфовая камера.
2. люминесцентный - основан на способности веществ к отсроченному или немедленному свечению под воздействием излучения.
- флуоресцентный счетчик - детектирование основано на способности некоторых веществ (активизированное серебро и др.) накапливать энергию от ядерных излучений. Впоследствии при нагревании или освещении ультрафиолетом энергия отдается и измеряется с помощью термолюминесцентных и стеклянных дозиметров.
- сцинтилляционный счетчик - детектирование основано на способности атомов специальных веществ-сцинтилляторов возбуждаться под воздействием излучений и при возвращении в основное состояние испускать фотоны видимого света (сцинтилляции), которые улавливаются специальным прибором –фотоэлектронным умножителем. На выходе фотоэлектронного умножителя, появляется ток, по величине которого судят об излучении.
3. калориметрический - основан на измерении тепла, выделяемого в веществе при поглощении излучения. В медицинской практике не применяется из-за незначительного уровня тепловыделения и сложности его регистрации при дозах облучения, имеющих практическое клиническое значение.
б) химические - в их основе лежит количественное определение изменений в химических растворах (цвета, прозрачности, выпадения осадков, выделения газа), которые возникают в результате поглощения энергии излучения.
1. колориметрический - фиксирование с помощью цветных реакций изменения вещества под воздействием ионизирующего излучения. Например, хлороформ в воде при облучении разлагается с образованием соляной кислоты, которая дает цветную реакцию с красителем; двухвалентное железо в кислой среде окисляется в трехвалентное под воздействием свободных радикалов воды, образующихся при ее облучении, а трехвалентное железо дает с красителем цветную реакцию. Изменение окраски растворов измеряется с помощью колориметра, по плотности окраски судят о дозе облучения.
2. фотографический - основан на измерении степени почернения фотоэмульсии, т.е. на регистрации восстановления галогенидов серебра в фотопленке с дальнейшим качественным или количественным анализом. Прохождение ионизирующего излучения через фотоэмульсию делает затронутые им кристаллы галогенидов серебра способными к проявлению, при этом плотность почернения пропорциональна дозе облучения. Сравнивая плотность почернения с эталоном, определяют дозу облучения, полученную пленкой. На этом принципе основана работа индивидуальных фотодозиметров.
в) биологические - основаны на способности излучений изменять биологические объекты. Величину дозы оценивают по уровню летальности животных, степени лейкопении, количеству хромосомных аберраций, изменению окраски и гиперемии кожи, выпадению волос, появлению в моче дезоксицитидина и др. Биологические методы не всегда точны и менее чувствительны по сравнению с физическими. Однако они незаменимы в случае определения относительной биологической эффективности тяжелых частиц с большой энергией, учете индивидуальных различий радиочувствительности, а также при невозможности определить дозу другими методами.
1. клинические - используется лишь для грубой оценки поглощенной дозы. Неточности в оценках дозы возникают из-за высокой вариабельности симптоматики у различных пациентов и влияния множества других факторов. Клиническая дозиметрия рекомендуется в случаях, когда не требуется большой точности дозиметрических исследований. Частота, сроки развития и степень тяжести симптомов имеют прямую зависимость от мощности. Например, начало рвоты через 2 часа и позже характерно для дозы облучения 1-2 Гр, через 1-2 часа - для дозы 2-4 Гр, через 30 мин-1 час - для дозы 4-6 Гр, менее, чем через 30 мин - для дозы 6-10 Гр.
2. гематологические - основаны на регистрации изменений в состоянии гемопоэтической системы, которая высокочувствительна к излучению.
- метод подсчета лимфоцитов - лимфоциты чрезвычайно радиочувствительны и реагируют в течение нескольких часов от начала облучения (даже в малых дозах по сравнению с другими клетками крови)
- метод подсчета гранулоцитов - доза облучения до 2 Гр вызывает постепенную депрессию числа гранулоцитов до 50 % через 30 дней после облучения. Дозы 2-5 Гр вызывают начальное повышение числа гранулоцитов (сдвиг влево), которое обычно длится только часы и сопровождается затем резким снижением (из-за снижения образования и поступления в кровь зрелых гранулоцитов). Через 2 недели после облучения возникает еще один подъем гранулоцитов (абортивный) с дальнейшим резким снижением их числа за несколько дней (из-за выхода в кровь клеток, находившихся на заключительных стадиях дифференцирования, а потому менее чувствительных к облучению). Дозы более 5 Гр обычно вызывают резкое снижение с дальнейшим постепенным снижением содержания вплоть до агранулоцитоза в течение 3 недель.
3. цитогенетические:
- подсчет хромосомных аберраций - основан на анализе дицентриков и других аберраций хромосом. В случае высоких доз (> 1 Гр острого облучения) необходим для планирования терапии, при подостром облучении используется для определения риска развития стохастических эффектов. С помощью данного метода можно обнаруживать «ложные тревоги», когда доза, зарегистрированная на индивидуальном дозиметре действительно не получалась владельцем; подтверждать подлинное сверхнормативное облучение и обеспечивать альтернативную оценку дозы независимо от физических методов; подтвердить или опровергнуть подозреваемое облучение лиц, не носящих индивидуальные дозиметры.
Возможные радиационно индуцированные повреждения ДНК: двойные разрывы, одиночные разрывы, повреждения оснований, сахаридов, сшивки ДНК-ДНК, ДНК-белок и др.
Чаще всего на практике используют подсчёт количества дицентриков в лимфоцитах и FISH-метод (Fluorescent In Situ Hybridization) - предварительное окрашивание определённых участков ДНК различными флуоресцентными красителями (прямой метод) или нефлуоресцирующими метками с последующей обработкой флуоресцентными антителами (косвенный метод).
- анализ упаковки хроматина - в оптическом микроскопе при окраске серебром на различных стадиях митоза видны основные структуры упаковки ДНК; по степени их повреждения судят о дозе облучения.
4. биофизические - представлены методом электронного парамагнитного резонанса - основной прямой метод обнаружения свободных радикалов.
г) расчетные - дозу излучения определяют путем математических вычислений; единственно возможный метод определения дозы от инкорпорированных радионуклидов.
Радиометрия - процесс измерения количества радиоактивных изотопов и их концентрации в различных объектах. Методы радиометрии используются в дозиметрии для определения доз излучения.
В основу работы измерительных приборов положена количественная оценка физических явлений, сопровождающих взаимодействие излучений с веществом.
Регистрирующий излучение прибор обычно состоит из трех основных частей:
1) детектора, датчика - чувствительного элемента, воспринимающего излучение, в который поступают частицы или кванты и с помощью преобразователя эффекта взаимодействия превращаются в электрические импульсы
2) источника электрического питания
3) счетчика электрических импульсов, амперметра, интенсиметра - измерительного устройства, учитывающего степень изменений в облучаемой среде.
Приборы делятся на:
а) дозиметры - используют для контроля доз внешнего облучения человека.
1. индивидуальные дозиметры - предназначены для определения индивидуальной дозы внешнего облучения конкретного человека
2. общие (групповые) дозиметры - определяют мощность дозы внешнего облучения, что позволяет использовать их для косвенного подсчета дозы внешнего облучения человека.
б) радиометры - используют для контроля доз внутреннего облучения человека.
1. прямые - предназначены для определения содержания радионуклидов в теле человека с дальнейшим подсчётом дозы внутреннего облучения.
2. косвенные - предназначены для определения содержания радионуклидов в объектах окружающей среды с целью определения возможной дозы внутреннего облучения.
12. Дозиметрия. Дозы: экспозиционная, поглощенная, эквивалентная и эффективная; соотношение между системными и внесистемными (традиционными) единицами доз. Коллективные дозы.
Дозиметрия - это измерение дозы или ее мощности.
Доза ионизирующего излучения - количество энергии ионизирующей радиации, поглощенной единицей массы любой облучаемой среды. Мощность дозы - доза излучения в единицу времени.
Основная задача дозиметрии - определение дозы излучения в различных средах и в тканях живого организма.
Значение дозиметрии:
- необходима для количественной и качественной оценки биологического эффекта доз ионизирующих излучений при внешнем и внутреннем облучении организма
- необходима для обеспечения радиационной безопасности при работе с радиоактивными веществами
- с ее помощью можно обнаружить источник излучения, определить его вид, количество энергии, а также степень воздействия излучения на облучаемый объект.
Виды доз:
а) экспозиционная доза (Х) - количественная характеристика поля источника ионизирующего излучения (гамма или рентгеновского), характеризующая величину ионизации сухого воздуха при атмосферном давлении.
Кулон на килограмм (Кл/кг, C/kg) - системная единица экспозиционной дозы; 1 Кл/кг равен экспозиционной дозе фотонного излучения, при которой сумма электрических зарядов всех ионов одного знака, созданных электронами, освобожденными в облученном воздухе массой 1 кг, при полном использовании ионизирующей способности всех электронов, равна 1 Кл.
Рентген (Р, R) - традиционная (внесистемная) единица экспозиционной дозы; 1 рентген равен экспозиционной дозе рентгеновского или гамма-излучения в воздухе, при которой в результате полной ионизации в 1 см3 сухого атмосферного воздуха при температуре 0о С и давлении 760 мм рт. ст. (т.е. в 0,001293 г сухого атмосферного воздуха) образуются ионы, несущие заряд, равный 1 единице заряда СГС каждого знака.
СГС - система единиц измерения, в которой существуют три независимые величины: сантиметр-грамм-секунда.
Соотношение единиц: 1 Р = 2,58*10-4 Кл/кг (точно); 1 Кл/кг = 3,88*103 Р (приблизительно).
Мощность экспозиционной дозы - величина, выраженная в мР/ч или мкР/ч. Обычные фоновые показатели мощности экспозиционной дозы для Беларуси - до 18-20 мкР/ч.
По традиции экспозиционную дозу использовали в рентгенодиагностике благодаря тому, что ионизирующая способность рентгеновского излучения для воздуха и биологической ткани приблизительно одинакова. Однако, при переходе к высокоэнергетическим типам излучения, выяснилась ограниченность использования этой характеристики при оценке поглощенной дозы, особенно в живых организмах. В связи с этим экспозиционная доза применяется для оценки поля источника излучения, а для определения взаимодействия ионизирующих излучений со средой используется поглощенная доза.
б) поглощенная доза (D) - количество энергии, поглощаемое единицей массы облучаемого вещества.
Джоуль на килограмм (Грей, Гр, Gy) - системная единица поглощенной дозы. 1 Дж/кг = 1 Гр.
Рад (rad, rd - radiation absorbed dose - поглощенная доза излучения) - традиционная (внесистемная) единица поглощенной дозы.
Соотношение единиц: 1 рад = 0,01 Гр.
Для мягких тканей человека в поле рентгеновского или -излучения поглощенная доза в 1 рад примерно соответствует экспозиционной в 1 P.
Поглощенная доза не зависит от вида и энергии ионизирующего излучения и определяет степень радиационного воздействия, т.е. является мерой ожидаемых последствий облучения.
Учитывая существенные различия в механизме взаимодействия разных типов излучения с веществом, ионизирующей способности и т.д., следует ожидать, что одна и та же поглощенная доза может дать разный биологический эффект. Для количественной оценки такого различия вводятся понятия: “взвешивающие коэффициенты для различных видов излучения (WR)” и “эквивалентная доза”.
в) эквивалентная доза (HTR) - мера выраженности биологического эффекта облучения. При расчете эквивалентной дозы используют взвешивающие коэффициенты как множители поглощенной дозы:
 , где HTR - эквивалентная доза в органе или ткани Т, созданная излучением R; DTR- средняя поглощенная доза от излучения R в ткани или органе T; WR – взвешивающий коэффициент для излучения R.
, где HTR - эквивалентная доза в органе или ткани Т, созданная излучением R; DTR- средняя поглощенная доза от излучения R в ткани или органе T; WR – взвешивающий коэффициент для излучения R.Взвешивающие коэффициенты (WR) позволяют учесть относительную эффективность различных видов излучения в индуцировании биологических эффектов.
Так как WR - безразмерный множитель, системная единица для эквивалентной дозы та же, что и для поглощенной дозы - Дж/кг (специальное название - Зиверт: Зв, Sv)
Бэр (rem) - внесистемная единица эквивалентной дозы (бэр - биологический эквивалент рада).
Соотношение единиц: 1 бэр = 0,01 Зв.
Взвешивающие коэффициенты для отдельных видов излучения.
| Вид излучения и диапазон энергии | Взвешивающий коэффициент WR |
| Фотоны любых энергий | 1 |
| Электроны и мюоны любых энергий | 1 |
| Альфа-частицы, осколки деления, тяжелые ядра | 20 |
| Нейтроны с энергией: менее 10 кэВ | 5 |
| от 10 кэВ до 100 кэВ | 10 |
| от 100 кэВ до 2 МэВ | 20 |
| от 2 МэВ до 20 МэВ | 10 |
| более 20 МэВ | 5 |
Риск развития стохастических последствий облучения организма человека зависит не только от эквивалентной дозы, но и от радиочувствительности тканей или органов, подвергшихся облучению. Радиочувствительность органов и тканей учитывает эффективная доза.
г) эффективная доза (Е) - величина воздействия ионизирующего излучения, используемая как мера риска возникновения отдаленных последствий облучения всего тела человека и отдельных его органов с учетом их радиочувствительности; представляет сумму произведений эквивалентных доз в тканях и органах тела на соответствующие взвешивающие коэффициенты:
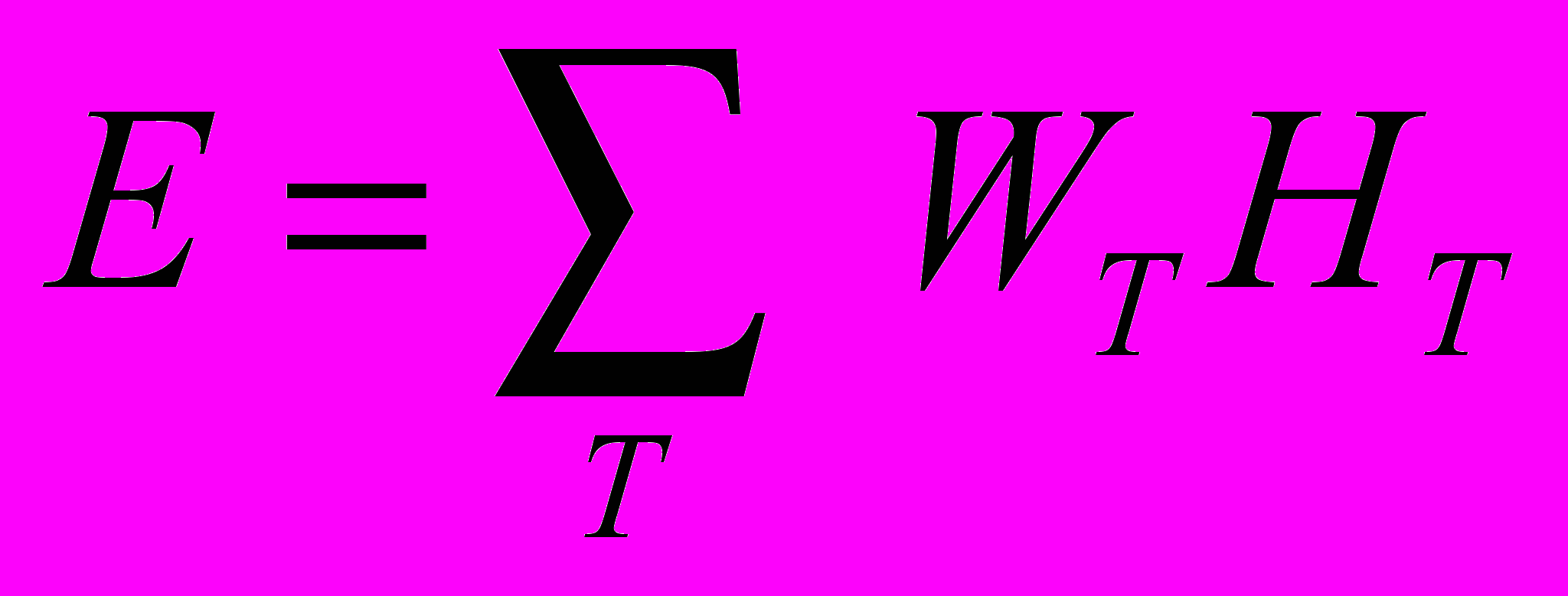 ,
, где HT - эквивалентная доза в ткани или органе T; WT - взвешивающий коэффициент для органа или ткани T.
Взвешивающий коэффициент WT характеризует относительный вклад данного органа или ткани в суммарный ущерб здоровью из-за развития стохастических эффектов. Сумма WT равна 1.
Системная единица эффективной дозы - зиверт (Зв, Sv); внесистемная единица – бэр. 1 Зв равен 100 бэр.
Взвешивающие коэффициенты для тканей и органов при расчете эффективной дозы (WT).
| Ткань или орган | WT | Ткань или орган | WT |
| Гонады | 0.20 | Печень | 0.05 |
| Красный костный мозг | 0.12 | Пищевод | 0.05 |
| Толстый кишечник | 0.12 | Щитовидная железа | 0.05 |
| Легкие | 0.12 | Кожа | 0.01 |
| Желудок | 0.12 | Клетки костных поверхностей | 0,01 |
| Мочевой пузырь | 0.05 | Остальное | 0.05 |
| Молочные железы | 0.05 | | |
