Урок сказка по теме: «Оксид углерода (II), Оксид углерода (IV)»
| Вид материала | Урок |
СодержаниеСО – активный Домашнее задание Особенности физиологического действия углекислого газа и его экологическая опасность. |
- Вариант 1 часть а, 22.67kb.
- Опорный конспект «Подгруппа углерода»; тест «Подгруппа углерода»; периодическая система, 77.6kb.
- Конспект урока «Общая характеристика подгруппы углерода. Углерод», 56.22kb.
- Электросинтез углерода в форме нанотрубок, алмазных нанопорошков и пленок, 22.89kb.
- 8 Производство чугуна, 108.71kb.
- План занятия №1 Классификация, номенклатура и пространственное строение органических, 96.42kb.
- Консультации для педагогов по теме «Возникновение жизни нам земле», 109.88kb.
- Название Мембранные контакторы высокого давления для выделения диоксида углерода, 124.92kb.
- Шунгит Характеристика минерала, 489.73kb.
- Антонова Ирина Игоревна, 233.92kb.
Урок – сказка по теме:
«Оксид углерода (II), Оксид углерода (IV)».
Цели урока: изучить физические и химические свойства, получение, приме-
нение и физические действия оксидов углерода (II, IV),
развивая познавательную активность и самостоятельность
учащихся в учебной работе.
Оборудование: NаОН, СаО, Са(ОН)2 , Н2О, НСl, мрамор СаСО3, лакмус,
пищевая сода NаНСО3, уксусная кислота СН3СООН,
стеклорез, графит.
План изучения темы:
1). Опрос: аллотропия С, адсорбиция, химические свойства С.
2). Оксид углерода (II). Физические и химические свойства; применение.
3). Оксид углерода (IV). Физические и химические свойства; применение.
4). Сообщения : «Экологические последствия антропогенного воздействия
на природный круговорот углерода».
Оформление доски:
На левой доске написана тема, на средней доске таблица, которая заполняется
в течении урока.
| Вопросы для сравнения | Оксид углерода ( II ) | Оксид углерода ( IV ) |
| 1. Получение 2. Физич. св – ва. 3. Химич. Св – ва. 4. Применение. | | |
Правая доска для опроса.
Сегодня, мы с вами проведем урок – сказку по теме: «Оксид углерода (II ). Оксид углерода (IV). Побывав в сказочном химическом царстве мы познакомимся с физическими и химическими свойствами данных оксидов, их получением и применением. Послушаем сообщение об экологической опасности, которую представляют углекислый и угарный газы. Итак, внимательно слушаем сказку и активно в ней участвуем.
Ведущая: В сказочном царстве, химическом государстве жил – был граф
Углерод. Он был очень важной персоной, так как находился в родстве со всеми живыми организмами. Граф был мягким и добродушным, но, когда случалось вспупать с кем то в спор, когда на него оказывали давление и доводили его до «белого каления», Углерод становился совсем другим, непохожим на самого себя: (демонстрирует стеклорез), бесцветным, прозрачным. В такой момент он
необычайно хорош и привлекал внимание всех красавиц сказочного государства.
Учитель: О каком химическом понятии идет речь? (аллотропия С: графит, алмаз).Чем отличаются структуры алмаза, графита, карбита и почему их можно назвать « родными братьями».
Ведущий: Углерод очень любил принимать гостей, проявляя при этом свои окислительные способности. (звучит медленная музыка, поочереди входят Н2 ,
Са, Аl).
1. С водородом он образовывал углероды.
С + 2Н2 = СН4
2. А с друзьями металлами- карбиды.
2С + Са = Са С 2 - карбид кальция.
3С + 4Аl = Аl4 С3 - карбид алюминия.
( на спинах у учащихся образовавшаяся формула).
Учитель: ребята, кто желает записать на доске окислительные способности С -?
Ведущий: Благодаря восстановительным свойствам было у углерода два сына: - угарный газ (Угарик), углекислый газ (Углекислик). (Граф обнимает своих детей).
Учитель: Обратите внимание на таблицу, заметьте, что при неполном сгорании образуется угарный газ, а при полном СО2 , а также СО2 можно получить восстановление оксида меди ( II )углем.(в таблице записаны формулы).
Получение: 2С + О2 = 2СО (неполное сгорание)
С + О2 = СО2 +Q
С + 2СuО = С О2 + 2Си (можно продемонстрировать).
А как в природе образуются СО и СО2 ?
( дыхание живых организмов, фотосинтез, брожение, гниение, извержение вулканов, сжигание топлива).
Учащиеся перечерчивают таблицу в тетрадь.
Ведущий: Дети росли, а отец радовался глядя на них. Угарный газ был бесцветным, без запаха, немного легче воздуха, плохо растворим в воде, с очень низкой температурой кипения – 191,5 С (физич. свойства).(записывают свойства в таблицу).
Он как и папа, восстановителем – восстанавливал металлы из их оксидов:
СО + СиО = Си + СО2
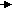 С - 2е С восстановитель
С - 2е С восстановитель Си + 2е Си окислитель
Си + 2е Си окислительВ кислороде он горел голубоватым пламенем.
2СО + О2 = 2СО + Q
С + 2е С+4 восстановитель СО – активный
О + 2е О -2 окислитель восстановитель
Было у Угарного газа свойство, которое очень огорчало отца: Угарик прочно соединялся с гемоглобином крови. При этом кровь уже не могла переносить кислород, и это было смертельно опасно.
СО – Яд!
Углекислый газ был, как и брат бесцветен, но в 1,5 раза тяжелее воздуха. Было очень много друзей, с которыми он образовывал соли, основания и основные
оксиды:
СО 2 + 2 NаОН = Nа2СО3 + Н2О - карбонат натрия
СО2 + NаОН = NаНСО3 - гидрокарбонат натрия (пищ. сода)
СО 2 + СаО = СаСО 3 - карбонат кальция
СО2 + 2М g 2М g О + С
С + 4е С окислитель СО2 - окислитель
Мg - 2е Мg восстановитель
Только известковая вода не любила Углекислика. Завидев его, она начинала нервничать, и ее по ее помутнению все сразу узнавали о появлении Углекислого газа.
СО2 + Са(ОН) 2 = СаСО3 + Н2 О (демонстрируется опыт)
Углекислый газ помогал тушить пожары, производить сахар, соду, стекло, и многое друг СО 2 умел превращаться в «сухой лед»,чем очень гордился.
Однажды старый граф Углерод поехал на бал в Водное царство.
(музыка, танец).
Их встретила принцесса Вода. Она была так прекрасна в своем ослепительно-
голубом наряде ,что Углекислый газ сразу влюбился в нее и весь вечер танцевал
только с принцессой.
Углекислый газ покорил сердце красавицы Воды. Вскоре они поженились и у них родилась дочь. Ей дали красивое имя – Кислота. От отца она унаследовала фамилию – Угольная.
СО 2 + Н 2О = Н 2СО 3 (определяют лакмусом)
СО и СО2 вместе: мы рассказали вам о нас немного,а что вы можете сказать нам о
нашем применении?
СО – используется в качестве газообразного топлива., в реакциях органического синтеза.
Применение.
(учащиеся)
СО2 - получение сахара
тушение пожаров
производство фруктовых вод
получение «сухого льда»
получение соды ( Na2CO3, NаНСО3 ).
Учитель: А теперь послушаем сообщения – какую же экологическую опасность представляют: углекислый и угарный газы.
Заключение: Обратить внимание на таблицу, на вредное воздействие данных газов на живые организмы и на окружающую среду.
Домашнее задание : §30, 31 .
1. Какое вещество называют «сухим льдом». Где оно применяется в
сельском хозяйстве? (оксид углерода - один из основных источников
минерального питания растений. В зеленых листьях из СО2 и Н 2 O
синтезируются углеводы).
2. Как с помощью СО2 тушат пожары?
Литература:
- В.Г. Андросова. Внеклассная работа по химии. М.: Просвещение. 1983
- М.В. Дряпина. Дайте возможность ребятам поиграть. Химия в школе. 1994 .№ 4.
- В.В. Северюхина. Старые опыты с новым содержанием. Химия в школе. 1999 . №2.
- Н.М. Кузьменок Экология на уроках химии. Минск. 1996 .
Экологическая опасность представляемая СО.
Угарный газ – очень ядовитый газ, без цвета и вкуса, с очень слабым запахом (обычно не ощущаемым), слегка напоминающим запах чеснока. Летальный исход может наступить для человека при 10 мин. вдыхании воздуха, содержащего 5, 7 г/м СО.
Ядовитость СО обусловлена тем, что этот оксид соединяется с гемоглобином крови, в результате чего кровь не способна переносить достаточно кислорода из легких к тканям. В воздухе СО и СО2 находятся в отношении 1: 200, кровь поглощает оба газа в равных количествах. Поэтому достаточно самой ничтожной концентрации СО, чтобы значительно понизить способность крови воспринимать О 2 и тем самым вызвать удушие. Однако при вдыхании чистого воздуха или чистого О2 , СО постепенно удаляется из крови.
СО – образуется в тех процессах, где существуют условия для полного сгорания веществ, содержащих С, а также при взаимодействии СО2 с раскаленным углем:
2С2 Н 4 + 5О2 = 2СО + 2СО + 4Н 2О (при недостатке О 2).
С + СО2 = 2СО.
В больших городах основным поставщиком СО в атмосферу является автомобильный транспорт.( В среднем каждый автомобиль сжигает 2т. бензина и 30 т. воздуха в год, выбрасывая 0,7 т. угарного газа, 40 кг. Оксидов азота, 2,5 т. твердых веществ, содержащих много свинца.
Значительное снижение выбросов СО ( до 10 раз) и повышение экономичности двигателей происходит при применении газового топлива (метан, этан, пропан, а также смесей (бензина с метаном, водорода и бензина).
В настоящее время каталитическая очистка выхлопных газов автотранспорта признана во всем мире.
Она предполагает окисленные СО до СО2 . В качестве катализаторов используются различные композиции на основе оксидов металлов: алюминия Аl, платины Рt , палладия Рd , радия Rh .
Особенности физиологического действия углекислого газа и его экологическая опасность.
В результате каких природных процессов образуется СО2 ,поступающий в атмосферу? (дыхание растений, животных, в результате брожения, гниения, извержения вулканов, сжигания топлива).
Небольшое содержание СО2 в воздухе полезно для живых организмов, так как стимулирует деятельность дыхательного центра, поэтому в небольшой концентрации СО2 не оказывает отравляющего действия на организм. Но если содержание СО2 повышается, то это губительно для человека и животных. При наличии в воздухе 3% СО2 наблюдается головокружение, шум в ушах, быстрая утомляемость, сонливость. При повышении концентрации СО2 в воздухе до 20% человек начинает задыхаться и возможен летальный исход.
Увеличение содержания СО2 в атмосфере может привести к экологической катастрофе.
На содержание СО2 в атмосфере существенное влияние оказывает деятельность человека, особенно все увеличивающиеся масштабы использования ископаемого топлива. Человечество за год сжигает около 3 млрд. тонн каменного угля, 2 млрд. тонн нефти, 800 млрд. м природного газа, при этом в атмосферу выбрасывается более 2 млрд. тонн СО2 .При сжигании топлива двигателя одного автомобиля в атмосферу попадает более 3000 кг. СО2 в год. Эти и ряд других факторов приводят к возрастанию содержания СО2 в атмосфере, за последние 100 лет концентрация СО2 в атмосфере увеличилась в 1,2 раза.
Ученые считают, что это вызовет серьезные нарушения равновесия процессов в природе, в частности может привести к изменению климата на земле.
Расчеты показывают, что удвоение содержания СО2 в атмосфере приведет к повышению средней температуры на планете на 2-3 градуса (парниковый эффект).Так, быстрое изменение климата может привести к исчезновению части лесов и других экосистем, что ослабит способность атмосферы поглощать СО 2 Более того, потепление может привести к быстрому высвобождению углерода, содержащегося в составе мертвой органической материи. Этот углерод, количество которого вдвое больше, чем в атмосфере постоянно превращается в СО2 и метан под действием почвенных бактерий.
Также, потепление климата вызовет резкие вспышки болезней среди животных и растений, в том числе и с/х культур в результате разрушения экосистем.
