А. И. Демков Проблемы в экологическом закон
| Вид материала | Закон |
- Решение (проект) 4-ой Всероссийской научно-практической конференции " Экологические, 55.94kb.
- ««Балыклейская средняя общеобразовательная школа», 172.42kb.
- Закон республики таджикистан об экологическом мониторинге, 716.47kb.
- Модель «Кейс-study» в экологическом воспитании школьников Тема Понятие кейса и кейс-метода, 1254.05kb.
- Тематический план подготовки в Учебно-производственном экологическом центре специалистов, 40.35kb.
- Техническое задание на оказание услуг по подготовке и проведению 9 -ой областной научно-, 26.66kb.
- Гвездослав Взаимоотношения Человека и Природы носят сложный характер и нуждаются, 77.69kb.
- Е окружающей природной среды» и«Об образовании» иПостановлен6ия «Об экологическом образовании, 89.18kb.
- Доклад на 2-ой международной научно практической конференции «Проблемы безопасности, 310.23kb.
- Развитие системы качества в экологическом менеджменте предприятий газовой промышленности, 291.1kb.
А. И. Демков
Проблемы в экологическом законодательстве
Не Боги горшки обжигают... Каждый в своей жизни ошибался, но Разум человеку дан, чтобы ошибки мог бы исправлять. Однако, проблема в том, что Законотворчество или не видит свою некомпетентность или не хочет ничего менять... О существенных проблемах в экологическом законодательстве в данной статье.
Мы привыкли доверять профессионализму санитарных врачей и поэтому не задумываемся о том, насколько их действия правильны. Продавцов овощей, колбасных изделий штрафуют за превышение нитритов и нитратов и мы, простые потребители, дружно одобряем их действия... Санитарные врачи закрывают работу очистных сооружений водопровода городов на сутки и более из – за неэффективной работы этих очистных сооружений (в основном, по превышению показателя мутности очищенной воды) после сильных ливней или паводков. Уже все население города ощущает суровое действие законов об экологии, санитарном надзоре... По логике, действия врачей правильны. А так ли это? По поступающей новой научной информации и личного анализа я увидел здесь проблемы. Тема весьма актуальная, но несколько радикальная, экстремистская. Как быть? Однако, после продолжительного размышления, все – таки решился на эту критическую статью. Ради научной истины, ради преодоления не компетенции, ради нас, мыслящих граждан ...
1. Санитарные требования к качеству питьевой воды
Подготовка пригодной для питья воды должна обеспечивать такой ее качественный состав, который бы не нарушал нормального функционирования организма человека. Основными требованиями, предъявляемыми к питьевой воде, являются безопасность в эпидемическом отношении, безвредность по токсикологическим показателям, хорошие органолептические показатели и пригодность для хозяйственных нужд.
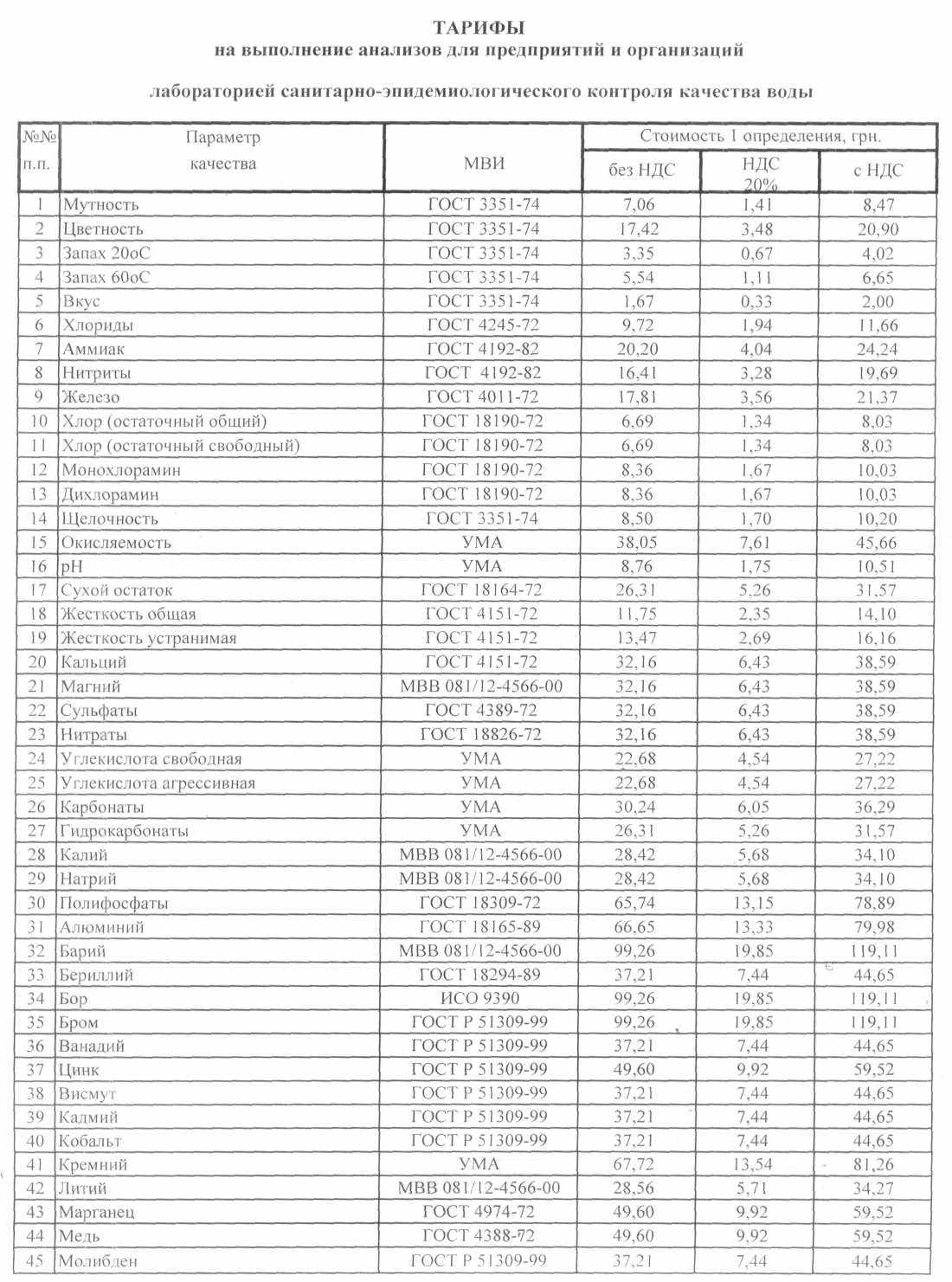
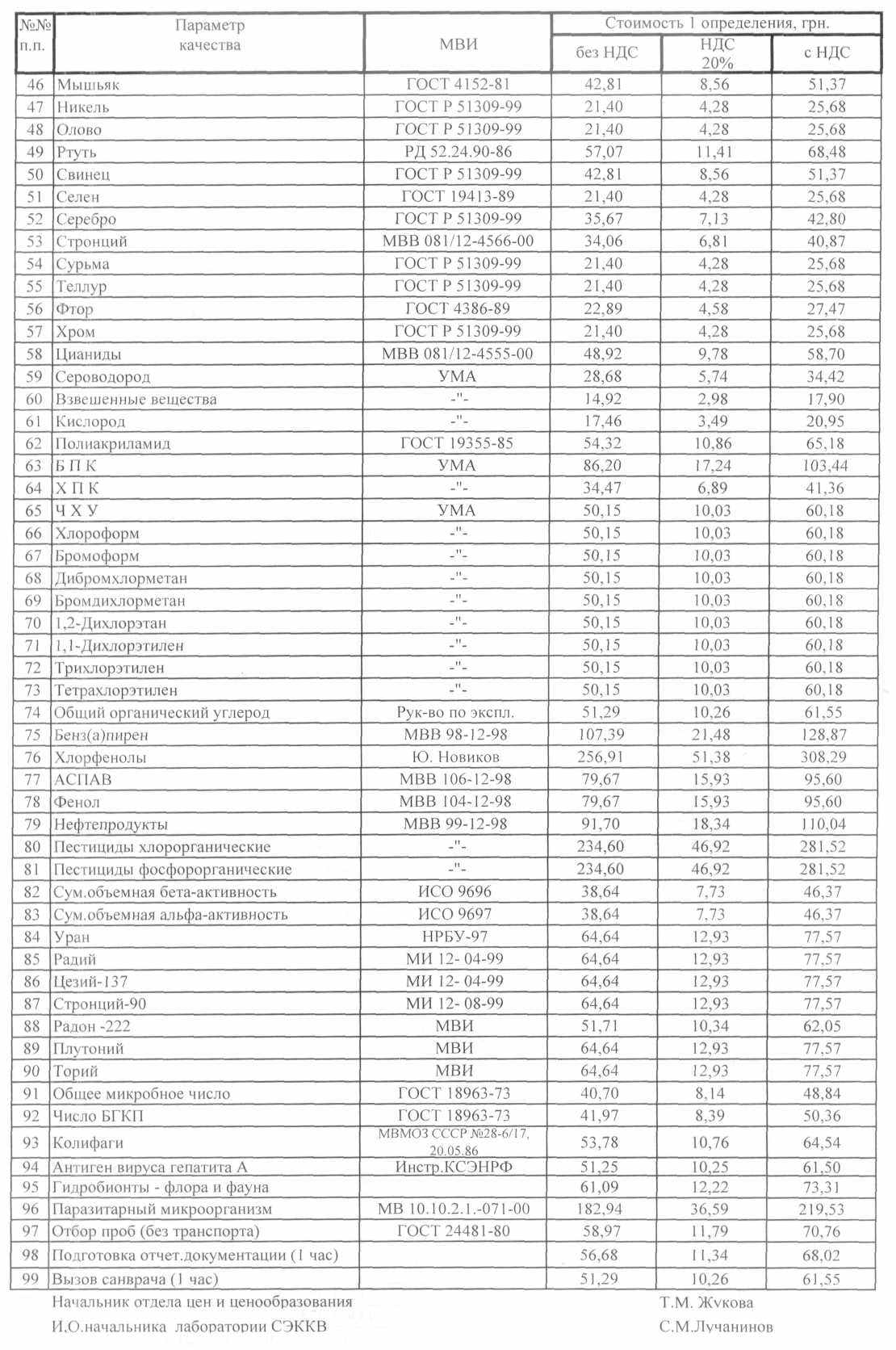
На очередном ЭВТЭК в 2009г., проходившем в г. Ялте, я ознакомился с работой лаборатории санитарно – эпидемического контроля качества воды г. Харькова (КП «ПТП «Вода»). Приятно было изучать работу хорошо оснащенной промышленной лаборатории, показывающей себя с хорошей стороны не один год, встретиться с людьми, любящие свое дело. На память я взял от них рекламный листок – почему бы не изучить содержание! И вот данный проспект перед Вами. Ничего особенного: приводятся данные по ПДК для питьевой воды по различным показателям, стоимости услуг лаборатории по исследованиям для организаций и населения... Это все для жителей Украины. В России имеются такие же лаборатории и стоимость услуг, наверное, те же самые. Я не сравнивал. Я специально привел экономическую составляющую по проверке качества воды, что бы читатель мог сориентироваться экономически в этом вопросе...
Физические показатели качества воды
К ним относятся: температура, запах, вкус, прозрачность, мутность, цветность, плотность. [1]
Химические показатели качества воды
«При полном санитарно-химическом анализе воды производят следующие определения: 1)* взвешенные вещества, мг/л; 2)* сухой остаток, мг/л; 3)* прокаленный остаток, мг/л; 4)* электропроводность, Ом-1 ·см-1; 5) * окисляемость, мг 02/л; 6) * растворенный кислород, мг/л; 7)* биохимическое потребление кислорода (БПК5) мг/л; О2; 8)* свободный хлор, мг/л; 9)* хлороемкость, мг/л; 10)* активную реакцию среды, рН; 11)* кислотность, мг-экв/л; 12)* щелочность, мг-экв/л; 13)* ионы Са2+, Мg2+, Fе2+, Fе3+*, Мп2+, А13+, Nа+, К+ ,С1-*, SO2-4,
Р03-4, F- ,I- мг/л; 14)* азотсодержащие вещества: азот аммонийных солей (NН+4), нитриты и нитраты, мг/л; 15)* жесткость воды, мг-экв/л; 16)* углекислоту, мг/л; а) общую;
б) * свободную (СО2), в) * гидрокарбонатную (НСО3-); г) карбонатную; д) равновесную; е) * агрессивную; 17) кремниевый ангидрид SiO2, мг/л; 18) поверхностно-активные вещества; 19) сероводород Н2S20; 20) ионы тяжелых металлов Рb2+, Сu2+, Zп2+ и Sn2+.
Полный санитарно-химический анализ позволяет получить подробную характеристику воды, однако в полном анализе нет надобности, и поэтому ограничиваются определениями, отмеченными звездочками *.[1]
Таблица 1. Санитарные требование к качеству питьевой воды.
| Показатель | Едини- ца измер. | ГОСТ 2874 - 73 | СанПиН 2.1.4.1074 – 01. | Директива Совета ЕС 98/83/ЕС по качеству воды |
| 1.Органолиптический | | | | |
| 1.1 Мутность (по коалину) | мг/л | 1,5 | 1,5 | - ( 1; 5) |
| 1.2 Цветность | град | 20 | 20 | 20 |
| 1.3 Вкус | балл | 2 | 2 | 3 |
| 1.4 Запах | балл | 2 | 2 | 3 |
| 1.5 Температура | ˚С | 7 - 11 | | |
| 2. Обобщенные показатели | | | | |
| 2.1 Водородный показатель рН | | 6,5 – 8,5 | 6 - 9 | 9,5 |
| 2.2 Сухой остаток | мг/л | 1000 | 1000 | 1500 |
| 2.3 Жесткость | мг экв/л | 7 | 7 | 1,5 |
| 2.4 Щелочность общая | мг/л | | | |
| 2.4 Окисляемость | мг/л | 5 | 5 | 5 |
| 2.5 Кальций Са | мг/л | | | 100 |
| 2.6 Магний Mg | мг/л | | | 50 |
| 2.7 Хлор свободный | мг/л | 0,3 – 0,5 | 0,3 – 0,5 | |
| 2.9 Нефтепродукты | мг/л | 0,1 | 0,1 | |
| 2.1 АПАВ | мг/л | 0,5 | 0,5 | 0,2 |
| 3. Неорганические вещества | | | | |
| 3.1 Железо | мг/л | 0,3 | 0,3 | 0,2 |
| 3.2 Марганец | мг/л | 0,1 | 0,1 | 0,05 |
| 3.3 Медь | мг/л | 1 | 1 | 2 |
| 3.4 Сульфаты | мг/л | 500 | 500 | 250 |
| 3.5 Хлориды | мг/л | 350 | 350 | 25 - 250 |
| 3.6 Алюминий | мг/л | 0,5 | 0,5 | 0,2 |
| 3.7 Аммоний | мг/л | | 2 | 0,5 |
| 3.8 Натрий | мг/л | 200 | 200 | 150 |
| 3.9 Калий | мг/л | | | 12 |
| 3.10 Хром | мг/л | 0,5 | 0,5 | 0,5 |
| 3.11 Никель | мг/л | 0,1 | 0,1 | 0,05 |
| 3.12 Нитраты | мг/л | 10 | 45 | 50 |
| 3.13 Нитриты | мг/л | 3,3 | 3 | 0,1 |
| 3.14 Свинец | мг/л | 0,1 | 0,03 | 0,05 |
| 3.15 Фтор | мг/л | 1,5 | 1,5 | 0,07 |
| 4. Общее микробное число (ОМЧ) | КОЕ/мл | 100 | 50 | 10 |
проводят. В основном, ограничиваются двумя показателями (!): мутностью воды и общим микробным числом. Отсюда следует, какой важности имеет показатель мутности для коммунальных служб и санитарных органов надзора. Поэтому подробно остановимся на этом физическом показателе. Исходя из этого, надо внести ясность в том, какой смысл вкладываются в понятия мутность, прозрачность, взвешенные вещества. На собственном опыте убедился, что мало кто из специалистов по воде не путают эти понятия, не знают их физического смысла. Из - за этого незнания понятия мутность возводят в степень от квадрата и более, а понятие прозрачность вообще не упоминается в официальных документах. Это существенные технологические вопросы, на которых нельзя не остановиться.
В чем принципиальное отличие понятий «мутности» от «взвешенных веществ»?
«Прозрачность воды выражается высотой (в см) столба воды, через который еще возможно чтение стандартного шрифта (прозрачность по Снеллену); этот метод применим при анализе вод с относительно малой прозрачностью, в соответствии, с чем в качестве максимального берется столб воды высотой 30 см. При анализе вод с высокой прозрачностью (вода после фильтрования) проводят определение ее по кресту (установление максимальной высоты столба воды, через который еще видно стандартное изображение креста).
Прозрачность определяется «по кресту». На рис.1 показана данная установка. Прозрачность определяется в см. столба воды в трубке 1, при котором видна деталь 4.
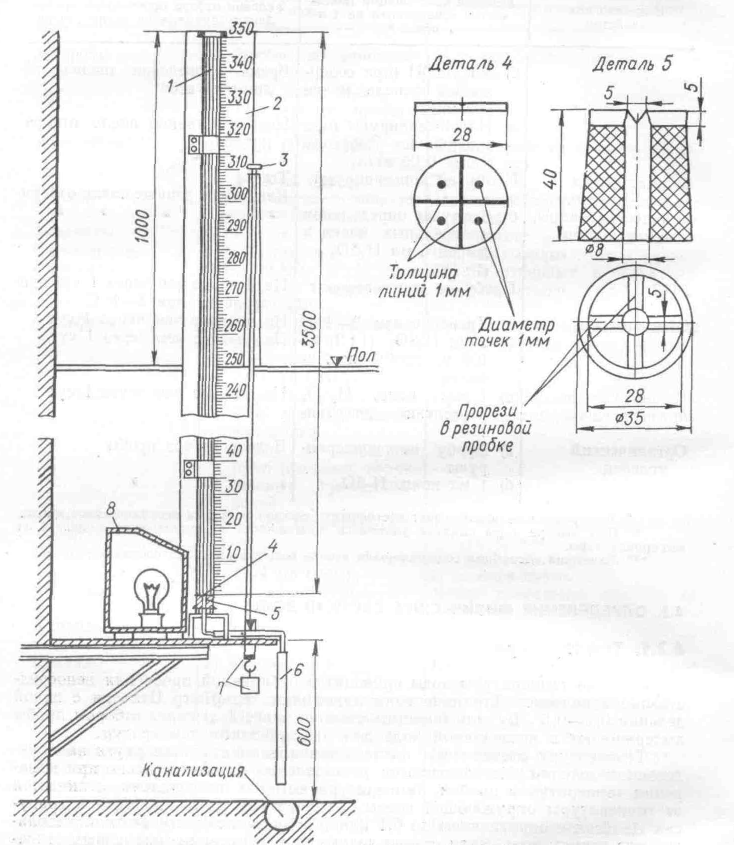
Рис. 1. Прибор для определения прозрачности «по кресту»:
1 – стеклянный цилиндр; 2- шкала с делениями; 3 – тяга зажима; 4 – белый фарфоровый диск с черными линиями и точками; 5 – резиновая пробка с прорезями; 6 – резиновый шланг для слива; 7 – зажим с грузом; 8 – электрическая лампа в кожухе.
Мутность воды является обратной функцией ее прозрачности. Определение проводят, сравнивая (визуально или при помощи приборов) мутность исследуемой воды с мутностью стандартных растворов, содержащих различные концентрации суспендированной SiO2 (а также каолина, фуллеровой земли и др.). Мутность воды выражают в мг/л SiO2». [2]
« Взвешенными веществами называются крупные частицы (d > 0,1 мкм), задерживающиеся бумажными фильтрами». [1] В лабораторных исследованиях применяют бумажный фильтр белая лента по ТУ 6-09-1706 – 82.
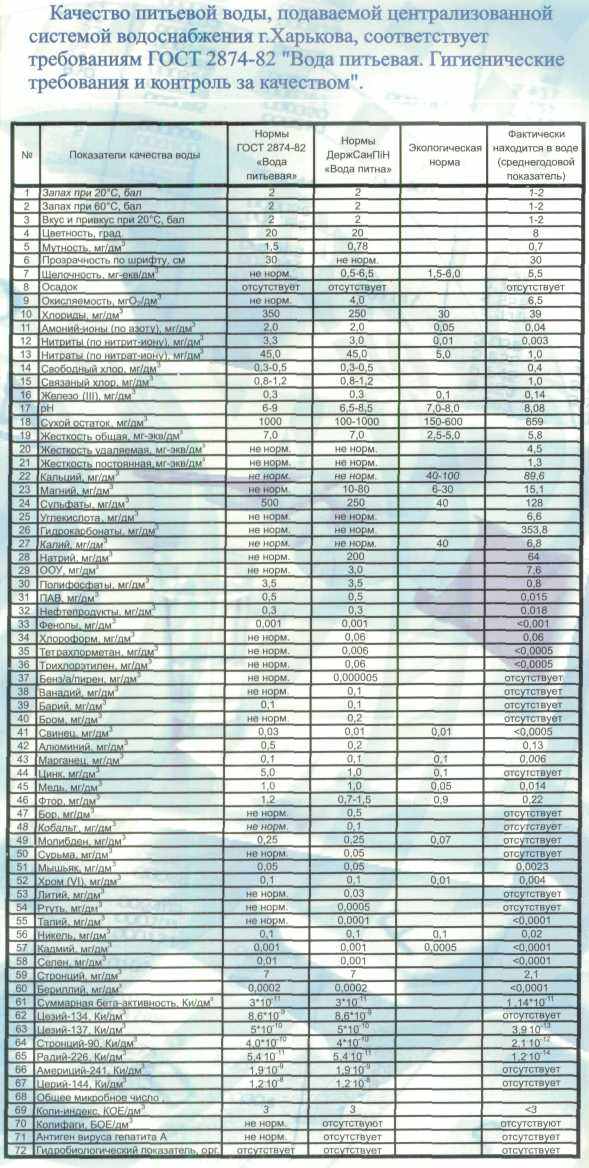
По конструкции данного прибора можно отметить, что высота трубки 1 не может быть большой – максимум 3500 мм – ограничения производителей трубок. Отсюда максимальная прозрачность возможная для измерения прозрачности может быть 350 см. Справочник [2] дает переводную таблицу прозрачности в мутность и наоборот. Методом интерполяции можно предположить, что мутности 1,5 мг/л соответствовала бы прозрачность в 610 см, а 0,78 мг/л соответственно 11,75 м (!).
Таблица 2. Перевод прозрачности «по кресту» на ее мутность[2]
Из приведенных технических данных можно сделать следующие аналитические выводы.
1. Физические параметры питьевой воды есть отражение его химического, бактериологического и биологического состава, за исключением температуры.
2. Мутность и прозрачность относятся в физическим параметрам (органолептическим), взвешенные вещества – к химическим (санитарно – токсикологическим).
3. Оптимальные физические параметры питьевой воды должны иметь рекомендательный характер и не регламентироваться официальными органами, т. к. это дело вкуса каждого человека.
4. Санитарными службами на профессиональном уровне игнорируют показатель взвешенных веществ в питьевой воде и «обожествляют» показатель мутности воды.
5. Международная организация ВОЗ показатель мутности воды не регламентирует, а относит его к рекомендациям до 5 мг/л для потребителей питьевой воды, и 1 мг/л для технологических нужд при обеззараживанием ультрафиолетом.
6. ГОСТ 2874-82 «Вода питьевая» регламентирует прозрачность питьевой воды в 30см, что соответствует 30,5 мг/л (см. табл. ) мутности, при этом показатель мутности регламентирует на уровне 1,5 мг/л. Это противоречит здравому смыслу.
7. Украинский новый ДержСанПин «Вода питьевая» регламентирует мутность воды показателем 0,78 мг/л, при этом показатель прозрачность не нормирует. Это научно необоснованная норма, которая противоречит и международному законодательству и здравому смыслу. Не понятно, чем это обусловлено, если не желанием администрирования, при этом очистка даже с мутностью в 1,5 мг/л часто является не преодолимым технологический барьер для всех очистных сооружений водопровода городов.
Для устранений этого существенного противоречия предлагаю:
- Не регламентировать органолептические показатели питьевой воды, а перевести их показатель рекомендательного характера.
- Вести нормирование питьевой воды по взвешенным веществам с учетом международного опыта, рекомендаций ВОЗ.
- В Киеве торгуют арбузами без разрешений, а в них нитраты, нитриты!
Азот является элементом V группы периодической системы, атомный номер 7, природные изотопы: 14N (99,635%, 15 N (0,365%).. В воздухе находится 78% молекулярного, довольно инертного азота N2 (кислорода - 21%). Соединения азота необходимы для растений и животных. Растения не могут усваивать азот из воздуха, а берут его из почвы в виде солей азотной кислоты (HNO3) и солей аммония (NH4 NO3, NH4Cl, ). Неорганические соединения азота: аммиак NH3, оксиды N2O, NO, N2O3, N2O4, N2O5, соли азотной кислоты: калийная селитра KNO3, NaNO3, NaNO2; органические соединения: амины, содержащие аминогруппу – - NH2 ; нитрилы - - C ≡ N; нитросоединения - - NO2, нитрозосоединения - - N = O; гидразины – NH2-NH -; гидрозосоединения - -NH – NH - ; азосоединения - -N = N - ; диазосоединения; фосфины, металлорганические соединения, аминкислоты и белки.
Нитраты представляют собой соли азотной кислоты (HNО3), нитриты же являются солями азотистой кислоты (HNО2). Нитриты легко окисляются в соответствующие нитраты. Концентрация первых в среде обычно очень низка (в воде, например 1 - 10 мг/л), в то время как концентрация нитратов высока (50 - 100 мг/л). Во всем мире отмечен рост содержания нитратов в поверхностных и грунтовых водах. Во многих шахтных колодцах США содержание нитратов составляет 45 – 450 мг/л, в Ленинградской области – 310 – 400 мг/л. В среднем содержание нитратов в реках, озерах находится от единиц до 20 мг/л. Среди нитратов наиболее известны нитраты аммония, натрия, калия, кальция, обычно называемые селитрами. Все селитры широко и давно используются в качестве удобрений.
Ионы аммония NH4+ находятся в природных водах в концентрациях от долей до нескольких мг/л. Повышенная концентрация NH4+ обычно указывает на загрязнение воды сточными водами.
Ионы NH4+ в присутствии О2 легко подвергаются биохимическому окислению, продуктами которого могут являться гидроксиламин NH2OH, элементарный азот N2, нитриты NO2-, нитраты NO3-. Образование того или иного продукта обусловлено окислительным потенциалом воды, определяемым в основном концентрацией растворенного О2. Все соли NH4+ хорошо растворимы в воде, подвергаясь в ней умеренному гидролизу.
Азотсодержащие вещества (аммиак, нитриты и нитраты) образуются в воде в результате протекания химических процессов и гниения растительных остатков, а также за счет разложения белковых соединений, попадающих почти всегда со сточными бытовыми водами. Конечным продуктом распада белковых веществ является аммиак. Присутствие в воде аммиака растительного или минерального происхождения не опасно в санитарном отношении. Воды, причиной образования аммиака в которых является разложение белковых веществ, непригодны для питья. По наличию в воде тех или иных азотсодержащих соединений судят о времени ее загрязнения. Наличие в воде аммиака и отсутствие нитритов указывает на свежее загрязнение. Совместное присутствие этих веществ свидетельствует о том, что с момента загрязнения уже прошло некоторое время. Отсутствие аммиака при наличии нитритов и особенно нитратов указывает, что загрязнение воды произошло давно и вода за это время уже самоочистилась. Вступая в общий круговорот азота, нитриты и нитраты могут выполнять сразу две функции - служить источником кислорода в анаэробных условиях и быть источником азота, например, при биосинтезе водорослей. Интенсивное зарастание имело место на ряде прудов и водохранилищ, сооруженных для целей водоснабжения: поверхности Магнитогорского водохранилища 1 - й очереди - покрылось зарослями за первые 3 - 4 года эксплуатации; катастрофические размеры принимало развитие растительности на прудах Горьковской, Брянской и других ГРЭС до проведения на них дноуглубляющих работ. Разведение растительноядных рыб (амура, толстолобика) в оросительных каналах и других водоемах является единственным радикальным и экономически выгодным средством борьбы с интенсивным зарастанием каналов, которое часто выводит из строя оросительные системы.
Подпороговая концентрация нитратов, определяемая по органолептическим показателям, 400 мг/л [3]. Сомы переносят концентрации порядка 400 млн-1, для молоди чавычи ЛК50 =
5800 мг/л (96 ч), для золотых рыбок концентрация 3000 мг/л не токсична в течении 24 ч [3,4,5 ].
ПДК для питьевых водоемов – 45 мг/л, для рыбохозяйственных – 40 мг/л, класс опасности – 4э. В России принята норма потребления нитратов 312 в сутки (или 5 мг/кг веса человека), для грудных детей соответственно - 10 мг.
Сколько раз нас с телеэкранов и страниц газет пугали нитратами! Сколько было протоколов и штрафов на продавцов овощей и других пищевых продуктов. Официально выведены гигиенические нормы по допустимой концентрации нитратов в овощах (мг/кг): картофель – 250, капуста ранняя – 900, морковь ранняя – 400, томаты – 300, огурцы – 400, свекла столовая – 1400, листовые овощи (салат, петрушка, укроп) - 2000. арбузы – 60, виноград – 60, яблоки – 60. Содержание нитратов в мясе, рыбе в пределах 5 – 25 мг/кг, сыро копченных колбасах – 150 мг/кг, а в варенных – 60 мг/кг. Таким образом, создалась правовая нормативная база для работы ветеринарным и санитарным врачам.
Свои действия врачи оправдывали тем, что токсичен сам нитрат – ион; вторичную, связанную с образованием нитрит – иона, и третичную, образованием из нитрит и аминов нитрозаминов. [6] Только ленивый не писал о вреде нитратов. Но насколько эти выводы правильны? Приведем несколько публикаций из Интернета.
Вы, наверное, заметили, что самое большое количество нитратов находится в свекле. Так вот, на этом овоще сделали исследования ученые из Университета Эксетера (Великобритания), которые утверждают, что свекольный сок повышает выносливость.
«Свекольный сок не только повышает выносливость, но и понижает кровяное давление.
Причиной тому нитрат, содержащийся в корнеплоде, который сокращает поглощение кислорода человеческим организмом. Благодаря этому нитрату спортсмены, пьющие свекольный сок, меньше устают от физических нагрузок; таким образом, длительность занятий может быть увеличена на 16%. Наиболее заметный эффект от приема сока свеклы достигается при регулярных тренировках. Эти выводы были сделаны по результатам исследования восьми мужчин в возрасте от 19 до 38 лет, которые на протяжении шести дней выпивали по пол-литра (в два раза больше гигиенической нормы по нитратам !) свекольного сока. На седьмой день всем испытуемым было предложено пройти серию тестов, включая езду на велотренажере. Через некоторое время эксперимент повторили, но на сей раз вместо свекольного сока использовался напиток -плацебо из черной смородины. Спустя шесть дней мужчины прошли те же тесты, что и в первый раз.
Результаты показали, что после приема свекольного сока участники крутили педали велотренажера в среднем 11,25 минуты - на 92 секунды дольше, чем при употреблении плацебо. Кроме того, выяснилось, что сок свеклы понижал у подопытных кровяное давление, что тоже благотворно сказывалось на их физическом состоянии».
Самыми насыщенными по содержанию нитратов являются травы. Ученые из Китая и здесь их весьма высоко оценивают именно по этим свойствам.
«Древние китайские травяные формулы могут помочь работе сердечно-сосудистой системы и потенциально предотвращают сердечные болезни, утверждают врачи Университета Техаса и Университета Брауна. Согласно их исследованию, традиционная китайская травяная терапия способна устранить опасные тромбы и бляшки в артериях, понизить давление и способствовать притоку крови к сердцу. Китайские травы обладают глубокой биоактивностью прежде всего за счёт расширения оксида азота во внутренних стенках кровеносных сосудов и благодаря свойствам преобразовать нитриты и нитраты в оксид азота, поясняют учёные.
Биологи провели лабораторные испытания трав даншен, гуалу и других, чтобы оценить их способность производить оксид азота. На животных было также проверено действие трав на расширение кровеносных сосудов. Американские кардиологи обнаружили, что травы помогают нормальному функционированию сердечно-сосудистой системы и обладают полезными эффектами на сердце. Как полагают медики, такой альтернативный способ лечения может помочь людям с сердечными показаниями».
В работе, результаты которой были опубликованы в журнале American Journal of Clinical Nutrition, ученые рассматривали потенциальную связь опухолей мозга - глиом, с употреблением мяса и веществ, называемых нитрозаминами, сообщает сайт "Здоровье Украины".
«Эти способные вызвать рак вещества находятся в некоторых видах пищи или формируются организмом из потребляемых нами веществ, таких как нитраты и нитрит натрия. Их используют при переработке и ароматизации мясных продуктов - сосисок, ветчины, буженины. Именно поэтому продукты из переработанного мяса являются основным источником пищевых нитрозаминов.
В течение нескольких десятилетий ученые были уверены, что нитрозамины, которые из крови попадают в мозг, могут играть роль в образовании глиом - опухолей, составляющих 80% всех злокачественных раковых опухолей мозга у взрослых. В своем анализе ученые использовали данные трех масштабных продолжающихся исследований здоровья американских докторов и медсестер, которых в течение трех десятилетий периодически опрашивают об их образе жизни и питании.
В результате оказалось, что среди 238000 человек у 225 нашли раковую опухоль мозга. Связи между риском развития заболевания и употреблением мяса, колбас, нитритов, нитратов или нитрозаминов обнаружено не было. Более того, подобной связи не было среди тех, кто ел много мяса и получал мало таких антиоксидантов, как витамин Е и С, способных замедлить образование нитрозаминов в желудке».
В газете «Аргументы и факты в Украине» № 4, 2009г. опубликована статья Александра Мельникова «Кушай нитраты, нитраты жуй!»
«Лет 50 назадж потребление нитратов попытались ограничить, введя жесткие предельно – допустимые нормы. И причины тому были: химикам хорошо известно, что нитраты превращаются в нитриты, а из последних в кислой среде образуются нитроза мины – самые настоящие канцерогены. Поскольку желудочный сок кислый, ученые сразу предположили, что это жуткое вещество может образовываться из нитратов, съеденными с овощами и фруктами, и все это способствует развитию рака желудка.
«Ученые даже подтвердили, что подобные метаморфозы могут происходить и в живом организме, когда в эксперименте животным в желудок вводили чистые нитраты, нитриты и амины, необходимые для этих реакций, - говорит Давид ЗАРИДЗЕ, член-корреспондент РАМН, директор Научно-исследовательского института канцерогенеза Онкологического научного центра РАМН. - Получается, что овощи и фрукты действительно могут быть канцерогенными? Оказывается, нет. В реальности у человека эти реакции не происходят. Во фруктах и овощах присутствуют антиоксиданты, которые блокируют такие реакции. Сегодня эта проблема с точки зрения науки закрыта, а овощи и фрукты считаются очень полезными.»
Формально предельные нормы потребления нитратов сохраняются, но все чаще ученые говорят об их бессмысленности. Тем более что 25 - 50% нитратов наш организм производит сам, а остальное мы получаем с едой и водой. Кроме овощей и фруктов нитратов достаточно много в мясных продуктах, воде, пиве. Практически все колбасные и готовые мясные изделия содержат нитраты и нитриты (пищевые добавки Е249 – Е 252), которые придают им розовый мясной цвет и защищают от порчи. Уже во рту под действием бактерий нитраты превращаются в нитриты и со слюной попадают в желудок. А там, как оказывается, из них образуются не столько канцерогенные нитроза мины, сколько полезнейшая для нас окись азота. Она улучшает кровообращение в желудке, защищая от гастрита, язв и даже от агрессивного действия лекарств типа аспирина. Это совсем недавно доказано экспериментами шведских ученых из университета в Упсале».
Вывод статьи таков, что отказ от продуктов с нитратами может быть опасен для Вашего здоровья. Новые научные открытия, исследования, как видно по прессе, не вызывают интерес у законодателей, а жаль!
Нитраты являются биогенными элементами, т. е. их присутствие в водоемах усиливает рост водорослей. Ну, с водорослями, которые растут из почвы, дна могут справиться рыбы амур и толстолобик. А как быть с сине – зелеными водорослями, которые летом озера, водохранилища превращают в сплошной зеленый ковер?
Данные водоросли являются хорошим удобрением для полей. На основании этого посыла, мотивации были проведены научные изыскания. В УкрНИИ экологических проблем г. Харьков в 2007г. в рамках госбюджетной теме «Разработка рекомендаций к внедрению метода альголизации при очистки загрязненных вод от биогенных элементов» группой специалистов, с моим участием, под руководством к.б.н. Горбань Н.С. были предложены научные, технологические решения по сбору сине – зеленых водорослей и способах их очистки. Были предложено утилизацию сине – зеленых водорослей проводить как на стационарных очистных сооружениях, так и на плавучих сооружениях, установках. Так что и данная проблема решаемая и технологически, и экологически, и экономически...
3. Отказаться законодательно от хлорирования воды!
Вопрос о качестве воды в городском питьевом водопроводе остается технологически на прежнем низком уровне. В бессилии расписался харьковский профессор В. А. Петросов: « В условиях техногенных загрязнений водных ресурсов – источников водообеспечения населения, действующие составы сооружений водопроводов уже не способны поддерживать качество воды, необходимое для продолжительной жизни человека».
Для подготовки питьевой воды используют флокулянты – реагенты способные укрупнять примеси, т. е. уменьшать дисперсность примесей для более эффективной очистки воды на песчаном фильтре. При этом происходит ухудшение воды из – за алюминатов. Для обеззараживания используют повсеместно хлор (первичная и вторичная обработка питьевой воды). Однако при наличии в природной воде поллютантов после хлорирования неизбежно образование хлорорганических соединений (ХОС), время жизни которых исчисляются годами (СlCH2COOH), десятилетиями (СН2Сl2), и даже столетиями (CH3Cl, CCl4), которые могут являться причиной различных, в том числе и канцерогенных заболеваний у населения, употребляющих эту воду. При хлорировании в питьевой воде неизбежно образуются ХОС: хлороформ, четыреххлористый углерод и трихлорэтилен, 1,2 – дихлорэтан, тетрахлорэтилен. Основной вклад (78,4%) в суммарный канцерогенный риск вносят такие галоформные соединения, как хлороформ бромдихлорметан, дибромхлорметан. При применении такой воды, образуется производное хлора - диоксин, который, медленно накапливаясь в организме, как раз разрушает иммунную, эндокринную, репродуктивную и другие функции. Многие употребляют только кипяченую воду. Но оказывается, что при кипячении вредные свойства хлора лишь усиливаются, он переходит в тригалометан – канцерогенное вещество, которое, например, при приеме ванны всасывается внутрь обезжиренной с помощью мыла кожей. Получается, если не заболеешь от инфекций, то заболеешь от канцерогенов.
Я Вас не убедил, и хотите знать больше по этому поводу? Тогда еще приведу то, что пишет Стив Мейеровиц в своей книге «Вода – лучшее лекарство». Достаточно интересно, чтобы обойти его вниманием.
«С помощью хлора научились успешно контролировать вспышки холеры, тифа, гепатита, дизентерии и других передающихся с водой заболеваний. Сегодня хлорирование все еще считается единственным надежным методом уничтожения бактерий в водопроводной воде. По иронии судьбы, процесс, который когда-то освободил нашу воду от этих инфекционных организмов, сейчас обвиняется в том, что он стал причиной появления нового поколения опасных загрязнителей.
Хлор оказался первым в мире биологическим оружием, которое использовалось в качестве отравляющего газа в Первой мировой войне. Позднее его стали применять в мирных целях для уничтожения бактерий в воде. Даже небольшое количество хлора вызывает ощущение, что вы пьете воду из плавательного бассейна. Но если хлора может оказаться достаточно, чтобы придать воде отвратительный запах, то при попадании в организм он может уничтожить полезные бактерии в пищеварительном тракте.
Однако хлорирование может оказывать и более коварное воздействие. Хлор легко вступает в реакцию с органическими, содержащими углерод загрязняющими веществами промышленного и естественного происхождения, образуя опасные химические соединения нового класса, так называемые тригалометаны (ТНМ). Существуют сотни смертельно - опасных ТНМ, в том числе карбонтетрахлорид и хлороформ. По данным норвежского исследователя доктора Петера Магнуса из Национального института здравоохранения в Осло, ТНМ обладают мутагенными и канцерогенными свойствами. Доктор Магнус обнаружил, что использование хлора вызывает 14 - процентный рост общего числа врожденных дефектов. Калифорнийский департамент здравоохранения провел обследование 5144 беременных женщин, в ходе которого было установлено, что у женщин, которые пили 5 стаканов воды, зараженной ТНМ, процент выкидышей составил 16,4%, в то время как у тех, кто пил воду с более низким уровнем содержания ТНМ, выкидышей оказалось 6,1%.
Эти химические вещества, плюс большое семейство хлорсодержащих углеводородов, таких, как дихлордиаденилтрихлорэтан, 2,4,5-Т (трихлорфеноксиуксусная кислота), принято связывать с сердечными заболеваниями, слабоумием, раком мочевого пузыря, печени, поджелудочной железы, толстой кишки и мочевыводящих путей.
В дополнение к тому, что мы потребляем побочные продукты дезинфекции, не следует забывать, что вода, используемая для принятия ванн, душа, стирки и мытья посуды, тоже способствует загрязнению. При использовании воды в бытовых приборах (например, посудомоечные и стиральные машины) хлор высвобождается. Когда зараженная ТНМ вода используется в душе, токсичные пары очень быстро попадают в легкие... Сегодня всем известно, что хлор, который добавляется в воду, чтобы уничтожать бактерии, вступает в реакцию с другими веществами и создает массу химических соединений, вызывающих рак. Однако далеко не все знают, что это знаменитое бактерицидное средство не столь эффективно в борьбе с более крупными организмами, такими, как цисты, амебы, протозоа и др. Впервые это стало известно в конце 1970-х годов, когда Национальная академия наук США зарегистрировала 99 вспышек передаваемых через воду заболеваний, включая эпидемию лямблиоза, вызванного цистами, содержавшимися в хлорированной воде!»
Добавлю, что по докладу на ЭКВАТЭК - 2006 (стр. 952) сокращение ожидаемого продолжительности жизни из – за общетоксического риска хронического действия для мужчин составляет 12,5 лет, женщин – 18,8 лет.
Какие еще нужны аргументы, чтобы законодательно запретить хлорировать воду, как водопроводную, так и после очистных сооружений?
Законодатель скажет, а что можно предложить вместо хлора? На это есть тоже профессиональный ответ – перекись водорода. Для того, чтобы оценить это предложение сделаем технико – экономический анализ этого вещества.
В природе существуют несколько видов перекиси водорода Н2О2; Н2О3; Н2О4, наиболее распространенной является Н2О2
Перекись водорода Н2О2 – бесцветная прозрачная жидкость. Молекулярный вес Н2О2 - 34,01. Вкус жгучий, вяжущий. Смешивается с водой в любых соотношениях и ведет себя как слабая кислота. Плотность 1,46 г/см3. Температура кипения 151ºС. Водный раствор 31% и выше называется пергидролем. Это более устойчивый продукт для хранения, чем перекись. Благоприятные условия хранения – отсутствие солей тяжелых металлов (Cu, Mn, Pb и т.д.), кислая среда при рН – 3,5 – 4.5, отсутствия солнечного света и нагрева. В щелочной среде неустойчив и разлагается с выделением кислорода. ПДК в воздухе 1,4 мг/м3.
В зависимости от концентрации Н2О2 действует по - разному на различные виды микроорганизмов:
бактериостатически при 0,2 – 0,3%;
бактерицидно при 0,5 – 3%.
В тех же концентрациях оказывает дезодорирующий эффект.
В высоких концентрациях 30% и более обладает местнораздражающим действием и вызывает депигментацию кожи и слизистой оболочки.
Важно, что перекись водорода уже использовался для обезвреживания бытовых и сточных вод (стр. 402, Химическая энциклопедия, т 1, М., 1988г.).
Стоимость пергидроля в мелком опте чистотой класса чда - 21,6 грн/ кг (цена 2007г).
Формы выпуска и традиционное применение перекиси водорода
Перекись водорода называют также пергидролъю, гидроперитом, гиперолом, лаперолом. Японцы недавно изобрели эквивалент перекиси водорода, под названием флюзол, который они с успехом применяют при облучении раковых больных.
Перекись водорода - это бесцветная жидкость (в больших объемах или концентрации -чуть синеватая), без запаха. Это нестойкое соединение, хорошо растворимое в воде и разлагающееся даже при комнатной температуре на свету, в связи с чем хранить ее лучше в пузырьках из темного стекла.
Гидроперит выпускается в таблетках и содержит около 35% Н2О2. Перед употреблением таблетки растворяют в воде: 1 таблетка на 1 ст. ложку воды (15 мл), что соответствует 3%-ному раствору Н2О2. Причем использовать гидроперит можно только наружно, так как он недостаточно очищен.
Пергидроль - концентрированный раствор Н2О2, в котором она находится в количестве 27,5-35%. В аптечной сети, как правило, продается 3%-ная перекись, часто даже без обозначения концентрации.
Многие обеспокоены тем, что Н2О2 якобы грязная и содержит ряд вредных для организма веществ, в частности, свинец и цинк. В отличие от технической, поступающая в аптеки Н2О2 достаточно чистая, особенно приготовленная для акушеров. Конечно, наличие примесей того же свинца нежелательно, но в тех количествах перекиси водорода, которые рекомендуются для приема внутрь или внутривенно, этим можно пренебречь, учитывая тот лечебный эффект, который она вызывает, тем более что количество свинца, поступающего в организм из других источников, всегда превышает допустимые нормы. Цинк же является необходимым элементом, без которого не происходят многие биохимические и энергетические реакции.
Перекись водорода традиционно применяют в качестве антисептического, кровоостанавливающего средства, в качестве отбеливателя, для получения кислорода и в качестве окислителя в ракетной технике. Последнее обстоятельство указывает на то, что производственные мощности и запасы этого антисептика большие.
Литература.
1. Возная Н.Ф. Химия воды и микробиология. М.: «Высшая школа», 1979.- 341с.
2 Кульский Л.А., Гороновский И.Т., Когановский А.М., Шевченко М.А. Справочник по свойствам, методам анализа и очистки воды. Киев.: Наукова думка, 1980. - 680 с.
- Беспамятнов Г.П., Кротов Ю.А. Предельно – допустимые концентрации химических веществ в окружающей среде. Л. 1985,.
- Грушко Я.М. Вредные неорганические соединения в промышленных сточных водах. Л., 1979. 160 с.
- Метелей В.В. Водная токсикология. М., 1971. 248 с.
- Вредные химические вещества. Неорганические соединения V – VIII групп: Справ. узд. /А.Д. Банд ман и др..; Под ред.. В.А. Филова и др..-Л.:Химия, 1989. 592 с.