Ефанов михаил германович сегментарные резекции при очаговых образованиях печени
| Вид материала | Автореферат |
- Реферат: Вглавном военном клиническом госпитале проведено 43 операции трансуретральной, 62.24kb.
- Рак печени и органов билиопанкреатодуоденальной зоны: современная диагностика и лечение, 411.75kb.
- Способ лечения метастатических опухолей печени, 54.42kb.
- Лечение заболеваний печени, 65.93kb.
- При нарушении функций печени и желчного пузыря, 82.35kb.
- План лекции Актуальность патологии. Классификация абсцессов и кист печени. Основные, 76.95kb.
- План реферата: Цирроз печени 4 Этиология 4 Патогенез 4 Исторические классификации циррозов, 451.11kb.
- Лекций по дисциплине «Внутренние болезни» для студентов Vкурса лечебного факультета, 44.37kb.
- Заболевания печени и желчевыводящих путей при беременности, 128.83kb.
- Хирургическая тактика при травмах печени, 105.18kb.
Таблица 4
Распределение по нозологиям больных, перенесших различные по объему резекции печени, в зависимости от топографии очаговых образований
| Диагноз | Клинические группы | |||
| Основные | Контрольные | |||
| резекции центральных сегментов | мезогепат-эктомии | резекции латеральных сегментов | обширные резекции | |
| Метастазы КРР в печень | 22 | 7 | 36 | 54 |
| Доброкачественные опухоли и ФНГ | 14 | 3 | 117 | 25 |
| Эхинококкоз | 65 | 0 | 63 | 6 |
| Итого: | 101 | 10 | 216 | 85 |
Ближайшие и отдаленные результаты повторных резекций печени были изучены у 25 больных метастазами КРР в печень и 26 больных резидуальным эхинококкозом печени. Распределение больных по объему и кратности резекций при метастазах КРР в печень представлено в таблице 5.
Таблица 5
Вид, число и последовательность повторных сегментарных (СР) и обширных (ОР) резекций печени по поводу метастазов КРР
| Виды и последовательность операций на печени | Число больных | |||
| 1-я | 2-я | 3-я | 4-я | |
| СР | СР | - | | 13 |
| СР | ОР | - | | 5 |
| СР | СР | ОР | | 1 |
| СР | СР | ОР | СР | 1 |
| ОР | СР | - | | 5 |
| Всего: | 32 | 6 | 3 | 25 |
Сегментарные резекции печени преобладали как среди первичных, так и в качестве повторных резекций у неоднократно оперированных на печени больных. Из 7 первичных обширных резекций печени две выполнены в расширенном объеме. Из 54 включенных в настоящее исследование сегментарных резекций повторные резекции за анализируемый период выполнены 20 больным, что составило 37%. Среди повторно оперированных больных преобладали пациенты с местным распространением первичной опухоли и/или наличием отдаленных метастазов на момент резекции кишки (IV стадия TNM у 62% больных), местно распространенной опухолью печени (IV стадия по mTNM у 63% больных), множественными (68%) и билобарными (66%) метастазами в печень.
Спиральная компьютерная томография (СКТ) и ультразвуковое исследование с последующим совместным анализом полученных данных проводились в отделе лучевой диагностики (руководитель – проф. Г.Г. Кармазановский). Комплексное ультразвуковое исследование выполнялось на сканерах «ACUSON XP/210», а также «SONOLINE Sienna» и «SONOLINE Elegra» фирмы «Simens». Для изучения особенностей и вариантов нормальной сосудистой анатомии печени были анализированы данные СКТ у 200 пациентов с неизмененной анатомией печени, которым исследование выполнялось по поводу различных заболеваний органов брюшной полости и забрюшинного пространства. В группе 1 обследовано 100 больных на односпиральном компьютерном томографе Phillips Secura (Philips Medical Systems (Cleveland)), в группе 2, также включавшей 100 пациентов, исследование проведено на 64-срезовом компьютерном томографе Phillips Brilliance CT (Philips Medical Systems (Cleveland)). Анатомию магистральных сосудов печени (печеночных артерий, ветвей портальной вены, печеночных вен) у пациентов, обследованных на односпиральном томографе, изучали по аксиальным срезам, а у пациентов, обследованных на мультиспиральном томографе, сосудистая анатомия оценивалась как на аксиальных срезах, так и путем построения мультипланарной реконструкции (МПР) в режиме MIP при использовании толстых слэбов. Построение МПР во второй группе проводили с целью проверки информации, полученной на аксиальных срезах.
Определение биохимических показателей функционального резерва печени проводилось в клинико-биохимической лаборатории (руководитель – д.м.н. В.С.Демидова). Изучали динамику уровня аминотрансфераз, общего белка, альбумина, билирубина, псевдохолинэестеразы. Исследования выполнены на автоматическом биохимическом анализаторе «Spectrum EPx» фирмы «ABBOTT Lab” США.
Статистическая обработка материала проводилась с использованием пакета программ «Statistica 6». В статистическом анализе использованы методы описательной статистики, непараметрические критерии Крускала-Уоллиса, Манна-Уитни, χ2, корреляционный анализ, анализы повторных измерений ANOVA, анализ выживаемости по Каплану-Майеру, одно- и многофакторный регрессионный анализ Кокса. Статистически достоверными считали различия при р<0.05.
Результаты исследований
- Методика анатомических сегментарных резекций печени с атравматическим экстрапаренхиматозным выделением глиссоновых ножек и печеночных вен разработана в эксперименте и внедрена в Институте хирургии в клиническую практику в 2007 г. Особенностью данной методики является выделение глиссоновых элементов (долевых и секторальных) без предварительных разрезов паренхимы печени и без ее дигитоклазии, что позволяет выполнить доступ к основным структурам глиссоновых ворот печени практически бескровно с минимальным риском повреждения как собственно глиссоновых сосудисто-секреторных элементов, так и притоков печеночных вен. Помимо этого с целью контроля за кровотечением из притоков магистральных печеночных вен выполняется их атравматическая экстрапаренхиматозная изоляция в кавальных воротах с наложением турникетов.
1.1 Техника ключевых элементов данной методики анатомических сегментарных резекций печени – атравматическое экстрапаренхиматозное выделение глиссоновых ножек и печеночных вен в воротах печени, была отработана в эксперименте на нефиксированных трупах 25 взрослых людей. Экспериментальные исследования на трупном материале позволили установить, что технически экстрапаренхиматозное проведение инструмента (диссектора) вокруг правой долевой ножки, а затем глиссоновых ножек правых латерального и парамедианного секторов было возможно во всех случаях (рис. 1).
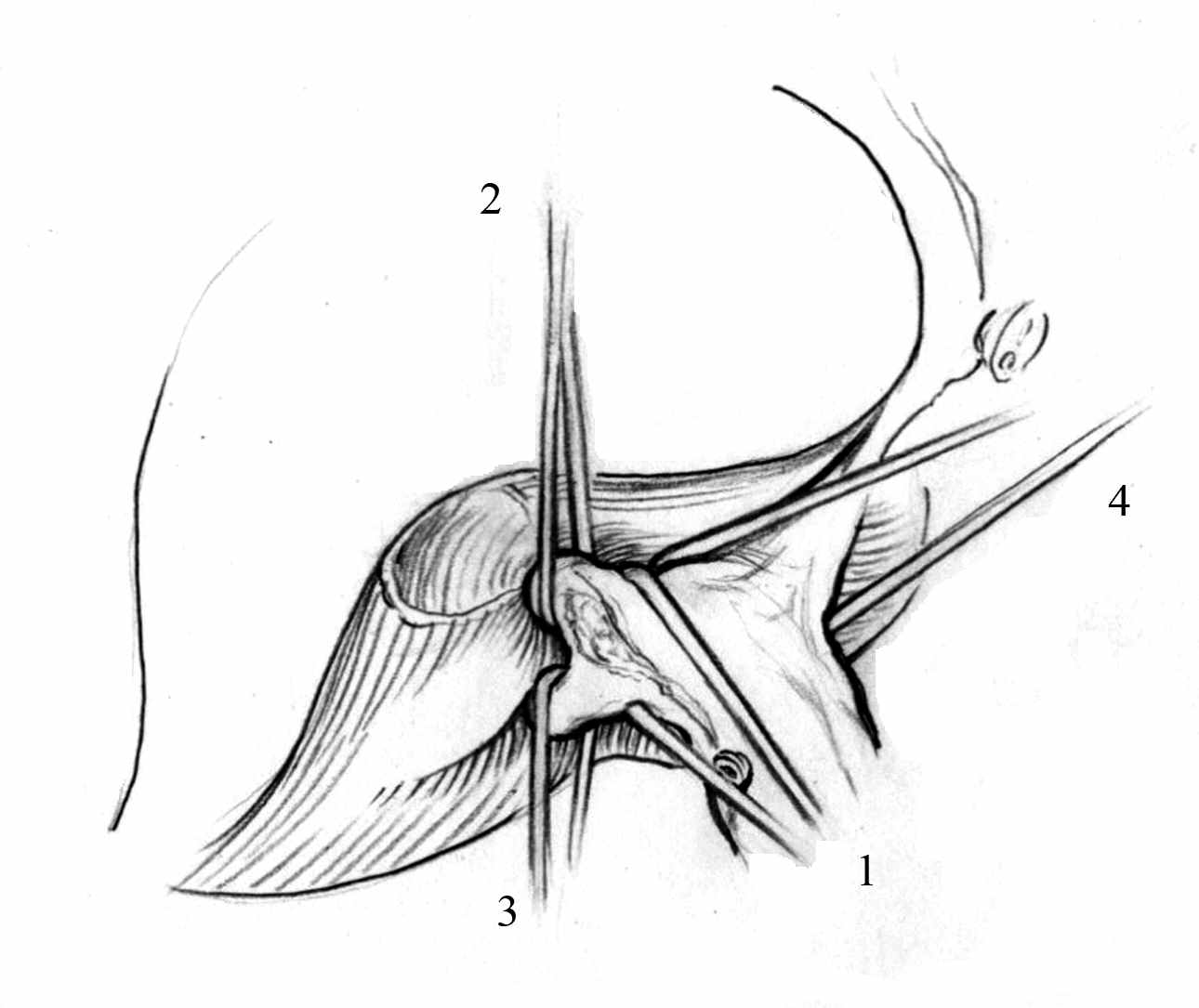
Рис. 1. Выделены и взяты на тесьму долевые правая (1) и левая (4), а также правые секторальные парамедианная (2) и латеральная (3) глиссоновы ножки (схема).
Манипуляции в большинстве случаев (n=16) выполняли в условиях жирового гепатоза, приведшего к ситуации так называемых «закрытых» ворот печени, когда гипертрофированная паренхима полностью закрывала секторальные ножки и существенно затрудняла визуализацию и доступ к долевой ножке.
Разрушая тупым путем сращение капсулы печени, брюшины гепатодуоденальной связки и воротной пластинки вдоль долевой ножки на протяжении 3-5 мм, попадали в слой между паренхимой печени и воротной пластинкой и далее отслаивали последние друг от друга. Данная манипуляция производилась практически бескровно без разрушения прилежащей к воротной пластике паренхимы печени во всех случаях (рис. 2).
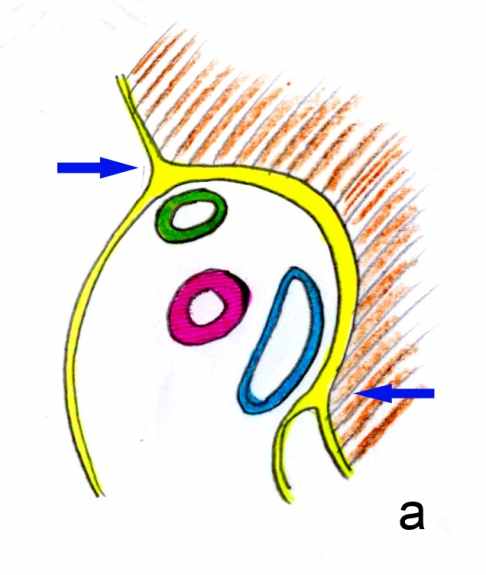

Рис. 2. Сагиттальный срез ворот печени (схема). Сращение капсулы печени, брюшины гепато-дуоденальной связки и воротной пластинки – а (обозначено тонкими стрелками) разделяется при выполнении обхода глиссоновой ножки (обозначен толстыми стрелками) – б.
Принципиальным условием методики было проведение инструмента вдоль воротной пластинки без попыток ее расслоения, которое может привести к травме желчных протоков. Обход диссектором секторальных глиссоновых ножек правой доли осуществляли сразу у места их отхождения от правой долевой ножки. Ни в одном случае не наблюдали и не травмировали сосудисто-секреторных элементов, которые отходили бы от правой долевой и секторальных ножек на этом уровне. В эксперименте было также установлено, что в абсолютном большинстве случаев возможно атравматическое экстрапарехиматозное выделение не только правой верхней, но и общего ствола левой и средней печеных вен, которые в области устья обычно отделены от ткани печени прослойкой рыхлой соединительной ткани (рис. 3). В ряде случаев было возможно раздельное экстрапаренхиматозное выделение левой и средней печеночных вен.
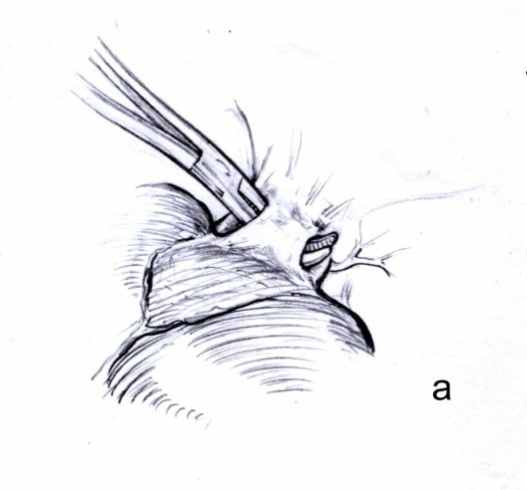
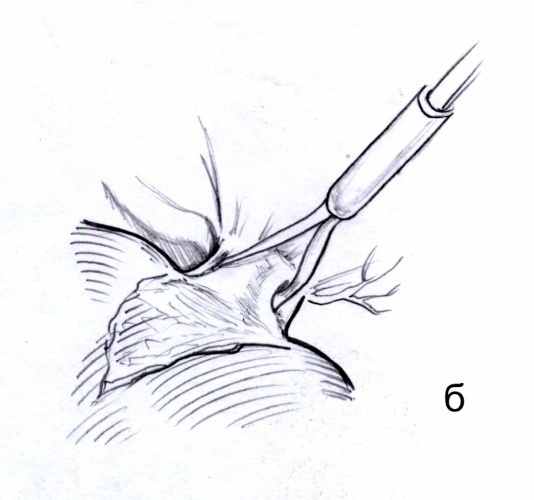
Рис. 3. Выделение (а) и взятие на турникет (б) общего ствола средней и левой печеночных вен (схема).
1.2. Топографо-анатомическое обоснование возможности и безопасности выделения долевых и правых секторальных глиссоновых ножек печени в ее воротах. При изучении гистологического строения комплексов гепатодуоденальной связки с прилежащей к воротам печени паренхимой установлено, что воротная пластинка представлена фасциальной плотной структурой, покрывающей сосудисто-секреторные элементы со стороны ворот печени и отделяющей их от паренхимы печени. Фиброзная пластинка, покрывающая долевые и секторальные ножки, на всех препаратах была образована плотной волокнистой соединительной тканью и имела толщину 856±100 мкм (от 502 до 1374 мкм), в то время как толщина брюшины гепатодуоденальной связки составила только 319 ± 25 мкм (от 245 до 393 мкм), а капсулы висцеральной поверхности печени вблизи ее глиссоновых ворот - 65 ± 4 мкм (от 50 до 75 мкм). Покрывая обращенную к печени полуокружность долевых ножек, в том числе конфлюенса печеночных протоков спереди и разветвления воротной вены сзади, воротная пластинка выходит к поверхности печени, образуя линейное сращение с капсулой печени и брюшиной гепатодуоденальной связки, окаймляющее весь периметр гепатодуоденальной связки и видимую снаружи поверхность долевых ножек. Толщина воротной пластинки, покрывающей обращенную к печени поверхность долевых глиссоновых ножек, составила 1135 ± 75 мкм, в то время как толщина глиссонова футляра секторальных ножек составила 578 ± 25 мкм. Несмотря на двукратное уменьшение толщины, структура глиссонова футляра при переходе с долевых на секторальные ножки не менялась, сохраняя строение плотной волокнистой соединительной ткани. На нативных препаратах и, в особенности фиксированных, паренхима печени легко отслаивалась от воротной пластинки. Однако при микроскопическом изучении препаратов паренхима на всех срезах тесно прилежала к воротной пластинке без каких-либо дополнительных промежуточных слоев.
1.3. Ближайшие результаты клинического применения методики. За период с сентября 2007 г. метод воротного доступа с атравматическим выделением глиссоновых ножек, а также атравматическим экстрапаренхиматозным выделением магистральных печеночных вен в воротах печени был использован при резекции печени у 52 больных. По описанной методике выполнено 33 сегментарных резекций печени и 19 обширных. Глиссоновы ножки были выделены у 49 из 52 больных (94%). Выделение и временное пережатие печеночных вен на этапе резекции печени применено у 21 из 52 больных (40%). Клиническое применение методики показало, что все описанные манипуляции атравматического выделения глиссоновых ножек и печеночных вен проводились бескровно, или же сопровождалась незначительным венозным кровотечением, которое быстро останавливалось самостоятельно без применения каких-либо специальных методов гемостаза. Методика позволяла выделить глиссоновы ножки даже у больных с крупными опухолями, расположенными вблизи ворот печени.
Ближайшие и отдаленные результаты были оценены у больных метастазами КРР в печень. Сравнение проводилось в двух группах больных. В основную группу вошли 22 пациента, у которых сегментарные резекции печени были выполнены воротным доступом с применением селективной сосудистой изоляции. В эту группу помимо 16 больных, оперированных атравматическим воротным доступом по новой методике за анализируемый период с 2007 г., были также включены 6 больных, оперированных в предыдущие годы с аналогичным выделением глиссоновых ножек в воротах печени. У этих пациентов данный прием был выполнен благодаря открытому типу ворот печени. В контрольной группе, куда были включены 50 пациентов, резекции выполнялись фиссуральным способом. Не было достоверных отличий сравниваемых групп по следующим параметрам: средний максимальный размер опухоли, число метастазов, би- или унилобарное поражение, поражение центральных сегментов, инвазия или тесный контакт опухоли с крупными сосудами, стадия метастатической опухоли по Gennari (II-III/IV), стадия первичной опухоли по TNM (II-III/IV), проведение химиотерапии, внепеченочное распространение опухоли, среднее число резецированных сегментов.
При сравнении ближайших результатов сегментарных резекций печени по поводу метастазов КРР в зависимости от вида доступа к воротным элементам печени не получено достоверных различий между группами по следующим параметрам: объем кровопотери, ширина отступа плоскости резекции от края опухоли, длительность операции, частота осложнений, длительность стационарного лечения, летальность. Достоверные отличия получены только по одному показателю – частота применения приема Прингла (р=0.008). В основной группе прием Прингла использовался редко (14% vs 65%). У больных основной группы существенно реже, хотя и не достоверно, имели место осложнения в послеоперационном периоде (27% vs 56%). К осложнениям мы относили биломы и другие жидкостные скопления в зоне резекции, желчеотделение по дренажам, нагноение раны, гидроторакс, требовавший пункционного лечения. Случаев острой печеночной недостаточности не отмечено в обеих группах. Летальных исходов в основной группе не было.
Более детально изучено влияние сосудистой изоляции на объем интраоперационной кровопотери. Исходя из разницы объемов кровопотери между основной и контрольными группами в зависимости от значений факторов, достоверно влиявших на кровопотерю, установлено, что методы селективной сосудистой изоляции позволяют существенно снижать потерю крови при крупных опухолях (≥ 80 мм), солитарных опухолях, унилобарном поражении, резекции латеральных сегментов.
Влияние центрального венозного давления (ЦВД) на объем кровопотери было оценено проспективно в группе больных, которым были выполнены сегментарные резекции с применением методов раздельной сосудистой изоляции печени. Мы не обнаружили корреляции между величиной ЦВД и объемом интраоперационной кровопотери, как у больных метастазами КРР в печень (р=0.539), так и у больных доброкачественными новообразованиями (р=0.819). Следовательно, по нашим данным ЦВД не оказывает решающего влияния на объем интраоперационной кровопотери при сегментарных резекциях печени.
Осложнения. В основной группе послеоперационные осложнения имели место у 6 больных (27%) и включали биломы и непродолжительное желчеистечение по дренажам, разрешившееся к моменту выписки больного из стационара. В контрольной группе частота осложнений составила 56%.
1.4. Отдаленные результаты анатомических сегментарных резекций по разработанной методике при злокачественных опухолях. С момента освоения методики сроки наблюдения за больными в основной группе составили от 2 до 24 мес. С учетом 6 больных, оперированных до 2007 г., продолжительность наблюдения увеличилась до 4 лет. В качестве контрольной группы мы использовали больных, оперированных в объеме сегментарной резекции печени фиссуральным способом (34 пациента, оперированные после 2002 г.). Отдаленные результаты в контрольной группе прослежены в сроки от 5 до 65 мес. (табл. 6).
Таблица 6
Выживаемость больных метастазами КРР в печень в зависимости
от способа сегментарной резекции
| Способ резекции | n | Выживаемость | ||
| 1-летняя (%) | 3-летняя (%) | 4-летняя (%) | ||
| Воротный | 22 | 88 | 65 | 65 |
| Фиссуральный | 34 | 77 | 56 | 45 |
Различия выживаемости более выражены в пользу больных, оперированных атравматическим воротным доступом, хотя достоверных отличий в силу малого числа наблюдений в основной группе не получено (р=0.523).
1.5. Обоснование целесообразности выполнения сегментарных резекций печени в анатомическом варианте при метастазах КРР в печень. Величина отступа плоскости резекции от края опухоли ≥1см достоверно влияла на выживаемость. Ретроспективно анализированы данные 95 из 102 больных с прослеженной выживаемостью. Получены кратные отличия выживаемости в группах (табл. 7).
Таблица 7
Пятилетняя выживаемость при метастазах КРР в печень в зависимости от величины отступа плоскости резекции от края опухоли и объема резекции
| Объем резекции | n | 5-летняя выживаемость в зависимости от величины отступа (%) | Р | |
| ≥1см | < 1 см | |||
| Сегментарные | 43 | 35 | 8 | 0.044 |
| Обширные | 52 | 42 | 12 | 0.009 |
| Всего | 95 | 38 | 15 | 0.0005 |
Мы также сравнили выживаемость после 61 сегментарной резекции при метастазах КРР в печень (56 больных, оперированных с 1995 по 2007 г., и 5 пациентов, оперированных по новой методике позже) в зависимости от варианта сегментарной резекции: анатомической (28 пациента) или сегменториентированной (33 пациента). Достоверных отличий в выживаемости не получено (р=0.124), но отдаленные результаты были лучше после анатомических резекций (табл. 8).
Таблица 8
Выживаемость больных метастазами колоректального рака в печень в зависимости от варианта сегментарной резекции печени:
анатомической или сегменториентированной
| Вариант сегментарной резекции | n | Выживаемость | |||
| 3-летняя (%) | 5-летняя (%) | 7-летняя (%) | Медиана (мес.) | ||
| Анатомическая | 28 | 57 | 35 | 35 | 46 |
| Сегменториентированная | 33 | 43 | 30 | 0 | 22 |
При изучении гистологических препаратов, окрашенных на СОХ-2, исследование ткани печени, окружающей метастатический очаг, не выявило микрометастазов на расстоянии 1-1.5 см от края основной опухоли. Несоответствие данных о влиянии на выживаемость ширины отступа и метода выполнения сегментарных резекций результатам изучения микрометастазирования объясняется высокой вероятностью выполнения резекции печени в объеме R1 за счет феномена отрыва более плотного метастаза от рыхлой паренхимы печени при тракции удаляемого фрагмента печени во время резекции. При этом на плоскости ткани печени, контактировавшей с опухолью, остаются опухолевые клетки. Вероятность этого события увеличивается с уменьшением ширины отступа плоскости резекции от края опухоли, а также при атипичной резекции печени, поскольку анатомические сегментарные резекции достоверно увеличивали частоту достижения широкого (≥1 см) отступа (табл. 9).
Таблица 9
Распределение больных по величине отступа плоскости резекции
от края опухоли*
| Ширина отступа | n | Вариант выполнения сегментарных резекций печени | Р | |
| Анатомический | Сегменториентированный | |||
| < 1 см | 30 | 8 | 22 | <0.05 |
| ≥ 1 см | 27 | 18 | 9 | |
| Всего | 57 | 26 | 31 | |
*-данные о ширине отступа известны у 57 из 61 больного, перенесшего сегментарные анатомические и сегменториентированые резекции
- Определение вариантов нормальной сосудистой анатомии печени при помощи спиральной компьютерной томографии. Анатомия афферентных сосудов печени. Варианты ветвления печеночных артерий классифицировали по Michels (1966). В нашей серии наблюдений мы встретились с тремя наиболее распространенными вариантами анатомии печеночных артерий - I, II, III типами по классификации Michels. В группе 2 проведена выборочная проверка полученной информации, включавшая сопоставление двухмерных и трехмерных реконструкций у 5 пациентов с I, II и III типами и у всех пациентов с другими типами. Отмечено полное совпадение выявленных типов. Частота выявленных типов в целом совпадала в обеих группах и в среднем составила: I тип - 78% от всех наблюдений; II тип – 12%, III тип – 6% наблюдений. По 1% составили наблюдения V, VI, IX типов по Michels, а также отхождение правой и левой печеночных артерий непосредственно от чревного ствола (неклассифицированный тип). Варианты строения воротной вены классифицировали согласно описанию, данному В.С. Шапкиным (1967). Наиболее распространенными вариантами ветвления воротной вены были: бифуркация - с формированием правой и левой долевых ветвей (рис. 4 а), трифуркация (рис. 4 б), а также общий ствол ветвей правого парамедианного сектора и левой доли, объединяющий два варианта - транспозицию ветви правого парамедианного сектора справа налево и проксимальное смещение ветви правого латерального сектора, которые мы не разделяли между собой, полагая, что они имеют одинаковое влияние на выбор хирургической тактики (рис. 4 в).
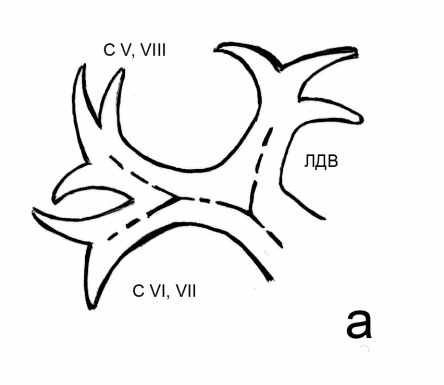
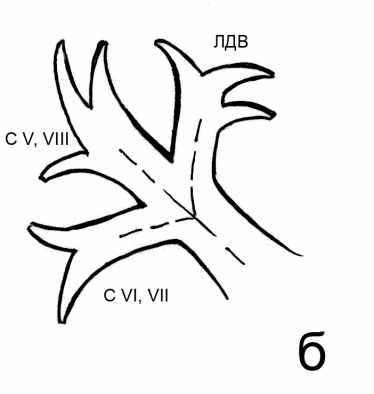
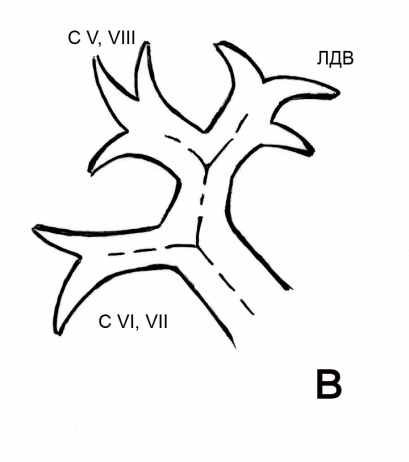
Рис. 4. Варианты ветвления воротной вены (схема): а – бифуркация, б – трифуркация, в – общий ствол ветвей правого парамедианного сектора и левой доли. С V,VIII и C VI,VII – правые секторальные ветви воротной вены. ЛДВ – левая долевая воротная вена. Пунктирными линиями обозначен ход магистральных ветвей воротной вены.
При сопоставлении данных трехмерной реконструкции изображения и аксиальных срезов, полученных на 64-детекторном томографе, мы не отметили различий в трактовке варианта ветвления воротной вены – данные полностью совпали. Надежность нашей интерпретации вариантов анатомии афферентных магистральных сосудов печени подтверждается сравнением выявленной нами частоты встречаемости основных вариантов ветвления печеночных артерий и воротной вены с данными других авторов (табл. 10, 11).
Таблица 10
Частота наиболее распространенных типов артериального кровоснабжения печени
согласно классификации Michels
| Авторы | n | Наиболее частые типы артериального кровоснабжения печени по Michels (%) | |||||||
| I | II | III | IV | V | VI | IX | Другие* | ||
| Сводные данные** | 4148 | 69,1±4,0 (55,5-83,5) | 8,7±1,5 (1,0-12,0) | 7,5±1,1 (4,0-11,0) | 2,1±0,5 (0-3,8) | 4,3±1,1 (1,0-8,9) | 2,3±1,0 (0,2-7) | 2,0±0,5 (1,0-4,5) | 7,6±3,7 (1,0-17,6) |
| Наши данные | 200 | 78 | 12 | 6 | - | 1 | 1 | 1 | 1 |
*- неклассифицированные Michels типы артериального кровоснабжения печени.
**- усредненные данные 6 авторов с 1966 по 2008 гг.
Таблица 11
Частота вариантов ветвления воротной вены
| Авторы | n | Частота наиболее распространенных вариантов ветвления воротной вены (%) | |||
| типичный | трифуркация | общий ствол ветвей SV,VIII и левой доли | Другие | ||
| Сводные данные* | 2938 | 79,7±2,9 (65,5-90) | 10,0±1,0 (6,0-14,0) | 7,4±2,5 (1,2-23,5) | 2,9±1,9 (0,3-12,6) |
| Наши данные | 200 | 81 | 6 | 12 | 1 |
*- усредненные данные 8 авторов с 1954 по 2008 гг.
Анатомия эфферентных сосудов печени. Строение терминального отдела левой и средней печеночных вен мы классифицировали, принимая во внимание наличие или отсутствие, а также длину общего ствола левой и средней печеночных вен (рис. 5). Выбор классифицирующих признаков был основан на влиянии вариантов впадения в нижнюю полую вену левой и средней печеных вен на возможность и безопасность их экстрапаренхиматозного выделения. Частота выявленных вариантов составила: общий ствол (длина последнего ≥1 см) – 42%; общее устье (длина общего ствола < 1 см) – 44%; раздельное впадение (граница между левой и средней печеночными венами совпадала с контуром нижней полой вены) – 14%.
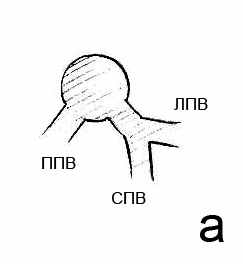
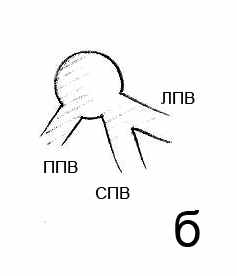
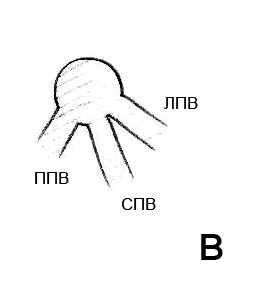
Рис. 5. Варианты впадения в нижнюю полую вену левой и средней печеночных вен: а – общий ствол; б – общее устье; в – раздельное впадение. ППВ – правая печеночная вена. СПВ – средняя печеночная вена. ЛПВ – левая печеночная вена.
Определение варианта анатомии терминальных отрезков средней и левой печеночных вен посредством изучения как аксиальных изображений, так и трехмерных было произведено выборочно во 2-ой группе у 5-10 пациентов в каждом из вариантов. Различий не выявлено.
- Сравнительная оценка радикальности и прогноз сегментарных и обширных резекций печени по поводу злокачественных опухолей. Для сравнительной оценки радикальности сегментарных и обширных резекций печени у больных злокачественными опухолями печени были прослежены отдаленные результаты (выживаемость) пациентов с метастазами КРР и первичным раком печени. При анализе отдаленных результатов решались следующие задачи: 1) определение выживаемости больных после резекций различных объемов по поводу различных злокачественных опухолей печени; 2) определение факторов, влияющих на выживаемость после резекции печени по поводу злокачественных опухолей помимо объема резекции печени; 3) сравнение однородности групп сегментарных и обширных резекций при метастазах КРР и первичном раке печени по факторам, достоверно влияющим на выживаемость; 4) сравнение радикальности сегментарных резекций по сравнению с обширными резекциями по поводу различных злокачественных опухолей; 5) разработка прогностических шкал выживаемости больных, перенесших резекции печени по поводу метастазов КРР и первичного рака печени.
Общая актуариальная выживаемость при первичном раке печени составила: 3-летняя – 50%, 5-летняя – 39%, 10-летняя – 25%. Медиана выживаемости - 36 мес. Из 53 больных первичным раком 44 пациента страдали гепатоцеллюлярным раком (83%). Поэтому их выживаемость не существенно отличалась от выживаемости в общей группе больных первичным раком. Отличия выживаемости между больными ГЦР и ХЦР не носили достоверного характера (р=0.503). В связи с этим, а также принимая во внимание небольшую долю больных ХЦР, мы рассматривали результаты лечения этих нозологий (ГЦР и ХЦР) в общей группе (табл. 12).
Таблица 12
Выживаемость больных первичным раком печени в зависимости
от нозологии (ГЦР и ХЦР)
| Нозология | | Выживаемость | ||
| 3-летняя (%) | 5-летняя (%) | 10-летняя (%) | Медиана (мес.) | |
| ГЦР | 60 | 42 | 28 | 41 |
| ХЦР | 23 | 23 | 0 | 22 |
Общая актуариальная выживаемость при метастазах КРР в печень при оценке с 1995 по 2007 гг. выглядела хуже по сравнению с ГЦР и составила: 3-летняя – 35%, 5-летняя – 23%, 10-летняя – 15%. Медиана выживаемости - 21 мес. Необходимо отметить, что совершенствование технологий резекции печени и применение современных цитостатиков (иринотекан, оксалиплатин) привели к существенному увеличению 5-летней выживаемости больных метастазами КРР, которая с 2003 г. возросла до 42%.
Первичный рак печени. Проведена оценка влияния различных факторов на выживаемость пациентов, перенесших резекции печени по поводу первичного рака печени. Вначале влияние факторов исследовано в общей группе больных, включавшей как обширные, так и сегментарные резекции. Изучено 19 прогностических факторов: возраст, пол, стадия метастатической опухоли (TNM), максимальный размер опухоли в печени, число очагов опухоли в печени, число пораженных сегментов, уни- или билобарный характер поражения, метастазы в регионарные лимфатические узлы, внепеченочное распространение опухоли, инвазия и компрессия опухолью крупных сосудов печени, объем резекции (сегментарные и обширные), объем интраоперационной кровопотери, трансфузия донорской эритроцитарной массы, применение аппарата возврата крови, применение приема Прингла и его длительность, отступ от края опухоли (<1 и ≥1 см), осложненное течение послеоперационного периода.
После сегментарных резекций отмечена недостоверно лучшая выживаемость (р=0.172) (табл. 13). Факторы, оказавшие достоверное влияние на выживаемость, приведены в таблице 14.
Таблица 13
Выживаемость больных первичным раком печени в зависимости от объема резекции
| Объем резекции печени | n | Выживаемость | |||
| 3-летняя (%) | 5-летняя (%) | 10-летняя (%) | Медиана (мес.) | ||
| Сегментарные | 16 | 72 | 53 | Не достигнута | 28 |
| Обширные | 35 | 47 | 37 | 22 | 26 |
