Координационные взаимодействия глюкозамина, хитозана и их гидрохлоридов с ионами d-металлов в водных растворах
| Вид материала | Автореферат |
- Эффект электроиндуцированного селективного дрейфа катионных аквакомплексов в водных, 268.96kb.
- Эффект электроиндуцированного селективного дрейфа катионных аквакомплексов в водных, 268.92kb.
- Электрохимические и физико-химические аспекты фиторемедиации сточных и промывных вод,, 396.8kb.
- Коррозия металлов, 40.27kb.
- Термодинамика образования молекулярных комплексов в водных растворах аминокислот, пептидов,, 609.89kb.
- Тема: Теоретические основы аналитической химии Расчёт pH в водных растворах, 410.88kb.
- Доцента кафедры Хиээ ланской, 49.44kb.
- План лекций по химии на 2011-2012 учебный год Стоматологический факультет (по нечетным, 11.03kb.
- Реферат по теме: «Металлы. Свойства металлов.», 196.2kb.
- Коррозия это разрушение металлов в результате его физико-химического взаимодействия, 375.69kb.
Д
Таблица 1
Результаты взаимодействия ГХГА с нитратом цинка в воде
ля системы ГХГА-нитрат цинка воспроизводимые аналитические данные получались как сразу после смешения реагентов, так и после выдерживания реакционных смесей в течение определенного времени (до 7 суток). Эти результаты свидетельствуют о том, что комплекс образуется быстро и состав его не изменяется во времени. Состав комплекса определяли по данным о равновесных концентрациях как отношение количества молей ГХГА, вступивших в реакцию с одним молем соединения металла. Принимая ГХГА за лиганд для состава комплекса (n) имеем n = [L]/[MX2]. Значения n, полученные при различных соотношениях реагентов в исходном состоянии ([L]o/[MX2]o) приведены в табл. 1. Как видно из этих данных состав комплекса не зависит от указанного соотношения и в пределах ошибки опыта равен двум. В табл. 1 приведены также данные о степенях связывания металла в комплекс (x), которые определяли как отношение чисел молей металла, вошедших в комплекс с ГХГА, к их начальным значениям. Как видно из представленных результатов степень связывания монотонно возрастает по мере увеличения соотношения [L]о/[MX2]о и при значении 4:1 она становится практически полной при концентрации нитрата цинка 0,02 моль/л.
По данным о равновесных концентрациях участников реакции нами вычислена константа комплексообразования KС, значения которой при разных соотношениях [L]о/[MX2]о приведены также в табл. 1. Для определения схемы комплексообразования важное значение имеет тот факт, что при смешивании растворов реагентов не наблюдалось снижения pH. Это исключает взаимодействие соединения металла с ГХГА по схеме с вытеснением хлористого водорода:
MX2+C6H11O5NH3Cl C6H11O5NH2∙MX2 + HCl.
Таким образом, значение n соответствует количеству молей ГХГА, вошедших в комплекс с группой -NH3Cl. На этом основании формальное стехиометрическое уравнение комплексообразования и выражение для концентрационной константы равновесия можно представить следующим образом:
2C6H11O5NH3Cl + MX2 (C6H11O5NH3Cl)2∙MX2 ,
 ,
,где выражения в квадратных скобках - равновесные концентрации комплекса ГХГА и соединения металла.
Предположения о возможных структурах комплекса ГХГА-нитрат цинка были сделаны на основании данных ИК спектров продукта, полученного в твердом состоянии в виде пленки. Следует отметить, что аспект структурной химии комплексов ГХГА и в целом хитозана в твердом состоянии имеет и самостоятельное значение.
В ИК спектре пленки реакционной смеси, полученной при соотношении реагентов 2:1, максимумы полос поглощения деформационных колебаний группы +NH3 (1575 см-1 и 1535 см-1) смещены в длинноволновую область соответственно на 10 и 15 см-1 относительно их положения в спектре ГХГА. Эти факты можно рассматривать как свидетельство, что атомы водорода группы +NH3 ГХГА образуют водородную связь либо с анионом комплекса, либо с аквалигандом при атоме металла. Недавно возможность такого типа водородных связей была установлена рентгеноструктурным методом на примере комплексного соединения – тетрахлорцинката диметиламмония1.
Сильные изменения в ИК спектре пленки наблюдаются также в области полос поглощения валентных колебаний связей C-O, тетрагидропирановой группы C-O-C и деформационных колебаний гидроксильных групп (интервал 1250-1035 см-1), которые смещаются в сторону низких частот относительно спектральных характеристик ГХГА. В ИК спектре пленки также четко проявляются полосы поглощения группы NO3.
Из полученных данных следует, что при взаимодействии нитрата цинка с ГХГА образуется комплекс состава [ZnL2(H2O)n]2+(NO3)2 , где L= C6H11O5NH3Cl, (H2O)n - число молекул воды в виде аквалигандов.
Р
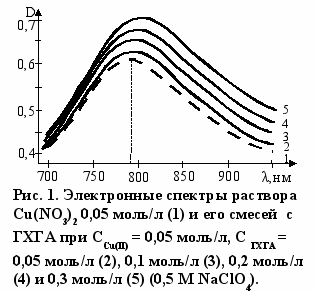 ассмотрим результаты взаимодействия ГХГА с нитратом меди. На рис. 1 приведены электронные спектры поглощения нитрата меди (II) и его смесей с ГХГА при постоянной концентрации соли и постоянной ионной силе. Как видно из приведенных спектров с ростом соотношения ГХГА/металл наблюдается увеличение интенсивности и смещение максимума полосы поглощения в длинноволновую область. Эти характерные особенности в изменении электронного спектра однозначно указывают на координационное взаимодействие иона меди (II) с ГХГА. Смещение полосы поглощения в длинноволновую область говорит о том, что по крайней мере один аквалиганд замещается молекулой ГХГА. Прежде, чем рассмотреть возможную структуру комплекса, отметим, что повышенной термодинамической устойчивостью обладают комплексные соединения, содержащие пяти- и шестичленные хелатные лиганды. Поэтому при прочих равных условиях доминирует координация лигандов с образованием именно такого рода структур. ______________________________________________________________
ассмотрим результаты взаимодействия ГХГА с нитратом меди. На рис. 1 приведены электронные спектры поглощения нитрата меди (II) и его смесей с ГХГА при постоянной концентрации соли и постоянной ионной силе. Как видно из приведенных спектров с ростом соотношения ГХГА/металл наблюдается увеличение интенсивности и смещение максимума полосы поглощения в длинноволновую область. Эти характерные особенности в изменении электронного спектра однозначно указывают на координационное взаимодействие иона меди (II) с ГХГА. Смещение полосы поглощения в длинноволновую область говорит о том, что по крайней мере один аквалиганд замещается молекулой ГХГА. Прежде, чем рассмотреть возможную структуру комплекса, отметим, что повышенной термодинамической устойчивостью обладают комплексные соединения, содержащие пяти- и шестичленные хелатные лиганды. Поэтому при прочих равных условиях доминирует координация лигандов с образованием именно такого рода структур. ______________________________________________________________1 Никитина Н. В., Шебелова И. Ю., Фукин Г. К., Бодриков И. В. Реакция системы дихлорид серы-ZnCl2 с гексаметилтриамидофосфатом. // Журнал органической химии. 2008. Т. 44. Вып. 3. С. 466 - 467.
В работах Ривса2 по исследованию комплексов аммиакатов меди (II) с глюкозой было установлено, что в растворе образуются хелаты с участием гидроксильных групп, находящихся в ee- или ea-конформациях.
П
 о аналогии со структурой аммиакатов Cu(II) с глюкозой можно считать, что комплекс ГХГА с Cu также имеет хелатное строение (структура 4). Следует отметить, что пятичленный хелатный цикл, когда лиганды находятся в ee- и ea-конформациях, является сильно напряженным. В обычных комплексах атом металла и два лиганда, связанные с ним, лежат в одной плоскости. Двухгранный угол между заместителями, находящимися в ee- или ea-положениях при кресловидной конформации циклогексанового цикла, составляет 60о. В этом случае плоская структура хелатного цикла невозможна, и возникающая напряженность компенсируется искажением кресловидной конформации шестичленного цикла глюкозы, в данном случае глюкозамина, ведущей к уменьшению значения двухгранного угла, а также изменением структуры координационного соединения. Исходя из сказанного, образование такого рода хелатов следует ожидать, если соединения металла обладают высокой
о аналогии со структурой аммиакатов Cu(II) с глюкозой можно считать, что комплекс ГХГА с Cu также имеет хелатное строение (структура 4). Следует отметить, что пятичленный хелатный цикл, когда лиганды находятся в ee- и ea-конформациях, является сильно напряженным. В обычных комплексах атом металла и два лиганда, связанные с ним, лежат в одной плоскости. Двухгранный угол между заместителями, находящимися в ee- или ea-положениях при кресловидной конформации циклогексанового цикла, составляет 60о. В этом случае плоская структура хелатного цикла невозможна, и возникающая напряженность компенсируется искажением кресловидной конформации шестичленного цикла глюкозы, в данном случае глюкозамина, ведущей к уменьшению значения двухгранного угла, а также изменением структуры координационного соединения. Исходя из сказанного, образование такого рода хелатов следует ожидать, если соединения металла обладают высокой склонностью к изменению их структуры. Видимо, такая особенность характерна для комплексов Cu(II).
Как отмечается в монографии3 координационные соединения Cu(II) легко изменяют строение в зависимости от природы лиганда и противоионов. Основываясь на этом, можно предположить, что комплекс (4) имеет структуру искаженного тетраэдра, поскольку в этом случае может существенно уменьшаться деформация лиганда.
__________________________________________________________________
2 В кн. Терентьев А. П., Потапов В. М. Основы стереохимии - М.: Химия, 1964. - 688 с. и ссылки, цитируемые там.
3 Ливер Э. Электронная спектроскопия неорганических соединений - М.: Мир, 1987, часть 1. - 491 с., часть 2. - 441 с.
Д
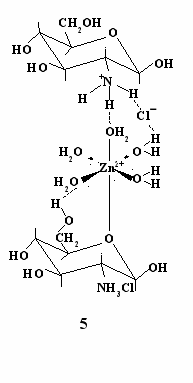 ля ионов переходных металлов с конфигурацией d10, которую имеет и Zn2+, энергия стабилизации кристаллическим полем равна нулю. Поэтому образование хелата с напряженным циклом для таких ионов маловероятно. Но Zn2+ является достаточно жесткой кислотой и должен хорошо координироваться с жесткими основаниями, содержащими атом кислорода, такими как спирты и простые эфиры. Поэтому можно полагать, что одна из координационных связей в комплексе образуется в результате взаимодействия иона металла с тетрагидропирановым атомом кислорода, поскольку его донорная способность выше кислородных атомов гидроксильных групп. Кроме того, он стерически более доступен. Координация второго лиганда, как это следует их ИК спектров, осуществляется, видимо, за счет водородных связей между атомами водорода гидрохлоридного иона и аквалигандами цинка (структура 5).
ля ионов переходных металлов с конфигурацией d10, которую имеет и Zn2+, энергия стабилизации кристаллическим полем равна нулю. Поэтому образование хелата с напряженным циклом для таких ионов маловероятно. Но Zn2+ является достаточно жесткой кислотой и должен хорошо координироваться с жесткими основаниями, содержащими атом кислорода, такими как спирты и простые эфиры. Поэтому можно полагать, что одна из координационных связей в комплексе образуется в результате взаимодействия иона металла с тетрагидропирановым атомом кислорода, поскольку его донорная способность выше кислородных атомов гидроксильных групп. Кроме того, он стерически более доступен. Координация второго лиганда, как это следует их ИК спектров, осуществляется, видимо, за счет водородных связей между атомами водорода гидрохлоридного иона и аквалигандами цинка (структура 5).В заключение можно отметить, что каковы бы ни были причины отсутствия координации ГХГА с Co(II), Ni(II) и Cd(II), полученные данные показывают, что это соединение как лиганд обладает невысокими координационными свойствами.
Взаимодействие гидрохлорида хитозана с солями кобальта, никеля, меди, цинка и кадмия в воде. В отличие от ГХГА гидрохлорид хитозана взаимодействует со всеми использованными в работе ионами металлов. Значение рН, как и в реакции с ГХГА, в процессе взаимодействия не изменяется, что свидетельствует о том, что образующиеся комплексы содержат ион +NH3. Характеристики комплексообразования рассчитывали на мономерное звено ГХХТ (C6H9O4NH3Cl), которое принимали за лиганд.
Из табл. 2, 3 видно, что значения степени связывания ионов металлов увеличиваются с повышением соотношения [L]о/[M(II)]о и не слишком различаются для разных солей при равных условиях реакции. В целом они меньше всего в реакции с CoCl2, и больше для ионов кадмия и меди.
Для реакции с Cu(II) только при соотношениях [L]о/[Cu(II)]о от 1:4 до 1,4:1 анализ методом титрования позволяет определять в реакционной смеси остаточные количества ионов меди (табл. 3). При более высоких значениях соотношения лиганд/Cu(II) компоненты реакционной смеси кондуктометрическим титрованием раздельно не определяются. Это говорит о том, что соль металла практически полностью связывается ГХХТ.
Таблица 2
Результаты взаимодействия ГХХТ с солями кобальта и никеля в воде
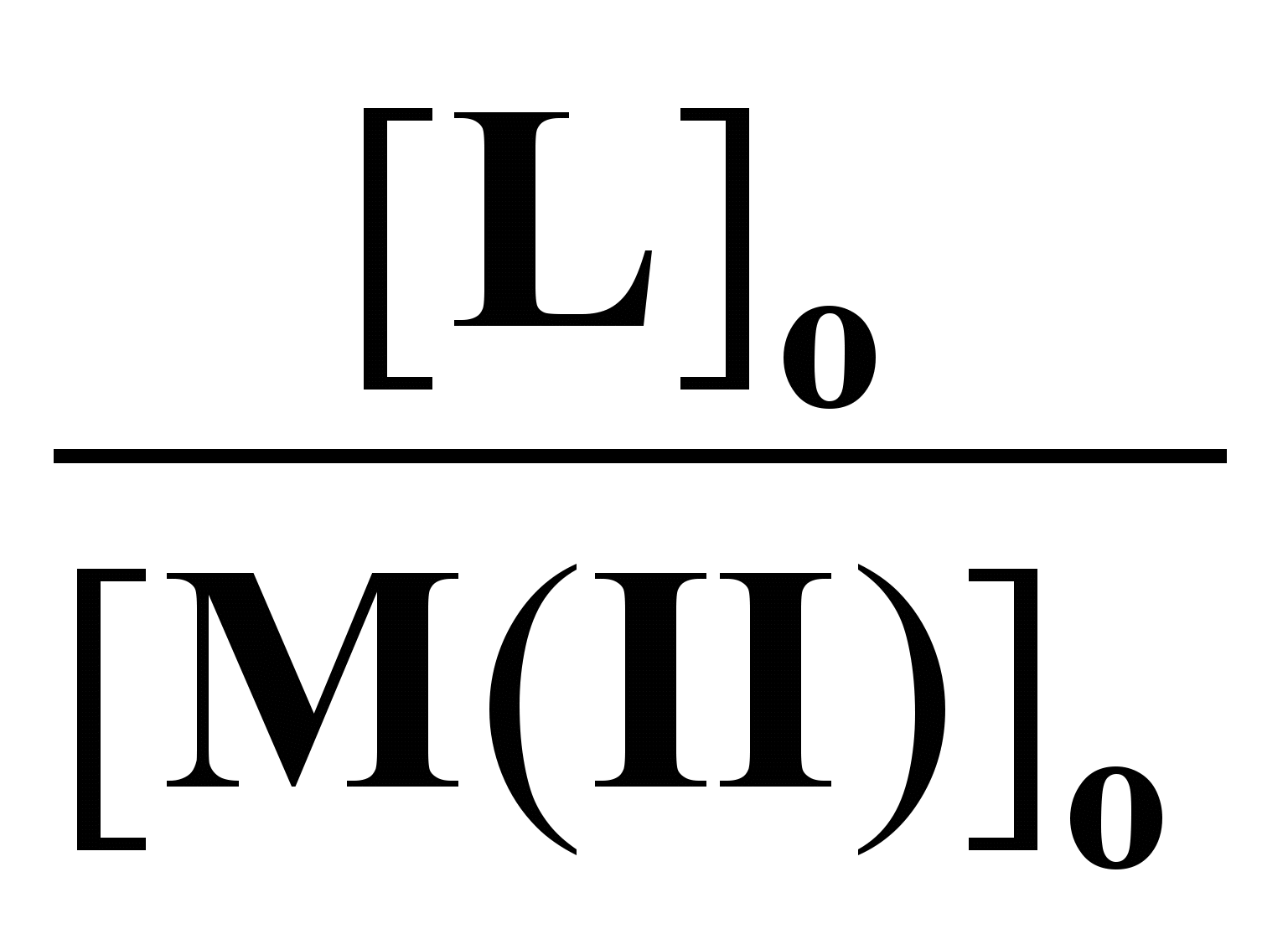 | реакция с Co(NO3)2 | реакция с CoCl2 | реакция с Ni(NO3)2 | реакция с NiCl2 | |||||||
| n | lg KC | n | x | lg KC | n | x | lg KC | n | x | lg KC | |
| 4:1 | 1,5 | 2,15 | 1,0 | 0,48 | 1,01 | 2,0 | 0,87 | 2,90 | 2,0 | 0,81 | 2,87 |
| 3,5:1 | 1,6 | 2,14 | 1,0 | 0,44 | 1,06 | 2,0 | 0,73 | 2,83 | | | |
| 3:1 | 1,6 | 1,91 | 1,1 | 0,39 | 0,95 | 2,0 | 0,63 | 2,86 | 2,1 | 0,60 | 2,79 |
| 2,5:1 | 1,5 | 1,89 | 1,0 | 0,36 | 0,92 | 2,1 | 0,53 | 2,67 | | | |
| 2:1 | 1,5 | 1,94 | 1,1 | 0,29 | 0,77 | 2,1 | 0,45 | 2,60 | 1,9 | 0,49 | 2,73 |
| 1,7:1 | 1,5 | 1,81 | | | | 2,0 | 0,46 | 2,80 | | | |
| 1,4:1 | 1,5 | 2,10 | 1,0 | 0,34 | 1,00 | 2,0 | 0,37 | 2,84 | 2,0 | 0,37 | 2,76 |
| 1,2:1 | 1,5 | 2,05 | 1,0 | 0,25 | 0,84 | 2,0 | 0,35 | 2,87 | 2,0 | 0,32 | 2,91 |
| 1:1 | 1,5 | 1,97 | 1,0 | 0,22 | 0,84 | 2,0 | 0,26 | 2,78 | 2,0 | 0,25 | 2,72 |
| 1:1,2 | 1,5 | 2,13 | 0,9 | 0,25 | 1,07 | 2,0 | 0,22 | 2,74 | 2,0 | 0,22 | 2,80 |
| 1:1,4 | 1,5 | 1,90 | 1,0 | 0,28 | 1,05 | 2,0 | 0,19 | 2,77 | 2,0 | 0,20 | 2,90 |
| 1:2 | 1,4 | 2,11 | 1,0 | 0,22 | 0,95 | 2,0 | 0,15 | 2,71 | 2,0 | 0,17 | 2,78 |
| 1:4 | 1,5 | - | 0,9 | 0,28 | - | 2,0 | 0,12 | - | 2,0 | 0,14 | - |
| | nср = 1,5±0,1 | lg KC, ср = 2,01±0,20 | nср = 1,0±0,1 | | lg KC, ср = 0,95±0,15 | nср = 2,0±0,1 | | lg KC, ср = 2,78±0,15 | nср = 2,0±0,1 | | lg KC, ср = 2,81±0,10 |
Степень связывания достаточно высока и для других металлов. Так при соотношении лиганд-металл 4:1 один грамм мономерного звена ГХХТ связывает от 0,13 до 0,29 г металла. Для сравнения можно отметить, что твердый хитозан связывает от 0,14 до 0,31 г металла на 1 г хитозана.
По равновесным концентрациям комплекса, мономерного звена и металла вычисляли константы комплексообразования (табл. 2, 3).
Таблица 3
Результаты взаимодействия ГХХТ с солями меди, цинка и кадмия в воде
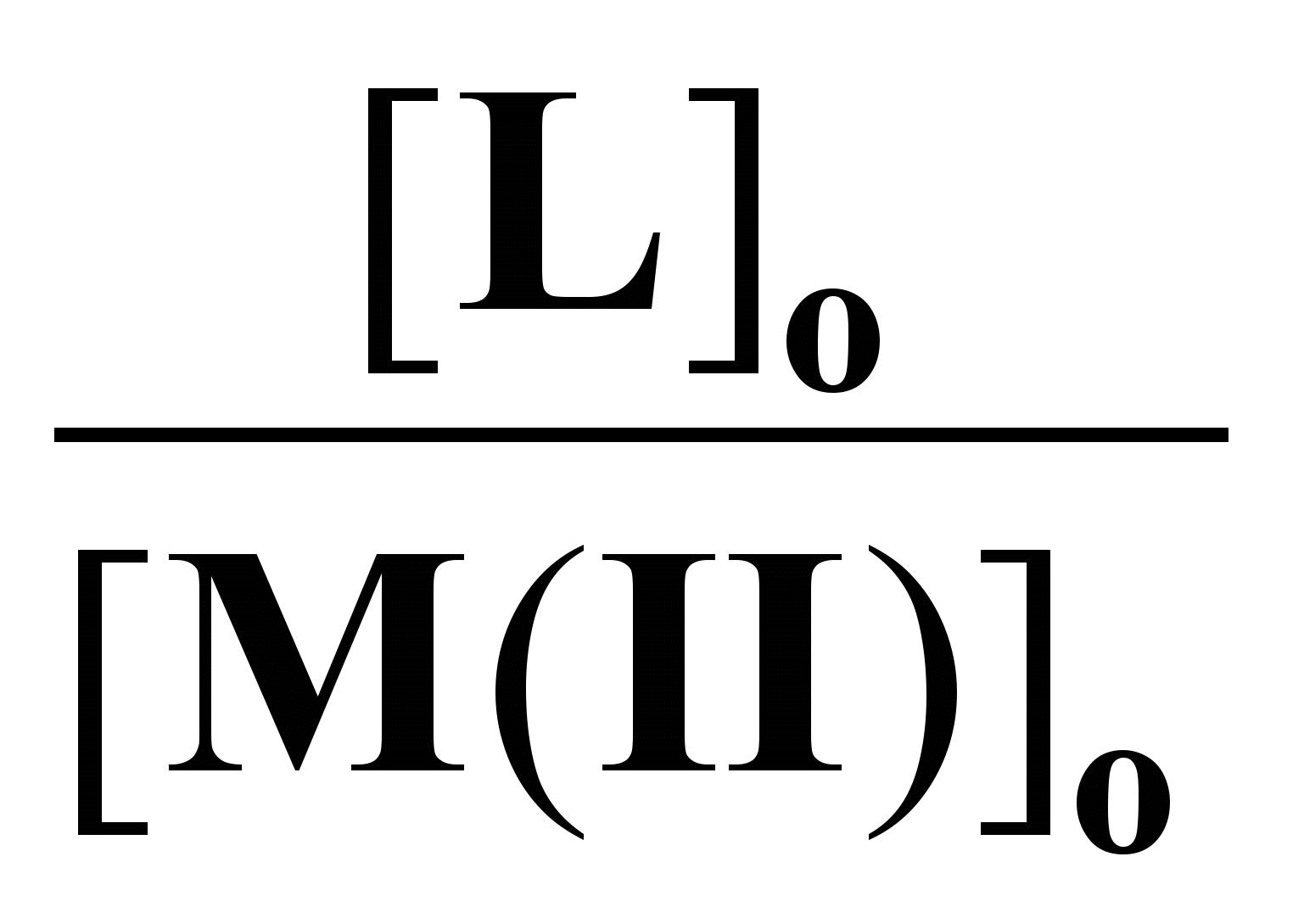 | реакция с Zn(NO3)2 | реакция с Cd(NO3)2 | реакция с Cu(NO3)2 | |||||
| n | x | lg KC | n | x | lg KC | n | x | |
| 4:1 | 2,1 | 0,68 | 2,96 | 2,0 | 1,00 | - | | |
| 3,5:1 | 2,0 | 0,67 | 2,89 | 2,1 | 0,87 | 3,72 | | |
| 3:1 | 2,0 | 0,64 | 2,94 | 2,0 | 0,82 | 3,66 | | |
| 2,5:1 | 1,9 | 0,59 | 2,97 | 2,1 | 0,76 | 3,69 | | |
| 2:1 | 2,0 | 0,45 | 2,68 | 2,0 | 0,66 | 3,57 | | |
| 1,7:1 | 1,9 | 0,41 | 2,66 | 2,1 | 0,49 | 3,52 | | |
| 1,4:1 | 2,0 | 0,42 | 2,94 | 1,9 | 0,53 | 3,49 | 2,0 | 0,73 |
| 1,2:1 | 2,0 | 0,33 | 2,80 | 2,0 | 0,47 | 3,60 | 2,0 | 0,56 |
| 1:1 | 2,0 | 0,26 | 2,69 | 2,0 | 0,35 | 3,40 | 2,1 | 0,45 |
| 1:1,2 | 2,0 | 0,19 | 2,71 | 2,0 | 0,30 | 3,35 | 2,0 | 0,40 |
| 1:1,4 | 2,1 | 0,16 | 2,68 | 1,9 | 0,27 | 3,65 | 1,9 | 0,35 |
| 1:2 | 2,0 | 0,11 | 2,67 | 2,0 | 0,17 | 3,57 | 2,0 | 0,26 |
| 1:4 | 2,0 | 0,10 | 2,87 | 2,0 | 0,14 | - | 2,0 | 0,14 |
| | nср = 2,0±0,1 | | lg KC, ср = 2,80±0,15 | nср = 2,0±0,1 | | lg KC, ср = 3,57±0,20 | nср = 2,0±0,1 | |
