Автофоретическое формирование полимерных покрытий на поверхности алюминиевых и медных сплавов
| Вид материала | Автореферат диссертации |
Содержание3.1.Адсорбционные процессы на алюминии и его сплавах в растворах олигомера КЧ-0125 3.2.Коррозионное поведение алюминия и его сплавов в растворекарбоксилсодержащего олигомера |
- Тема: сварка алюминия и его сплавов, 56.75kb.
- Флюсы и рециклинг алюминия, 130.43kb.
- Новые технологии и оборудование для формирования покрытий из полимерных экструдатов, 25.72kb.
- Протасов В. Н. Ргу нефти и газа им., 101.76kb.
- Реферат по научно-исследовательской работе г 08 Нано- и микроструктурная модификация, 64.1kb.
- Влияние импульсного электронного облучения на формирование ультрамелкозернистой структуры, 35.51kb.
- Развивающаяся область модификации поверхности это нанокомпозиты на основе сверхтонких, 41.9kb.
- Физические свойства вакуумно-плазменных покрытий для режущего инструмента, 338.06kb.
- Онно-твердеющих сплавов в основе своей связано с разработкой и исследованием высокопрочных, 98.83kb.
- Технологические и металлургические особенности лазерной сварки современных авиационных, 212.71kb.
3.1.Адсорбционные процессы на алюминии и его сплавах
в растворах олигомера КЧ-0125
Одним из важнейших свойств мицеллярных систем является специфическая адсорбция на поверхности металлов. Нами исследованы изотермы адсорбции на образцах из алюминиевого сплава в зависимости от концентрации олигомера и рН раствора композиции (рис.2).
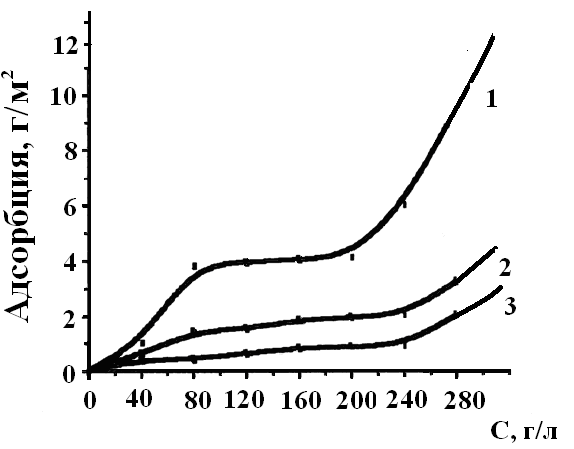 | Изотерма адсорбции олигомера КЧ-0125 в изучаемой области концентраций имеет сложный характер. С увеличением концентрации адсорбция увеличивается, а изотерму адсорбции можно разбить на 3 участка. Первый участок изотермы описывается уравнением Ленгмюра и характеризуется сильным химическим взаимодействием молекул олигомера между собой и поверхностью алюминия. |
| Рис.2. Изотерма адсорбции олигомера КЧ-0125 при различных значениях рН композиции: 1 – рН = 7,3; 2 – рН = 8,0; 3 – рН = 9,0 |
На втором участке изотерм выполняются одновременно уравнения Ленгмюра и Темкина. При концентрации (80 – 180) г/л из раствора адсорбируются устойчивые мицеллы. На третьем участке мицеллы могут взаимодействовать друг с другом и с поверхностью металла.
Таким образом, адсорбция протекает через образование монослоя единичными полиионами, на который затем «налипают» мицеллы под действием вторичных сил адсорбции (кривые 1, 2). При рН = 9 также формируется второй адсорбционный слой, но он состоит главным образом из молекул (следовательно, образование второго адсорбционного слоя связано со значительной деформацией мицелл вплоть до их полного разрушения, и на адсорбцию оказывает влияние неоднородность поверхности).
По изотермам адсорбции рассчитали эффективные площадки, занимаемые одной молекулой и толщины адсорбционных слоев (табл.2).
Из таблицы 2 следует, что толщина 2 адсорбированного слоя в значительной степени зависит от рН среды. Увеличение рН приводит к снижению количества адсорбированного пленкообразователя и толщины адсорбционного слоя.
Таблица 2
Характеристики адсорбционных слоев
| рН | Толщина 1 адсорбционного слоя, δ1 ·1010 м | Эффективная площадка, занимаемая одной молекулой Sэф · 1018 м2 | Толщина 2 адсорбционного слоя, δ2 ·1010 м | Число молекул на 1 м2 поверхности, n · 10-16 |
| 7,3 | 4,2 | 6,2 | 17,2 | 19,5 |
| 8,0 | 2,7 | 7,1 | 7,0 | 16,4 |
| 9,0 | 2,1 | 2,0 | 2,0 | 12,2 |
При изменении рН среды Ок (рис.3) от рН = 7 до рН = 8,5 происходит резкое, а выше – незначительное уменьшение количества адсорбата. Резкое снижение адсорбции на первом участке связано с увеличением количества адсорбировавшихся частиц. На втором участке достигнут предел разворачивания мицелл, а снижение адсорбции обусловлено внедрением в адсорбционный слой противоионов нейтрализатора.
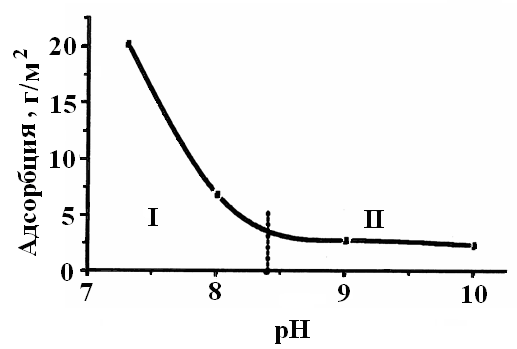 |
| Рис.3. Зависимость адсорбции олигомера КЧ-0125 от рН среды |
Таким образом, установлено, что между структурой водного раствора олигомера и формированием полимерного покрытия имеет место взаимосвязь, оценить которую можно путём исследований коррозионного поведения алюминия в фоновых и мицеллярных растворах олигомера КЧ-0125
3.2.Коррозионное поведение алюминия и его сплавов в растворе
карбоксилсодержащего олигомера
Особенностью осаждения Оп на алюминий и его сплавы является то, что в зависимости от природы полимерного материала, рН среды, температуры, вводимых добавок и других факторов формируются определенные свойства подложки.
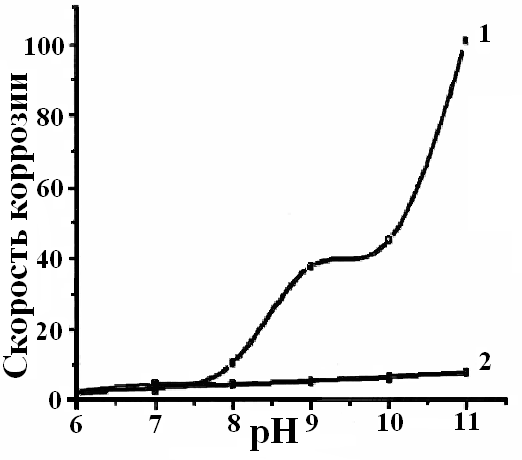
Установлено, что введение гидроокиси аммония в фоновый электролит способствует растворению оксидной пленки и активированию поверхности электрода. Скорость коррозии алюминиевой основы незначительна при рН=6–8. С увеличением рН наблюдается резкий рост скорости коррозии, и поверхность алюминия активируется. Смещение электродного потенциала в область отрицательных значений свидетельствует об облегчении анодного процесса коррозии металла, и контролирующим фактором является катодный процесс (рис.4).
 а) | 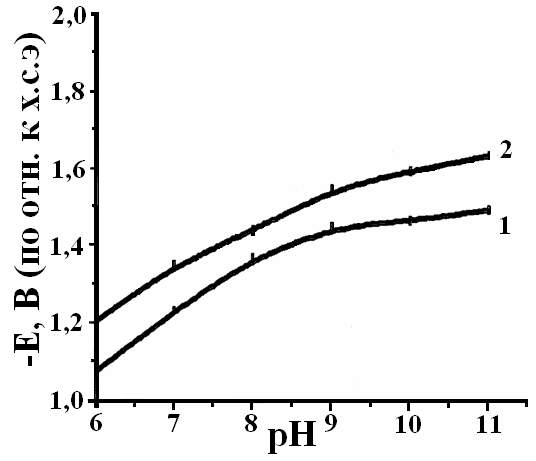 б) |
| Рис.4. Зависимость скорости коррозии (j∙105, а/см2) – а) и потенциала алюминия – б) от рН растворов: 1 – фоновый раствор (H2C2O4 ∙ 2H2O = 0,32 моль/л); 2 – раствор олигомера КЧ-0125 (16% раствор) | |
Поведение алюминия в водных полимерных растворах мало чем отличается от фоновых растворов (рис.4а). Однако ввиду различной природы растворов, в Ок на поверхности алюминия формируется не только оксидная, но и тонкая Оп, наличие которой подтверждается данными капельного метода.
Из-за формирования олигомерного осадка поверхность металла менее подвержена воздействию коррозионной среды, чем в случае с фоновыми растворами, вызывая незначительное снижение скорости коррозии алюминия. Рост скорости коррозии с увеличением рН согласуется со смещением стационарного электродного потенциала в область отрицательных значений (рис.4б). Высокое значение электродного потенциала в растворе олигомера КЧ-0125 объясняется адсорбцией полярных молекул олигомера на металлической поверхности. Таким образом, можно говорить о незначительном облегчении анодного процесса коррозии с ростом рН.
Согласно диаграмме Пурбе, при рН = 7 алюминий находится в области, соответствующей термодинамически устойчивому состоянию алюминия в виде гидроокиси Al(OH)3. Следовательно, в диапазоне рН = 6 – 8 на анодных (А) и катодных (К) участках поверхности металла протекают следующие процессы: (А) 2Al + 3H2O = Al2O3 + 6H+ + 6ē (3)
(К) 2H2O + 2ē = H2↑ + 2OH– (4)
Эти процессы сопровождаются генерацией протонов за счет окисления поверхности алюминия. При более высоких значениях рН = 10 – 11 процесс коррозии протекает с большей скоростью, и выделяющийся водород снимает гелеобразную пленку с поверхности алюминия.
Таким образом, адсорбционно-коррозионные испытания показали, что процесс образования Оп на поверхности алюминиевых сплавов можно разделить на три взаимосвязанные параллельно протекающие процесса:
– первый процесс начинается с миграции отрицательно заряженных мицелл к металлической поверхности, их ориентации полярными группами по отношению к полярным группам оксида металла. Устанавливается адсорбционное равновесие, и начинают действовать молекулярные силы с последующим образованием фазового полимолекулярного слоя;
– второй процесс – образование оксидной пленки на поверхности металла, сопровождающееся генерацией протонов;
– третий процесс – взаимодействие адсорбированных полиионов с протонами с образованием Оп в виде «кислой» формы, которое не снимается при дальнейших промывках: RCOO- + H+ → RCOOH↓ (5)
Выше приведенный подход к механизму образования Оп подтверждается закислением приэлектродного пространства в начальный момент процесса, данными ИК-спектроскопии, которые показали идентичность химического строения исходного олигомера и автоосажденного из его растворов Оп. Смещение полос поглощения и изменений интенсивности полос основных групп не наблюдалось.
Электрохимический взгляд на механизм автоосаждения подтверждается отсутствием ионов трехвалентного алюминия в Оп и величинами кислотных чисел (кч).
Однако полимерные пленки, полученные из водных растворов олигомера КЧ-0125 (рН=7), пористы и имеют незначительную толщину.
Введение органических соединений улучшает реологические свойства и структуру водного раствора пленкообразователя при электроосаждении, поэтому изучили влияние ряда органических добавок: лака К-424-02, смолы
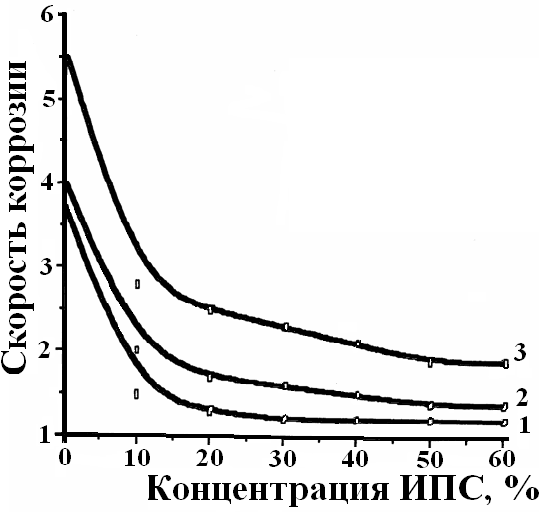
Э-30, олигомера ПФ-60 и изопропилового спирта. Введение изопропилового спирта (ИПС) позволяет значительно улучшить качество Оп и является предпосылкой для создания Ок (рис.5).
 а) | 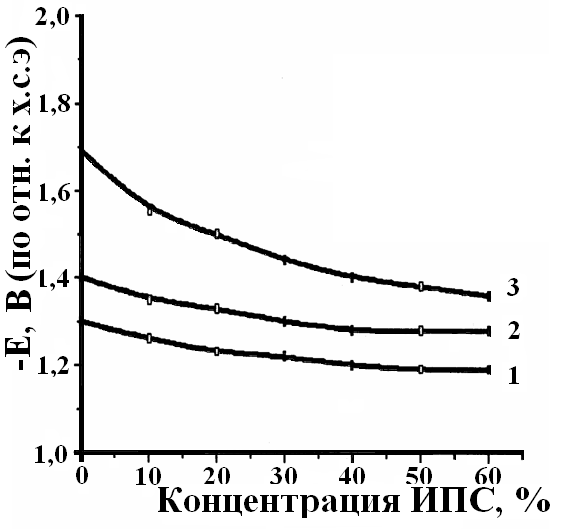 б) |
(б) – потенциала алюминия от разбавления раствора олигомера КЧ-0125 смесью ИПС:Н2О: 1 – рН =7; 2 – рН = 8; 3 – рН = 11.
С увеличением концентрации ИПС скорость коррозии алюминия снижается при всех значениях рН (рис.5а), а потенциал электрода смещается в положительную сторону (рис.5б), что свидетельствует о торможении анодного процесса коррозии за счет образования на поверхности металла более плотной полимерной пленки.
Исследования устойчивости Пп к агрессивному раствору показали, что наибольшей устойчивостью обладают Пп, полученные при рН = 7 из композиции, содержащей ИПС и воду в равных долях.
