И доречевой тугоухости
| Вид материала | Автореферат диссертации |
- Санитарные правила и нормы СанПиН 2 570-96, 1345.17kb.
На правах рукописи
МАРКОВА
Татьяна Геннадьевна
КЛИНИКО-ГЕНЕТИЧЕСКИЙ АНАЛИЗ ВРОЖДЕННОЙ
И ДОРЕЧЕВОЙ ТУГОУХОСТИ
14.00.04 – болезни уха, горла и носа
03.00.15 – генетика
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2008
Работа выполнена на базе лаборатории ДНК-диагностики ГУ Медико-генетический научный центр РАМН (г. Москва), ГУЗ «Московский научно-практический центр оториноларингологии» Департамента здравоохранения города Москвы.
Научные консультанты: доктор медицинских наук, профессор Кунельская Наталья Леонидовна
доктор биологических наук, профессор Поляков Александр Владимирович
Официальные оппоненты: доктор медицинских наук, профессор Таварткиладзе Георгий Абелович
доктор медицинских наук, профессор Чистякова Валентина Ришардовна
доктор медицинских наук Зинченко Рена Абульфазовна
Ведущее учреждение: Государственный медико-стоматологический
университет
Защита диссертации состоится «___» _______ 2008 г. в ____ часов на заседании Диссертационного совета Д.850.003.01 при ГУЗ «МНПЦО» ДЗМ по адресу: 2-й Боткинский пр., 5, корп. 14.
С диссертацией можно ознакомиться в библиотеке ГУЗ «Московский научно-практический центр оториноларингологии» ДЗМ по адресу: 2-й Боткинский пр., 5, корп. 14.
Автореферат разослан «___» _______ 2008 г.
Ученый секретарь Диссертационного совета
кандидат медицинских наук, Ю.В.Лучшева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы: Настоящий прорыв в области молекулярно-генетических знаний об органе слуха выводит на качественно иной уровень подходы к установлению причин тугоухости и разработку эффективных способов лечения [Petit C., 2001]. Возможности ДНК-диагностики наследственных нарушений слуха открывают новые пути эффективной профилактики. В этой связи возрастает роль медико-генетического консультирования, пренатальной и постнатальной диагностики наследственной тугоухости. Необходимость организации особого диспансерного учета семей, угрожаемых по возникновению тугоухости, и выделение групп риска среди детей предлагалась давно [Тарасов Д.И., 1984, Smith S., 1991].
Идентификация патологических мутаций в семьях с разными формами наследственной тугоухости позволила описать клинические проявления при изменениях в различных генах [C.W.Cremers, et al., 1995; A.K.Lalwani, et al 1999; M.Bitner-Glindzicz, 2002; C.H.Hsu, et al 2005; Snoeckx R.L. et al., 2005]. Известен относительный вклад мутаций в некоторых генах в развитие врожденных и доречевых нарушений слуха: в ряде стран Европы и США мутации в гене коннексина 26 (Сх26) составили 50%, в 5% случаев выявлены мутации в генах Сх30 и кадерина 23. В отдельных странах в 5% случаев обнаружены мутации миозина 15, пендрина, стереосилина, в 3% случаев определены мутации отоферлина и митохондриального гена 12S р-РНК. Выраженная генетическая гетерогенность нарушений слуха считается главной проблемой точной диагностики причин тугоухости [C.W.Cremers, et al. 1991; K.S.Arnos, et al. 1992; Jacobson J.T., 1995, J.Finsterer, et al., 2005].
Молекулярно-генетические исследования среди пациентов с врожденной и доречевой нейросенсорной тугоухостью (НСТ) показали, что в этой группе генетически обусловленная тугоухость составляет от 35% до 42% [Kelsell D.P. et al., 1997; Lench N. et al., 1998; Поляков А.В., 2002; Некрасова Н.Ю. с соавт., 2002]. Только одна мутация - делеция 35delG в гене Сх26 является причиной нарушения слуха в 10-37% спорадических случаев [Estivill X. еt al. 1998; Van Laer L. et al. 2003].
Большинство детей с врожденной патологией слуха имеют слышащих родителей. Отсутствие сведений о других родственниках, имеющих нарушение слуха, не исключает возможность генетической природы заболевания. При отсутствии молекулярных методов исследования правильное консультирование семей таких пациентов практически невозможно. За рубежом благодаря современным технологиям проводится ДНК-диагностика 8 генов, включая анализ около 200 мутаций, приводящих к нарушению слуха [I.Schrijver, et al., 2006; K.Siemering, 2006]. В условиях Российской Федерации ДНК-диагностика доступна лишь для четырех генов.
Традиционно врожденная тугоухость/глухота не считается тяжелым заболеванием, поскольку дети, в большинстве своем, соматически здоровы. Тем не менее, тяжелая потеря слуха обуславливает грубое нарушение речевого, психо-эмоционального и социального развития ребенка и является основанием для получения инвалидности. Важность предупреждения случаев врожденной и тяжелой детской тугоухости обусловлена значительными материальными средствами, которые государство выделяет на выплаты по инвалидности, на программы раннего выявления, абилитации, специального обучения, на слуховые аппараты и кохлеарную имплантацию. Генетический скрининг новорожденных на мутации в гене Сх26 по данным зарубежных авторов способствует раннему выявлению наследственных нарушений слуха [F.P.Cremers, 1998; R.J.Smith, et al., 2003].
Основные проблемы диагностики наследственной тугоухости в нашей стране связаны в первую очередь с отсутствием системного подхода к их выявлению. Не ведется мониторинг синдромальных и несиндромальных форм тугоухости среди детского населения. В общей практике нет критериев для формирования групп риска по наследственным нарушениям слуха. Не используется современная рабочая классификация наследственных форм тугоухости [Willems P.J., 2000]. Нет достаточных данных о распространенности патологических изменений в известных генах «глухоты» среди населения России. Изучена распространенность патологических изменений лишь в гене Сх26 в ряде регионов страны [Аничкина А., 2001; Зинченко Р.А., 2003; Посух О., 2005; Хидиятова И.М., 2005; Шокарев Р.А., 2005]. Этого недостаточно для оказания полноценной помощи пациентам и членам их семей. Необходимо накопление клинического материала и возможность исследования других генов, если не обнаружены изменения в гене Сх26.
Другая проблема заключается в отсутствии тесного взаимодействия оториноларингологов, сурдологов и генетиков. Не налажен обмен информацией и современными знаниями в данной области. Не разработаны показания для направления пациента с нарушением слуха на консультацию к врачу генетику, что в условиях современной медицины является основным инструментом профилактики новых случаев врожденной тугоухости. ДНК-диагностика способствует большей объективности в решении вопросов этиологии тугоухости. Правильная диагностика причин, разъяснение сложившейся в семье генетической ситуации, прогноз на будущее важны для всех членов семьи детородного возраста [Гинтер Е.К., 2003]. Создание четкой системы взаимодействия между специалистами в отношении профилактики наследственных форм нарушений слуха основная цель нашего исследования.
Цель и задачи исследования
Целью настоящего исследования являлась разработка системы диагностики и профилактики наследственных форм врожденной и доречевой детской тугоухости на основе использования современных достижений медицинской генетики.
В связи с этим в работе ставились следующие задачи:
- Изучить распространенность синдромальных и несиндромальных форм тугоухости среди детей с врожденными и доречевыми нарушениями слуха.
- Оценить потребность в консультации генетика семей с тугоухими и глухими детьми, а также информированность родителей о возможных причинах потери слуха у ребенка.
- Изучить частоту мутаций в генах Cx26, Cх30 и мутации A1555G гена 12S p-РНК митохондриальной ДНК среди детей с врожденной и доречевой тугоухостью.
- Сравнить этиологическую структуру несиндромальной НСТ и глухоты до и после проведения скрининга мутации 35delG в гене Сх26.
- Разработать показания к медико-генетическому консультированию и создать алгоритм клинического и генетического исследований синдромальных и несиндромальных форм врожденной и доречевой тугоухости.
- Обозначить группы риска по наследственной патологии слуха, которым показана консультация генетика и генетическое тестирование.
- Разработать рекомендации для согласованных действий специалистов разного профиля в целях профилактики наследственных форм врожденной тугоухости и глухоты.
Научная новизна.
Впервые на территории Санкт-Петербурга и Ленинградской области изучена распространенность синдромальных и несиндромальных нарушений слуха среди детей с врожденной и доречевой тугоухостью.
Впервые для Российской Федерации проведена молекулярная диагностика в семьях с синдромом Ваарденбурга и бранхио-ото-ренальным синдромом.
Впервые для Российской Федерации в большой выборке детей с врожденной и доречевой тугоухостью (406 детей) проведен молекулярно-генетический скрининг мутации 35delG в гене Сх26.
Среди детей с врожденной и доречевой несиндромальной НСТ изученной группы подтверждена высокая распространенность мутации 35delG в гене Сх26.
Изучена клиническая характеристика несиндромальной НСТ у гомозигот по мутации 35delG в гене Сх26.
Описана клиническая характеристика тугоухости при биаллельном наследовании мутаций в гене Сх26 и дигенном наследовании мутаций генов Сх26 и Сх30.
Впервые на территории Санкт-Петербурга, Ленинградской области, Ярославля и Ярославской области сделана попытка определить спектр мутационных повреждений гена Сх26 и изучить частоту мутаций: 35delG, 312del14, 235delC, а также мутации A1555G митохондриального гена 12S p-РНК.
Показана эффективность анализа частой мутации гена Сх26 для установления наследственной тугоухости, особенно для детей с семейным анамнезом, отягощенным по нарушению слуха.
Впервые предложен алгоритм клинико-генетического обследования врожденной и ранней детской тугоухости, в котором прослеживается необходимость четкого разделения синдромальных и несиндромальных форм наследственной тугоухости. Обоснована важность консультации генетика для семей с тугоухим ребенком.
Разработаны показания для направления на медико-генетическое консультирование, выделены группы риска по наследственной тугоухости согласно результатам собственных исследований и работам других авторов.
Доказана важность совместных действий врачей генетиков и сурдологов и необходимость научно-практического подхода к диагностике наследственных форм нарушений слуха.
Практическая значимость работы. Решена важная для практического здравоохранения проблема:
- показано значение консультации генетика и ДНК-диагностики при выяснении причин врожденной и доречевой тугоухости, а также для профилактики новых случаев в отягощенных и неотягощенных по тугоухости семьях.
- определен спектр мутационных повреждений гена Сх26 среди детей с врожденной и ранней детской тугоухостью, проживающих на территории Санкт-Петербурга, Ленинградской области, Ярославля и Ярославской области.
- разработана оптимальная схема выявления наследственных форм тугоухости, включающая клиническое и молекулярно-генетическое обследование.
- подтверждена гетерогенная природа врожденных нарушений слуха.
- предложены этапы выявления наследственных форм тугоухости среди детского и взрослого населения, которые апробированы при проведении данного исследования и могут послужить основой создания регистра данных по синдромальным и несиндромальным нарушениям слуха.
- показано, что предупреждение рождения ребенка с наследственной тугоухостью в семье нормально слышащих родителей возможно в рамках планирования семьи благодаря скрининговой диагностике носительства наиболее распространенных патологических мутаций в генах у будущих родителей.
Положения, выносимые на защиту.
- Для правильной клинической и молекулярно-генетической диагностики синдромальных и несиндромальных форм наследственных нарушений слуха обязательна консультация генетика.
- Мутация 35delG в гене Сх26 является основной причиной врожденной и доречевой тугоухости, что обуславливает необходимость выполнения генетического анализа для всех детей с подобными нарушениями слуха.
- Молекулярно-генетический анализ гена Сх26 - достоверный тест для выявления наследственных форм тугоухости. Консультирование семьи с тугоухим ребенком становится более информативным благодаря диагностике мутационных повреждений в генах, обуславливающих нарушение слуха.
- Консультация генетика строго обязательна всем лицам, имеющим родственников с нарушением слуха, независимо от характера нарушений, и пациентам со стойкой тугоухостью неясной этиологии.
- Предложенный алгоритм клинического обследования пациента со стойким нарушением слуха и показания для направления к врачу генетику являются необходимой мерой системной профилактики наследственных нарушений слуха среди населения.
- Формирование групп риска по наследственной тугоухости на основе скрининговых программ среди населения является первым этапом эффективной профилактики новых случаев врожденной тугоухости.
- Детский сурдоцентр может являться идеальной базой для медико-генетического консультирования профильных больных и эффективной профилактики наследственных нарушений слуха среди населения.
Внедрение результатов работы в практику. Вопросы медико-генетического консультирования наследственной тугоухости и результаты работы по генетическому тестированию были темой выступлений и лекций перед врачами ЛОР общества, общества генетиков, на факультете усовершенствования врачей Санкт-Петербургской МАПО, среди детских оториноларингологов, врачей сурдологов. Осуществлялась просветительская деятельность среди персонала специализированных школ, детских садов, среди родителей тугоухих/глухих детей. В практику работы Центра восстановительного лечения детей со слухоречевой патологией г. Санкт-Петербурга внедрены показания для направления к врачу генетику и на ДНК-диагностику. По результатам тестирования на базе сурдоцентра проводилось медико-генетическое консультирование. Заключения по выявленным синдромам и наследственным формам тугоухости отражались в медицинской документации.
Апробация работы. Результаты собственных исследований представлялись в рамках Всероссийских научно-практических конференций для молодых ученых-оториноларингологов (1996, 1998, 1999, 2001), 1-го (3) съезда Российских генетиков (г.Москва, 1994), конференции "Генофонд Санкт-Петербурга" (1995), 7-го и 8-го Всемирных конгрессов по детской оториноларингологии (Финляндия, 1998; Англия, 2002), первого заседания Европейской рабочей группы по наследственным нарушениям слуха (Италия, 1999), XX и XXI международных конгрессов генетиков (Австрия, 2001; Голландия, 2002), конференции по биологии внутреннего уха (Италия, 2001), XVII съезда оториноларингологов России (г. Нижний Новгород, 2006), V и VI Всероссийской научно-практической конференции «Наука и практика в оториноларингологии» (г.Москва, 2006 и 2007), научно-практической конференции сотрудников МНПЦО ДЗМ и врачей оториноларингологов больницы им. С.П.Боткина (22 февраля 2008 года).
Публикации. По теме диссертации опубликовано 39 научных работ, из них 18 в центральной печати.
Структура и объем диссертации. Диссертация изложена на 29 страницах машинописного текста, состоит из введения, обзора литературы, описания материалов и методов исследования, 3 глав с описанием результатов собственных исследований, заключения с обсуждением результатов, выводов, практических рекомендаций, списка литературы. Работа содержит 25 таблиц, 47 рисунков и 3 приложения. Список литературы включает 60 названий работ отечественных авторов и 248 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Выявление детей с наследственными формами врожденной и ранней детской тугоухости проводилось среди семей, обратившихся к детскому сурдологу и генетику в Санкт-Петербургский НИИ уха, горла, носа и речи, а также среди детей, состоящих на учете в Городском центре восстановительного лечения детей со слухоречевой патологией №1 г.Санкт-Петербурга ГУЗ ДГП№68 (до 1995 г. Городской детский сурдологический кабинет). С целью поиска мутации 35delG в гене Сх26 проведены скрининговые осмотры в дошкольных и школьных учреждениях для слабослышащих и глухих детей. Для максимального привлечения родителей, имеющих детей с нарушением слуха, и уточнения данных о семье предварительно распространялись специально разработанные анкеты.
Первый контингент включал 1863 ребенка в возрасте от 0 до 16 лет со стойкой тугоухостью разного характера и степени тяжести, состоящих на учете в Городском детском сурдологическом кабинете Санкт-Петербурга на 1994г. Анализировались данные медицинских карт, родители детей активно приглашались на консультацию генетика. Основу базы данных составили дети с 1979 по 1994 год рождения, среди них 1001 мальчик (54%) и 862 девочки (46%). Клинические характеристики тугоухости: наличие сопутствующих симптомов, степень тяжести, возраст первичной диагностики изучены в группе из 665 детей, рожденных в период с 1980 по 1982 гг.
Второй контингент составили 573 семьи из числа обратившихся к сурдологу по поводу тугоухости у ребенка и активно вызванных на консультацию к генетику. В этих семьях проведено медико-генетическое консультирование. В молекулярной диагностике мутации 35delG гена Сх26 участвовали 406 неродственных пробандов, которые страдали стойкой врожденной и ранней детской тугоухостью невоспалительного генеза и проживали в г. Санкт-Петербурге, Ленинградской области, г. Ярославле и в ряде других регионов России. В рамках второго контингента консультацию генетика и молекулярный скрининг прошли 130 детей первого контингента. Среди прошедших ДНК-диагностику было 187 лиц мужского пола (46,06%) и 219 лиц женского пола (53,94%). Средний возраст обследованных до 20 лет был 11 лет. Средний возраст первичной диагностики тугоухости в данной выборке составил 19,8 месяцев или 1,7 года.
Разработанная схема первичного анализа данных и критерии отбора представлены на рисунке 1. Из общего числа выделены синдромальные и несиндромальные нарушения слуха, которые в свою очередь разделены на случаи с неотягощенным и отягощенным по нарушению слуха семейным анамнезом. Выделены три типа семей. I тип - семьи со слышащими родителями. Семьи с одним тугоухим родителем отнесены ко II типу. Семьи с ассортативным браком, где оба родителя имеют нарушение слуха, отнесены к III типу. Семьи I типа имели две подгруппы. Семьи IА типа - это семьи с неотягощенным семейным анамнезом. Семьи IБ тип имели родственников с нарушением слуха. Группа с отягощенным семейным анамнезом включала различные типы семей. В группе с неотягощенным семейным анамнезом (только семьи IА типа) выделялись две подгруппы: первая с экзогенной причиной тугоухости (согласно мнению сурдологов) и вторая с неотягощенным анамнезом заболевания.
На следующем этапе анализировались характер и степень поражения органа слуха. Изучалась этиологическая структура исследованной выборки до и после проведения скрининга изменений в гене Сх26.
Для клинической диагностики синдромов нами использовались критерии, перечисленные в монографии R.Gorlin [1995]. Клиническая диагностика несиндромальных форм базировалась на критериях, предлагаемых Институтом глухоты и коммуникативных расстройств, г. Омаха США [1995], и рекомендованных Европейской рабочей группой по наследственным нарушениям слуха [Италия, 1998].
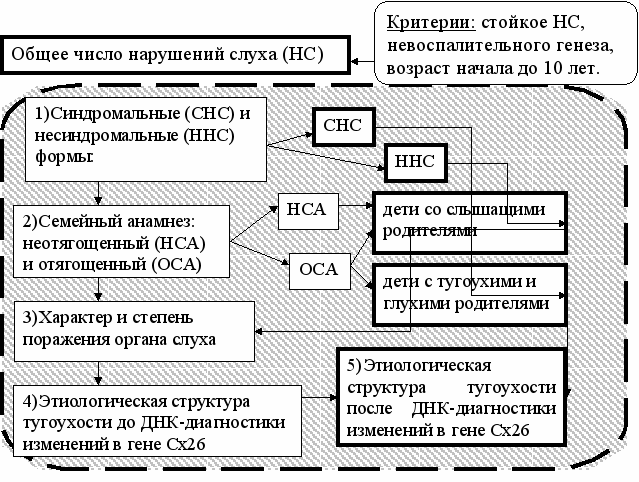
Рис.1. Схема анализа исследуемых групп детей с врожденной и доречевой тугоухостью.
Помимо общеклинического и сурдологического обследования в соответствии с задачами исследования использован ряд молекулярно-генетических методов. Выделение ДНК из цельной крови проводилось стандартным фенол-хлороформным методом [Vandenplas et al. 1984]. Выделение ДНК из пятен крови, высушенных на фильтровальной бумаге, осуществлялось методом абсорбции ДНК на диатомовые «шарики» с помощью набора реактивов DIAtomDNA Prep100 (производство фирмы «Диатом»). Для скрининга мутации 35delG в гене Сх26 применен метод ПЦР анализа, разработанный в ГУ МГНЦ РАМН д.б.н. Поляковым А.В [Поляков А.В., 2002]. Поиск мутаций в других фрагментах кодирующей области гена Сх26 осуществляли методом SSCP-анализа [Orieta et al., 1989]. Определение первичной нуклеотидной последовательности проводилось методом прямого автоматического секвенирования продукта ПЦР на основе ферментативного сиквенса по методу Сэнгера [Senger et al., 1977]. Секвенирование проводили по протоколу фирмы «Promega» на автоматическом секвенаторе ALF™ фирмы «Pharmacia Biotech», с использованием флуоресцентно-меченных праймеров. Для анализа гена РАХ3 и гена EYA1 также применялись методы ПЦР и SSCP-анализа.
В ходе скрининга предполагалось получение трех групп пациентов, отличающихся по генотипам. Первая группа - пациенты с двумя мутациями 35delG (гомозиготы по мутации), обозначаемые как ∆/∆. Вторая группа - дети с одной мутацией (гетерозиготы), обозначаемые как ∆/N. Обе группы были объединены в группу с «измененным генотипом». Третья группа – пациенты, у которых данная мутация не обнаружена (дикий генотип), обозначаемые как N/N. Каждая группа детей с определенным генотипом анализировалась по установленной схеме. В качестве контроля распространенности мутации 35delG в общей популяции использовались данные лаборатории ДНК-диагностики ГУ МГНЦ РАМН [Anichkina A. et al 2001]. Дополнительно тестировано 35 пар родителей обследованных детей.
Основой статистического анализа явились экстенсивные и интенсивные показатели, используемые в практическом здравоохранении. Для работы с базами данных использованы программы Access и Exsel 2003, Statistics ver.6.0.
