Динамика развития паркинсонизма на нейротоксической модели у мышей линии C57BL/6 03. 03. 01 Физиология
| Вид материала | Автореферат |
- Реакция гипоталамо-адренокортикальной системы молодых и старых мышей на стресс и возрастные, 693.1kb.
- Доклад динамика, 924.43kb.
- План сочинения "Моя линия второго порядка" Определение линии, 4.74kb.
- Социальная динамика и ее проявление в общественных изменениях и процессах, 1729.8kb.
- Урок 28 «Война лягушек и мышей», 1155.42kb.
- Самостоятельная работа 87 130 Всего часов на дисциплину, 58.84kb.
- Победители Всероссийского конкурса «Лучшие российские предприятия. Динамика, эффективность,, 41.15kb.
- Тема 13. Деконволюция цифровых сигналов если дом красив, то мы понимаем, что он был, 261.74kb.
- Канализация электроэнергии, 631.07kb.
- «специфика социально-экономической модели малайзии», 165.33kb.
На правах рукописи
Щеголевский Николай Валентинович
Динамика развития паркинсонизма на нейротоксической модели у мышей линии C57BL/6
03.03.01 – Физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва
2011
Работа выполнена на кафедре анатомии и физиологии человека и животных биолого-химического факультета ГОУ ВПО «Московский педагогический государственный университет» и в лаборатории нейрохимических механизмов обучения и памяти Учреждения Российской Академии Наук «Институт высшей нервной деятельности и нейрофизиологии РАН».
| Научный руководитель: | доктор биологических наук Базян Ара Саакович |
| Официальные оппоненты: | доктор медицинских наук, профессор Северин Александр Евгеньевич доктор биологических наук Пигарева Марина Леонидовна |
| Ведущая организация | Учреждение Российской Академии Наук «Институт теоретической и экспериментальной биофизики РАН» |
Защита состоится «20» июня 2011года в 13 часов на на заседании диссертационного совета Д 212.154.17 при ГОУ ВПО «Московский педагогический государственный университет» по адресу: 129164, г.Москва, ул. Кибальчича, д.6, корп.4, биолого-химический факультет, ауд. 205.
С диссертацией можно ознакомиться в библиотеке Московского педагогического государственного университета по адресу: 119991, Москва, ул. М.Пироговская, дом 1, стр.1 .
Автореферат разослан « 18 » мая 2011 года.
| Ученый секретарь диссертационного совета | Холмогорова Н.В. |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования.
Хронические нейродегенеративные заболевания, такие как болезнь Паркинсона (БП), болезнь Альцгеймера (БА), хорея Гентингтона и другие относятся к социально значимым заболеваниям, на лечение и исследование которых тратятся огромное количество денег во многих государствах [Голубев и др., 1999; Шток и др., 2002; Marras, Tanner, 2004; Левин, Федорова, 2006; Гаврилова, 2007, Угрюмов, 2010].
Вопрос об этиологии нейродегенеративныx заболеваний до сих пор остается нерешенным, хотя считается, что важнейшими факторами риска являются генетическая предрасположенность и эндогенные вещества, запускающие нейродегенеративный процесс. Так, в случае БП мутации в генах α-синуклеина, Паркина и других генов приводят к возникновению мутантных токсических белков, которые вызывают гибель специализированных нейронов нигро-стриатной дофаминергической системы и развитие болезни Паркинсона [Григорян, Базян, 2007; Базян, Григорян, 2010].
Несмотря на огромные усилия, которые тратятся различными государствами на паркинсонизм, проблема лечения этого заболевания встречает все еще большие трудности. На самом деле это и понятно, так как дегенерацию и выпадение целой нейромодуляторной системы мозга, практически невозможно восстановить, несмотря на все предпринимаемые до сих пор усилия. В основном пытаются компенсировать функцию выпавшей нигростриатной ДА-ергической системы мозга введением L-ДОФА, предшественника синтеза ДА, легко проходящего через гематоэнцефалический барьер. До сих пор L-ДОФА остается одним из основных препаратов лечения паркинсонизма, но его длительное применение вызывает нарушение моторной функции. Поэтому, в ряде экспериментальных исследований L-ДОФА нормализует вызванные паркинсонизмом изменения [Lindefors 1993; Levy et al., 1995; Vila et al., 1996; Katz et al, 2005; Stephenson et al., 2005; Wang et al., 2007], а в других случаях усугубляет их [Corvol et al., 2004; Jenner, 2003; Rinne et al., 2004; St-Hilaire et al., 2005; Aubert et al., 2005].
Другой подход, который находится в центре внимания исследователей, это исследование и использование компенсаторных процессов, не в разгар нейродегенеративных заболеваний, а в их начальных стадиях, например при досимптомной стадии паркинсонизма. Досимптомная стадия паркинсонизма это та стадия, когда уже начались нейродегенеративные процессы, но симптомы паркинсонизма еще не проявляются. Можно предположить, что отсутствие симптомы паркинсонизма связаны с коменсаторными процессами, которые протекают в мозге. Усиление этих компенсаторных процессов может оттянуть клиническую стадию паркинсонизма. Этот вопрос очень мало изучен на современном этапе и для его реализации необходимо подобрать хорошую экспериментальную модель паркинсонизма.
Есть несколько моделей паркинсонизма с использованием специфических токсинов. Протоксина МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) привлек внимание исследователей болезни Паркинсона в связи с тем, что являющийся примесью синтетического героина, вызывает у наркоманов и лиц, участвующих в производстве этого наркотика, неврологические симптомы, характерные для болезни Паркинсона: брадикинезию, ригидность и тремор (Langston et al., 1983, 1999). МФТП проходит в мозг, и связывается с активными центрами окислительного фермента моноаминоксидазы-В (МАО-В), локализованного в микроглии. При посредстве МАО-В протоксин превращается в N-метил-4-фенил-2,3-дигидропиридин-ион (МФДП+), который окисляется до конечного продукта - МФП+, обладающего селективной нейротоксичностью по отношению к ДА структурам. МФП+ активно транспортируется в нейроны ДА транспортером. В нейронах МФП+ входит в митохондрии и селективно тормозит митохондриальное дыхание на уровне комплекса 1 электронной транспортной цепи, вызывая оксидативный стресс и нарушения кальциевого гомеостаза. Это приводит к дегенерации ДА нейронов или посредством некроза или апоптоза (Langston, et al., 1983; Gerlach, Riederer 1996; Przedborski еt al., 2000). Экспериментально показано, что МФТП селективно моделирует ключевой патогенетический механизм БП - гибель нигростриатных дофаминергических нейронов, дефицит дофамина в стриатуме, при последующем проявлении паркинсонистических симптомов - тремор, ригидность, замедленность движения, семенящую походку, постуральную нестабильность [Кучеряну и др., 2010].
Наилучшие модели БП при использовании МФТП получается на мышах линии C57BL/6 и на обезьянах. Введение токсина [German, еt al., 1996] в больших дозах (50-300 мг/кг) мышам линии C57BL/6 приводило к почти полному истощению (до 95%) уровня стриатного дофамина и к выраженной гибели (от 55 до 75%) нейронов ниграстриатной системы. Но обычно для исследования миткродиализа у мышей в МФТП модели предварительно вводят животным различные вещества, увеличивающие концентрацию ДА так как выход ДА у мышей очень маленький и использование МФТП практически невозможно. Например, психостимулятор модафинил [Fuxe еt al., 1992], антагонист NMDA рецептора AP-5 [Richard еt al., 1995] или тирамин, резко повышающий концентрацию ДА в мозге [Schmidt, Ferger, 2004]. Мы полагали, что было бы гораздо лучше исследование концентрации ДА и его метаболитов в стриатуме под влиянием МФТП без дополнительного повышения концентрации ДА. В связи с этим были поставлены следующие цели и задачи исследований.
Цель исследования.
Изучить динамику развития паркинсонизма на нейротоксической модели у мышей линии С57BL/6.
Задачи исследования.
- Увеличить чувствительность хроматографического метода определения концентрации ДА и его метаболитов, 3,4-дезоксифенилуксусной кислоты (ДОФУК) и гомованилиновой кислоты (ГВК), при электрохимическом детектировании настолько, чтобы можно было прямо определять значительные уменьшения концентраций этих веществ в стриатуме мышей, без дополнительного его усиления.
- Определение межклеточной концентрации ДА и его метаболитов ДОФУК и ГВК в стриатуме свободноподвижных мышей методом микродиализа, в разные интервалы времени (сразу, через 7 суток, через 30 суток) после инъекции МФТП, в дозе 20 мг/кг при внутривенном введении.
- Выяснение корреляции между наличием двигательных расстройств и концентраций ДА и его метаболитов в межклеточной среде стриатума в эти интервалы времени.
- Исследование межклеточной концентрации ДА, его предшественника L–ДОФА и его метаболитов ДОФУК и ГВК в стриатуме мышей линии C57BL/6 методом микродиализа через 14 дней после подкожного введения МФТП в дозе 12 мг/кг.
Научная новизна.
Метод хроматографии модифицирован таким образом (подобран состав подвижной фазы, тип колонки, снята преколонка), что его чувствительность возросла на 2 порядка (в 100 раз). Это позволило с помощью метода микродиализа in vivo определить межклеточную концентрацию ДА в стриатуме мышей, после воздействия МФПТ, без дополнительного увеличения концентрации ДА предварительным введением фармакологических агентов, искусственно повышающих концентрацию ДА в стриатуме мышей.
Впервые исследована динамика нарушения поведения мышей после однократного введения МФТП в дозе 20 мг/кг и выяснена корреляция между наличием двигательных расстройств и межклеточных концентрацией дофамина и его метаболитов в те же интервалы времени
Впервые исследована досимптомная стадия паркинсонизма и показано, что через 14 суток после однократной подкожной инъекции МФТП в дозе 12 мг/кг наблюдается двукратное уменьшение межклеточной концентрации дофамина в стриатуме, но при этом не наблюдается каких либо двигательных нарушений.
Теоретическое и научно-практическое значение работы.
Повышение чувствительности хроматографического метода позволит широко использовать метод in vivo микродиализа для определения межклеточную концентрацию ДА в различных структурах мышей, даже в тех случаях, когда концентрация ДА значительно понижена предпринятыми воздействиями.
До сих пор специальное внимание не уделялось досимптомной стадии паркинсонизма, при которой, вероятнее всего, компенсаторные процессы наиболее выражены. Отсутствие двигательных расстройств, возможно, связано с высокой интенсивностью компенсаторных процессов, которые препятствуют проявлению симптомов паркинсонизма на фоне выраженного дефицита межклеточной концентрации ДА в стриатуме. Можно полагать, что целенаправленное усиление компенсаторных механизмов нивелирует уже имеющиеся нарушения и растянет развитие болезни на годы.
Основные положения, выносимые на защиту.
- Поведенческие и биохимические показатели активности мышей под воздействием введения МФТП находятся в зависимости от дозы токсического вещества, характера его введения (однократно или многократно) и времени последующего тестирования этих показателей.
- Однократное подкожное введение малой дозы (12 мг/кг) МФТП через 14 суток формирует экспериментальную модель досимптомной стадии паркинсонизма, сопровождаемое уменьшением межклеточной концентрации ДА в стриатуме и отсутствием нарушения поведения. Отсутствие нарушений поведения в модели досимптомной стадии паркинсонизма обусловлены компенсаторными механизмами, которые очень важно и удобно исследовать на данной модели паркинсонизма.
Апробация работы.
Апробация работы прошла 16.12.2010 г. на совместном заседания кафедры анатомии и физиологии человека и животных биолого-химического факультета ГОУ ВПО «Московский Педагогический Государственный Университет» и лаборатории нейрохимических механизмов обучения и памяти Учреждения Российской Академии Наук «Института высшей нервной деятельности и нейрофизиологии РАН». Материалы исследований были представлены, доложены и обсуждены на конференции молодых ученых в Учреждении Российской Академии Наук «Институте высшей нервной деятельности и нейрофизиологии РАН» (Москва, 2008 г.), конференции «Интеграция научных исследований в рамках реализации приоритетных направлений науки» (Москва, МПГУ, 2009 г.), международной конференции «Современные проблемы органической и биологической химии, молекулярной биологии, экологии и биотехнологии», посвященной 85-летию кафедры органической и биологической химии и 90-летию ссо дня рождения профессора МПГУ Юрия Борисовича Филипповича» (Москва, МПГУ, 2009 г.), конференции молодых ученых в Учреждении Российской Академии Наук «Институте высшей нервной деятельности и нейрофизиологии РАН» (Москва, 2009 г.), конференции «Интеграция научных исследований в рамках реализации приоритетных направлений науки». (Москва, МПГУ, 2010 г.).
Публикации.
По теме диссертации опубликованы 7 печатных работ, в т.ч. 3 в реферируемых журналах из списка ВАК РФ по направлению «Биология».
Структура и объем диссертации.
Диссертация состоит из введения, четырех глав (обзор литературы, методы исследования, результаты исследования, обсуждения результатов), заключения, выводов, списка литературы. Диссертация изложена на 136 страницах, объем основного текста – 108 страницы, иллюстрированных 29 рисунками и 2 таблицами, объем библиографического списка – 28 страниц (229 наименований источников, из них 210 – на иностранных языках).
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Были использованы две группы животных разного возраста. В первой группе опыты проводились на 23 самцах мышей линии C57BL/6, в возрасте 3-4 месяца, весом 28-32 грамма. Во второй группе опыты проводились на 12 мышей-самцов линии C57BL/6, в возрасте 2,5 месяца, весом 24-28 грамм. Выбор мышей в качестве экспериментальных животных обусловлен тем, что моторные нарушения при воздействии МФТП у них являются более выраженными, чем у крыс.
Операция по установке платформы к микродиализной канюле. За двое суток до эксперимента мышей анестезировали золетилом (Zoletil-100, 35 мг/кг) внутрибрюшинно и помещали в стереотаксис (“Kopff”, США). Скальпирование производили под дополнительной новокаиновой блокадой (2% подкожно). В костях черепа сверлили трепанационное отверстие для канюли, которую позднее вводили в мозг по координатам атласа Паксиноса и Франклина [Paxinos, Franklin, 2001] (АР=+0,5 мм; L=1,7 мм; Н=3,5-4,0 мм от поверхности мозга). Индифферентный электрод и платформу, то есть направляющую для микроманипулятора крепили к кости черепа с помощью зуботехнической пластмассы. После операции каждое животное содержали в отдельной клетке.
Микродиализ. Для прижизненного определения межклеточной концентрации ДА, его предшественника и его метаболитов использовали метод микродиализа с последующим анализом диализата с помощью жидкостной хроматографии. Как мы уже сообщали, для предупреждения прорастания мембраны канюли глиальными клетками, которые могут препятствовать прохождению биологически активных веществ и значительно уменьшать их концентрацию в диализате, мы вводили канюлю непосредственно перед экспериментом с помощью микроманипулятора, установленного на черепе животного.
В работе использовали канюли коаксиального типа, поскольку они имеют наименьший диаметр и меньше повреждают ткани мозга. В качестве диализного раствора использовалась среда Кребса–Рингера, в mМ: NaCl – 147; KCl – 3; CaCl2 – 1,4; MgCl2 – 0,8; Na-фосфатный буфер – 100 (pH 7,4). Раствор подавался с помощью шприцевого насоса, со скоростью 1 мкл/мин, через тонкую силиконовую трубку, подходящую к канюле. Выйдя из капилляра, раствор поступал в область полупроницаемой мембраны, где исследуемые вещества попадали в него по концентрационному градиенту, и через отводящую трубку поступали в пробирку, укрепленную на подающей трубке над головой животного. Специальное крепление пробирок позволяло менять их, не беспокоя животное.
Микродиализат собирали у свободнопередвигающихся животных, через 40 мин после введения канюли каждые 20 мин. Затем с помощью метода высокоэффективной жидкостной хроматографии высокого давления с электрохимическим детектором определяли концентрацию катехоламинов и их метаболитов в микродиализате. Для разделения диализата на фракции использовались хроматографические колонки (Dr. Maisch, Peprosil-Pur, C18, aq. 3мкм, 2х150 мм «Элсико», Россия) без преколонки. Подвижная фаза: цитратно-фосфатный буфер, pH 3,9, ацетонитрил 4% и тетрагидрофуран 0,8 %. Скорость потока 0,3 мл/мин. Для определения количества веществ использовали электрохимический детектор DIONEX ED50A. Напряжение на электроде 0,75 V. Чувствительность метода при использованной нами канюле, колонке с приведенной подвижной фазой и при удалении преколонки составляет 2,5 – 3 фмоль/20 мкл, в то время как наименьшие величины определяемой концентрации ДА составляет около 60 фмоль/20 мкл.
Протокол экспериментов. Мышам первой группы однократно вводили МФТП (“Sigma”, Германия), внутрибрюшинно, в дозе 20 мг/кг с 30 мкл физиологического раствора. Контрольным животным вводили физиологический раствор в том же объеме. Двигательную активность исследовали в открытом поле у одних и тех же мышей сразу, через 7 и 30 суток после инъекции. В эти же сроки проводили исследования по микродиализу.
Мыши второй группы исследовались в рамках Программы Президиума РАН «Фундаментальные науки медицине». Мышам второй группы однократно вводили МФТП, подкожно, в дозе 12 мг/кг с 30 мкл физиологического раствора. Контрольным животным вводили физиологический раствор в том же объеме. Двигательную активность исследовали в открытом поле через 14 суток после инъекции. В эти же сроки мы проводили исследования по микродиализу. Друга часть мышей была использована для морфологоческих исследований.
У животных первой группы, в экспериментах по исследованию влияния МФТП сразу после его введения (20 мг/кг), одни и те же мыши служили контролем для самих себя (5 животных). Интактным мышам, после 4 последовательных отборов микродиализата вводили МФТП внутрибрюшинно и затем отбирали еще 4 последовательных микродиализата. Девяти контрольным и девяти опытным мышам вводили физиологический раствор и МФТП соответственно. Сразу после введения животных помещали в открытое поле и тестировали двигательную активность. Тех же 18 мышей повторно тестировали в открытом поле через 7 суток после однократного введения МФТП. Четыре контрольных и четыре МФТП инъцированных мышей отбирали для микродиализа, сразу после повторного тестирования. Пять контрольных и пять МФТП инъецированных мышей тестировали в открытом поле через 30 суток после однократной инъекции, а затем подвергали микродиализу.
Животных второй группы, через 11 суток после введения МФТП (12 мг/кг) помещали в открытое поле и тестировали их поведение. После этого животные подвергались микродиализу.
Статистическая обработка результатов. Результаты представлены в виде средних арифметических значений стандартная ошибка (M SEM). При сопоставлении средних значений в нескольких группах наблюдений применяли однофакторный дисперсионный анализ (ANOVA) с последующим использованием post-hoc-критерия Ньюмена - Келлса. При выяснении совместного влияния двух факторов использовали аппарат двухфакторного дисперсионного анализа. Для статистической обработки использовали критерий Фишера, t критерий Стьюдента для независимых и связанных выборок, соответствующие непараметрические критерии Манна - Уитни и Вилкоксона. Заключения с вероятностью случайной ошибки p < 0.05 принимались как статистически значимые.
После каждого эксперимента проводили морфологический контроль (рис.1.).
 | Рис. 1. Фотография среза мозга мыши на уровне стриатума со следами канюли (координаты локализации канюли приведены в тексте). |
Результаты исследований
Поведение животных. У всех мышей через несколько минут после внутрибрюшинного введения МФТП наблюдалось отчетливое нарушение двигательного поведения, проявляемого в форме ретропульсии: животные мелкими шажками двигались в обратном направлении, а при редких движениях вперед осуществляли их не прямолинейно, а с поворотами в правую сторону. При этом наблюдался общий тремор тела и напряженный дугообразный хвост. При таком поведении в тесте открытого поля у мышей с введенным токсином практически были нулевые величины горизонтальной (число переходов) и вертикальной активности. Через 7 суток в тесте открытого поля статистически значимой разницы в проявлениях горизонтальной и вертикальной активности у контрольных и МФТП - инъецированных мышей не наблюдалось.
Но на 30-е сутки снова наблюдалось статистически значимое уменьшение обоих типов двигательной активности у МФТП - инъецированных мышей по сравнению с контролем. При этом у одной МФТП - инъецированной мыши происходило полное торможение двигательного поведения, у двух мышей - уменьшение двигательной активности, а еще у 2-х наряду с уменьшением двигательной активности появился общий тремор тела.
Через 11 суток после введения МФТП в опыте (12 мг/кг) и физраствора в контроле у мышей этих двух групп отсутствовали различия по всем использованным показателям моторного поведения: горизонтальной двигательной активности (длине пробега за 180 сек.), времени без движения и вертикальной двигательной активности (число стоек за 180 сек.).
У других мышей из той же серии исследований отсутствовали различия поведения в открытом поле и на 14 сутки.
Микродиализ. Межклеточная концентрация ДА в стриатуме у МФТП обработанных мышей первой группы оказалась статистически значимо меньше, чем у контрольных мышей. Об этом свидетельствуют данные двухфакторного дисперсионного анализа (ANOVA), который показал высоко значимый общий эффект ГРУППЫ [F(1, 85)=11.83; p < 0.001], т.е. итог сравнения МФТП инъецированных и контрольных мышей вне зависимости от времени забора диализата. С другой стороны, общий эффект ВРЕМЕНИ, т.е. результат сравнения межклеточной концентрации ДА в разные периоды времени у всех мышей без разделения их на группы [F(2, 85)=0.15; p > 0.05] и взаимодействие эффектов ГРУППЫ и ВРЕМЕНИ [F(2, 85)=0.70; p > 0.05] оказались статистически незначимыми.
На рис. 2,А показаны изменения межклеточной концентрации ДА в стриатуме мышей двух групп в разные периоды времени после интоксикации. У МФТП – обработанной группы среднее значение ДА сразу после введения токсина понижалось на 41.1% от значений контрольной группы (t=2.64; p = 0.02 по критерию Стьюдента для парных сравнений).
Через неделю после введения токсина снижение межклеточной концентрации ДА под влиянием МФТП хотя и имело место (на 21.7%), но было статистически незначимым (t=1.34; p = 0,19 по критерию Стьюдента для независимых выборок). Через месяц после введения МФТП межклеточная концентрация ДА опять значительно понижалась (на 45.7%) по сравнению со средними значениями контрольной группы (t=2.35; p = 0.025 по критерию Стьюдента для независимых выборок).
 | 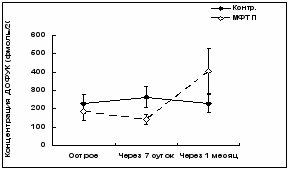 |
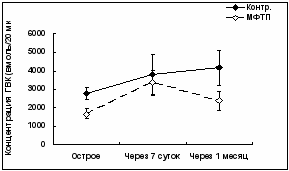 | Рис. 2. Межклеточная концентрация дофамина – ДА (A), 3,4-диоксифенилуксусной кислоты – ДОФУК (Б) и гомованилиновой кислоты – ГВК (В) в стриатуме мышей сразу, через 7 и 30 сут после введения МФТП (*p < 0,05; подробное описание статистики в тексте). |
Межклеточная концентрация дофук в стриатуме не зависела от принадлежности мышей к группе с токсическими повреждениями или к контролю, на что указывает статистическая незначимость общего эффекта ГРУППЫ [F(1, 87)=0.004; p = 0.94] ] (рис. 2, Б). Межклеточная концентрация ДОФУК мало менялась также в зависимости от того сразу, через неделю или месяц после введения МФТП проводили его исследование [F(2, 87)=1.69; p = 0.19]. Статистически незначимым для показателей концентраций ДОФУК было также взаимодействие эффектов ГРУППЫ и ВРЕМЕНИ, хотя оно и имело тенденцию к значимости [F(2, 87)=2.41; p = 0.09]. Эта тенденция была вызвана существенным увеличением концентрации ДОФУК у МФТП обработанной группы через месяц после введения токсического вещества.
Парные сравнения c помощью критерия Стьюдента средних значений уровня ДОФУК в контроле и после введения МФТП существенной разницы между ними в первом тестировании (t=0.12; p = 0.9) не выявили. Однако через неделю различие средних величин становилось почти значимым (р = 0.067), а различие дисперсий (при однофакторном анализе) по критерию Фишера - статистически значимыми (р=0.036). Наконец, через 1 месяц после введения МФТП различие средних было статистически незначимыми (p = 0.18), но различие дисперсий становилось высоко значимым (p < 0.001).
Межклеточная концентрация ГВК в стриатуме менялась статистически незначимо при совместном исследовании всех выборок с помощью двухфакторного дисперсионного анализа (ANOVA), как для исходных, так и для логарифмированных данных. Причем различий не было совсем по общему эффекту ВРЕМЕНИ [F(1, 86)=0.41; p = 0.66] и по взаимодействию эффектов ГРУППЫ и ВРЕМЕНИ [F(2, 86)=1.35; p = 0.26], тогда как по общему эффекту ГРУППЫ разница была пограничная [F(1, 87)=3.09; p = 0.08]. Между тем, после введения токсина наблюдалось заметное понижение уровня ГВК у МФТП – обработанной группы по сравнению с контрольными мышами (рис.2,В). Об этом свидетельствуют как сравнение средних значений ГВК для проб со взаимным соответствием (связанная выборка) по критерию Стьюдента и сравнение сумм рангов разностей значений ГВК по ранговому критерию Вилкоксона, так и сопоставление подопытных и контрольных мышей (по критерию Стьюдента для независимых выборок и ранговому критерию Манна – Уитни). Сразу после введения токсина разница между двумя группами результатов была статистически значимой по первому (t=2.52; p < 0.01) и второму (p = 0.01) критерию. Аналогично для сравнения экспериментальной группы мышей с ними же до введения (самоконтроль) эффект изменения ГВК был высоко значим (по парному критерию Стьюдента t=3.19; р < 0,01, по критерию Вилкоксона р < 0,01). Однако через неделю различия по критерию Манна-Уитни (p=0.86) были уже статистически незначимыми, а по критерию Стьюдента (p = 0.06) сохраняли тенденцию к значимости. Через месяц разница в уровне ГВК была снова статистически значимой (p < 0.05).
У мышей второй группы на 14-день после однократного введения МФТП в дозе 12 мг/кг наблюдалось значительное уменьшение межклеточной концентрации ДА по сравнению с контролем. Эти изменения проявлялись как в отдельных пробах, каждая из которых была собрана в течение 20 минут, так и при усреднении всех показателей, полученных в отдельных пробах. В первой пробе межклеточная концентрация ДА уменьшается на 56% (t = 3,86; p < 0,003), во второй – на 58% (t = 4,56; p < 0,001), в третьей - на 57% (t = 2,86; p < 0,02), в четвертой пробе достоверные изменения отсутствовали (Рис. 3, А). При усреднении значений, полученных в индивидуальных пробах, взятых от 6 контрольных и 6 опытных мышей, также оказалось, что межклеточная концентрация ДА вдвое ниже (на 54%) в эксперименте, чем в контроле (t = 5,00; p < 0,001) (Рис. 3, Б). В серии последовательных проб у контрольных животных межклеточная концентрация ДА постепенно снижается от 1 до 3 пробы на 34%, но эта разница недостоверна (t = 2,02; p > 0,05). У экспериментальных животных уменьшение равно 35%, и эта разница тоже недостоверна (t = 1,63; p > 0,05).
В отличие от ДА, концентрация L-ДОФА в первой двадцатиминутной пробе в опыте была достоверно выше (37%, t = 7,032; p < 0,001), чем в контроле. Однако во второй, третьей и в четвертой пробах, а также при усреднении проб от шести контрольных и шести опытных мышей, различия в концентрациях L-ДОФА в контроле и в опыте отсутствовали.
      |    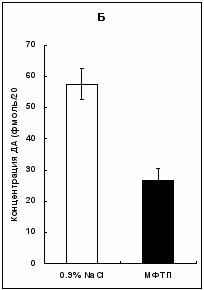 |
      Рис. 3. Межклеточная концентрация ДА ( А), в стриатуме мышей, серия последовательных проб с 20-и минутным интервалом. Усредненные величины по всем 4-ем пробам ДА (Б) ( p < 0,05; p < 0,01; p < 0,001; подробное описание статистики в тексте). Рис. 3. Межклеточная концентрация ДА ( А), в стриатуме мышей, серия последовательных проб с 20-и минутным интервалом. Усредненные величины по всем 4-ем пробам ДА (Б) ( p < 0,05; p < 0,01; p < 0,001; подробное описание статистики в тексте). | |
Также отсутствовали достоверные различия в концентрациях продуктов деградации ДА - ДОФУК и ГВК в опыте по сравнению с контролем как в индивидуальных пробах, так по усредненным значениям по всем четырем пробам. Однако наблюдалась ярко выраженная тенденция к увеличению концентрации ДОФУК в опыте по сравнению с контролем. В первой пробе межклеточная концентрация ДОФУК увеличивалась в 8,45 раза у экспериментальных животных по отношению к контрольным животным, но эта разница была недостоверной (t = 2,03; p = 0,07). Во второй, третьей и четвертой пробах концентрация ДОФУК увеличивалась в 8,56, 10,46 и 5,81 раза соответственно, но эти изменения так же были недостоверны по сравнению с контролем (t = 1,59; p = 0,14: t = 1,69; p = 0,12 и t = 2,14; p = 0,06 ) (Рис. 4, А).
 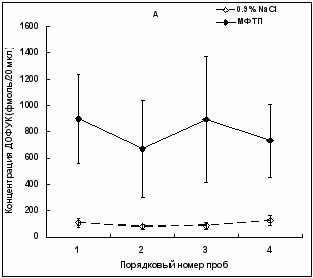 | Рис. 4. Межклеточная концентрация ДОФУК в стриатуме мышей, серия последовательных проб с 20-и минутным интервалом ( p > 0,05; подробное описание статистики в тексте). |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для оценки межклеточной концентрации ДА и метаболитов использовали микродиализ – единственный методический подход, который, по современным представлениям, дает возможность оценивать в мозге межклеточную концентрацию секретируемых веществ.
Одним из главных результатов исследований первой группы животных явилось то, что использованная нами микродиализная канюля и условия хроматографии позволили выявить соответствие поведенческих и биохимических изменений у мышей линии C57BL/6 в разные интервалы времени после введения однократной дозы (20 мг/кг) специализированного токсического агента МФТП, без каких-либо добавочных фармакологических воздействий, увеличивающих концентрацию межклеточного ДА в стриатуме. Сразу после введения МФТП происходило резкое нарушение поведения в форме ретропульсии – появление дрожащих отступательных реакций с редкими движениями вперед и заворотами в правую сторону – и существенное снижение уровня внеклеточного ДА и ГВК в стриатуме. Важно подчеркнуть, что тестирование до и после введения МФТП в 1-й день проводилось на одних и тех же мышах, поэтому для оценки и сравнения полученных результатов использовали иные статистические методы исследования, чем при сравнении результатов для разных групп животных на 7-й день и спустя 1 месяц. Через неделю после введения вещества поведение у МФТП – инъецированных мышей в «открытом поле» достоверно не отличалось по горизонтальной и вертикальной активности от такового у контрольных животных, а концентрация ДА и его метаболитов в стриатуме хотя и было чуть ниже, но без достоверной разницы, чем у контрольных животных. Наконец, через месяц 1 после введения МФТП у мышей наблюдались все признаки двигательных расстройств, характерных для нигро-стриатных повреждений и сопутствующие этим расстройствам значительные понижения внеклеточной концентрации дофамина и ГВК в стриатуме.
Полученные нами результаты позволяют сделать несколько предположений. Можно думать, что немедленное нарушение двигательного поведения и резкое уменьшение стриатного дофамина и ГВК в ответ на введение МФТП являются следствием влияния МФТП на синтез и метаболизм дофамина. Показано, что в течение первых 6 ч после введения МФТП (50 мг/кг, подкожно) синтез и метаболизм ДА существенно меняется [Pifl, Hornykiewicz, 2006]. В течение 1 ч после введения МФТП наблюдается уменьшение концентрации ДА, L-ДОФА, ДОФУК и увеличение концентрации 3-метокситирамина в ткани стриатума мышей. К 75-й минуте наблюдалось дальнейшее истощение ДА, дополнительное увеличение 3- метокситирамина и увеличение ГВК. Спустя 6 ч после введения МФТП концентрации ДА и всех его метаболитов были также понижены. В другой работе из этой же лаборатории [Pileblad, Carlsson, 1988] эффект такой же дозы МФТП исследовали через 2 ч и 7 сут. Через 7 сут, так же как через 2 ч наблюдали уменьшение концентрации ДА и ДОФУК и увеличение концентрации ГВК в ткани стриатума. Различия между нашими результатами и данными литературы могли быть вызваны двумя причинами. Во-первых, мы использовали значительно меньшую дозу МФТП (20 мг/кг, а не 50 мг/кг). Во-вторых, мы исследовали in vivo диализат из стриатума, а описанные выше данные литературы касаются измерения концентрации веществ в ткани мозга.
На 7-е сутки при однократной инъекции дозы МФТП 50 мг/кг [Pileblad et al., 1985] и даже дозы 30 мг/кг [Fornai et al., 2005] уже проявляется дегенерация нигро-стриатной ДА-ергической системы, возможно, поэтому концентрационные сдвиги в цитируемых работах настолько значительны. Доза 20 мг/кг, использованная нами, значительно меньше, и возможно, поэтому недостоверное уменьшение концентраций отражает только самое начало дегенерационного процесса. Этому соответствует и отсутствие изменений в двигательной активности.
Проявление нарушений поведения через несколько минут после введения МФТП, его нормализация через 7 суток и повторное нарушение поведения через 30 суток позволяют предположить, что повторное нарушение поведения, сопровождаемое уменьшением межклеточной концентрации ДА в стриатуме, связано с токсическим действием МФТП и с разрушением нигро-стриатной ДА-системы. Анализ результатов по межклеточной концентрации ДОФУК на 30-е сутки показывает, что к этому моменту времени метаболизм ДА через моноаминоксидазу-А резко нарушается, т. е. принимает нестабильный характер. У ряда животных межклеточная концентрация ДОФУК сильно варьирует, что выражается в проявлении высокой значимости различия дисперсий в сравниваемых группах при дисперсионном анализе (см. раздел Результаты исследований). Это можно объяснить, по-видимому, тем, что у разных животных нигро-стриатная ДА-ергическая система нарушена в разной степени. Разная степень нарушений отражается также и в поведении животных.
В литературе применяют разные тесты для оценки влияния МФТП на двигательную активность мышей, причем, как правило, токсический агент вводят не однократно, а в течение ряда дней и разными дозами [Donnan et al., 1987; Schwarting et al., 1999]. Например, В.А. Колотла и соавт. [Colotla et al., 1990] инъецировали мышам МФТП (в дозах 10, 20 и 30 мг/кг) в течение 3 дней подряд, а двигательную активность оценивали по пройденному мышами общему расстоянию за единицу времени в 3 последующих дня. Мыши, которые получали МФТП, проходили больший путь, чем контрольные животные, и длина этого пути находилась в зависимости от дозировки вводимого вещества. Сходные данные были получены в другой работе [Kordower et al., 1986], в которой также использовалось многократное (5 дней подряд, 30 мг/кг) введение МФТП, а проверка двигательной активности проводилась в 1-й, 3-й, 5-й и 7-й дни. В отличие от указанных данных многократное введение МФТП (10 дней по 30 мг/кг) не облегчало, а тормозило двигательную активность, оцениваемую с помощью плавания [Donnan et al., 1987]. Примечательно, что авторы тестировали ее через 30 мин, 24 ч и 7 дней после введения МФТП и в эти же сроки измеряли содержание дофамина в ткани стриатума. Несмотря на то что поведение мышей существенно страдало только в первые 30 мин после интоксикации, содержание стриатного дофамина у МФТП инъецированных мышей уменьшалось во всех случаях - на 13.9% через 30 мин, на 17.3% через 24 ч, и на 26.4% через 7 дней. Необходимо отметить, что в условиях, наиболее напоминающих нашу экспериментальную обстановку, И. Лерокс-Николлет и Дж. Констентин [Leroux-Nicollet, Costentin, 1986] наблюдали значительное торможение двигательной (горизонтальной и вертикальной) активности мышей в «открытом поле». Но в отличие от нас авторы исследовали двигательную активность мышей только в первые 8 ч после введения МФТП. В другой работе Р.К. Швартинг и соавт. [Schwarting et al., 1999] после многократных введений МФТП (15 и 20мг/кг по 4 раза) обнаружили существенное торможение горизонтальной и вертикальной двигательной активности в «открытом поле» через 2 часа после последней инъекции. Горизонтальная активность возвращалась к норме через 4 дня, а вертикальная, коррелирующая со степенью потери стриатного дофамина, оставалась в эти сроки ниже нормы.
Таким образом, приведенные данные свидетельствуют о том, что поведенческие и биохимические показатели активности мышей под воздействием МФТП находятся в зависимости от дозы токсического вещества, характера его введения, времени последующего тестирования этих показателей и ряда других, не обсуждаемых здесь переменных [Sedelis et al., 2000a; 2000b]. Практически во всех случаях мыши МФТП-группы отличаются от контрольных животных, но эти различия проявляют во времени разную динамику – от постоянного торможения всех реакций до их прогрессивного усиления или в виде смешанных возбудительно–тормозных реакций (когда на раннем отрезке времени происходит усиление двигательного поведения, а затем его торможение). В нашем исследовании была получена четкая ∩-образная зависимость – вначале торможение двигательной активности, затем возвращение ее к норме и потом снова торможение. Причем такая же динамика во времени наблюдалась для внеклеточной концентрации дофамина и ГВК в стриатуме.
Известно, что большие дозы или та же доза, что использовали мы, но применяемая многократно, часто приводит к летальности мышей [Schwarting et al., 1999; Jakowec et al., 2004] или к очень серьезной нервной дегенерации, которая находит отражение либо в чрезмерном возбуждении, либо в преобладании тормозных эффектов, в том числе на биохимическом уровне. Что особенно важно, нашей целью было не вызвать массированные нейродегенеративные изменения в нигро-стриатной системе и вне ее, а добиться плавного, медленно развивающегося процесса нейродегенерации на уровне этой системы для выявления критического момента с которого начинает проявляться поведенческая и биохимическая симптоматика заболевания. По нашим данным, этот момент находится где-то между 1-й и 4-й неделей после интоксикации, а до него заболевание протекает в виде латентной фазы.
Вторая часть нашей работы посвящена проверке гипотезы о том, что сохранение нормального моторного поведения у человека и животных при дегенерации значительного числа ДА-ергических нейронов в черной субстанции и соответствующей денервации стриатума возможно за счет включения механизмов пластичности мозга, направленных на поддержание нормального уровня ДА в межклеточной среде стриатума [Угрюмов, 2007б]. В качестве экспериментальной модели досимптомной стадии паркинсонизма использовали мышей через две недели после системного подкожного введения им малой дозы (12 мг/кг) МФТП, предшественника нейротоксина, который после поступления в мозг захватывается глиальными клетками и трансформируется в МФП+, специфический нейротоксин ДА-ергических нейронов [Wu et al., 2000]. В этом случае в стриатуме происходит дегенерация примерно половины ДА-ергических аксонов, что сопровождается уменьшением на 50% концентрации ДА в ткани. Напротив, в черной субстанции у этих животных отсутствуют изменения как числа ДА-ергических нейронов, так и содержания в них ДА [Хаиндрава и др., 2010].
Согласно полученным нами данным, концентрация ДА в межклеточной среде у мышей через две недели после введения МФТП в дозе 12 мг/кг была соизмерима с его концентрацией в ткани стриатума, т.е. в сохранившихся ДА-ергических аксонах [Хаиндрава и др., 2010], но в два раза ниже, чем в контроле. Это означает, что наша гипотеза о поддержании в стриатуме внеклеточной концентрации ДА на уровне нормы, несмотря на дегенерацию половины ДА-ергических аксонов, не подтвердилась. Отсюда следует, что отсутствие нарушений моторного поведения у этих животных обусловлено включением других компенсаторных механизмов.
Выводы
- Микродиализ, это единственный методический подход, который, по современным экспериментальным данным, дает возможность in vivo оценивать межклеточную концентрацию секретируемых веществ в мозге.
- После погружения микродиализной канюли в структуры мозга, через 40 минут, к 60 минуте, концентрации катехоламинов в диализате выходят на устойчивый базовый уровень. Это отражает реальные соотношения межклеточных концентраций эндогенных веществ.
- Использованная нами микродиализная канюля и условия хроматографии позволили выявить соответствие поведенческих и биохимических изменений у мышей линии C57BL/6 в разные интервалы времени после введения однократной дозы (20 мг/кг) специализированного токсического агента МФТП, без каких-либо добавочных фармакологических воздействий, увеличивающих концентрацию межклеточного ДА в стриатуме.
- Сразу после введения МФТП происходило резкое нарушение поведения и существенное снижение уровня внеклеточного ДА и ГВК в стриатуме. Этот эффект можно объяснить токсическим действием МФТП, который нарушает синтез и метаболизм ДА на фоне не деградированных нигростриатных ДА терминалнй.
- Через 7 суток после внутрибрюшинной инъекции МФТП (20 мг/кг), наблюдается недостоверное уменьшение концентраций ДА и его метаболитов ДОФУК и ГВК. Этому соответствует и отсутствие изменений в двигательной активности.
- Повторное нарушение поведения через 30 суток после введения МФТП, сопровождаемое уменьшением межклеточной концентрации ДА в стриатуме, указывают на то, что наблюдаемые нарушения связаны с токсическим действием МФТП и с разрушением нигро-стриатной ДА-системы.
- Анализ вариации результатов по межклеточной концентрации ДОФУК на 30-е сутки после введения МФТП показывает, что к этому времени метаболизм ДА через МАО-А резко нарушается, т. е. принимает нестабильный характер.
- Поведенческие и биохимические показатели активности мышей под воздействием введения МФТП находятся в зависимости от дозы токсического вещества, характера его введения (однократно или многократно) и времени последующего тестирования этих показателей.
- Однократное подкожное введение малой дозы (12 мг/кг) МФТП через 14 суток формирует экспериментальную модель досимптомной стадии паркинсонизма, сопровождаемое резким уменьшением межклеточной концентрации ДА в стриатуме и отсутствием нарушения поведения.
- На этой модели паркинсонизма также проявляются высокие вариации результатов по межклеточной концентрации ДОФУК указывающее на нарушение метаболизм ДА через МАО-А.
- Отсутствие нарушений поведения в модели досимптомной стадии паркинсонизма обусловлены компенсаторными механизмами, которые очень важно и удобно исследовать на данной модели паркинсонизма.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Н.В. Щеголевский Асимметрия содержания дофамина в прилежащем ядре и моторное предпочтение у крыс / С.Ю. Будилин, И.С. Мидзяновская, Н.В. Щеголевский, М.Е. Иоффе, А.С. Базян // Журнал Высшей Нервной Деятельности им. И.П. Павлова. – 2007. - том 57, № 5. – с.598-603. 0,27 п.л. (доля авторского участия 60%).
2. Н.В. Щеголевский Исследование межклеточной концентрации дофамина и его метаболитов в стриатуме мышей методом микродиализ при внутрибрюшинном введении МРТР / Р.Г. Аверкин, В.А. Коршунов, Н.В. Щеголевский, В.Н. Мац, В.А. Маркевич, Г.А. Григорьян, А.С. Базян // Журнал Высшей Нервной Деятельности им. И.П. Павлова. – 2010. - том 60, № 1, с. 109–119. 0,45 п.л. (доля авторского участия 65%).
3. Н. В. Щеголевский Моделирование досимптомной стадии паркинсонизма у мышей – анализ выделения дофамина в стриатуме / Ю. С. Украинцева, Н.В. Щеголевский, В. А. Коршунов, В. Г. Кучеряну, М. В. Угрюмов, А. С. Базян // Нейрохимия. – 2010. - том 27, № 2, с. 1–6. 0,27 п.л. (доля авторского участия 70%).
4. Н.В. Щеголевский, А.С. Базян, Ю.С. Украинцева, В.А. Коршунов, Н.В. Щеголевский, А.А. Фоломкина, В.Н. Мац, Г.А. Григорьян МРТР модель бессимптомной фазы болезни Паркинсона у мышей линии C57BL/6: микродиализ дофамина и его метаболитов из стриатума мышей, анализ возможных компенсаторных процессов // Фундаментальные науки – медицине. Тезисы докладов на конференциях и семинарах по научным направлением Программы в 2008 году. М.: Фирма «Слово». - 2008. - с.8-9. 0,1 п.л. (доля авторского участия не разделяется).
5. Н.В. Щеголевский Моделирование досимптомной стадии паркинсонизма у мышей – анализ выделения дофамина в стриатуме методом микродиализа / А.С. Базян, Ю.С. Украинцева, Н.В. Щеголевский, В.Н. Мац, Г.А. Григорьян // Фундаментальные науки – медицине. Тезисы докладов на конференциях и семинарах по научным направлением Программы в 2009 году. М.: Фирма «Слово». - 2009. -с.171. 0,1 п.л. (доля авторского участия не разделяется).
6. Н.В. Щеголевский Модель ранней функциональной недостаточности нигро-стриатной дофаминергической системы у мышей, исследование методом микродиализа // Труды научной конференции, посвященной 85-летию кафедры органической и биологической химии и 90-летию со дня рождения профессора МПГУ Юрия Борисовича Филипповича. – М.: МПГУ. - 2009. - с.79-80. 0,1 п.л. (доля авторского участия не разделяется).
7. Н.В. Щеголевский Динамика развития паркинсонизма на нейротоксической модели у мышей линии C57BL/6 // Научная конференция «Интеграция научных исследований в рамках реализации приоритетных направлений науки», 22 декабря, МПГУ. Тезисы докладов.-М.: МПГУ. - 2010.- С.21. 0,12 п.л. (доля авторского участия не разделяется).
СПИСОК СОКРАЩЕНИЙ
БП – болезнь Паркинсона
6-OHDA – 6-гидооксидофамин
МФТП – 1-метил-4-фенил-1,2,3,6-тетрагидропиридин
ДА – дофамин
L-ДОФА – L-диоксифенилаланин
ДОФУК – 3,4-диоксифенилуксусная кислота
ГВК – гомованилиновая кислота
MAO-B – моноаминоксидаза-B
ГАМК – гамма-аминомасляная кислота
