Е. А. Flora of the Siberia is the source of biologically active preparations and drugs Krasnov Ye. A. Сибирский государственный медицинский университет, г. Томск Краснов Е. А
| Вид материала | Документы |
СодержаниеCentaurea scabiosa |
- Томск, 11-14 октября 2006 г. Томск Сибирский государственный медицинский университет, 21461.95kb.
- Клиническая секция Устные доклады, 121.8kb.
- Г. Томск, Московский тракт, 2 e-mail: fpk@ssmu net, 912.48kb.
- Сибирский государственный медицинский университет, г. Томск 2 ООО «Биолит», г. Томск, 44.77kb.
- Сибирский государственный медицинский университет, г. Томск Полуэктова Т. В., Коломиец, 93.3kb.
- Ии в медицинских библиотеках труды научно-практической конференции г. Томск, 20-23, 632.51kb.
- Н. А. Корнетов Сибирский государственный медицинский университет, г. Томск, 390.07kb.
- Методические рекомендации для студентов, интернов, ординаторов и врачей Томск-2008, 3401.18kb.
- «Сибирский государственный медицинский университет Федерального агентства по здравоохранению, 927.55kb.
- Сибирский государственный медицинский университет, г. Томск Лившиц И. К., Белобородова, 73.14kb.
Флора Сибири — источник биологически активных веществ
и лекарственных средств*
Краснов Е.А.
Flora of the Siberia is the source of biologically active preparations
and drugs
Krasnov Ye.A.
Сибирский государственный медицинский университет, г. Томск
Краснов Е.А.
УДК 615 (571):615.322:581.19
Сибирский государственный медицинский университет (СибГМУ) (г. Томск) является признанным научным центром, в котором уже около 70 лет успешно проводятся систематические исследования по созданию и внедрению в медицинскую практику новых лекарственных средств (ЛС) природного и синтетического происхождения. Инициатором этого научного направления был крупный российский ученый, основоположник сибирской школы фармакологов академик АМН СССР Н.В. Вершинин, а в дальнейшем направление развил его талантливый ученик, один из ведущих отечественных фармакологов, заслуженный деятель науки РФ профессор А.С. Саратиков.
Успешная разработка новых ЛС на современном уровне является весьма сложной задачей, реализация которой возможна лишь в результате проведения широких комплексных исследований с участием специалистов различного профиля. Указанный принцип реализован в СибГМУ, где имеются возможности для выполнения всех этапов, необходимых для создания и внедрения оригинальных препаратов, при этом фундаментальные исследования сочетаются с разработкой патенто- и конкурентоспособных ЛС. Помимо внутривузовского комплексирования широко используются творческие договоры с НИИ Томска, Новосибирска, Москвы, Уфы, Тюмени, Иркутска, Караганды.
Основное внимание уделяется разработке фитопрепаратов, преимущества которых перед синтетическими общеизвестны.
* Основой cтатьи являются материалы доклада на IV Всероссийской научной конференции «Химия и технология растительных веществ» (Сыктывкар, 26—30 июня 2006 г.) [12].
Не случаен тот факт, что 80% населения мира используют лекарства, полученные на основе растений. Лекарственное значение многих из них известно тысячелетиями, и растения успешно применяются в традиционной медицине. Даже в странах Запада, где основное внимание уделяется синтетическим препаратам, свыше 25% лекарственных средств получают на основе растительного сырья [38]. В этом отношении флора Сибири является неисчерпаемым источником ЛС. На тернистом пути создания фитопрепаратов возникает несколько проблем. Одна из них состоит в выборе перспективных объектов и решается на основе комплексного подхода, включающего анализ данных народной медицины, результаты фармакологического и химического скрининга.
Исходя из указанного подхода, отобран ряд видов флоры РФ, обладающих психостимулирующим, адаптогенным, противосудорожным, противопаразитарным, ноотропным, гипогликемическим и противовоспалительным действием.
Другой сложной проблемой на пути создания растительных ЛС является выделение действующих веществ, поскольку природные объекты представляют собой сложные многокомпонентные системы, зачастую трудно поддающиеся разделению. Однако изолирование и установление строения или идентификация соединений, обусловливающих специфическую активность фитопрепаратов, помимо важного научного значения имеет еще прикладной характер,
так как это необходимо для последующей стандартизации ЛС.
Кроме того, изучение механизма действия выделенных из растений биологически активных веществ (БАВ) и установление корреляции «структура — биологическая активность», так называемый лекарственный дизайн, важны для направленного синтеза более активных препаратов. С целью придания известным соединениям новых фармакологических свойств в последнее десятилетие используют компьютерную программу PASS, с помощью которой можно учитывать структурные модификации, ответственные за возникновение нового механизма действия. Указанный подход позволяет значительно ускорить получение целевого продукта [39].
На основе подземных частей видов рода родиола (Rhodiola) и рапонтикума сафлоровидного (Rhaponticum carthamoides (Willd.) Iljin) были разработаны ЛС психостимулирующего действия, внедренные в медицинскую практику [26]. Глубокое изучение химического состава указанных растений позволило впервые установить молекулярные носители лечебного эффекта: фенолоспирты и их гликозиды (n-тирозол, салидрозид) в препаратах родиолы и экдистероиды (экдистерон, инокостерон) — у рапонтикума (рис. 1 и 2). В дальнейшем профессорами В.А. Куркиным и Г.Г. Запесочной выявлено, что к числу основных действующих веществ родиолы розовой помимо указанных фенолоспиртов относятся также циннамилгликозиды (в основном розин и розавин) [27].
Экстракт родиолы и его фенольные компоненты обнаружили значительную антиоксидантную активность в сочетании с противоопухолевым и антиметастатическим действием [5, 11, 36, 41]. Особое значение имеет n-тирозол, синтез которого осуществлен в Новосибирском институте органической химии РАН (г. Новосибирск). На основе порошка п-тирозола получены «таблетки тирозола», разработаны нормативные документы (НД) на субстанцию и лекарственную форму в качестве адаптогенного и антистрессорного препарата для повышения неспецифической устойчивости организма, коррекции дезадапционных нарушений здоровья. Перспективными являются экстракт родиолы и п-тирозол для использования в онкологии в качестве средств, повышающих противоопухолевую резистентность. Они ослабляют токсический эффект цитостатиков, усиливают их противоопухолевое и противометастатическое действие, обладают иммуномодулирующим влиянием у онкологических больных [26].
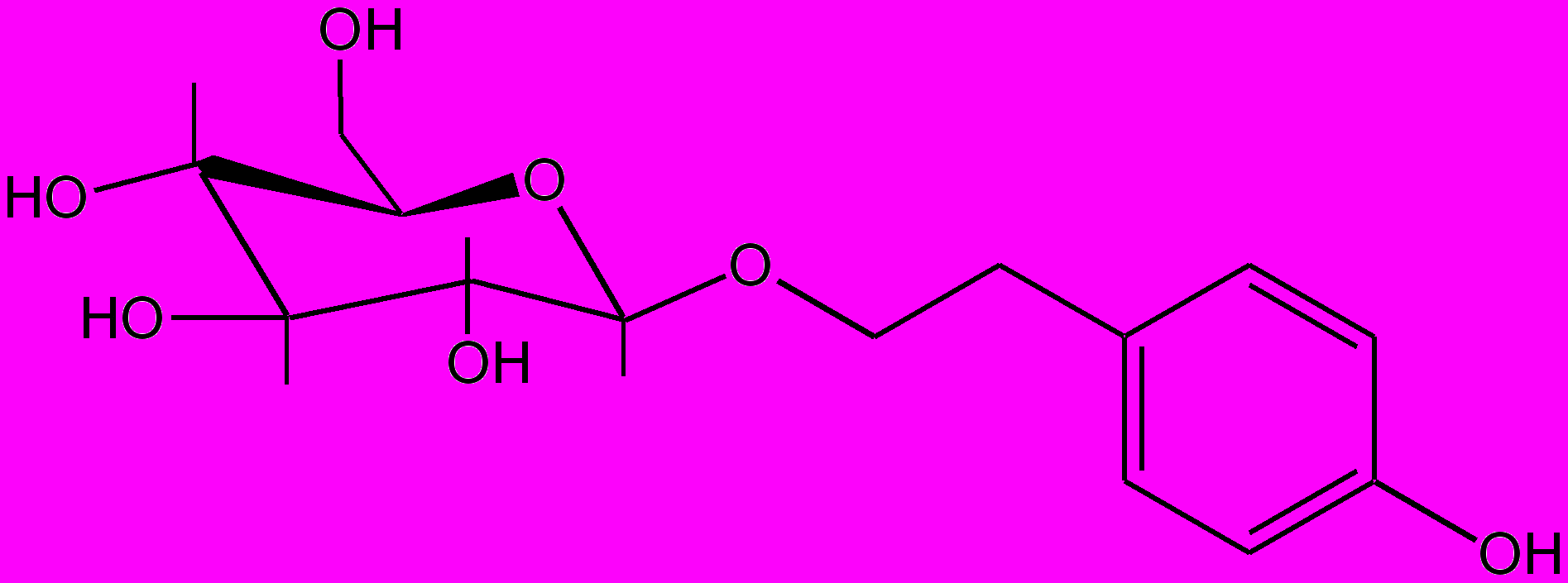
Салидрозид

n-Тирозол
Розин
Розавин
Рис. 1. Действующие вещества родиолы розовой
В последние годы в НИИ фармакологии ТНЦ СО РАМН осуществлены глубокие фармакологические исследования ампульного раствора тирозола, в результате которых рекомендовано его применение в медицинской практике при осложненных формах ишемической болезни сердца и мозга. При этом установлено, что п-тирозол обладает широким спектром фармакологической активности, в том числе антитромбоцитарными и гемореологическими свойствами [24, 25].
О важности и актуальности исследований родиолы свидетельствует тот факт, что один из семинаров международного съезда, проходившего в июне 2004 г. в Финляндии, был полностью посвящен различным аспектам изучения родиолы розовой [22]. Современные достижения в изучении этого ценного растения были обобщены в монографии, вышедшей в 2004 г. [27].
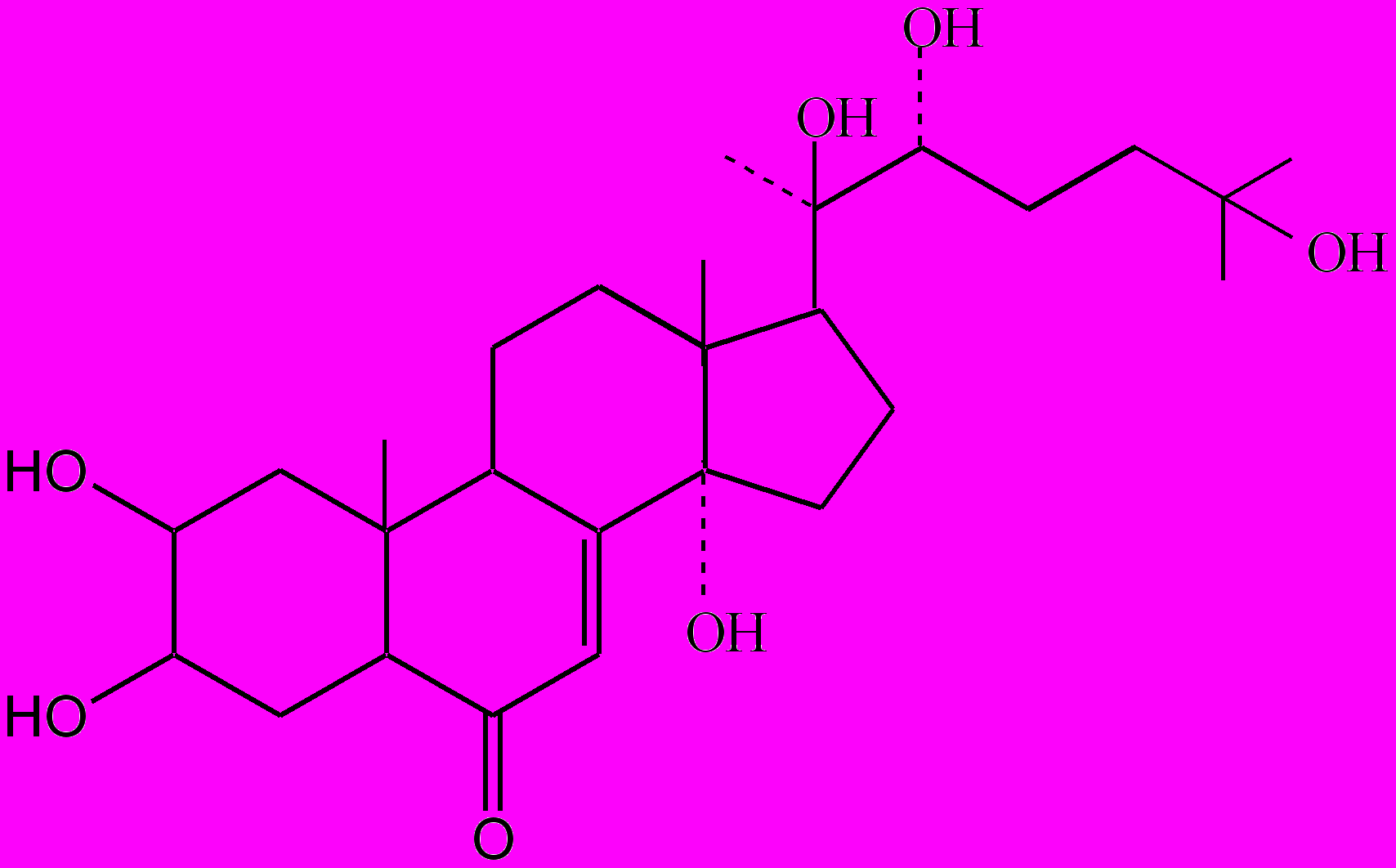
Экдистерон
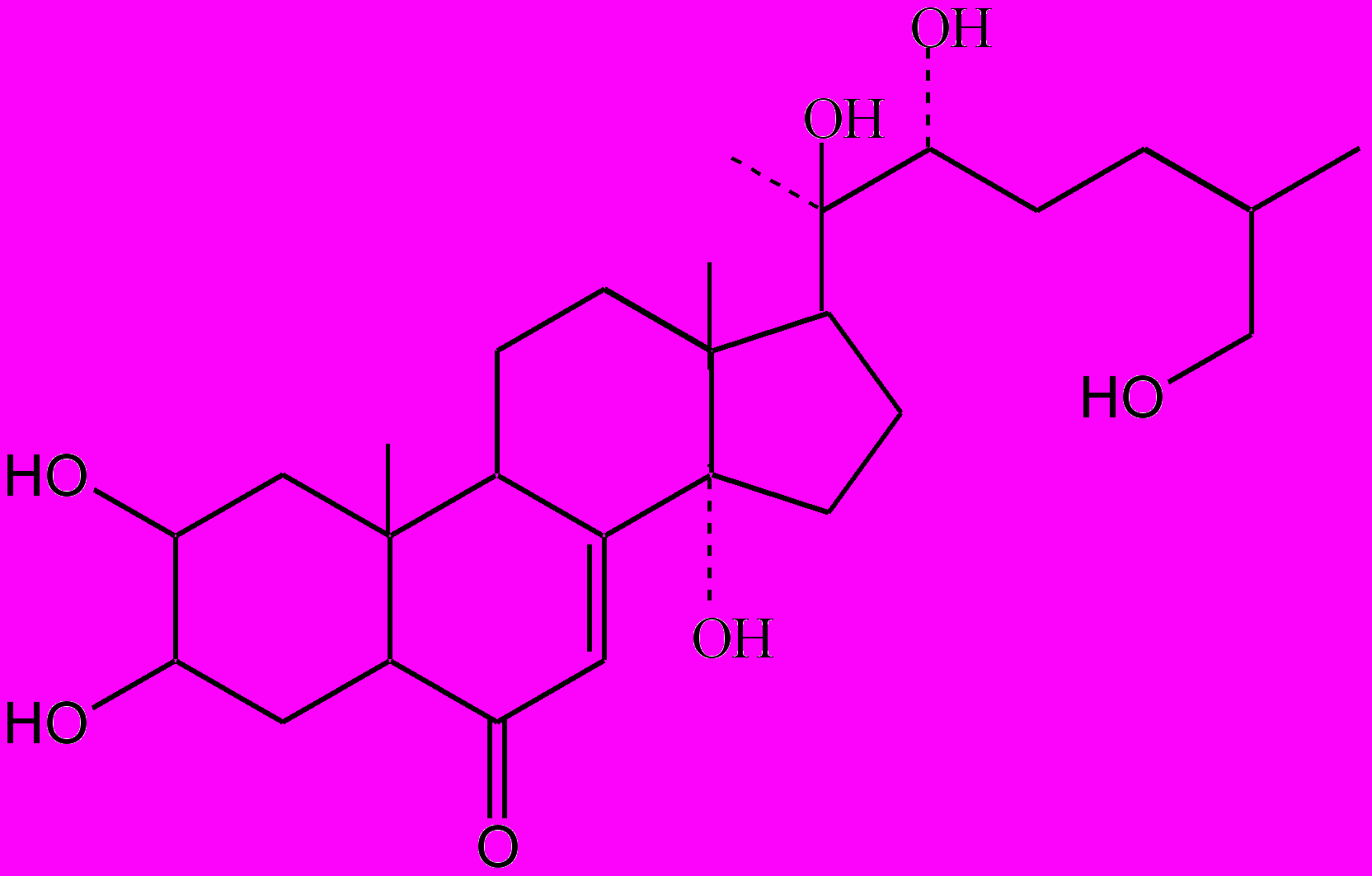
Инокостерон
Рис. 2. Основные экдистероиды рапонтикума сафлоровидного
Традиционным объектом исследований является рапонтик сафлоровидный (маралий корень), препараты из которого обладают адаптогенным, анаболическим, противосклеротическим действием. Действующими веществами лекарственного растения и препаратов в основном являются экдистерон и инокостерон [18, 19]. Рапонтик является одним из важнейших представителей экдистероидсодержащих растений, используемых для получения однородных фитоэкдистероидов, а также различных препаратов (например, экдистен) и БАД [31].
Экдистероиды принадлежат к группе полигидроксилированных стеринов, обладающих структурой, подобной гормону линьки и метаморфоза у членистоногих. К настоящему времени идентифицировано более 150 различных структур фитоэкдистероидов из свыше 1 тыс. теоретически возможных [17, 32]. Они обладают разнообразными биологическими функциями. В современных наукоемких технологиях экдистероиды находят применение в качестве естественных и безопасных лигандов в молекулярных системах переключения генов (экдизониндуцированные системы экспрессии генов), в разработке селективных и экологически чистых инсектицидов [37, 40].
В результате последних исследований, выполненных совместно с Томским НИИ фармакологии (проф. М.Б. Плотников), на основе рапонтикума сафлоровидного разработана технология получения нового запатентованного гемореологического ЛС для коррекции синдрома повышенной вязкости крови при артериальной гипертензии и инфаркте миокарда [24, 25].
В реализации указанного действия ведущую роль, по-видимому, играют фитоэкдистероиды.
Важным направлением исследований томских ученых является разработка противосудорожных ЛС.
С помощью оригинального методического подхода удалось существенно повысить возможность обнаружения противосудорожной активности у растительных экстрактов и показана перспективность исследования водяники и чертополоха. В результате фундаментальных химико-фармакологических исследований побегов водяники [6, 7, 28] и травы чертополоха курчавого [29, 30] впервые разработаны и запатентованы оригинальные противоэпилептические препараты «Эмпетрин» и «Кариспин» [16, 17]. С помощью современного набора выделительной техники (колоночная, обращенно-фазовая ВЭЖХ, комплексообразование) из экстрактов водяники получены макроциклические алканы состава С22Н44 — С32Н64 и ретрохалконы эмпетрон и метилэмпетрон, впервые выделенные из растений [6, 7]. Установлен химический состав липофильных фракций, обладающих высокой противосудорожной активностью. Оба ЛС резко отличаются по своему химическому составу: если в эмпетрине противосудорожное действие обусловлено липофильными соединениями со спиртовыми группами [9], то антиконвульсивная активность кариспина связана преимущественно с иридоидами, имеющими гидрофильный характер: гарпагидом и 8-О-ацетилгарпагидом. Об этом свидетельствует установленный факт низкой активности близкого вида — чертополоха поникшего, отличающегося незначительным содержанием иридоидов [29].
При изучении спектра противосудорожной активности указанных препаратов установлено, что они оказывают антиконвульсивное действие на моделях коразоловых, камфорных, ареколиновых судорог, максимального электрошока и неактивны на модели тиосемикарбазидных судорог [34]. В то же время указанные ЛС несколько отличаются по спектру действия: эмпетрин активен в отношении стрихниновых и никотиновых судорог, а кариспин дает отрицательный результат.
В ходе исследований разработаны и запатентованы оптимальные способы получения противоэпилептических фитопрепаратов из надземных частей водяники и чертополоха курчавого и созданы проекты ФСП на новое лекарственное сырье и лекформы. Помимо противосудорожного действия выявлены и другие фармакологические эффекты экстракта водяники. Он может использоваться в качестве церебропротектора, для лечения атопического дерматита. Данные средства были запатентованы [14, 33], и работы в этом направлении продолжаются с применением других растений в составе полиэкстракта.
Актуальной проблемой в медицине являются паразитарные заболевания — описторхоз и лямблиоз. Широкое их распространение, поражение гепатобилиарной, панкреатической, сердечно-сосудистой и других систем в сочетании с широким кругом побочных действий и противопоказаний к назначению синтетических ЛС диктуют необходимость создания фитопрепаратов. На основе коры осины и растений рода Saussurea были предложены эффективные противоописторхозные и противолямблиозные средства попутрил и саусифол в виде нескольких лекарственных форм — жидких экстрактов, таблеток и капсул, сочетающие высокую специфическую активность с низкой токсичностью. При исследовании in vitro жидких экстрактов на 70%-м этаноле установлено, что соссюрея иволистная является наиболее перспективным источником противопаразитарного средства, в то время как соссюрея солончаковая обнаружила значительно более низкую активность, а соссюрея горькая отличается от соссюреи иволистной выраженной токсичностью [23].
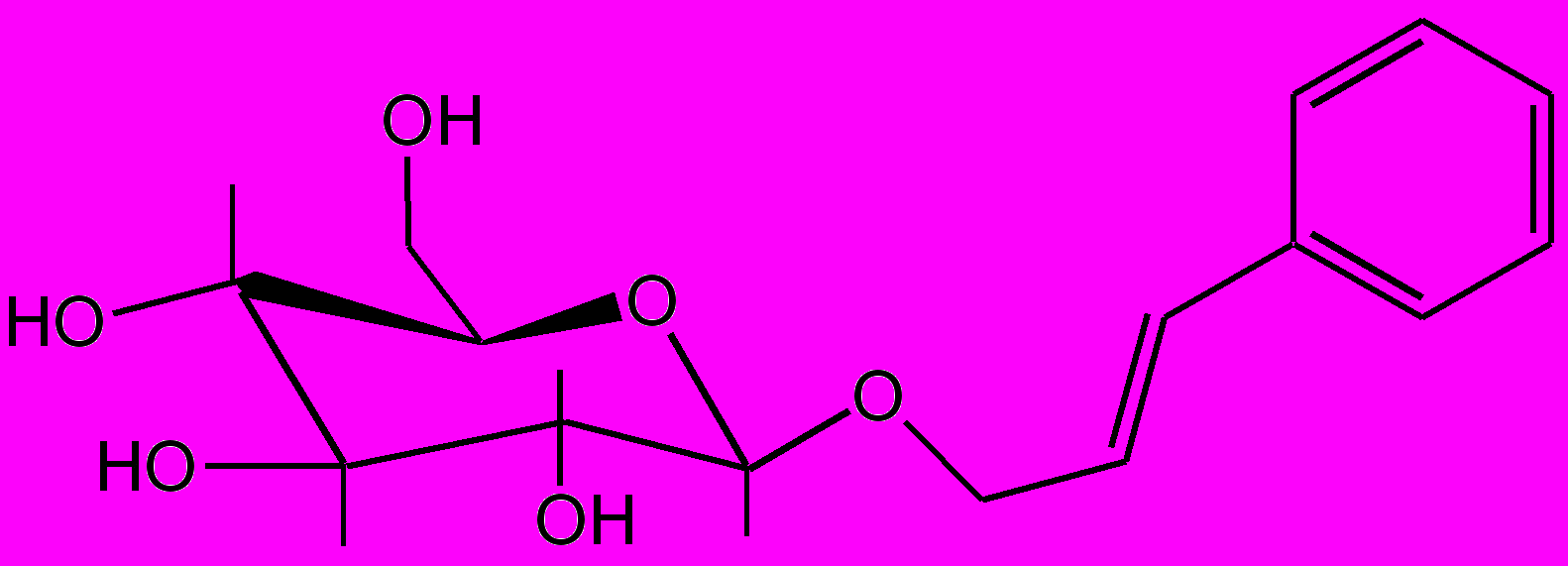
Указанные выше ЛС не проявляют аллергизирующих и иммунотоксических свойств, а саусифол, напротив, в эксперименте обнаружил иммуностимулирующее действие. Активность попутрила, по данным исследования, обусловлена гликозидами салицилового спирта: салицином, тремулоидином, саликортином, салирепозидом и др. (рис. 3). Это было доказано путем синтеза гликозидов по методу Кенигса—Кнорра с установлением их противоописторхозной активности в опытах на золотистых хомячках, искусственно зараженных метацеркариями описторхов. С целью получения широкого ряда гликозидов, производных салицилового спирта, были разработаны методы химической трансформации путем восстановления и гидролиза функциональных групп, входящих в агликоновый фрагмент.
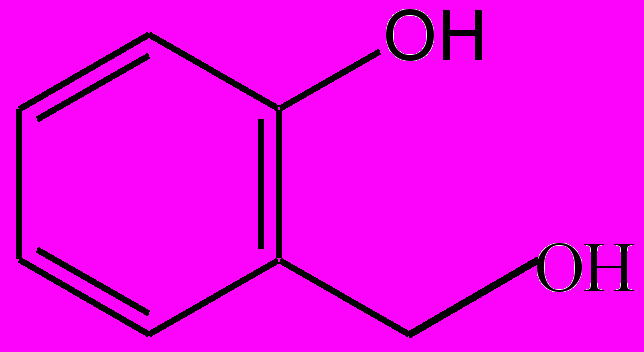

Салициловый спирт Салицин

Салирепозид
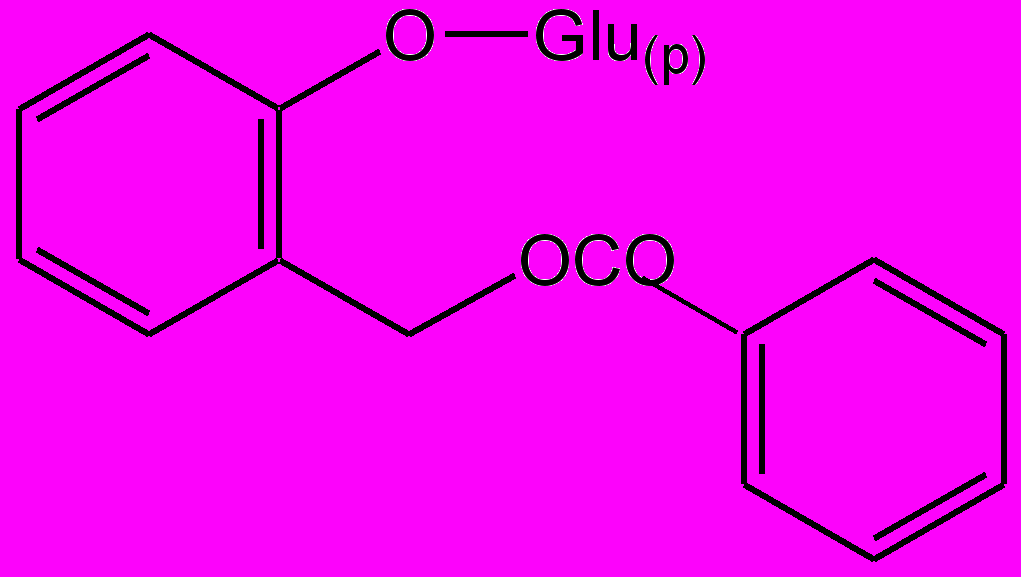
Тремулоидин
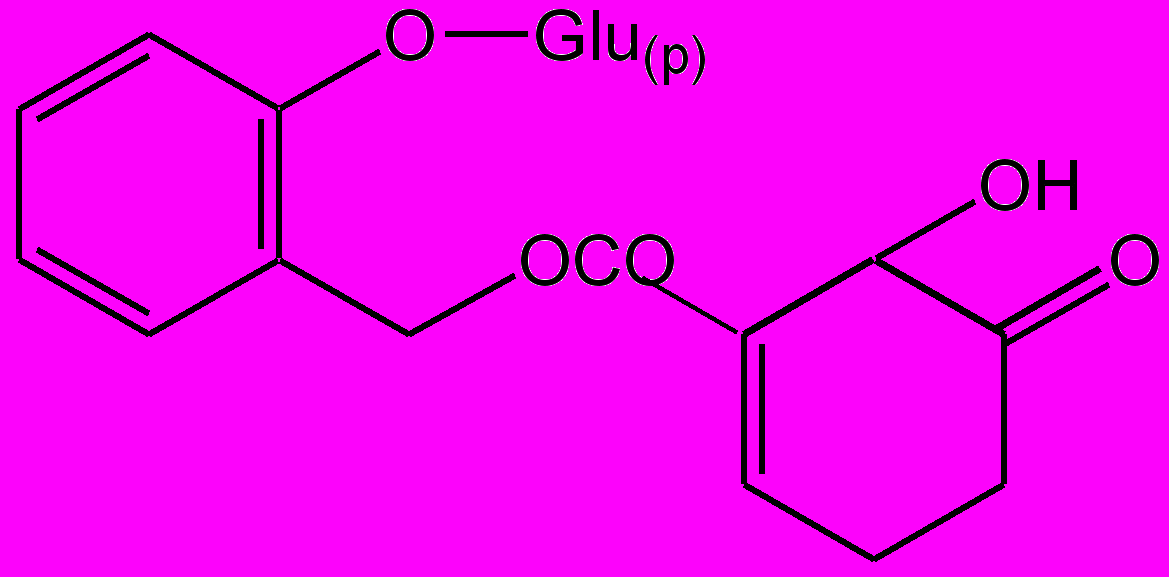
Саликортин
Рис. 3. Биологически активные вещества противоописторхозного препарата попутрила
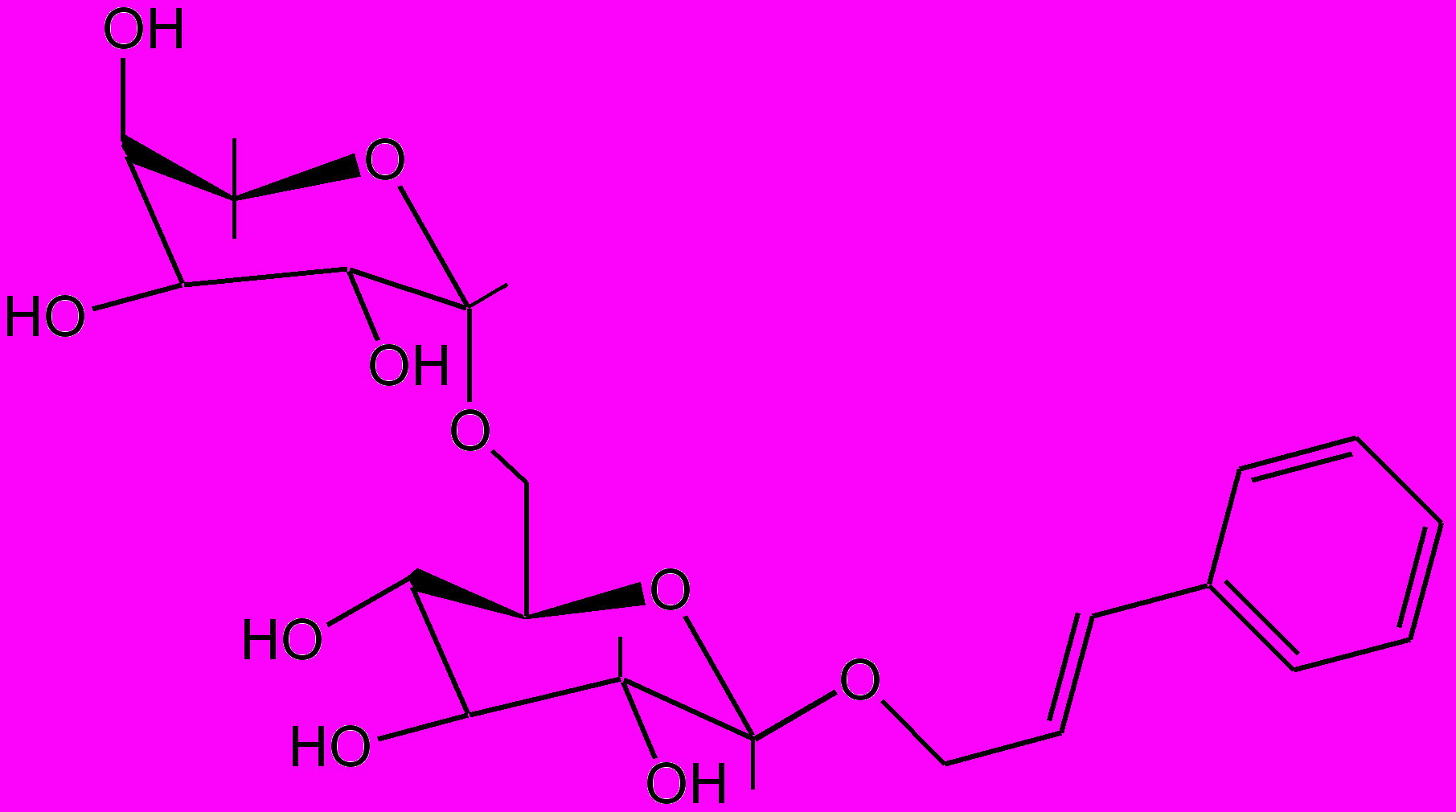
Действующими веществами противолямблиозного препарата саусифола являются сесквитерпеновые лактоны гвайянового типа: репин, янерин, цинаропикрин (рис. 4). Первые два вещества по строению очень близки между собой и отличаются лишь фрагментом боковой цепи. Исследование суммы сесквитерпеновых лактонов методом ВЭЖХ с использованием стандартных образцов показало, что янерин является одним из основных лактонов, содержащихся в растении и препарате, поэтому сумму лактонов пересчитывали на указанное соединение. На сырье и лекформы разработаны проекты нормативных документов.
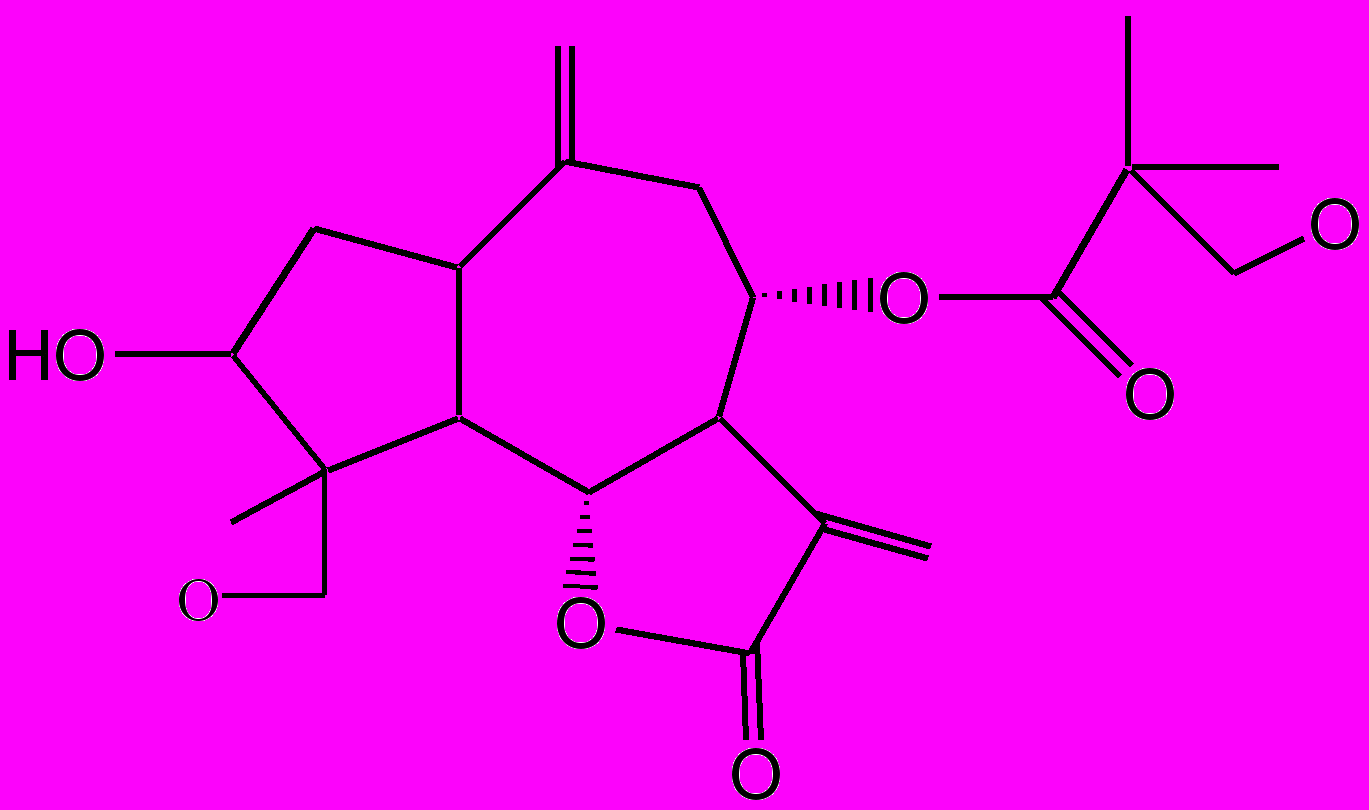
Репин

Янерин
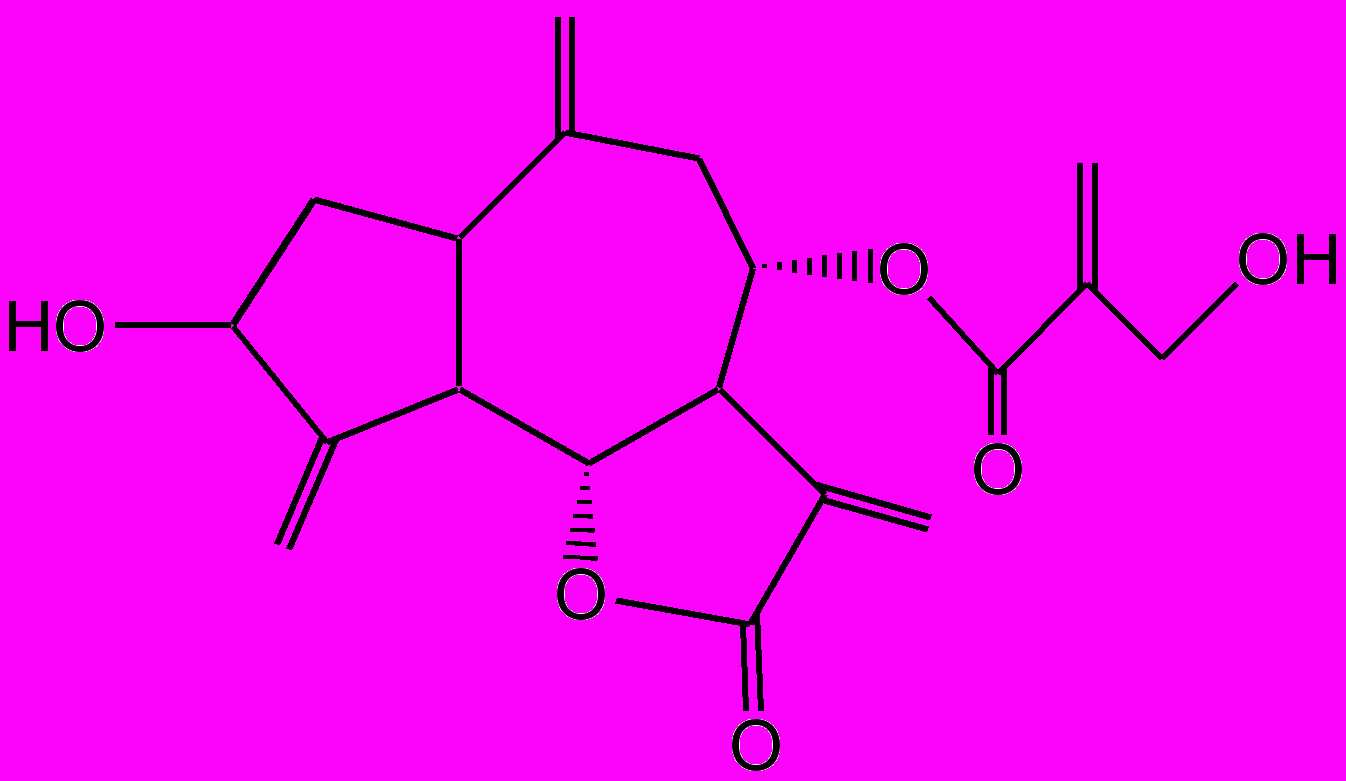
Цинаропикрин
Рис. 4. Сесквитерпеновые лактоны соссюреи иволистной
и лекарственного средства саусифола
Близким к соссюрее в таксономическом отношении является василек шероховатый ( Centaurea scabiosa L.), применяемый в народной медицине как противовоспалительное, диуретическое средство, а также при
малярии, асците и представляющий значительный интерес для химико-фармакологических исследований. Установлена противосудорожная, антиоксидантная и антигипоксическая активность экстрактов данного растения. В ходе химических исследований идентифицирован ряд флавоноидов (апигенин, байкалеин, кверцетин, рутин), фенолкарбоновых кислот (кофейная, хлорогеновая, феруловая, п-кумаровая) и полисахаридов. Весьма важен факт выделения из растения сесквитерпенового лактона гроссгемина (рис. 5), идентифицированного на основании спектральных данных и впервые обнаруженного в растениях рода Centaurea, что наряду с выявлением цинаропикрина сближает данное растение с соссюреей.

Рис. 5. Гроссгемин
В современной медицине наибольшее значение приобретают фитопрепараты для лечения заболеваний, связанных с нарушением детоксицирующей функции печени и всех видов обмена веществ, в первую очередь, углеводного. По данным ВОЗ, во всех странах мира в 2004 г. насчитывалось 200 млн больных сахарным диабетом (СД), и их количество ежегодно возрастает, при этом у 80—90% пациентов будет иметь место СД 2 типа. В связи с этим увеличивается потребность в лекарственных средствах, способных эффективно корректировать данное заболевание [1].
В этом направлении, исходя из данных народной медицины, внимание привлек ряд растений семейств Asteraceae и Urticaceae, имеющих широкую сырьевую базу. Установлено наличие основных групп БАВ исследуемых экстрактов и разработана патентоспособная технология получения водных и водно-этанольных сухих полиэкстрактов предложенного авторами гипогликемического сбора. Оценку гипогликемической активности проводили с использованием теста толерантности к глюкозе у интактных животных (половозрелые крысы), а также моделей адреналиновой гипергликемии и аллоксанового диабета.
Наибольшую активность проявили водный и водно-этанольный экстракты, снизив уровень глюкозы на 48,11—53,6%, что в 4—5 раз превышает действие препарата сравнения арфазетина (10,03—12,05%).
Проведенные испытания на фоне экспериментального гепатита у животных подтвердили наличие предполагаемого вида активности у исследуемых объектов.
В последние годы вызывает интерес поиск эффективных ноотропных средств на основе растительного сырья, имеющих важное значение в профилактике и лечении многих тяжелых заболеваний (ИБС, инсульты и др.) и патологии нейрогенного характера. В этом отношении значительные перспективы имеет ряд растений, среди которых следует особенно отметить лабазник вязолистный и княжик сибирский.
В надземной части лабазника выявлен значительный набор флавоноидов (кверцетин, дигидрокверцетин, изокверцитрин, авикулярин, кемпферол, апигенин и новый гликозид кверцетина) и фенолкарбоновых кислот (п-гидроксибензойная, салициловая, гентизиновая, галловая, кофейная, феруловая и хлорогеновая кислота) [15]. Полученные данные послужили основанием предполагать наличие высокой антиоксидантной активности, что нашло подтверждение в эксперименте.
В ходе систематического исследования химического состава княжика выявлен богатый набор БАВ, включающий фенольные компоненты, притерпеновые гликозиды, алкалоиды дитерпенового ряда, каротиноиды, полисахариды и др.
В результате фармакологического изучения установлено выраженное антистрессорное и транквилизирующее действие экстрактов княжика, улучшение условно-рефлекторной деятельности животных после перенесения гипоксической травмы и в условиях ишемии головного мозга. Выделенные фракции проявили значительный ноотропный эффект, превосходящий по ряду показателей стандартный препарат пирацетам (рис. 6). Полученные данные свидетельствуют о том, что фенолоспирты (3,4-дигидроксифенилэтанол-2 или о-гидрокситирозол и его глюкозид), изолированные из надземной части княжика, обусловливают его ноотропный эффект (рис. 7).
Указанное обстоятельство представляет большой интерес, так как фенолоспирты княжика по структуре близки к действующим веществам родиолы розовой — п-тирозолу и салидрозиду, что позволило высказать предположение о возможности проявления ноотропной активности препаратами родиолы, что было подтверждено в эксперименте.
Разработанные технологии получения экстрактов и фармацевтических составов, обладающих ноотропной и противоишемической активностью, защищены патентами РФ [13, 20].



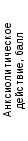
Рис. 6. Сравнительная фармакологическая активность экстракта княжика сибирского и его бутанольной фракции: ИК — интактный контроль; ГК — гипоксический контроль; ЭК — суммарный экстракт княжика; БФ — бутанольная фракция

3,4-Дигидроксифенилэтанол-2
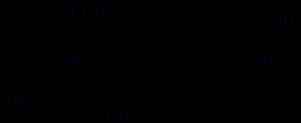
2-(3,4-Дигидроксифенил)-этил-O--D-глюкопиранозид
Рис. 7. Биологически активные вещества княжика сибирского
По результатам исследований составлен проект фармакологического стандарта на новое лекарственное растительное сырье «Трава княжика сибирского» и отработан ряд вопросов стандартизации сырья и лекарственных форм (экстракты, таблетки).
Важным направлением является разработка методик стандартизации ЛС. В частности, значительно усовершенствован действующий НД на настойку календулы введением важнейших параметров, характеризующих качество препарата, — подлинность и количественное содержание БАВ (флавоноиды, сапонины, каротиноиды). Установлена нецелесообразность использования 70%-го спирта в качестве экстрагента и предложен способ получения значительно более эффективного препарата.
Опыт показывает, что, учитывая сложность, многостадийность и значительные финансовые затраты на создание новых ЛС, возрастает необходимость комплексирования и объединения усилий специалистов различного профиля (фитохимиков, фармакологов, токсикологов, фармакогностов, ботаников, технологов, ресурсоведов, специалистов по стандартизации) уже на ранних этапах разработки эффективных и безопасных ЛС.
Литература
- Амосова Е.Н., Зуева Е.П., Турецкова В.П. и др. Противоязвенная активность флавоноидов и фенологликозидов, выделенных из коры осины // Бюл. эксперим. биологии и медицины. 2000. Т. 129. С. 28─30.
- Балоболкин М.И. Фармэкономика сахарного диабета // Фарматека. 2003. Т. 79. № 16. С. 13─16.
- Бронштейн А.М. Паразитарные болезни: протозоозы и гельминтозы. М.: BINOM, 2002. 302 с.
- Бужак О.Н. Терапевтическая эффективность различных форм экстракта коры осины при лечении больных хроническим описторхозом: Автореф. дис. ... канд. мед. наук. Томск, 2001.
- Дементьева Л.А., Яременко К.В. Изучение влияния экстракта золотого корня на рост опухоли в эксперименте // Бюл. СО АМН СССР. 1983. № 6. С. 77─79.
- Ермилова Е.В. Химическое изучение растений рода Empetrum и возможности использования их в медицине: Дис. ... д-ра фарм. наук. Пермь, 2002. 373 с.
- Ермилова Е.В., Кадырова Т.В., Краснов Е.А. Разделение липофильных кислородсодержащих соединений водяники комплексообразованием с TiCl4 // Хим.-фарм. журн. 2001. Т. 35. № 7. С. 39─41.
- Ермилова Е.В., Кадырова Т.В., Краснов Е.А., Ильюшенко С.В. Технология получения густого экстракта водяники черной, его антиокислительная и антигипоксическая активность // Хим.-фарм. журн. 2002. Т. 36. № 11. С. 36─37.
- Ермилова Е.В., Краснов Е.А., Кадырова Т.В. и др. Спектрофотометрическое определение спиртов в препарате «Эмпетрин» // Хим.-фарм. журн. 1997. Т. 31. № 10. С. 52─54.
- Кадырова Т.В. Исследование биологически активных веществ водяники и возможности создания безотходной технологии ее переработки: Автореф. дис. ... канд. фарм. наук. Пермь, 2001. 24 с.
- Краснов Е.А. Химическое изучение растений и возможности использования в медицине ряда растений семейства толстянковых флоры СССР: Автореф. дис. ... д-ра фарм. наук. М., 1990. 46 с.
- Краснов Е.А. Флора России — источник БАВ и фитопрепаратов // Химия и технология раст. веществ: Тезисы докл. IV Всерос. науч. конф. Сыктывкар, 2006. С. 252.
- Краснов Е.А., Андреева Т.И., Суслов Н.И., Блинникова А.А. Способ получения экстракта, обладающего противоишемической и ноотропной активностью: Патент РФ № 2104018.
- Краснов Е.А., Пестерев П.Н., Балюра Е.В. и др. Средство для лечения атопического дерматита.
- Краснов Е.А., Ралдугин В.А., Шилова И.В., Авдеева Е.В. Фенольные соединения Filipendula ulmaria (Maxim.) // Химия природ. соединений. 2006. № 2. С. 122─124.
- Краснов Е.А., Саратиков А.С., Ханин Г.З. и др. Способ получения средства, обладающего противосудорожной активностью: Патент РФ № 1312777.
- Краснов Е.А., Саратиков А.С., Ханин Г.З. и др. Способ получения средства, обладающего противосудорожным действием: Патент РФ № 1647966.
- Краснов Е.А., Саратиков А.С., Якунина Г.Д. Инокостерон и экдистерон из Rhaponticum carthamoides // Химия природ. соединений. 1976. № 4. С. 550.
- Краснов Е.А., Саратиков А.С., Якунина Г.Д. Действующие вещества левзеи сафлоровидной // Изв. СО АН СССР. Сер. биол. наук. 1977. № 5. С. 93─95.
- Краснов Е.А., Шилова И.В., Суслов Н.И. Фармацевтический состав, обладающий ноотропной активностью: Патент РФ №2276992.
- Лафон Р. Фитоэкдистероиды и мировая флора: разнообразие, распределение и эволюция // Физиология растений. 1998. Т. 45. С 326─346.
- VIII Междунар. съезд «Актуальные проблемы создания новых лекар. препаратов природ. происхождения „Фитофарм-2004“». Миккели, Финляндия, 21—23 июня 2004 г.: Матер. съезда. СПб.: ВВМ, 2004. 771 с.
- Нурмухаметова К.А., Краснов Е.А., Бычкова Н.К. и др. Химико-фармакологическое исследование растений рода соссюрея // Бюл. сиб. медицины. 2004. Т. 3. № 4. С. 67─70.
- Плотников М.Б., Алиев О.И., Васильев А.С. и др. Гемореологическая активность экстрактов Lychnis chalcedonica и Rhaponticum carthamoides при экспериментальном инфаркте миокарда // Растит. ресурсы. 1999. Т. 35. Вып. 1. С. 103─107.
- Плотников М.Б., Алиев О.И., Маслов М.Ю. и др. Гемореологическое средство и способ его получения: Патент РФ № 2178658.
- Саратиков А.С., Краснов Е.А. Растительные психостимуляторы-адаптогены // Фундаментальные науки — медицине (реалии, приоритеты, перспективы). Красноярск: КГТУ, 1998. С. 366─381.
- Саратиков А.С., Краснов Е.А. Родиола розовая (золотой корень). 4-е изд., перераб. и доп. Томск: Изд-во Том.
ун-та, 2004. 292 с.
- Саратиков А.С., Ханин Г.З., Горшкова В.К., Краснов Е.А. Противосудорожные свойства экстракта Empetrum nigrum L. // Растит. ресурсы. 1991. Т. 27. Вып. 4. С. 31─32.
- Терентьева С.В. Разработка эффективного противосудорожного средства из чертополоха курчавого: Автореф. дис. ... канд. фарм. наук. Пермь, 2000. 27 с.
- Терентьева С.В., Краснов Е.А., Саратиков А.С. Изучение противосудорожной активности некоторых видов флоры Сибири и Алтая // Бюл. СО РАМН. 2001. № 3. С. 49─54.
- Тимофеев И.П. Возраст и динамика плотности агропопуляций Rhaponticum carthamoides и Serratula coronata (Asteraceae) на Европейском Севере // Растит. ресурсы. 2005. Т. 40. Вып. 3. С. 1─12.
- Фитоэкдистероиды. СПб.: Наука, 2003. 293 с.
- Хазанов В.А., Эскина С.В., Краснов Е.А. и др. Церебропротектор и способ его получения: Патент РФ № 2237856.
- Ханин Г.З. Противосудорожный препарат из Empetrum nigrum L.: Автореф. дис. ... канд. биол. наук. Томск, 1988. 24 с.
- Шилова И.В. Исследование княжика сибирского как эффективного ноотропного средства: Автореф. дис. ... канд. фарм. наук. Пермь, 2001. 27 с.
- Krasnov E., Yaremenko K., Dementeva L. Phenols from Rhodiola as antitumor drugs // J. Internat. d’etude du groupe Polyph. Montpellier. 1986. P. 17B.
- Lafont R., Dinan L. Practical uses for ecdisteroids in mammals including humans: as update // J. of Insect. Sci. 2003. V. 3. № 7. P. 1─30.
- Nolan L.L., Labbe R.G. Future of natural products from plants in the struggle with emerging diseases: Case of food-bome pathogens and leishmaniasis // J. Herbs Spices and Med. Plants. 2004. V. 11. № 1—2. P. 161─190.
- Poroikov V.V., Filimonov D.A. How to asquire new biological activites in old compands by computer prediction // S. Comput-Aided Mol. Des. 2002. V. 16. № 11. P. 819—824.
- Wang S.F., Ayer S., Segraves W.A. et al. Mollecular determinants of differential ligand sensitivities of insect ecdysteroid receptors // Mol. Cell. Biol. 2000. № 20. P. 3870─3879.
- Yaremenko K.V., Dementeva L.A., Krasnov E.A. Antitumor properties of Rhodiola roses extract and its components // Internat. Confec. Polyphenols JIEP, 84. Plovdiv, Bulgaria, 1984. P. B—11.
Бюллетень сибирской медицины, 2006. Приложение 2
