Н. М. Эмануэля ран защита состоится 27 сентября 2011 г в 13
| Вид материала | Автореферат |
- Кинетика ферментативного гидролиза полипептидов и гидрофобные эффекты, 573.63kb.
- Автореферат диссертации на соискание ученой степени, 275.48kb.
- Трудовой потенциал пореформенной России: социально-демографические аспекты, 601.55kb.
- Которая состоится 8 сентября 2011 года в Москве, 15.37kb.
- Программа саратов, 12 15 сентября 2011 г. Научный совет ран по акустике Общественная, 576.97kb.
- Примерная программа конференции: Заезд участников конференции 12 сентября 2011 г. Регистрация, 91.77kb.
- Особенности биологии донных и придонных рыб, 1533.54kb.
- Онтология, эпистемология и диалектика Николая Кузанского, 335.03kb.
- Эволюция итальянской проповеди XIV-XV, 600.86kb.
- История и миф в операх Сергея Слонимского, 335.75kb.
патологических процессах, лучевом воздействии и гипокинезии.
Средние значения (MSEM) содержания ХЭ и их отношений, характерные для опухолевой ткани при доброкачественных и злокачественных поражениях скелета, приведены в таблице 10. В этой же таблице приведены результаты сопоставления данных для опухолей с данными для контрольной группы.
Таблица 10. Средние значения (MSEM) содержания (на сухую ткань) и отношений химических элементов в образцах костной ткани при опухолевых заболеваниях скелета в сравнении с ««Контролем I».
| Элемент или отношения элементов | ОБК 7–47 лет | Злокачест. ОБК 13–56 лет | Остео-хондрома 10–42 лет | Хондро- саркома 8–65 лет | Остео- саркома 6–71 лет | Р-Э саркома 4–24 лет |
| n=13 | n=13 | n=14 | n=25 | n=61 | n=12 | |
| Ag, нг/г | 4,50,5а | 1,80,7 | 3,20,3 | 3,00,8 | 7,43,6 | 2,71,3 |
| Ca, мг/г | 15616b | 12919c | 16014с | 14018c | 13710c | 818c |
| Cl, мг/г | 4,90,8с | 8,20,8c | 1,880,23 | 8,81,7b | 8,71,0c | 131c |
| Co, нг/г | 34±7а | 37±8a | 21±2 | 37±6b | 49±7c | 59±3c |
| Cr, мкг/г | 0,32±0,07 | 0,42±0,10 | 0,29±0,02 | 0,5±0,1 | 0,6±0,1b | 0,34±0,09 |
| F, мкг/г | 24925а | 25396 | – | – | 400110 | – |
| Fe, мкг/г | 353±81b | 640±145b | 138±62 | 178±34b | 247±32c | 507±147b |
| Hg, нг/г | 5,5±0,9 | 7,7±2,1 | 2,3±1,3 | 17±5a | 7,7±1,3 | 15±7 |
| K, мг/г | 3,50,8а | 8,22,2b | 1,990,20 | – | 7,02,1a | – |
| Mg, мг/г | 2,40,2 | 2,40,3 | 2,50,3 | 2,60,1 | 2,80,2 | 2,340,37 |
| Mn, мкг/г | 0,260,03 | 0,50,1a | 0,320,06 | – | 0,180,03 | – |
| N, мг/г | 879b | 8717 | 468 | 775b | 8212a | 10217a |
| Na, мг/г | 6,740,54 | 9,90,8c | 5,00,4a | 122a | 8,70,5c | 10,41,6a |
| P, мг/г | 768c | 6513b | 786c | 728c | 1159 | 8411a |
| Rb, мкг/г | ≤1,2 | 2,2±0,5a | 3,1±0,5 | 1,6±0,4b | 2,2±0,3b | 1,3±0,3c |
| Sb, нг/г | 31±11 | 33±7a | 8,2±1,1 | 17±3 | 37±9 | 18±9 |
| Sc, нг/г | ≤5 | ≤140 | ≤3100 | 2470±680 | 601±130 | ≤120 |
| Se, мкг/г | 1,5±0,4c | 1,8±0,4c | 1,8±0,9 | 1,8±0,3c | 1,9±0,2c | 2,2±0,5c |
| Sr, мкг/г | 284100 | 13838c | 19931b | 19778a | 19829b | 16197a |
| Tb, нг/г | 7814 | 5312 | 286 | 9623 | 16042 | 5918 |
| Zn, мкг/г | 115±8a | 66±13 | 237±68a | 118±14 | 192±16c | 131±32 |
| Ca/P | 2,000,12 | 2,110,33 | 2,080,05 | 1,920,16 | 1,310,09c | 1,100,16c |
| (Ca/Mg)·0,01 | 0,660,06 | 0,530,08a | 0,710,09 | 0,570,10 | 0,490,03c | 0,330,05c |
| (Ca/Na)·0,01 | 0,250,03b | 0,140,02c | 0,320,02 | 0,160,02c | 0,200,02c | 0,090,01c |
| (Ca/Zn)·0,001 | 1,20,15c | 3,61,8 | 1,10,2c | 1,40,3b | 0,90,1c | 1,20,7 |
| (Cl/Ca)·100 | 2,40,5c | 6,41,6c | 1,40,4a | 115a | 144b | 184c |
| Cl/Na | 0,670,10c | 0,870,09c | 0,390,06a | 0,840,12c | 0,840,04c | 1,20,15c |
«Контроль I» – условно здоровая кость в области диафизов и метадиафизов, ОБК – остеобластокластома, Злокачест. ОБК – злокачественная остеобластокластома, Остеосаркома – остеогенная саркома, Р-Э саркома – ретикулоэндотелиальная саркома, n – число исследованных образцов, М – среднее арифметическое, SЕМ – стандартная ошибка среднего, a – p ≤0,05, b – p ≤0,01, c – p ≤0,001 – сопоставление с «Контролем I» (t-тест Стьюдента).
Обнаружено, что ткани костных опухолей, включая остеогенную саркому, содержат меньше Са (минеральный матрикс) и больше N (органический матрикс), чем кортикальная кость («Контроль I). Пониженная минерализация костных опухолей подтверждается рентгенологически [Зацепин С.Т., 2001; Маланин Д.А., Черезов Л.Л., 2007]. Все опухоли, за исключением остеохондромы, содержат больше Cl и Fe, чем кортикальная и трабекулярная кость, что связано с повышенной гидрофильностью и васкуляризацией (или насыщенностью кровью) опухолей по сравнению с «нормальной» костной тканью. Это заключение подтверждается ангиографическими исследованиями [Зацепин С.Т., 2001; Маланин Д.А., Черезов Л.Л., 2007]. Для тканей костных опухолей характерно повышенное содержание многих микроэлементов Co, Hg, Sb, Se и Zn, что указывает на нарушение элементного гомеостаза, присущего как кортикальной, так и трабекулярной здоровой кости.
Сопоставление данных об элементном составе ткани из очага поражения при заболеваниях, представляющих особые трудности для дифференциальной диагностики, выявили различия по многим параметрам (табл. 11). Полученные данные легли в основу способа диагностики заболеваний костей, основанного на in vitro или in vivo NAA содержания Ca, Cl, и Na в ткани очага поражения. Способ защищён авторским свидетельством №677748 и был внедрён в практику клиники МРНЦ РАМН.
Таблица 11. Параметры элементного состава ткани очага поражения, по которым выявлено статистически достоверное различие при сопоставлении различных заболеваний костей с целью дифференциальной диагностики.
| Сопоставляемые нозологические пары при дифференциальной диагностике заболеваний костей | Информативный параметр (статистически достоверное различие) |
| «Заболевание 1 – Заболевание 2» | |
| Остеомиелит – остеогенная саркома | Ca (-), Cl(+), Co(+), Fe(+), Mg(-), Na(+), Rb(-), Se(+), Tb(+), Zn(+), Ca/P(-), Ca/Mg(-), Ca/Na(-), Ca/Zn(-), Cl/Ca(+), Cl/Na(+) |
| Хондрома – хондросаркома | Cl(+), Co(+), Hg(+), N(+), Na(+), Rb(-), Sb(+), Tb(+), Ca/Na(-), Cl/Ca(+), Cl/Na(+) |
| Остеобластокластома (ОБК) – злокачественная ОБК | Ag(-), Cl(+), Na(+), Zn(-), Ca/Na(-), Cl/Ca(+) |
| Остеогенная саркома – ретикуло-эндотелиальная саркома | Ca(+), Cl(-), P(+), Tb(+), Ca/Mg(+), Ca/Na(+), Cl/Na(-) |
| Ретикуло-эндотелиальная саркома (опухоль Юинга) – остеомиелит | Ca(+), Cl(-), Co(-), Fe(-), Mg(+), N(-), Na(-), Rb(+), Se(-), Ca/P(+), Ca/Mg(+), Ca/Na(+), Cl/Ca(-), Cl/Na(-) |
(-) и (+) – соответственно, уменьшение или увеличение параметра в ткани очага поражения при заболевании «2» по сравнению с заболеванием «1»
Лучевое лечение остеогенной (70–100 Гр) и ретикулоэндотелиальной (50–60 Гр) саркомы приводит к частичной «нормализации» элементного состава ткани в очаге поражения. Это заключение для остеогенной саркомы иллюстрируют данные в таблице 12.
Таблица 12. Сопоставление средних значений (MSEM) содержания и отношений некоторых химических элементов в образцах ткани остеогеной саркомы с данными для ткани остеогенной саркомы после лучевого лечения и контрольной группы (на сухую ткань).
| Элемент или отношения | Остеогенная саркома | Контроль I | Остеогенная саркома | t-тест Стьюдента p ≤ | |
| элементов | до лечения n=61 | n=27 | после лечения n=26 | Остеосаркома до - после лечения | Остеосаркома после лечения и Контроль I |
| Ag, нг/г | 7,43,6 | 2,70,5 | 2,90,5 | Н.Р. | Н.Р. |
| Ca, мг/г | 13710 | 2229 | 18710 | ≤0,001 + | ≤0,05 - |
| Cl, мг/г | 8,71,0 | 1,50,3 | 5,31,1 | ≤0,05 - | ≤0,01 + |
| Co, нг/г | 49±7 | 15±3 | 20±3 | ≤0,001 - | Н.Р. |
| Cr, мкг/г | 0,56±0,07 | 0,27±0,06 | 0,34±0,03 | ≤0,01 - | Н.Р. |
| F, мкг/г | 400110 | 491118 | - | - | - |
| Fe, мкг/г | 247±32 | 64±16 | 189±48 | Н.Р. | ≤0,05 + |
| Hg, нг/г | 7,7±1,3 | 5,7±1,4 | 11,3±4,4 | Н.Р. | Н.Р. |
| K, мг/г | 7,02,1 | 1,650,33 | - | - | - |
| Mg, мг/г | 2,840,17 | 2,450,37 | 3,180,50 | Н.Р. | Н.Р. |
| Mn, мкг/г | 0,180,03 | 0,230,02 | - | - | - |
| N, мг/г | 81,612,5 | 55,93,4 | - | - | - |
| Na, мг/г | 8,730,51 | 6,400,36 | 8,440,82 | Н.Р. | ≤0,05 + |
| P, мг/г | 1159 | 1126 | 89,67,3 | ≤0,05 - | ≤0,05 - |
| Rb, мкг/г | 2,17±0,26 | 3,8±0,5 | 1,63±0,52 | Н.Р. | ≤0,01 - |
| Sb, нг/г | 37±9 | 15,1±3,2 | 11,9±0,9 | ≤0,01 - | Н.Р. |
| Sc, нг/г | 601±130 | ≤14 | 1400±440 | Н.Р. | - |
| Se, нг/г | 1930±220 | 176±29 | 441±89 | ≤0,001 - | ≤0,01 + |
| Sr, мкг/г | 19829 | 41861 | - | - | - |
| Tb, нг/г | 16042 | ≤30 | 141±47 | Н.Р. | - |
| Zn, мкг/г | 192±16 | 91,1±4,4 | 179±18 | Н.Р. | ≤0,001 + |
| Ca/P | 1,310,09 | 2,060,07 | 2,010,08 | ≤0,001 + | Н.Р. |
| (Ca/Mg)·0,01 | 0,490,03 | 0,810,07 | 0,650,03 | ≤0,001 + | ≤0,05 - |
| (Ca/Na)·0,01 | 0,200,02 | 0,360,02 | 0,260,02 | ≤0,05 + | ≤0,001 - |
| (Ca/Zn)·0,001 | 0,880,11 | 2,320,16 | 1,150,15 | Н.Р | ≤0,001 - |
| (Cl/Ca)·100 | 14,44,2 | 0,590,10 | 4,381,85 | ≤0,05 - | ≤0,05 + |
| Cl/Na | 0,840,04 | 0,220,03 | 0,560,05 | ≤0,001 - | ≤0,001 + |
Примечание: «Контроль I» – условно здоровая кость в области диафизов и метадиафизов, n – число исследованных образцов, М – среднее арифметическое, SЕМ – стандартная ошибка среднего, Н.Р. – нет различия, «+» или «-» – больше или меньше по сравнению с данными до лучевого лечения и контролем.
Лучевое лечение остеогенной саркомы (70–100 Гр) не оказывает влияния на содержание и отношения содержания химических элементов в прилежащей к опухоли визуально здоровой костной ткани (табл. 13).
Таблица 13. Влияние лучевого лечения на содержание (в сухой ткани) и отношения некоторых химических элементов (MSEM) в визуально здоровой кортикальной костной ткани прилежащей к опухоли при остеогеной саркоме.
| Элемент или отношения | До лечения | После лечения | t-тест Стьюдента |
| Ca, мг/г | 22511 | 20716 | Н.Р. |
| Cl, мг/г | 2,190,37 | 1,20,2 | Н.Р. |
| Mg, мг/г | 3,080,23 | 2,600,26 | Н.Р. |
| Na, мг/г | 6,240,45 | 5,150,54 | Н.Р. |
| P, мг/г | 11911 | 87,07,4 | Н.Р. |
| Ca/P | 1,950,08 | 2,440,19 | Н.Р. |
| (Ca/Mg)·0,01 | 0,770,08 | 0,820,05 | Н.Р. |
| (Ca/Na)·0,01 | 0,360,02 | 0,420,04 | Н.Р. |
| (Cl/Ca)·100 | 0,990,18 | 0,600,08 | Н.Р. |
| Cl/Na | 0,330,06 | 0,260,05 | Н.Р. |
М – среднее арифметическое, SЕМ – стандартная ошибка среднего, Н.Р. – нет различия
Показано, что разработанное и используемое в ЦИТО им. Н.Н. Приорова медикаментозное лечение детей с генетически обусловленными формами рахита (ГОФР) приводит к норме содержание Са и Р в крыле подвздошной кости (табл.14) и обеспечивает индивидуальную прибавку содержания Са в кисти в диапазоне от 0 до 63% от исходного уровня (табл. 15).
Таблица 14. Средние значения содержания (М±SD, на сухую ткань) химических элементов в биоптате крыла подвздошной кости в группе детей с ГОФР до и после медикаментозной терапии, а также в контрольной группе.
| Элемент | Пациенты с ГОФР n=20 | Контрольная группа n=13 | t-тест Стьюдента ГОФР и контроль | ||
| До | После | До | После | ||
| Ca, мг/г | 108±7 | 146±12 | 157±18 | p <0,05 | Н.Р. |
| CI, мг/г | 1,41±0,11 | 1,76±0,26 | 1,35±0,20 | Н.Р. | Н.Р. |
| К, мг/г | 1,14±0,16 | 0,96±0,11 | 0,94±0,14 | Н.Р. | Н.Р. |
| Mg, мг/г | 0,78±0,07 | 0,98±0,07 | 1,43±0,19 | p< 0,01 | p< 0,05 |
| Mn, мкг/г | 1,40±0,21 | 1,18±0,11 | 0,82±0,08 | p <0,02 | p <0,02 |
| Na, мг/г | 4,19±0,25 | 4,78±0,30 | 4,79±0,45 | Н.Р. | Н.Р. |
| P, мг/г | 34,4±2,7 | 42,8±2,6 | 48,2±4,3 | p <0,05 | Н.Р. |
| Sr, мкг/г | 228±35 | 209±24 | 140±11 | p <0,02 | p <0,02 |
М – среднее арифметическое, SD – стандартное отклонение среднего.
Таблица 15. Содержание кальция в кисти (in vivo NAA) и в крыле подвздошной кости (in vitro NAA) у детей с генетически обусловленным рахитом до и после медикаментозного лечения.
| Больной | Возраст | in vivo NAA кисть | in vitro NAA крыло подвздошной кости | ||||
| Импульсов 49Са | Δ % | Са, мг/г сырой ткани | Δ % | ||||
| До (Q1) | После (Q2) | До (Q1) | После (Q2) | ||||
| Ц-ов | 16 | 1213 | 1978 | +63 | 57 | 83 | +46 |
| Л-ва | 14 | 883 | 1244 | +41 | 130 | 180 | +38 |
| А-ин | 10 | 857 | 1063 | +24 | 75 | 170 | +127 |
| Ж-ва | 13 | 1209 | 1510 | +25 | 96 | 110 | +15 |
| Щ-на | 13 | 1338 | 1057 | -21 | 80 | 79 | -1 |
| Ф-ан | 12 | 804 | 804 | 0 | 98 | 77 | -21 |
Δ = [(Q2-Q1)/Q1]·100%, коэффициент корреляции для Δ (%) в in vivo и in vitro исследованиях r=0,44
Обнаружено, что содержание химических элементов в эмали зубов при периодонтите и пародонтите отличается от нормального уровня, причём каждому заболеванию присущи специфические изменения элементного состава. С возрастом содержание Na в эмали постоянных зубов увеличивается, а Cl и Sr уменьшается. В эмали постоянных зубов женщин содержание Са, Р и отношение Ca/Na статистически достоверно выше, чем у мужчин.
Выявлено, что воздействие малых доз ионизирующего излучения (до 20 сГр) приводит к достоверному увеличению содержания Zn и уменьшению величины отношения Ca/Zn в эмали постоянных зубов (Рис. 3).
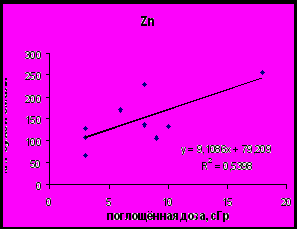
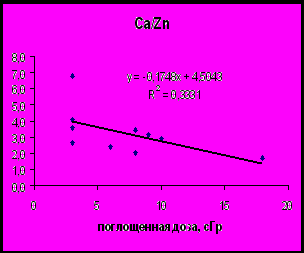
Рис. 3. Зависимость содержания Zn и отношения (Ca/Zn)·0,001 в эмали постоянных зубов подростков, проживающих на территориях, загрязнённых вследствие аварии на Чернобыльской АЭС.
Отсутствие достоверных различий в содержании Zn и Sr в эмали здоровых резцов, клыков и премоляров было показано методом in vivo EDXRF.
Впервые в экспериментах с антиортостатической гипокинезией был использован метод in vivo NAA, который позволил осуществить прямое определение содержания кальция в стопе, кисти и позвоночнике обследуемого. В экспериментах с 120- и 370-суточной антиортостатической гипокинезией было показано, что только комплексная профилактика, проводимая на протяжении всего эксперимента и включавшая фармацевтические средства и физические упражнения, обеспечивала стабильное состояние минерального матрикса всех исследованных участков скелета.
Впервые методом in vivo NAA были обнаружены статистически достоверные циклические изменения минеральной насыщенности различных звеньев скелета в зависимости от сезона года. Показано, что минерализация костной ткани изменяется в пределах ±5% от среднего уровня в течение года, при этом минимум насыщенности кальцием кисти и позвоночника приходится на летне-осенний период, а стопы на осенне-зимний период. Этот феномен следует учитывать при диагностике и лечении остеопороза, а также в спортивной медицине.
