Використання фіксованої комбінації інгібітора протонової помпи та прокінетика – новий підхід до лікування функціональної шлункової диспепсії
| Вид материала | Документы |
- Курс 4 Факультет медичні №1 та 2 Спеціальність- лікувальна справа к-сть годин-, 574.1kb.
- Система обмеженого доступу в країнах, що розвиваються: новий підхід до проблем розвитку, 2932.17kb.
- Національний проект «Здорова нація» — дорожня карта реформування медичної галузі, 155.08kb.
- Тернопільський державний технічний університет імені Івана Пулюя, 135.66kb.
- «Загальні відомості про геоінформаційні технології та картографування», 148.2kb.
- Кардіо-ренальний синдром: новий підхід до старої проблеми, 151.93kb.
- Уніфікований клінічний протокол медичної допомоги лікування пацієнтів з хронічної хворобою, 398.66kb.
- Інші методи лікування та оздоровлення психотерапія, альтернативні традиційні І нетрадиційні, 476.66kb.
- 2 закон Ньютона (основне рівняння динаміки для тіла незмінної маси), 35.13kb.
- Роблема неонатальних інфекцій та надання медичної допомоги новонародженим з цією патологією, 1119.02kb.
Використання фіксованої комбінації інгібітора протонової помпи та прокінетика – новий підхід до лікування функціональної шлункової диспепсії
Палій І.Г., Заїка С.В.
кафедра внутрішньої та сімейної медицини
Вінницький національний медичний університет ім. М.І. Пирогова
Одним з найбільш розповсюджених станів в структурі гастроентерологічної патології на сучасному етапі є шлункова диспепсія, про що переконливо свідчать результати чисельних популяційних досліджень, проведених у США та Європі. Вона спостерігається у 20-40% дорослого населення розвинутих країн світу [8].
Водночас в структурі всієї шлункової диспепсії у 2/3 хворих вона носить функціональний характер,а знайти органічні чинники, що пояснюють причини її виникнення, вдається лише у 1/3 обстежених [11, 12].
У жінок функціональна шлункова диспепсія зустрічається у двічі частіше, ніж у чоловіків, а найбільша кількість звернень із диспептичними скаргами припадає на пацієнтів віком 35-45 років [9].
Функціональна шлункова диспепсія (ФШД) – це стан, який характеризується наявністю у пацієнта симптомів, що з’являються у гастродуоденальній ділянці без будь-яких органічних, системних або метаболічних порушень, які могли б пояснити ці скарги [13].
Для синдрому шлункової диспепсії характерна наявність наступних симптомів:
- Біль або дискомфорт з локалізацією в епігастральній ділянці;
- Швидке насичення їжею – відчуття, що шлунок переповнюється відразу ж після початку їди, незалежно від об’єму вжитої їжі;
- Переповнення – неприємне відчуття затримки їжі в шлунку, яке може бути пов’язаним або ж не пов’язаним із вживанням їди;
- Здуття в епігастральній ділянці – суб’єктивне відчуття розпирання в епігастральній ділянці, яке необхідно відрізняти від справжнього (яке видно під час огляду) здуття;
- Нудота.
Слід зазначити, що тільки за симптомами шлункової диспепсії, доволі складно відрізнити яка шлункова диспепсія, органічна чи функціональна, наявна у даного пацієнта.
Враховуючи серйозність прогнозу для хворих саме у разі органічних захворювань стравоходу, шлунка та дванадцятипалої кишки (пептична виразка шлунка та дванадцятипалої кишки (ПВДПК), гастроезофагеальна рефлюксна хвороба (ГЕРХ), пухлини, жовчнокам’яна хвороба, хронічний панкреатит), перед постановкою діагнозу ФШД необхідно виключити органічну причину захворювання даних органів [12].
Верхню ендоскопію обов’язково необхідно проводити тим хворим у яких є наступні симптоми небезпеки («симптоми червоних прапорців») [11]:
- Анемія;
- Блювання;
- Дисфагія;
- Немотивоване схуднення;
- Прийом нестероїдних протизапальних препаратів;
- Лихоманка;
- Високе ШОЕ;
- Вік хворих більше 40 років.
Таким чином, згідно Римських критеріїв ІІІ, для ФШД характерна наявність хоча б одного симптому (відчуття важкості після їди, відчуття швидкого насичення їжею, епігастральний біль, відчуття печіння в епігастрії) тривалістю не менше ніж 3 місяці, впродовж останніх 6 місяців, при відсутності органічних причин, які могли б пояснити виникнення захворювання [26]. Слід звернути увагу на те, що у випадку ФШД, симптоми хвороби не зникають після дефекації і не пов’язані із змінами частоти та характеру стула.
На міжнародній конференції гастроентерологів та гепатологів, яка проходила у 2010 році в Таїланді, було відзначено, що у хворих на ФШД крім симптомів, характерних для даного захворювання, у 7-20% хворих спостерігаються симптоми ГЕРХ; симптоми подразненої товстої кишки спостерігаються у 8-50% хворих на ФШД. Наявність даної патології не виключає ФШД, а є підставою для верифікації декількох самостійних діагнозів [25].
В залежності від переважання тих чи інших клінічних проявів захворювання виділяють: постпрандіальний дистрес-синдром (дискінетична форма за Римськими критеріями ІІ) та епігастральний больовий синдром (виразкоподібна форма за Римськими критеріями ІІ) [11, 13, 27].
Для поспрандіального дисстрес-синдрому характерно:
- Відчуття швидкого насичення (виникає після разового прийому їжі, декілька раз в тиждень);
- Відчуття важкості після їди (перешкоджає завершенню прийому їжі, виникає декілька раз на тиждень).
Для епігастрального больового синдрому характерно:
- Інтермітуючий біль або печіння;
- Легкі або помірні за вираженістю;
- Локалізуються в епігастрії і турбують не менше 1разу на тиждень.
Згідно концепції Talley N.J., виділяють наступні етіологічні чинники розвитку ФШД [9, 11]:
- Спадковість – GNβ3cc генотип;
- Наявність порушень моторної функції шлунка та кишечнику;
- Інфекція Helicobacter pylori (Н.р.);
- Кислотно-пептичний фактор, шлункова гіперсекреція на тлі гіперчутливості хеморецепторів дванадцятипалої кишки;
- Шкідливі звички (прийом алкоголю та тютюнопаління) та прийом медикаментів (НПЗП, антибіотиків, теофіліну, препаратів наперстянки, гормонів щитовидної залози).
Як зазначається у міжнародних домовленостях щодо діагностики та лікування Н.р. (Маастрихт ІІІ, 2005 р.), успішна ерадикація Н.р. тільки у частини хворих (близько 25%) покращує перебіг ФШД, однак, всім хворим на ФШД рекомендується обов’язкове обстеження на Н.р., а при його виявленні – проходження антигелікобактеріальної фармакотерапії з метою зменшення ризику виникнення у майбутньому органічної патології шлунка та дванадцятипалої кишки [11, 12].
Серед багатьох етіологічних чинників ФШД, провідну роль у виникненні симптомів ФШД відіграють порушення рухової активності верхніх відділів шлунково-кишкового тракту, а також вісцеральна гіперчутливість хеморецепторів дванадцятипалої кишки [11]. У 75% хворих на ФШД спостерігаються різноманітні порушення гастродуоденальної моторики [17, 20, 21, 24]:
- сповільнення евакуаторної функції шлунка;
- зниження частоти і амплітуди перистальтики шлунка;
- порушення антродуоденальної координації;
- сповільнення постпрандіальної моторики антрального відділу шлунка;
- порушення рецептивної та адаптивної релаксації шлунка, що призводить до порушення розподілення їжі всередині шлунка і викликає відчуття швидкого насичення.
Крім того, хворі на ФШД доволі часто мають особливий психосоціальний статус, який проявляється підвищеним рівнем тривоги, хронічного стресу, депресивними проявами, зниженою психологічною адаптацією, невротичними та іпохондричними реакціями.
Загальні принципи ведення хворих на ФШД, які були вперше запропоновані Talley N.J., Holmann G. у 2000 році залишаються актуальними і в сучасних умовах [11]:
- Інвазивні обстеження, після встановлення діагнозу, мають бути мінімізовані, повторні тести не проводяться без обґрунтованих показів.
- З хворим обов'язково проводяться співбесіди щодо доброякісного характеру захворювання (бесіди проводяться при кожному наступному візиті).
- Необхідно намагатись модифікувати дієту та спосіб життя.
- Терапія по можливості має бути спрямована на усунення патофізіологічних механізмів захворювання.
- Препарати потрібно призначати економно, в залежності від симптомів, які викликають найбільший дискомфорт у хворого.
- В кожному конкретному випадку слід розглядати необхідність проведення психотерапії.
- Кожний хворий потенційно може потребувати тривалої курації.
Основні дієтичні рекомендації хворим на ФШД спрямовані на подолання симптомів диспепсії [11, 13]:
- Вживати таку кількості їжі, яка не спричиняє дискомфорту.
- Вживати їжу малими порціями, але за 5- 6 прийомів впродовж дня.
- Розмежовувати прийом твердих та рідких страв.
- Не лягати протягом 2-3 год. після їди;
- Уникати фізичного навантаження після їди.
- Повністю відмовитись від продуктів, які спричиняють симптоми.
- Зменшити в раціоні рівень жирів і збільшити – білків.
- Обмежити вживання кави, алкоголю, шоколаду, цитрусових, томатів, винограду, слив, яблук (сповільнюють евакуацію із шлунка).
Поряд із дієтичними рекомендаціями та модифікацією способу життя, в лікуванні ФШД, виходячи із ланок патогенезу даного захворювання, значну роль відіграє кислотосупресивна фармакотерапія та заходи, спрямовані на відновлення моторно-евакуаторної функції стравоходу, шлунка та дванадцятипалої кишки [11, 13].
Проводячи кислотосупресивну фармакотерапію при лікуванні ФШД, ми зменшуємо закислення дванадцятипалої кишки, що у подальшому призводить до зменшення її вісцеральної гіперчутливості. Крім того, збільшення інтрадуоденального рН зменшує вивільнення холецистокініну, який бере безпосередню участь в розвитку порушень моторики верхніх відділів шлунково-кишкового тракту [11]. Як правило, позитивна відповідь на призначення монотерапії інгібітором протонової помпи спостерігається у хворих на ФШД із клінічними проявами епігастрального больового синдрому.
Слід зазначити, що вимоги до кислотосупресивної фармакотерапії для лікування хворих на ФШД мають бути менш жорсткими ніж при лікуванні ПВДПК та ГЕРХ [11].
Серед кислотоблокуючих фармакопрепаратів незаперечну перевагу у лікуванні хворих на ФШД мають представники групи інгібіторів протонової помпи [11]. Цьому сприяють такі властивості даної групи препаратів, як:
- Оптимальний кислотосупресивний ефект.
- Зручність прийому (один раз на добу).
- Швидка динаміка клінічної симптоматики.
- Відсутність «синдрому відміни».
- Ефект «післядії».
- Мінімальна кількість побічних ефектів та безпечність у разі потреби в тривалому використанні.
Серед представників інгібіторів протонової помпи за своєю вивченістю беззаперечно виділяється омепразол, який протягом тривалого часу продовжує зберігати провідні позиції в лікуванні кислотозалежних захворювань, не зважаючи на наявність великої групи конкурентних препаратів [14, 16].
На кафедрі внутрішньої та сімейної медицини Вінницького національного медичного університету ім. М.І. Пирогова за допомогою добового гастро-рН-моніторингу проводилось всебічне вивчення ефективності кислотоблокуючої дії омепразолу в дозі 0,02 г та 0,04 г при лікуванні хворих на ПВДПК: в першу добу від початку лікування, на 4-6 добу прийому омепразолу та через 2-3 дні після відміни препарату [1, 2, 3, 4].
Проаналізувавши результати лікування омепразолом в добовій дозі 0.02 г на 6-7 добу від початку проведення фармакотерапії (рис. 1), авторами було встановлено, що у 37% обстежених хворих (група І) внутрішньошлунковий рН > 3,5 Од. спостерігався протягом 24 год.; ще у 48,2% обстежених (група ІІІ) пацієнтів внутрішньошлунковий рН > 3,5Од. спостерігався протягом 17-20 год. і тільки у 14,8% обстежених (група ІІ) внутрішньошлунковий рН > 3,5Од. спостерігався менше 16 год. на добу [1].
Крім того, через 2-3 дні після відміни омепразолу, що застосовувався в дозі 0,02 г х 1 раз на добу, більш ніж у 80% пролікованих пацієнтів з ПВДПК зберігалась післядія препарату [3].
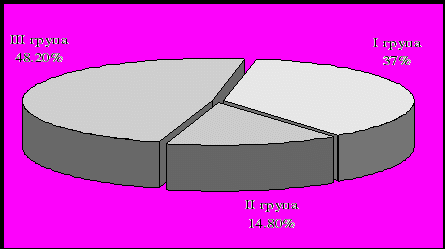
І група – кислотосупресивна дія протягом 24 год.
ІІ група – кислотосупресивна дія протягом до 16 год.
ІІІ група – кислотосупресивна дія протягом 17-20 год.
Рис. 1. Ступінь кислотоблокуючої дії омепразолу в дозі 0,02 г х 1 раз на добу у хворих на ПВДПК (6-7 день лікування).
Серед фармакопрепаратів, що впливають на моторно-евакуаторну функцію шлунка та дванадцятипалої кишки, увагу клініцистів привертають прокінетики [11]. Їх фармакологічні ефекти реалізуються за рахунок [5, 11]:
- Відновлення тонусу та моторики антрального відділу шлунка.
- Відновлення антродуоденальної координації.
- Відновлення моторно-евакуаторної функції шлунка.
- Відновлення постпрандіальної моторики шлунка.
Прокінетичний ефект характерний для цілої низки препаратів із різноманих фармакологічних груп, до яких належать:
- Агоністи холінергічних рецепторів.
- Блокатори допамінових рецепторів:
а) неселективні (метоклопрамід);
б) селективні (домперидон);
в) селективні з антихолінестеразною дією (цизаприд).
- Макроліди.
- Препарати, які взаємодіють з 5НТ3-рецепторами (ондасетрон).
- Гормональні пептиди (октреотид).
- Агоністи каппа-рецепторів (федотозин).
- Антагоністи рецепторів холецистокініну.
- Антагоністи опіатних рецепторів.
Найбільш вивченими серед прокінетиків є неселективні та селективні блокатори допамінових рецепторів [5, 11]. Домперидон, на відміну від метоклопраміду, не має здатності до проникнення через гематоенцефалічний бар’єр, тому для нього практично не характерна наявність побічних ефектів, притаманні метолопраміду (лакторея, порушення менструального циклу та гінекомастія, екстрапірамідні розлади). Майже повна відсутність побічних ефектів домперидону збільшує прихильність пацієнтів до лікування [5, 7].
Домперидон активує перистальтику антрального відділу шлунка та сприяє покращенню евакуаторної функції шлунка [5, 19, 28]. Крім того, домперидон є ефективним препаратом при лікуванні гастропарезу, особливо діабетичної етіології, та гіпокінезах жовчного міхура [19, 22, 23].
Однак, за силою антирефлюксної дії, домперидон поступається інгібторам протонової помпи та блокаторам Н2-рецепторів гістаміну [18]. Так, у порівняльному дослідженні ефективності антирефлюксної фармакотерапії інгібіторами протонової помпи, блокаторами Н2-рецепторів гістаміну та домперидоном під час контрольної верхньої ендоскопії через 4 та 8 тижнів від початку фармакотерапії даними препаратами, найменшу ефективність в епітелізації ерозій стравоходу було виявлена при застосуванні домперидону [5, 11].
Під час аналізу результатів добового езофаго-рН-моніторингу, В.Т. Івашкін та Є.Ю. Абидін встановили, що домперидон не мав антирефлюксної дії ні на кислотні, ні на лужні гастроезофагеальні рефлюкси (хворі отримували домперидон в дозі 0,01г х 4 рази на добу) [5]. Подібні результати щодо впливу домперидону на кислотні та лужні гастроезофагеальні рефлюкси були отримані в дослідженні С.П. Колісника та В.М. Чернобрового. Автори дослідження проводили перший езофаго-рН-моніторинг до початку прийому препарату, повторне обстеження виконувалось на 7-й день від початку лікування домперидоном в дозі 0,01г х 4 рази на добу. При аналізі результатів, істотних змін з боку як кислотних, так і лужних гастроезофагеальних рефлюксів виявлено не було [6].
На нашу думку, недостатній вплив домперидону на гастроезофагеальні рефлюкси та симптоми ФШД перш за все пов’язаний із особливостями фармакокінетики препарату, а саме низькою біодоступністю та коротким періодом напіввиведення і, відповідно, необхідністю більш частого прийому препарату [7].
Підтвердженням нашого припущення стало дослідження, виконане на кафедрі внутрішньої та сімейної медицини Вінницького національного медичного університету, в якому під час проведення багатогодинного езофаго-рН-моніторингу вивчалась антирефлюксна дія домперидону в дозі 0,02 г та 0,01 г протягом 2 год. (рис. 2). Було встановлено, що домперидон в дозі 0,01г не впливає ні на кислотні, ні на лужні гастроезофагеальні рефлюкси. Водночас, було встановлене вірогідне (р<0,01) зменшення кількості кислотних гастроезофагеальних рефлюксів на 2 год. після прийому препарату в дозі 0,02 г [15].
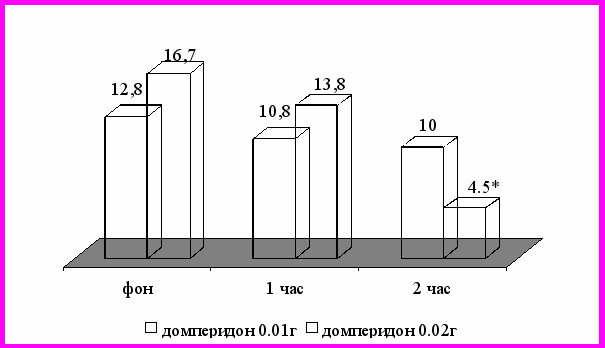
Рис. 2. Порівняльна антирефлюксна ефективність домперидону в дозі 0,01 г та 0,02 г за результатами проведенні багатогодинної езофаго-рН-фармакопроби.
Таким чином, виходячи із принципів лікування хворих на ФШД, раціональним методом лікування даної категорії хворих було б використання кислотоблокуючого фармакопрепарату із доведеною ефективністю та безпечного прокінетика (селективного блокатора допамінових рецепторів – домперидону), бажано з повільним вивільненням, для забезпечення адекватної терапевтичної дози прокінетика протягом 12-24 год.
На фармацевтичному ринку України представлений комбінований препарат під торговою назвою «Лімзер» виробництва МЕГА Лайфсаенсис Пти ЛТД. Одна капсула препарату «Лімзер» містить 0,02 г омепразолу в кишково-розчинних гранулах та 0,03 г домперидону в особливій формі випуску – гранули з пролонгованим вивільненням (SR-форма).
За рахунок використання SR-форми, забезпечується достатня терапевтична концентрація домперидону протягом тривалого періоду часу. Така інноваційна технологія виготовлення препарату дозволяє ефективно використовувати «Лімзер» один раз на добу за 15-30 хв. до їди.
В Україні проведено ряд досліджень по вивченню ефективності використання фармапрепарату «Лімзер» в лікуванні хворих з патологією верхніх відділів шлунково-кишкового тракту [10, 14].
Зокрема, в дослідженні проф. А.С. Свінцицького та співавторів вивчався вплив «Лімзеру» на симптоми ФШД у хворих з хронічними ерозіями шлунка. Авторами оцінювалась динаміка внутрішньошлункового рН, крім того, за допомогою гастросцинтіграфії вивчався вплив препарату на швидкість евакуації шлункового вмісту. При цьому вивчали: час початку евакуації шлункового вмісту, період напіввиведення 99Тс-колоїду; відсоток виведення 99Тс-колоїду за 30хв.
Групу порівняння склали пацієнти, які отримували омепразол та домперидон у традиційній формі випуску, що приймався в дозі 0,01г х 3 рази на добу.
За результатами дослідження було встановлено, що «Лімзер» призводив до швидкої ліквідації симптомів функціональної шлункової диспепсії, будучи однаково ефективним із омепразолом щодо блокування секреції хлористоводневої кислоти в парієтальних клітинах шлунка. Однак, «Лімзер» суттєво (р<0,01) переважав комбінацію омепразолу та домперидону за показниками оцінки моторно-евакуаторної функції шлунка [14].
В іншому досліджені, проведеному в Українській військово-медичній академії МО України на базі Головного військово-медичного клінічного центру «ГВКГ» МО України м. Київ, вивчалась динаміка клінічних проявів ФШД, оцінювалась якість життя пацієнтів та вивчались можливості поєднання препарату «Лімзер» з методами апаратної фізіотерапії при функціональній диспепсії у військовослужбовців.
Згідно з аналізом результатів, проведеним через 4 тижні від початку лікування, була відзначена позитивна динаміка клінічних симптомів у більшості обстежених військовослужбовців. Особливо це стосувалось таких проявів, як відчуття переповнення після їжі, відчуття важкості, здуття та болю в епігастрії, нудоти і печії.
Оцінюючи показники якості життя дослідники відзначили, що у хворих на ФШД спостерігалось підвищення середнього показника якості життя по шкалі загального здоров’я з 76,3±3,4 до 89,7±6,4 балів (p<0,05), житєздатність підвищилась з 60,1±2,9, до 78,5±5,9 балів (p<0,05), показник шкали рольового емоційного функціонування зріс з 74,1±4,1 до 97,8±5,4 балів (p<0,05).
Таким чином, Г.В. Осьодло, C.М. Прокопчук та О.С. Зубрицький прийшли до висновку, що під впливом препарату «Лімзер» зменшуються клінічні прояви ФШД, покращується якість життя хворих, підвищуються показники водного тесту, що свідчить про зниження гіперчутливості шлунка [10].
Підводячи підсумок викладеному, слід відзначити, що ФШД є актуальною проблемою сучасної гастроентерології, яка потребує комплексного підходу до її вирішення.
До етіологічних чинників виникнення ФШД належать процеси порушення моторно-евакуаторної функції шлунка та гіперчутливість рецепторного апарату слизової оболонки дванадцятипалої кишки до хлористоводневої кислоти.
Використання комбінованого препарату «Лімзер», до складу якого входить омепразол 0,02 г та домперидон 0,03 г у вигляді гранул з пролонгованим вивільненням (SR-форма) є найбільш оптимальним, патогенетично та клінічно доведеним підходом до лікування ФШД.
Література:
- Заїка С.В. Обґрунтування ефективних схем лікування омепразолом пептичної виразки дванадцятипалої кишки (за результатами внутрішньошлункового рН-моніторингу) // Ліки - №3-4 –2000-С.117-119.
- Заїка С.В. Омепразол як компонент антихелікобактеріальної терапії пептичної виразки дванадцятипалої кишки // Вісник Вінницького державного медичного університету.- 2000.- №4.(2). – С. 296-297.
- Заїка С.В. Особливості кислотоблокуючої дії блокаторів Н+-К+-АТФ-ази першого покоління у хворих на пептичну виразку дванадцятипалої кишки (за результатами добового внутрішньошлункового рН-моніторингу) // Ліки. - 2001– №1-2 -С.102-105.
- Заїка С.В. Порівняльна оцінка призначення омепразолу в дозі 20мг та 40мг в першу добу лікування у хворих на пептичну виразку дванадцятипалої кишки // Гастроентерологія (міжвідомчий збірник) випуск 31 – Дніпропетровськ, 2000.- С. 314-319.
- Ивашкин В.Т., Трухманов А.С. Болезни пищевода. Патологическая физиология, клиника, диагностика, лечение.- М. : Триада Х, 2000. – 180 с.
- Колісник С.П., Чернобровий В.М. Проблеми лікування прокінетиками хворих на гастроезофагеальну рефлюксну хворобу (за даними добового езофаго-рН-моніторингу) // Проблеми військової охорони здоров’я та профілактики.- 2006.- Вип.15.- С. 195-202.
- Компендиум 2010 – лекарственные препараты: под ред. В.Н. Коваленко, А.П. Викторова.- К.: Морион, 2010.- 2240 с.
- Маев И.В., Самсонов А.А. Болезни двенадцатиперстной кишки. М.МЕДпресс–информ, 2005. 512 с.
- Маев И.В., Самсонов А.А., Буеверов А.О., Кочетов С.А. Место прокинетиков в последних алгоритмах диагностики и лечения функциональной диспепсии // Русский медицинский журнал. – 2010.- №9 (Т.18).- С. 549-554.
- Осьодло Г.В., Куц Т.В., Прокопчук С.М. Сучасні аспекти діагностики і лікування функціональної диспепсії // Здоров’я України XXI сторіччя (тематичний номер по гастроентерології). - 2010.- С. 44-45.
- Передерий В.Г., Ткач С.М., Кузенко Ю.Г., Скопиченко С.В. Кислотозависимые заболевания. Современные подходы к диагностике, лечению и ведению больных с ГЭРБ, пептическими язвами, НПВП-гастропатиями, функциональной диспепсией и другими гиперсекреторными заболеваниями: монография.- К. : ООО «Тиса ЛТД», 2008.– 425 с. – (Библиотека практического врача).
- Передерий В.Г., Чернявский В.В. Диагностический поиск и ведение пациентов при неисследованой диспепсии // Сучасна гастроентерологія.- 2007.- №2(34).- С. 4-7.
- Пиманов С.И., Силивончик Н.Н. Римский III консенсус: избранные разделы и комментарии. Пособие для врачей. Витебск: Издательство ВГМУ, 2006.–160 с.
- Свинцицкий А.С., Соловьева Г.А., Кундин В.Ю., Миронова Е.А. Эффективность «Лимзера» при хронических эрозиях желудка // Сучасна гастроентерол.- 2008.- №3 (41).- С. 70-74.
- Чернобровий В.М., Вехбе М.А., Заїка С.В. Вплив домперидону на гастроезофагеальний рефлюкс у хворих на дуоденальну пептичну виразку (за даними багатогодинного езофаго-рН-моніторингу) // Вісник морфології.- 2003.- №2(9).- С. 336-339.
- Чернобровий В.М., Мелащенко С.Г., Заїка С.В. Досвід використання комп’ютерної внутрішньопорожнинної рН-метрії шлунка в практиці гастроентеролога // Сучасна гастроентерологія – 2002. - №2(8) – С.8-11.
- Шептулин А.А. Современные представления о патогенезе, диагностике и лечении синдрома функциональной диспепсии // Рос. журн. гастроэнтерол., гепатол., колопроктол.- 2003.- №1(Т. 19).- С. 19–25.
- De Caestecker J. Prokinetics and reflux: a promise unfulfilled // Eur. J. Gastroenterol. Hepatol. — 2002. — № 14 (1). — Р. 5-7.
- Franzese A. Domperidone is more effective than cisapride in children with diabetic gastroparesis / A. Franzese, O. Borrelli, G. Corrado, P. Rea, G. Di Nardo, et al // Aliment. Pharmacol. Ther.- 2002.- May; №16(5).- Р.951-957.
- Shuster MM. Atlas of gastroentestinal motiliti in Health and Disease. Hamilton London, 2002; 472.
- Smout MD, Arrermans PhD. Normal and disturbed Motility of the gastrointestinal tract. 1992; 313 р.
- Sturm A, Holtmann G, Goebell H, Gerken G. Prokinetics in patients with gastroparesis: a systematic analysis // Digestion.- 1999.- Sep-Oct; №60(5).- Р.422-427.
- Szabelska K, Chojnacki J, Grzegorczyk K, Mamos A. Effect of prokinetic drugs inhibiting dopaminergic system on gallbladder motility in subjects with duodenal ulcer // Pol. Merkuriusz. Lek.- 1999.- Apr; №6(34).-188-191.
- Tack J, Bisschops R, Sarnelli G. Pathophysiology and treatment of functional dyspepsia // Gastroenterology.- 2004.- №127.- Р. 1239–55.
- Tack J. Update on Functional Dyspepsia; Ganaton Regional Advisory Board Meeting Thailand 2010; 2:1–15 PR-RU-Abb-GAN-27(05/10).
- Tack J., Talley N.J., Camilleri M. et al. Functional gastroduodenal disorders // Gastroenterology. – 2006. – Vol.130. – P. 1466–1479.
- Talley T.J., Stanghellini V., Heading R.C. et al Functional gastroduodenal disoders – Rome II: Amultinational consensus Document on functional gastrointestinal disorders // Gut. – 1999. – Vol. 45 (Suppl. 11). – P. 1137–1142.
- Veldhuyzen van Zanten S.J., Jones M.J., Verlinden M., Talley N.J. Efficacy of cisapride and domperidone in functional (nonulcer) dyspepsia: a meta-analysis // Am. J. Gastroenterol.- 2001.- Mar; №96(3).- Р. 689-696.
