О. В. Кондращенко Корозія І захист будівельніх матеріалів та конструкцій Конспект
| Вид материала | Конспект |
- Нформаційний пакет напрям підготовки 0921 "Будівництво " Спеціальність 092101 "Технологія, 428.25kb.
- Рювання вимог регламентних технічних умов, державних стандартів, будівельних норм,, 17.24kb.
- Реферат Харків 2009, 139.06kb.
- М. Трускавець, затверджених рішенням Трускавецької міської ради від. 2007р. № Перелік, 128.93kb.
- Зміни до Порядку проведення експертизи матеріалів на лікарські засоби, що подаються, 2751.76kb.
- Типовий договір купівлі-продажу об'єкта незавершеного будівництва, що підлягає продажу, 231.5kb.
- Конспект лекцій з дисципліни «Державне регулювання земельних відносин та захист навколишнього, 497.61kb.
- Як конспект лекцій Дніпропетровськ Нметау 2008, 735.01kb.
- Відповідно до постанови Кабінету Міністрів України від 26., 3656.85kb.
- Робоча навчальна програма предмет Методи дослідження властивостей матеріалів (Р-32), 48.64kb.
Лекція 7 ЕЛЕКТРОХІМІЧНА І ЕЛЕКТРИЧНА КОРОЗІЯ ЗАЛІЗОБЕТОНУ
Досвід експлуатації залізобетонних конструкцій свідчить, що однією з причин їх передчасного руйнування є корозія сталевої арматури, виникненню і прискореному протіканню якої сприяє корозія самого бетону. Процеси корозії арматурної сталі в залізобетоні мають електрохімічний характер і підкоряються закономірностям, за якими протікає електрохімічна корозія металів. Але в зв'язку з тим, що арматурна сталь у з/б завжди знаходиться під захисним шаром бетону, необхідно враховувати специфіку цього процесу. Швидкість корозії арматури залежить як від властивостей самої сталі, так і від властивостей і структури бетону, товщини захисного шару, характеру навколишнього середовища. Захисний шар бетону захищає арматуру від зовнішнього середовища, але не ізолює її повністю. Варто сказати, що бетон завжди є проникним для вологи і кисню – основних необхідних речовин процесу електрохімічної корозії стали. Відомо, що корозія металів найчастіше відбувається за електрохімічним механізмом, для чого необхідне виконання таких умов: 1) наявність різниці потенціалів між окремими ділянками поверхні металу, тобто його електрохімічна неоднорідність; 2) наявність електролітичного зв'язку між цими ділянками; 3) активний стан поверхні на анодних ділянках, де метал руйнується (розчиняється) за схемою n2O + Me ® Me+× n2O + 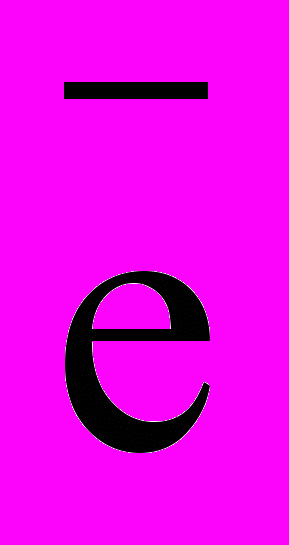 ; (14) ; (14)
H2O + ½О2 + 2 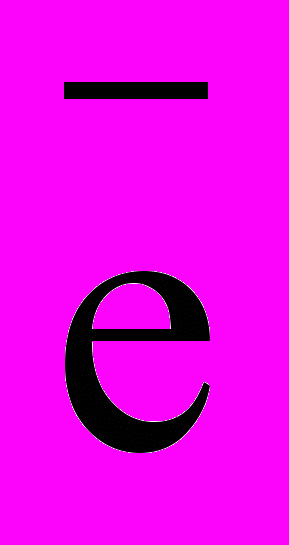 ® 2ОН-. (15) ® 2ОН-. (15)Оскільки структура сталі і контактного шару бетону в її поверхні неоднорідні, то наявність різниці потенціалів між окремими ділянками поверхні металу має місце завжди. Важливою особливістю цементного бетону є лужність рідкої фази, насиченої Са(ОН)2. Пористість же бетону сприяє активній взаємодії його із середовищем. Тому відсутність корозії арматури в бетоні обумовлена пасивністю сталі в лужному середовищі, тобто нездатністю до розчинення за наведеною вище реакцією (14), а якщо процес розчинення металу має місце, то це пов'язано з умовами виготовлення конструкції або процесом експлуатації. Анодний процес на поверхні арматурної сталі являє собою реакцію окислювання заліза: Feо = Fe2+ + 2 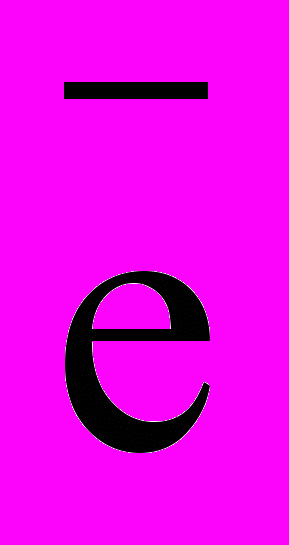 . (16) . (16)Анодний процес проходить тим легше, чим вище вологість бетону. Причиною цього можуть бути збільшення числа контактів поверхні сталі з електролітом у порах бетону і полегшення переміщення іонів на поверхні арматури. Катодний процес, при наявності високолужного середовища, протікає з кисневою деполяризацією, тобто відбувається відновлення кисню з перетворенням його в присутності води в іон гідроксилу: ½ О2 + Н2О + 2е = 2ОН-. (17) При реальних умовах служби з/б у бетоні будь-якої щільності вміст кисню в порах набагато більший, ніж це необхідно для одержання захисних плівок на арматурі. Величина потенціалу арматурної сталі в бетоні з різними добавками (наприклад, СаС12) може на 0,5 В відрізнятися від потенціалу в звичайному бетоні. Це призводить до утворення електронегативного поля між анодом і катодом. Крім того, великий вплив на розвиток процесів корозії має відношення площ катодних (Sк) і анодних (Sа) поверхонь. Якщо опірність бетону мала і відношення Sк/ Sа достатньо значне, арматурна сталь у зонах з низьким значенням рН може піддаватися сильній корозії. Об’єм продуктів корозії заліза більше, ніж у вихідного металу, що призводить до руйнування захисного шару бетону.
За даними М. Петрококкино [10], арматурна сталь може стати пасивною, коли створити середовище, що окислює. А це складне завдання, тому що на залізобетон можуть ще впливати різні агресивні агенти, наприклад, кислі гази: H2S, SO2, CO2, іони Н+, SO42- і Cl-. Для того щоб попередити виникнення корозії, важливо визначити термодинамічні умови протікання електрохімічних реакцій і залежність їхнього окислювально-відновного потенціалу Еh від рН середовища. Окислювально-відновний потенціал не залежить від природи металу. Якщо значення рН середовища електроліту недостатнє для того, щоб іон двовалентного заліза, що утвориться на аноді, сформував захисну плівку безпосередньо на поверхні аноду, то арматурна сталь піддається корозії. За певних умов метал, який знаходиться під впливом корозійних процесів, може покриватися безпористим шаром продуктів реакції, наприклад оксидом, що перешкоджатиме безпосередній взаємодії металу й електроліту, тобто наступить пасивний стан металу. Цей стан виникає при потенціалах вище деякого значення, що залежить від природи і складу електроліту, і значення рН (плівкова теорія пасивності). За допомогою термодинамічних розрахунків М. Пурбе [11] вивів залежності Еh - рН і на цій основі побудував діаграму полів стійкості заліза. На ній є вісім зон різного поводження заліза залежно від співвідношення Еh – рН (див. рис. 1). У зоні А залізо знаходиться в стані термодинамічної стабільності (виділяється водень). У зоні В залізо є надактивним, дуже швидко розчиняється без утворення іржі. Реакція корозії протікає за відсутності кисню, оскільки вся зона розташована нижче лінії r = 0. У зоні З залізо активне. Корозія з утворенням іржі здійснюється при незначних парціальних тисках кисню 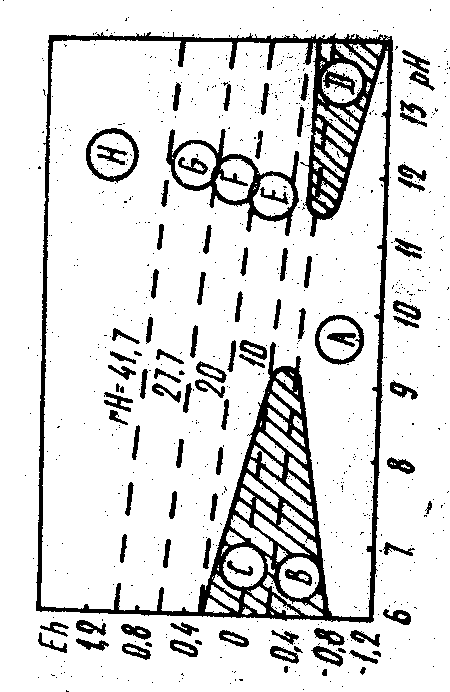  (r = 0-15). Зона D – це лужна область корозії заліза, де продуктом реакції є ферити. У зоні Е залізо має слабку активність, оскільки їй відповідає r = 0-10, продуктом корозії може бути іржа. Зона F характеризує стан заліза, при якому воно може швидко окислятися й залежно від рН середовища кородувати з утворенням іржі (рН < 10) або бути пасивним через захисні плівки (рН = 10-12,5). У зонах G і H залізо в основному пасивне, але при r > 50 у сильнокислому середовищі воно знову може стати активним. Найліпші умови експлуатації арматурної сталі в залізобетоні відповідають зоні F, бо пасивність заліза в ній визначається сприятливими умовами утворення різних захисних плівок. Установлено, що на залізі пасивуюча плівка складається з g- Fe2O3 або Fe3O4, кристалічні ґрати яких подібні. Ця плівка має товщину від 20 до 100 Å, тому градієнт потенціалу в ній досягає 3×10-6 В/см, що викликає протікання невеликого електричного струму через пасивні аноди за рахунок переносу іонів металу в порах плівки. Оскільки безпосередньо розчинятися може тільки пасивуюча плівка, постійна товщина якої підтримується за рахунок анодного процесу під нею, то швидкість корозії дуже мала. З'ясуванню термодинаміки утворення і стійкого існування різних захисних плівок на залізі у вигляді сполук Fe, Fe2O3, Fe3O4, Fe(OH)2, FeOOH, Fe(OH)3 і іонів двовалентного і тривалентного заліза присвячені дослідження В.І. Бабушкіна, С.В. Гонтового [12] та ін. Вони показали, що в лужній зоні (рН > 7) найбільш термодинамічно стійким продуктом є Fe2O3. У присутності кисню (Ро2 = 0,021 МПа) і при активній концентрації іонів заліза, яка дорівнює 1 ммоль/л, самим стійким у термодинамічному відношенні продуктом є Fe3O4. Розрахунки також показали, що крім зазначених продуктів у лужних середовищах ймовірне утворення Fe(OH)2, FeOOH, Fe(OH)3. Таким чином, можна зробити висновок, що для збереження арматурної сталі в з/б, крім великого значення рН, потрібно створити щільну структуру з замкнутими порами, заповненими воднем або інгибіруючими газами. Присутність водню запобігає утворенню гідроксиду: Fe(OH)3 + ½ Н2 = Fe(OH)2 + H2О (18) Застосування добавок до бетону у вигляді летючих інгібіторів приводить до створення пасивних адсорбційних плівок на поверхні сталі. Крім цього летючі інгібітори, заповнюючи пори, зменшують парціальний тиск кисню в повітрі. У такий спосіб пасивність досягається в присутності досить сильного окислювача, на чому і заснована дія пасиваторів, таких як хромати, нітрити та ін. Підвищення величини рН в бетоні сприяє тому, що кількість розчиненого кисню в поровому електроліті стає достатнім для збереження пасивності заліза. Різке зниження рН (при прониканні кислих газів) змінює рівновагу. Тому в лужному середовищі бетону при рН > 11,8 для корозії арматури контролюючим є анодний процес, якщо ж рН < 11,8, то утворення і наступна стійкість захисних плівок малоймовірні і контролюючим може виявитися катодний процес. Для захисту арматурної сталі при катодному контролі потрібна дуже надійна ізоляція арматури від повітряного середовища. Продукти ж корозії, що утворюються внаслідок вторинних процесів в електроліті, сталь не пасивують. Запобігати корозії арматурної сталі в цементних бетонах доцільно за допомогою прийомів і способів, що забезпечують лужне середовище (рН ≥ 12) по всій поверхні контакту порового електроліту з арматурною сталлю. Це гарантує анодний контроль корозійного процесу. Вдаватися до повної ізоляції арматурної сталі від кисню повітря і водяної пари слід тільки в тих випадках, коли заздалегідь відомо, що рН у поровому електроліті бетону при агресивному впливі буде значно знижуватися.
Важливим питанням є розгляд кінетики корозії арматурної сталі. Мірою швидкості корозії є кількість електрики, що протікає між катодними й анодними ділянками (у вигляді електронів у металі й аніонів в електроліті). Величина швидкості визначається омічним опором електроліту. Поки корозійний елемент не замкнутий (тобто корозія відсутня), анодний і катодний електроди мають свої початкові потенціали. Як тільки відбувається замикання і корозійний елемент починає функціонувати, концентрація іонів двовалентного заліза у поверхневому шарі аноду різко зростає (їхнє відведення вглиб розчину і можливі хімічні реакції залежать від іонного складу електроліту). Потенціал анодного електроду зрушується у бік позитивних значень. У той же час на катоді через недостатньо швидке зв'язування електронів, що надходять з анода, зсув потенціалу здійснюється у бік негативних значень. Таким чином, первісна різниця потенціалів електродів після поляризації стає меншою і сила корозійного струму набагато знижується. Неоднозначність потенціалу сталі пояснюється тим, що на нього впливають не стільки концентрація власних іонів, скільки Еh (тобто окисна здатність середовища), рН і процеси, що протікають на її поверхні. Значення потенціалу сталі залежить від вологості і проникності бетону для кисню. Дуже велике значення має вміст кисню в розчині. Кисень - гарний деполяризатор, його присутність збільшує швидкість корозії арматури. З іншого боку, під впливом кисню у деяких умовах створюються міцні захисні плівки, причому чим більше кисню в розчині, тим легше вони утворюються. У лужних середовищах інгибіторні властивості кисню виявляються значно сильніше, ніж у кислих, через меншу розчинність захисних плівок. Важливий і той факт, що для бетону навіть при невеликій вологості характерна іонна провідність. Через складність макро- і мікрокапілярної структури фізико-хімічні властивості електроліту бетону сильно відрізняються від звичайних рідких електролітів, і ці властивості безупинно змінюються в часі. Крім цього тверда структура бетону теж може мати фазові зміни внаслідок процесів твердіння цементу і взаємодії продуктів гідратації з іонами середовища. Різні переміщення в бетоні можуть здійснюватися в результаті фільтрації під тиском, капілярного підсмоктування, електроосмотичних явищ, що надає руху поровій рідині, при цьому може знаходитися в русі і газоподібна фаза. Тому важливо знати, як залежить корозійна активність бетону від повітропроникності. На ступінь вологості бетону і його аерованість сильно впливає температура, що, в свою чергу, пов’язано з кінетикою дифузійних і електродних процесів. Різкі періодичні температурні зміни можуть зруйнувати структуру як самого бетону, так і контактного шару на межі арматура - цементний камінь. Процеси корозії сталі посилюються з появою на поверхні бетону тріщин, що полегшують доступ вологи, кисню, кислих газів і агресивних солей. При значній вологості бетону, коли він має значну електричну провідність у зоні тріщини, може функціонувати концентраційна пара. Існування такої пари обумовлено різницею значень рН електроліту, що стикається зі сталлю (рН знижено, захисні плівки зруйновані - це анод) і під шаром бетону на певній відстані від неї (рН високе, наявність захисних плівок – це катод). У такому разі допускається можливість омічного контролю. При підвищенні вологості шляхом заповнення пор і капілярів водою дифузія кисню може бути утруднена - тоді омічний контроль заміниться катодним. При повному насиченні бетону водою, тобто для підводної зони споруди при розкритті тріщини до 0,5 мм корозія арматури припиняється. Дія контраційної пари може посилюватися дією мікропари, яка є наслідком диференціального напруження, що виникає в арматурі при розтягуванні, в зоні тріщини і під шаром щільного бетону. Більш напружена ділянка завжди стає анодом, а менш напружена – катодом. У загальному балансі корозійних процесів арматурної сталі в тріщинах потрібно враховувати і вплив іншої концентраційної макропари, що може з'явитися внаслідок різної концентрації кисню в зоні тріщини і під шаром щільного бетону. У цьому випадку катодом служать ділянки арматури, що знаходяться в зоні відкритої тріщини, а анодом – ділянки під щільним шаром бетону. Однак величина рН середовища не може однозначно характеризувати стан сталі в бетоні, тому що в ньому можуть знаходитися іони, які активізують, наприклад, іони хлору. Тому навіть якщо потенціал арматури має велике негативне значення, вона буде активною і при високому рН. Судити про електрохімічний стан сталі в бетоні можна за її здатністю поляризуватися. Пасивна сталь на відміну від активної дуже сильно поляризується, тобто її потенціал різко зміщується в позитивну сторону вже при малій щільності накладеного струму. Для забезпечення стійкості арматурної сталі в бетонах необхідно, щоб бетони мали пасивуючу дію щодо арматури. Крім того, їхня щільність повинна бути такою, щоб протягом усього терміну експлуатації конструкції захисний шар не був нейтралізований кислими газами і рідинами, а в самої поверхні сталевої арматури не відбувалося скупчення небезпечної кількості іонів, агресивних стосовно сталі. Довговічність залізобетонних конструкцій в умовах впливу агресивних середовищ забезпечується вибором складу бетону, товщиною його захисного шару, надійного протикорозійного захисту та ін. (див. табл. 8). Таблиця 8 - Вимоги до залізобетонних конструкцій залежно від ступеня агресивності експлуатаційних середовищ
В основі електрокорозії цементного каменю, бетону і залізобетону під дією електричного струму лежать електрохімічні й електроосмотичні процеси, що виникають під дією постійного і змінного струму. Впливу електричного струму піддаються всі компоненти залізобетону: цементний камінь, заповнювачі й арматурна сталь. Швидкість елетрокорозійних процесів у залізобетоні залежить від виду і параметрів струму, характеру його зміни, властивостей залізобетону та довкілля, включаючи температурно-вологісний режим, провідність, наявність агресивних компонентів. Найчастіше електрокорозію залізобетону викликають блукаючі струми, джерелом яких можуть бути трамвайні колії, електрифіковані залізниці, метрополітен, внутрішньозаводський та інший промисловий транспорт, електричні установки електролізних цехів підприємств, лінії електропередачі постійного струму системи провід-земля. Корозійний стан споруд, що знаходяться під впливом блукаючих струмів, визначають виміром потенціалу, сили, напрямку і щільності струму в конструкції. При вході струму в конструкцію утворюється катодна зона, а на виході – анодна. Анодні ділянки в бетоні мають позитивний потенціал щодо навколишнього середовища, а катодні – негативний. У всіх випадках електродом може бути тільки метал, тобто в з/б анодом і катодом можуть служити ділянки арматурної сталі або інших металевих конструкцій, що стикаються з бетоном. По залізобетонних конструкціях електричний струм рухається шляхом найменшого опору. Найбільшому руйнуванню внаслідок електролізу піддаються місця виходу електричного струму, тобто анодні ділянки арматури. Бетон має порівняно високий омічний опір, але у вологому стані його провідність може значно збільшуватися. Доведено, що чим вища провідність середовища, тим більша імовірність протікання струму тільки по середовищу, без переходу на металевий провідник. Під впливом електричного струму метали поводяться як провідники першого роду, а бетон, що є електролітом, - як провідник другого роду. Усі метали, в тому числі арматурна сталь, мають високу електричну провідність і значну теплопровідність, тому при протіканні струму через арматуру в ній не відбувається ніяких структурних змін, а спостерігається деякий розігрів або можуть виникнути значні напруження на контакті арматурна сталь-бетон. Якщо ж сталь виступає в ролі електродів, занурених в електроліт, то тоді ділянки сталі з боку негативного полюсу джерела струму будуть заряджені негативно, а ділянки, з'єднані з позитивним полюсом, заряджені позитивно. Арматурні стержні-аноди в міру анодного розчинення руйнуються, а на стержнях-катодах відбувається відновлення іонів Н+ до Н2. Найчастіше блукаючі струми входять у залізобетонну конструкцію з боку ґрунтового електроліту, тоді захисний шар бетону в конструкції трубопроводу, колектору та т.п. може піддаватися значному впливу електричного струму. Цей процес викликає в залізобетоні глибокі фізико-хімічні й структурні зміни. У всіх випадках на анодних ділянках арматури протікає реакція розчинення заліза. У процесі контакту поверхні сталевої арматури з поровою рідиною цементного каменя ділянки, що є анодом, схильні до переходу в пасивний стан через сильну поляризацію в цьому лужному середовищі (рН = 12-13). Уже при малих значеннях густини блукаючого струму внаслідок різкого підвищення опору (за рахунок утворення захисних плівок) швидкість анодного розчинення заліза сильно сповільнюється. Основними заходами боротьби з електрокорозією залізобетону є зменшення сил струмів витоку, застосування електрозахисту споруд, підвищення електричного опору самого бетону та використання ізоляційних покриттів, таких як бітумно-петролатумна суміш, бітумна мастика, органічні полімерні матеріали типу полімербетону, бетонополімеру. Лекція 8 ЕЛЕКТРОХІМІЧНА І ЕЛЕКТРИЧНА КОРОЗІЯ МЕТАЛІВ
До металів відносяться 67 елементів з 106 відомих хімічних елементів періодичної системи Д.І. Менделєєва. Вони легко віддають електрони, тобто легко окислюються, а, отже, всі вони є відновниками. Метали мають багато специфічних властивостей, у тому числі високу міцність і пластичність, що дає змогу широко застосовувати їх у будівництві. Але безповоротні втрати металів від корозії в цілому знаходяться на рівні 8% від початкової їхньої маси, з них 30% втрат приходиться на металеві будівельні конструкції. У чистому вигляді метали практично не використовуються, а широке застосування знайшли їхні сплави, що приведені в табл. 9. Таблиця 9 - Найбільш поширені види сплавів
Найбільш поширеними в будівництві є сплави заліза - сталі й чавуни. Сталь | |||||||||||||||||||||||||||||||||
