Организация специализированной ортопедической помощи больным остеоартрозами тазобедренного и коленного суставов 14. 00. 22. травматология и ортопедия 14. 00. 33. общественное здоровье и здравоохранение
| Вид материала | Автореферат диссертации |
- Квалификационный тест по специальности «организация здравоохранение и общественное, 1347.84kb.
- Академия Кафедра «Общественное здоровье и здравоохранение», 807.94kb.
- Примерная программа дисциплины общественное здоровье и здравоохранение Для студентов, 386.71kb.
- Программа по дисциплине «Общественное здоровье и здравоохранение», 120.06kb.
- Комбинированное применение артроскопии и метода чрескостного остеосинтеза при лечении, 328.95kb.
- Рабочая программа дисциплины общественное здоровье и здравоохранение I. Цели и задачи, 1223.51kb.
- Влияние оперативного удлинения врожденно укороченной нижней конечности на естественный, 411.61kb.
- Приказ от 28 декабря 1998 г. N 383 о специализированной помощи больным при нарушениях, 697.49kb.
- Программа научно-практической конференции «Основные проблемы эндопротезирования тазобедренного, 81.3kb.
- План занятий по общественному здоровью и здравоохранению для студентов 5 курса в Xсеместре, 371.26kb.
Диагностика остеоартроза и этиопатогенетические механизмы его развития.
Проанализированы результаты комплексного обследования и последующего лечения 335 больных обменно-дистрофическим ОА крупных суставов нижних конечностей в возрасте от 18 до 74 лет (женщин – 254, мужчин – 81). Двусторонний остеоартроз отмечен у 278 (83,0 %) больных, односторонний – у 57 (17,0 %) пациентов, сочетанная форма ОА (тазобедренных и коленных суставов) – у 31 (9,3 %) больного.
Клиническое обследование. У 114 больных отмечены характерные для поражения тазобедренного сустава жалобы на периодические неинтенсивные боли в паховой области, в области больших вертелов с иррадиацией в коленные суставы и по передней поверхности бедра, на чувство усталости в передней группе мышц бедра без нарушения при этом оси конечности и формы суставов. Определялась болезненность в паравертебральных точках, в проекции поясничных LII-LV и крестцовых позвонков, а также ощущались щелчки в суставах при ротационных движениях и болевые ощущения в крайних амплитудных точках приведения и внутренней ротации бедра. Объем движений при раннем ОА не был ограничен. Патологические симптомы Дюшенна-Тренделенбурга не определялись. Длина ног была равной, видимой гипотрофии мышц бедра и голени не отмечалось.
Для раннего ОА коленных суставов (221 всего) характерными были жалобы на периодические боли во внутренних отделах сустава, иррадиирующие по передней поверхности голени, на быстро появляющееся чувство усталости в икроножных мышцах и голеностопных суставах. При осмотре и пальпации определялась болезненность по ходу внутренних отделов суставной щели, в области собственной связки надколенника. Явления синовиита и препателлярного бурсита (припухлость над надколенником и в области верхнего заворота, положительный симптом баллотирования надколенника) выявлены в 87 случаях (39,4%). При пальпации во время сгибательно-разгибательных движений ощущались щелчки, болевые ощущения в крайних амплитудных точках усиливались. Объем движений, как правило, при раннем ОА, не был ограничен. Связочный аппарат стабильный.
Рентгенологическое исследование тазобедренных суставов заключалось в рентгенографии таза в стандартной переднезадней проекции и в проекции по Лауэнштейну; коленных суставов – в переднезадней, боковой и аксиальной проекциях. Всем пациентам также была выполнена рентгенография позвоночника в прямой и боковой проекциях.
Рентгенологическая картина начальных проявлений дистрофических изменений складывалась из признаков, характеризующих изменение структуры субхондральных отделов сочленяющихся костей: 1) уплотнение (склероз) субхондральной кости в наиболее нагружаемых участках, 2) остеопороз суставных концов, следующий за зоной склероза, 3) мелкие, единичные кистовидные просветления правильной формы с четкими гладкими контурами в субхондральном слое. Об изменениях структуры и уменьшении толщины хряща судили по снижению высоты (равномерному или клинообразному) суставной щели.
К начальным признакам ОА тазобедренного сустава относились появляющиеся костные разрастания по краям суставных поверхностей: оссификация участков хрящевой губы (labrium glenoidale) у верхне-латерального края вертлужной впадины и оссификация в области поперечной связки (ligamentum transversum), которая определялась в виде выступа между нижними концами обоих контуров вертлужной впадины. Для начальных стадий ОА коленного сустава характерен субхондральный склероз медиальных отделов сустава, незначительное сужение суставной щели в медиальных отделах, заострение межмыщелкового возвышения, начальные краевые разрастания вокруг верхнего и нижнего полюсов надколенника.
Компьютерная томография проведена 36 больным ОА тазобедренного и 86 больным ОА коленного суставов. В тазобедренном суставе, по данным КТ, отмечались изменения показателей плотности головки бедренной кости, достоверное ее увеличение в центральном сегменте. С увеличением возраста отмечалось уменьшение плотности лонной и седалищной костей. Объективные показатели плотности субхондрального слоя были намного ниже (630 HU) нормы (800 HU). Следовательно, при ранних стадиях остеоартроза речь идет об относительном увеличении плотности субхондрального слоя, а не об истинном склеротическом процессе, когда плотность увеличивается до 1000 и более HU. При раннем ОА коленного сустава на КТ отмечались изменения плотности костной ткани, перестройка мыщелков бедренной и большеберцовой костей, надколенника. Общее снижение плотности мыщелков бедренной и большеберцовой кости было от 104 до 208 HU и повышение плотности медиального мыщелка большеберцовой кости – от 201 до 260 HU. Диагностически значимым для ранних стадий ОА коленного сустава является уменьшение высоты суставной щели до 0,32-0,37 см.
Ультразвуковое исследование тазобедренных суставов проведено 112 пациентам с коксартрозом на аппаратах «Sonoline» SL-450 или «Voluson» 730PRO в режиме реального времени с использованием линейного датчика 7,5 Мгц и усилением 36 dB в положении больного лежа на спине при нейтральном положении тазобедренных суставов. С помощью программы «Общие измерения (General Measurements)» в В-режиме методом гистограмм (H Histogram) измеряли толщину гиалинового хряща и эхоплотность суставной губы (фиброзно-хрящевого кольца) в передневерхних отделах вертлужной впадины на участке, ограниченном контуром переднего края впадины и верхним контуром головки бедра (Патент № 2 321 350 РФ. Способ ультразвуковой диагностики ранних стадий остеоартроза тазобедренного сустава).
Для начальной стадии ОА тазобедренных суставов характерна сглаженность контура шейки бедренной кости, гладкий контур головки, легкая глыбчатость и неравномерность субхондрального слоя, умеренно истонченный (1,2±0,3 мм) гиалиновый хрящ сохранялся на всем протяжении. Толщина фиброзной капсулы составляла 3,4±0,4 мм, синовиальной оболочки – 6,1±0,5 мм. Плотность изучаемого участка суставной губы вертлужной впадины была 26,0±2,0 условных единиц (у.е). При прогрессировании ОА появлялись сглаженность контура шейки бедренной кости, бугристость контура головки, прерывистость субхондрального слоя с появлением в нем множества мелких фрагментов. В суставной губе и субхондральном слое головки появлялись единичные крупные (от 3 мм до 22 мм в диаметре) или множественные мелкие (от 1 мм до 2 мм в диаметре) дегенеративные кисты. Таким образом, при ультразвуковом исследовании тазобедренных суставов дифференциальная диагностика ранних стадий ОА осуществлялась по таким качественным изменениям, как сохранность контура шейки и головки, сферичность головки, состояние субхондрального слоя, наличие или отсутствие дегенеративных кист в нагружаемых отделах суставной губы. Количественными показателями ранних проявлений ОА тазобедренных суставов были: толщина гиалинового хряща (I ст. – 1,2±0,3 мм, II ст. – 0,7±0,2 мм при норме 2,4±0,6 мм), толщина синовиальной оболочки (I ст. – 6,1±0,5 мм, II ст – 8,2±1,5мм при норме 5,5±1,0 мм) и плотность суставной губы вертлужной впадины (I ст. 26±2,0 у.е.; II ст. – 30±1,0 у.е. при норме 22,01,0 у.е.).
Ультразвуковое исследование коленных суставов при гонартрозах проведено 177 пациентам на ультразвуковых установках «Sonoline» SL-450, «Voluson» 730PRO или "SONODIAGNOST" 360 линейными высокочастотными датчиками с базовыми частотами 7,5 МГц, работающих в режиме реального времени. Выполняли продольные, поперечные, косые срезы в зависимости от ориентации анатомических структур или локализации патологического процесса в двух плоскостях. Для раннего гонартроза были характерны следующие сонографические признаки: толщина синовиальной оболочки составляла 1,5±1,1 мм, фиброзная капсула сустава не была изменена, визуализировалось истончение гиалинового хряща во внутренних отделах сустава, отмечались неровность контуров бедренной и большеберцовой костей, появлялись небольшие краевые остеофиты и признаки пролабирования менисков. Наличие гиперэхогенных краевых остеофитов при нормальных размерах суставной щели и толщины гиалинового хряща характеризовало проявления первой стадии артроза. Вторая стадия характеризовалась незначительным утолщением синовиальной оболочки – 3,3±0,8 мм, формированием краевых остеофитов с акустической тенью, сужением суставной щели и более выраженным истончением гиалинового хряща. Дальнейшее прогрессирование остеоартроза проявлялось значительным истончением гиалинового хряща (толщина менее 1 мм) с фрагментацией и неравномерным утолщением субхондральной пластинки, образованием грубых остеофитов, значительным сужением суставной щели коленного сустава по медиальной поверхности, пролабированием мениска на треть ширины (третья стадия остеоартроза). В стадии выраженных изменений наблюдалось полное пролабирование деструктивно измененного мениска, отсутствие суставной щели, грубые массивные экзостозы суставных поверхностей. При гонартрозе II-III стадии в 55% случаев в подколенной области была определена киста Бейкера.
Денситометрическое исследование проведено 178 больным остеоартрозами I и II стадии, из них 94 – с двусторонним коксартрозом, 84 – с двусторонним гонартрозом. Анализ полученных данных показал: при ОА тазобедренных суставов у женщин в возрасте 41-50 лет происходит значимое уменьшение коэффициента (kmineral) минеральной плотности костной ткани (МПКТ) до 0,9; у мужчин – его увеличение до 1,2 в возрасте 41-65 лет. У женщин наблюдается возрастное снижение МПКТ в проекции проксимального участка головки бедренной кости. У мужчин МПКТ в проекции проксимального участка головки бедренной кости незначительно увеличивалась: с 2,4 г/см2 и 2,5 г/см2 до 2,6 г/см2. В проекции дистального участка головки бедренной кости МПКТ достоверно не отличалась от нормы во всех возрастных группах. В проекции надацетабулярной области, как у мужчин, так и у женщин регистрировалось возрастное снижение МПКТ.
У больных ОА коленных суставов при анализе значений МПКТ в проекции латерального мыщелка бедренной кости максимальные показатели отмечены у женщин старше 40 лет. В возрасте 41-50 лет также отмечалось достоверное снижение МПКТ латерального мыщелка большеберцовой кости. Других статистически значимых отличий МПКТ от нормы у женщин не наблюдалось. У мужчин, больных ОА, по сравнению с нормой статистически достоверное повышение МПКТ было в проекции латерального мыщелка бедренной кости в возрасте 41-50 лет и 51-65 лет, а также в проекции проксимального метадиафиза большеберцовой кости в возрасте 31-40 лет. Достоверных отличий между значениями МПКТ правой и левой нижних конечностей как у мужчин, так и женщин нами не обнаружено. Диагностически значимым для ранних стадий гонартроза являлось только опережающее повышение плотности медиального мыщелка большеберцовой кости при одновременном снижение МПКТ латерального мыщелка.
Лабораторное биохимическое исследование проводилось для диагностики ранних стадий ОА больным с мышечно-суставным болевым синдромом. Выполнялось спектрофотометрическое биохимическое исследование периферической сыворотки крови и суточной мочи. В полученной сыворотке крови определяли концентрацию маркеров деградации органического матрикса хрящевой ткани гексуроновых кислот по H. Bitter и M. Muir (1962), гексозаминов по J.A. Elson и W.T. Morgan (1993), сульфатной серы по К.С. Десятниченко (1992), гексоз по C. Holt (1954) и вычисляли соотношения, выявляющие степень разрушения хряща: сульфат/гексуроновые кислоты, гексозы/гексуроновые кислоты, гексозы/сульфат, гексуроновые кислоты/гексозамины. Содержание сиаловых кислот (СК) определяли по Warren (1959). О метаболизме коллагена судили по количеству гидроксипролина, определенному по методу П.Н. Шараева (1999). После проведения биохимического анализа рассчитывали отношения: гексозы/ГУК, указывающие на изменение соотношения между гликопротеидами и протеогликанами в соединительной ткани пациентов, происходящее на ранней стадии остеоартроза; и сульфаты/ГУК, определяющие степень сульфатирования ГАГ и повышенное на ранней стадии болезни (на поздних стадиях остеоартроза – пониженные либо нормальные).
В результате проведенного биохимического исследования периферической крови и суточной мочи вышеуказанными методами были выявлены лабораторные критерии раннего ОА тазобедренных или коленных суставов, представленные в таблице 1.
Таблица 1
Биохимические показатели сыворотки крови и суточной мочи больных с начальными проявлениями остеоартроза крупных суставов по сравнению с нормальными показателями
| Показатель сыворотки крови | Норма | Начальные проявление ОА |
| Сульфаты | 1,07-1,54 ммоль/л | 2,96-3,41 ммоль/л |
| Гексуроновые кислоты | 1,23-2,00 моль/л | 0,85- 1,23 ммоль/л |
| Сиаловые кислоты | 1,8-2,7 ммоль/л | 2,80-3,40 ммоль/л |
| Гексозамины | 6,77-7,25 ммоль/л | 8,00-8,35 ммоль/л |
| Гексозы | 4,8-6,1 ммоль/л | 7,25-8,00 ммоль/л |
| гексозы/гексуроновые кислоты | 3,05-3,90 ммоль/л | 0,55-0,79 ммоль/л |
| сульфат/гексуроновые кислоты | 0,77-0,89ммоль/л | 2,56-4,02 ммоль/л |
| Показатель суточной мочи | Норма | Начальные проявления ОА |
| Гидроксипролин | 0,12-0,18 ммол/сут | 0,20-0,28 ммол/сут |
| Гексуроновые кислоты | 2,84-5,65 ммоль/сут | 7,15-8,00 ммол/сут |
| Сиаловые кислоты | 0,36-0,86 ммоль/сут | 1,11-1,75 ммол/сут |
| Сульфаты | 20,87-25,6 ммоль/сут | 18,05-20,12 ммол/сут |
| Гексозы | 1,8-2,5 ммоль/л | 1,00-1,45 ммол/сут |
| Гексозамины | 0,70-1,11 ммоль/л | 1,84 -3,05 ммол/сут |
Лабораторное иммунологическое исследование. Изучали содержание сывороточных цитокинов, для чего определяли уровни TNFα на иммуноферментном анализаторе BIO-TEK Instruments Inc. Изучение клеточного звена иммунной системы включало определение в сыворотке крови относительного и абсолютного количества CD3+CD16+,CD56+, CD3+CD25+ методом лазерной проточной цитофлюорометрии на цитометре «BECKMAN COULTER EPICS XL». Исследуемые показатели идентифицировали с помощью моноклональных антител, меченых флуоресцинизотиоцианатом и фикоэритрином. Определение ЦИК осуществляли методом преципитации 3,5 % ПЭГ (ММ 6000). Измерение оптической плотности опытных образцов и контролей проводилось на планшетном фотометре для ИФА при длине волны 340 нм.
Анализ результатов иммунологического исследования показал, что у больных с ОА ранних стадий содержание естественных киллеров /Т-лимфоцитов (CD3+CD16+CD56+) составляло 18,0 % и 0,32×109/л (контрольная группа – 1,5-7,5 % и 0,01-0,13×109/л), что являлось косвенным доказательством участия внутриклеточных микроорганизмов в развитии патологических изменений в суставных и околосуставных тканях при идиопатическом остеоартрозе. Статистически достоверные отличия были выявлены в отношении CD3+ CD25+, несущих маркеры ранней активации лимфоцитов: 38,0 % и 0,54×109/л (контрольная группа – 14,0-21,0 % и 0,13-0,28×109/л) и поздней активации лимфоцитов CD3+HLA-DR+: 5,2 % и 0,1×109/л (контрольная группа – 0,5-4,50% и 0,01-0,07 109/л). Наблюдалось увеличение уровня сывороточных ЦИК до 38,0 у.е. (контрольная группа - 17,0-32,0 у.е.). Статистически значимые отличия были выявлены в отношении сывороточного TNFα, являющегося одним из главных медиаторов костной резорбции и местной воспалительной реакции (M. Kobayashi et al., 2005). У пациентов с ранними стадиями остеоартроза данный показатель составлял 12,0 пг/мл (в контрольной группе – 0-9,0 пг/мл). Остальные показатели иммунограммы (лифоциты, моноциты, гранулоциты, CD3+, CD19-, IgA, IgM, IgG) не выходили за пределы нормальных значений и не отличались от показателей здоровых людей.
Физиологическое исследование.
Изучение системного артериального давления у больных остеоартрозом выявило зависимость величины АД от стадии заболевания. В подгруппах больных с остеоартрозами одинакового возраста (от 40 до 60 лет) обнаружено, что систолическое и диастолическое давление при I стадии составляло 1201,7 и 751,2 мм рт. ст., при второй стадии уровень АД существенно выше, по сравнению с первой: 1292,0 (р0,001) и 791,2 (р0,05). У больных с третьей стадией остеоартроза выявлены ещё более высокие показатели АД – 133 3,2 и 892,3 мм рт.ст. С возрастом систолическое АД увеличивалось также в артериях голени и было на 16,5 % (р0,01) выше плечевого. Постоянная составляющая уравнения регрессии возрастной динамики систолического АД на плече при первой стадии равнялась 78,9 (r=0,556), при 2-й – 86,5 (r=0,464) и при 3-й – 94,7 мм рт. ст. (r=0,323) (Заявка № 2008124068 РФ, МПК8 А 61 В 17/56, 17/66, 17/92 Способ оценки васкуляризации мышц конечностей).
Реовазография. У больных с гонартрозом регистрировалось снижение реографического показателя (РП) реограммы области коленного сустава относительно нормы: I ст. – 0,250,06 отн.ед.; 2 ст. – 0,200,06 отн.ед., 3 ст. – 0,200,009 отн.ед. (норма 0,30 отн.ед.). Как известно, расчетная формула РП включает в числителе реографический индекс (РИ), в знаменателе – базисное сопротивление (Rб). У данной группы больных РИ соответствовал норме, но имело место повышение базисного сопротивления тканей (в среднем на 20 %), что, возможно, явилось следствием ионно-осмотических сдвигов во внеклеточной среде. Расчетные показатели РВГ области коленного сустава и голени, отражающие упруго-эластические свойства артерий, периферическое сопротивление сосудов и венозный отток у пациентов с I стадией гонартроза в 55 % наблюдений соответствовали норме. В 45 % наблюдений регистрировались признаки вазоконстрикции. При II, III стадиях гонартроза на РВГ области коленного сустава регистрировались снижения упруго-эластических свойств артерий, повышение периферического сопротивления сосудов, затруднение венозного оттока. Расчетные показатели РВГ голени соответствовали норме. Выявление на реограммах голени признаков вазоконстрикции, повышения периферического сопротивления сосудов и затруднение венозного оттока расценивали как выраженную отрицательную динамику процесса.
Для пациентов с гонартрозом одним из диагностически значимых изменениий в показателях РВГ являлось повышение омического сопротивления тканей коленного сустава и, как следствие, снижение расчетного РП (реографического показателя) относительно нижней допустимой границы нормы на 17-25 % у пациентов с гонартрозом I, II стадии, на 20-36 % – при гонартозе III стадии. Анализ результатов реовазографического исследования больных с коксартрозом I-III стадии не выявил диагностически значимых отклонений значений РВГ бедра от нормы.
Динамометрия. Проанализированы относительные величины показателя силы мышц (момент силы, отнесенный к массе тела) нижних конечностей. Показатели силы передней и задней групп мышц бедра на больной конечности у больных коксартрозом были снижены по сравнению с контрлатеральной на 10 и 13 % соответственно, при гонартрозе – на 19 % (р0,001) и 11% (р0,001). Показатель силы передней и задней групп мышц голени (тыльные и подошвенные сгибатели стопы) на пораженной стороне при коксартрозе оказался меньше, чем на интактной конечности соответственно на 11 % и 8 %, при гонартрозе – на 8 % (р0,05) и 15 % (р0,001). По мере прогрессирования заболевания сила мышц снижалась в среднем на 13 % (II стадия) и на 19 % (III стадия) по сравнению с показателями больных с I стадией заболевания. Следовательно, динамометрическое исследование мышц нижних конечностей позволило выявить в начальных стадиях остеоартроза снижение показателей динамометрии, прежде всего мышц-разгибателей голени.
Электромиография. Анализ показателей произвольной биоэлектрической активности мышц нижних конечностей показал, что развитие ОА крупных суставов нижних конечностей ведёт к снижению активационных способностей мышц, не только обеспечивающих функционирование пораженного сустава, но и расположенных на удаленном сегменте конечности и даже на контралатеральной конечности. Это выражается в снижении амплитуды биоэлектрической активности. Степень снижения функционального состояния мышц нижних конечностей у больных с ОА крупных суставов коррелирует с выраженностью патологического процесса, однако его влияние на активационные характеристики мышц носит модулирующий, а не детерминирующий характер.
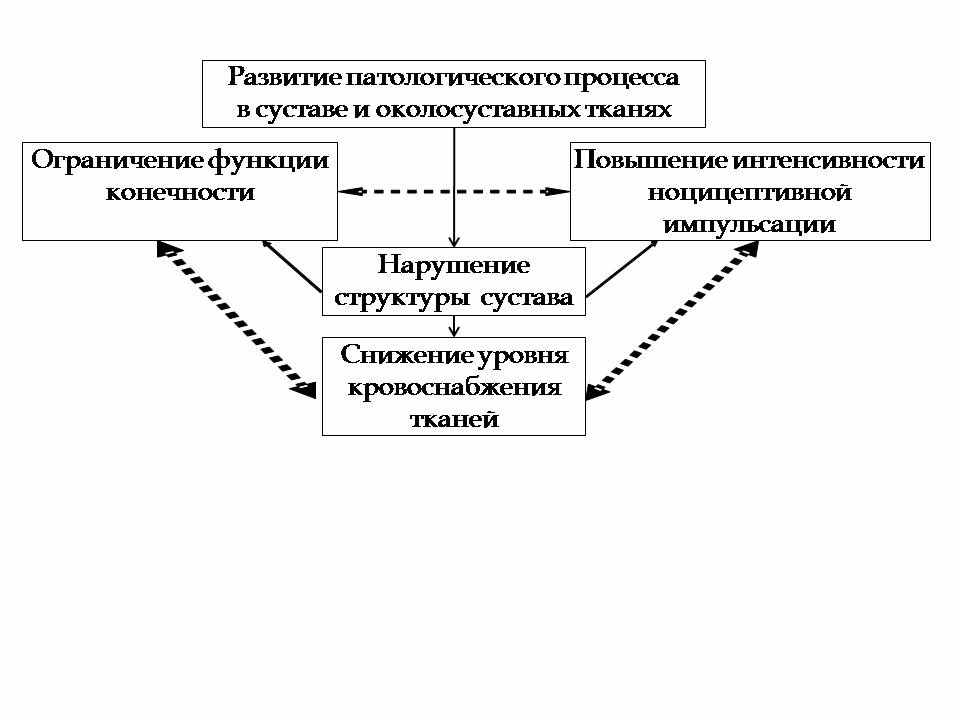
Рис. 1. Механизм снижения функционального состояния мышц нижних конечностей у больных остеоартрозом
При остеоартрозах крупных суставов нижних конечностей у больных регистрируются как локальные, так и системные изменения в организме. На начальном этапе заболевания, до развития выраженных клинических проявлений заболевания, включаются механизмы, способствующие компенсаторному повышению функциональных возможностей. С развитием заболевания прогрессирует ограничение двигательной активности. Снижение средних значений амплитуды ЭМГ у больных ОА свидетельствует о недостаточности активационных возможностей тестированных мышц, механизм развития которой сводится к трём взаимосвязанным составляющим – это повышенный уровень ноцицептивной афферентации, ограничение подвижности и снижение уровня кровоснабжения конечности (рис. 1).
Подография. Из временных параметров ходьбы наиболее информативным является длительность двухопорного периода, увеличение которого свидетельствует о нарушении структуры локомоторного акта, утраты необходимых качеств упругости, координированности и экономичности ходьбы. Анализ результатов подографии показал, что у мужчин при I-III стадиях ОА длительность двухопорного периода составила 0,063-0,067 с при опоре на интактную конечность, а на пораженную – 0,061-0,070 с. У женщин этот период при опоре на интактную конечность был равен 0,068-0,071 с, при опоре на пораженную – 0,070-0,073 с. При начальной стадии ОА на больной конечности увеличивалась длительность цикла шага на 6-13 % (физиологическая асимметрия не превышает 5 %) за счет увеличения времени интервала опоры на всю стопу, что способствует статической устойчивости при ходьбе. Обеспечение устойчивости также достигалось увеличением двуопорного периода шага на интактной конечности при уменьшении его на больной (на 12-22 %).
Вариабельность траектории Центра Давления (ЦД) увеличивается как на больной, так и на интактной конечности, что является компенсаторным механизмом частичного покрытия энергетического дефицита при ходьбе. У всех пациентов отмечалось уменьшение амплитуды составляющих главного вектора опорных реакций – переднего и заднего толчков при уменьшении величины демпферного провала и уменьшение соотношения задний/передний толчок, что свидетельствовало о снижении рессорной функции стопы.
Таким образом, анализ результатов физиологических исследований показал, что компенсаторно-защитные механизмы, способствующие повышению функциональных возможностей организма включаются уже на ранних стадиях ОА.
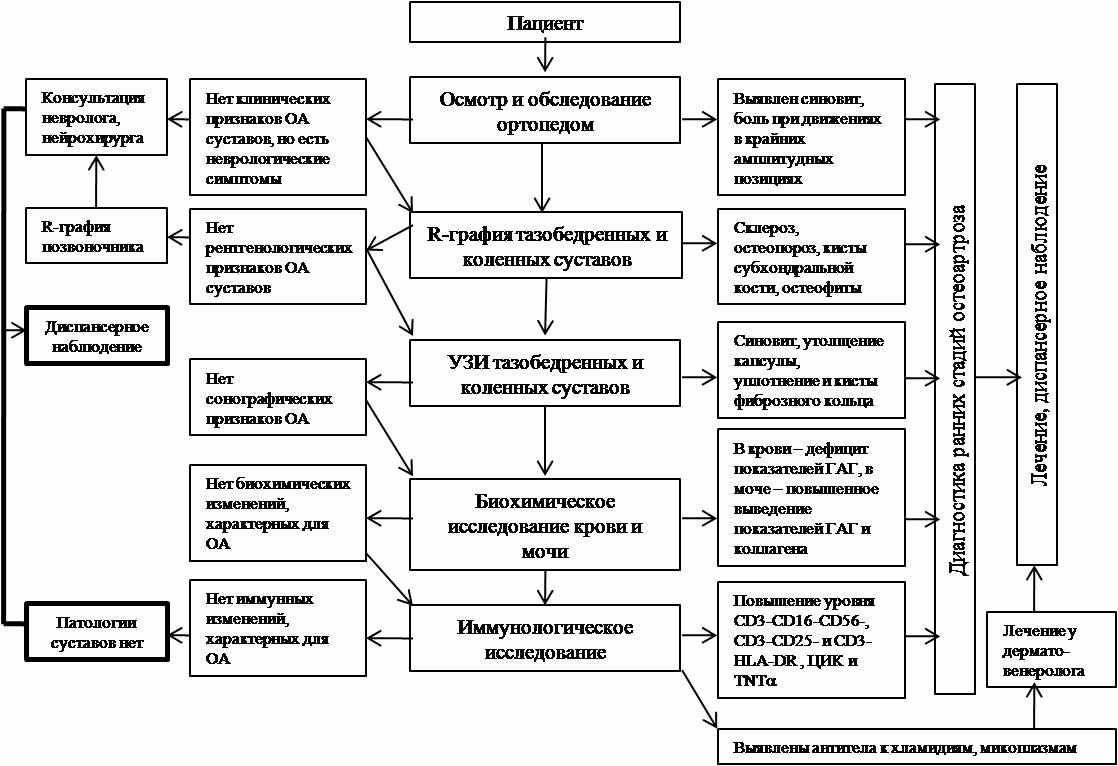
Алгоритм обследования больных в поликлинических условиях для выявления раннего остеоартроза крупных суставов
В результате комплексного изучения начальных проявлений ОА нами разработан алгоритм обследования больных в условиях поликлиники, куда, в первую очередь, обращаются больные с мышечно-суставным болевым синдромом и невыраженной клинико-рентгенологической картиной заболевания.
Алгоритм представлен в виде схемы (рис. 2), оформлен и зарегистрирован в виде медицинской технологии, которая предназначена для применения врачами общей практики и травматологами-ортопедами в поликлиниках лечебно-профилактических учреждений.
На первичном приеме врач травматолог-ортопед осматривает больного и заполняет амбулаторную карту с внесением данных ортопедического статуса, назначает поэтапное рентгенологическое и сонографическое обследование суставов, биохимическое исследование крови и мочи, иммунологическое обследование пациента. В результате оценки каждого из этапов обследования выявляются или не выявляются диагностические признаки раннего ОА. Диагностировать ранние стадии ОА возможно уже после проведения клинико-рентгенологического и ультразвукового обследования суставов. Каждый из последующих этапов обследования (биохимическое исследование сыворотки крови и мочи, иммунологическое исследование) позволяет получить дополнительные данные для подтверждения диагностики дистрофического поражения синовиальной среды основных опорных сочленений.