Фисенко елена полиектовна инструментальная диагностика осложнений контурной пластики тела гелевыми имплантатами
| Вид материала | Автореферат |
- На правах рукописи, 814.77kb.
- Тамбовское областное государственное учреждение, 105.55kb.
- Методика исследования специального оборудования не требуется. Для сбора кала используют, 74.49kb.
- Ультразвуковая диагностика и малоинвазивные методы лечения осложнений после оперативных, 622.01kb.
- А. С. Попов Изобретение радио Г. Маркони Современные средства связи (телевидение, сотовая, 27.99kb.
- Итоговые контрольные вопросы по факультетской терапии для 4 курса педиатрического факультета, 127.74kb.
- Фисенко Игнат Захарович: Жизнь семьи Фисенко до ареста отца Обыск, ссылка семьи в Томскую, 77.74kb.
- Календарно-тематический план лекций по курсу «Общая хирургия и анестезиология», 98.95kb.
- Перспективный метод лечения ожирения и его осложнений, 7885.05kb.
- «Белорусская медицинская академия последипломного образования», 397.72kb.
Результаты исследования пациентов после выполнения пластики инъекционным введением безоболочечных гелей (II группа)
Анализ результатов инструментального исследования пациенток после контурной пластики тела безоболочечными гелевыми имплантатами позволил выделить признаки начальных процессов дегидратации и деградации инъекционно введенного геля с помощью УЗИ, в виде его неравномерного уплотнения и фрагментации, в фазу латентных изменений, без клинических проявлений. Мы согласны с мнением Ю.В. Неугодова с соавт. (1999) и И.В. Крайника с соавт. (2002), что данная ультразвуковая картина геля указывает на возникновение ранних осложнений данного вида пластики, и не позволяет согласиться с выводами А.В. Плеханова (2000), считающего зоны неоднородности внутри инъекционно введенного геля вариантом неосложненного послеоперационного периода.
После увеличивающей маммопластики подобные изменения были зафиксированы уже через 2 недели, лица и нижних конечностей через 3-6 месяцев, что указывает на необходимость динамического наблюдения за данной группой пациентов через 1, 6, 12 месяцев после пластики и далее ежегодно.
Процесс миграции геля от места введения выявлен у всех обследованных пациенток после увеличивающей маммопластики (100,0%), нижних конечностей (100,0%) и у 81,5% пациенток после пластики лица. Очаги миграции определялись в подкожной клетчатке, мышцах, межмышечных пространствах, лимфатических узлах.
Определены преимущественные пути миграции инъекционно введенного геля и разработаны схемы поиска очагов миграции геля в зависимости от зоны коррекции:
- после увеличивающей маммопластики из ретромаммарного пространства миграция осуществлялась в ткань молочной железы (100,0%) и окружающие мягкие ткани грудной клетки (100,0%), преимущественно веерообразно вверх до подмышечной, подключичной и парастернальной областей, реже – вниз до подвздошной области (4,8%);
- после пластики нижних конечностей в 100,0% случаях миграция осуществлялась вниз по внутренней поверхности ног вплоть до стопы (36,8%), реже – по наружной и передней поверхностям (5,3%);
- после пластики лица гель мигрировал из области вертикальных морщин лба в область переносицы, из области губ – к основанию губы, в проекцию носогубных складок, из носогубных складок - веерообразно вверх и латерально (81,5%), реже вниз до угла нижней челюсти и на шею (1,.1%).
Тщательное планомерное УЗИ, выполненное по разработанным схемам, позволило выявить мелкие очаги миграции геля, начиная от 3-4 мм, еще до появления клинической картины. Панораму поражения, особенно при обширной отдаленной миграции, а также общий объем геля в мягких тканях определяли с помощью МРТ.
Миграция геля в ткань молочной железы вызывала формирование картины, симулирующей наличие у пациенток ФКБ, на что также было указано в ряде предшествующих работ (Плеханов А.В., 2000; Пшениснов К.П. с соавт., 2006). В результате проведенного исследования определены ультразвуковые дифференциально-диагностические критерии ФКБ и миграции геля в ткань молочной железы по совокупности признаков: локализация максимально расширенных протоков (при ФКБ – за соском, при прорыве геля – над местом прорыва), их форма и внутреннее содержимое (ветвистые анэхогенные при ФКБ, трубчатые, причудливые с неоднородным внутренним содержимым – при прорыве геля), наличие в окружающих мягких тканях вне железистого треугольника дополнительных жидкостных включений – очаги миграции геля из ретромаммарного пространства.
Отдельно лежащие фрагменты геля, окруженные плотной гиперэхогенной капсулой неравномерной толщины (от 0,3 до 1,5 мм), с неоднородным внутренним содержимым и перегородками, по данным гистологии представляли собой гелеому: очаг хронического асептического лимфоцитарного воспаления, формирующийся вокруг скоплений геля при продолжительном нахождении последнего в ткани.
По данным УЗИ соотношение ан-, гипо- и гиперэхогенных включений в гелеомах было различным, что совпадает с мнением W.E. Svensson (1997) и H. Madjar (2000): преобладание анэхогенного компонента выявлено в 46,0% наблюдений – кистозный тип, преобладание гиперэхогенных (склеротических) структур – в 3,0%, смешанный тип – в 51,0% наблюдений. В крупных гелеомах, размер которых был более 1,0 см, в 61,0% наблюдений определялись кровеносные сосуды, в том числе радиально направленные к центру образования (по данным гистологии врастание соединительной ткани и кровеносных сосудов происходит с периферии гелеомы), скорость кровотока в них достоверно не отличалась от аналогичных показателей артерий окружающих мягких тканей. Так в гелеомах молочной железы показатели скорости кровотока составили: Vmax=0,11±0,04 м/с; Vmin=0,04±0,02 м/с; RI=0,64±0,06; РI=2,08±0,52 и были сопоставимы с показателями кровотока в собственных артериях молочной железы у женщин контрольной группы.
Выявление гелеом в области мягких тканей лица и ног не вызывало больших затруднений. Наибольшие сложности для диагностики представляли гелеомы, сформированные в проекции молочной железы, симулирующие наличие таких образований, как кисты, абсцессы, фиброаденомы и рак. Наиболее значимые дифференциально-диагностические признаки новообразований молочной железы и осложнений гелевой пластики (гелеом) представлены в таблице 4.
Таблица 4
Дифференциально-диагностические ультразвуковые критерии новообразований молочной железы и гелеом
 Вид образования Вид образованияКритерии оценки | Доброкачественные образования | Злокачественные образования | Гелеомы |
| Локализация | Железистый треугольник | Железистый треугольник | Все слои мягких тканей передней грудной стенки и молочной железы |
| Дополнительные образования вне молочной железы | Не характерно | Не характерно | Характерно (100%) |
| Форма образования | Правильная | Неправильная | Неправильная |
| Контур образования | Ровный | Неровный | Неровный |
| Границы образования | Четкие | Нечеткие | (Не) четкие |
| Структура образования | Однородная | Неоднородная | Неоднородная |
| Сосудистый рисунок окружающих тканей | Не усилен * | Усилен (95.1%) | Не усилен * |
| Пограничные артерии | Определяются (94,5%) | Определяются (98,4%) | Не определяются |
| Радиальный ход сосудов | Не отмечено | Отмечено | Отмечено |
| Изменения спектра кровотока: -отсутствие позднего диастолического потока -наличие ретроградного потока | Не отмечено | Отмечено: (23,8%) (21,4%) | Не отмечено |
* Локальное усиление сосудистого рисунка мягких тканей выявлено только при развитии острого воспалительного процесса.
В результате проведенного исследования по совокупности ультразвуковых признаков (В-режим, ЦДК, спектральный анализ кровотока) чувствительность УЗИ в выявлении гелеом молочной железы составила 98,0%, специфичность – 88,7%, точность диагностики – 92,1%. При подозрении на злокачественный процесс пациентам выполняли рентгеновскую маммографию по стандартному протоколу с морфологической оценкой процесса.
Для скрининговой оценки мягких тканей на предмет наличия острого воспалительного процесса применяли УЗИ. Многократные оперативные вмешательства изменяли типичную ультразвуковую картину тканей, структура была перестроенная, грубая, с множественными гиперэхогенными включениями (зоны фиброза) и не имела специфических признаков воспаления по данным В-режима. Применение ультразвуковой допплерографии позволило выявить в этих зонах дополнительные признаки – локальное усиление сосудистого рисунка и повышение скорости кровотока по сравнению с симметричными участками тела или неизмененными тканями в 1,5-2,0 раза в 100,0% наблюдений, что позволило повысить эффективность диагностики острого воспалительного процесса на 48,0% (рис.8).
В зонах регионарного лимфооттока соответствующих анатомических областей (подмышечные, паховые, подчелюстные и околоушные) в 69,7% наблюдений выявлялись увеличенные лимфатические узлы с сохраненной эхоструктурой, что указывало на их реактивную гиперплазию. Васкуляризация их была повышена в 38,2% наблюдений.
Наиболее тяжелыми были гнойно-деструктивные осложнения (абсцессы – 19,1%, флегмоны – 10,1% наблюдений), развившиеся в области нижних конечностей и молочной железы (рис.9), у пациенток после инъекционной пластики безоболочечными гелями, с вовлечением в процесс всех слоев мягких тканей анатомической зоны поражения: на ногах – мышцы, подкожная клетчатка и кожа, в молочной железе – железистый треугольник, подкожная клетчатка, кожа и прилежащие грудные мышцы.
 %
%+46%
+47%
+40%
28%
26% 15%

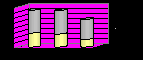
Рис.8. Частота выявления острого воспалительного процесса у пациенток после инъекционной контурной гелевой пластики тела
по данным УЗИ с применением режима ЦДК
Это приводило к необходимости удаления больших фрагментов мягких тканей с последующим возмещением утерянного объема путем реэндопротезирования с помощью оболочечных (силиконовых) эндопротезов.
Удалить одномоментно полностью мелкие островки геля технически не представлялось возможным. Повторные удаления фрагментов геля необходимы, т.к. они являются источниками хронической инфекции, создают условия для рецидива и прогрессирования осложнений. Однако это становится возможным только после их слияния в более крупные “озера”, доступные для манипуляций хирурга. Процесс укрупнения мелких гелевых фрагментов фиксировали только при проведении динамического УЗИ. При этом у всех пациенток через 3-12 месяцев определялось увеличение объема оставшихся фрагментов геля (за счет выдавливания их оболочечным эндопротезом, дополнительного притока геля от периферийных фрагментов) и формирование гелеом. Повторные воспалительные процессы вокруг оставшихся фрагментов геля выявлены у 32 пациенток (74,4%).
82%
75%
55%
37%
18%
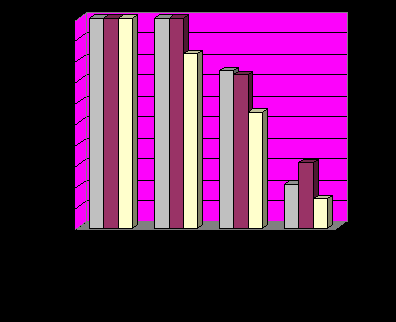 % 100% 100%
% 100% 100%73%
28%

фрагментация миграция острое гнойно-дистрофические
геля геля воспаление процессы
Рис.9. Выявленные осложнения у пациенток после контурной пластики тела инъекционным введением безоболочечного геля
Непосредственно перед очередной операцией проводили активный поиск геля по предполагаемым путям миграции, применяя разработанные схемы, с проведением предоперационной разметки фрагментов геля.
Дополнительно проводилась оценка оболочечного силиконового эндопротеза по разработанному алгоритму. В случаях прилежания гелеом к стенке эндопротеза отмечена деформация контура последнего, бóльшая волнистость его капсулы, локальное утолщение перипротезной фиброзной капсулы в зонах прилежания к гелевым скоплениям. Оценка перипротезной фиброзной капсулы была затруднена из-за выраженной неоднородности окружающих мягких тканей из-за развития фиброза. Капсулярная контрактура развилась у 2 пациенток, в двух наблюдениях выявлен разрыв силиконовых эндопротезов голеней. У 1 пациентки выявлен рак молочной железы. Патология, выявленная в результате динамического наблюдения за пациентами после повторных оперативных вмешательств, представлена на рис.10.


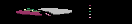
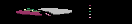
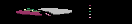
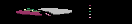
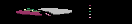
Рис.10. Патология, выявленная у пациенток II группы, перенесших многократные повторные хирургические вмешательства
В результате применения разработанной методики и оптимизации ультразвукового изображения удалось повысить показатели диагностической информативности УЗИ в выявлении осложнений контурной пластики тела с помощью оболочечных и безоболочечных гелевых имплантатов: чувствительность – до 95,9%, специфичность до 82,6%, точность диагностики – до 90,8%. Высокая чувствительность метода позволила применять его на этапе скринингового обследования и динамического контроля за пациентами после данного вида пластики. МРТ использовали как уточняющий метод при неясных и сомнительных результатах УЗИ.
На основании полученных данных разработан этапный алгоритм инструментального исследования пациенток после контурной гелевой пластики тела оболочечными и безоболочечными гелевыми имплантатами (рис.11).
I этап – скрининг. УЗИ по разработанному протоколу с оценкой имплантата и мягких тканей в зоне коррекции (с обязательным применением режима цветового картирования). При отсутствии патологии на этом инструментальное исследование завершали. При выявлении отклонений формулировали предварительную концепцию заключения на основании клинического осмотра, дополненного данными УЗИ, и определяли конкретные задачи для МРТ.
II этап – уточняющий. Выполнение МРТ.
III этап – детализация, разметка. При выявлении осложнений, подлежащих хирургической коррекции, выполняли повторно УЗИ непосредственно перед операцией для определения динамики изменений, для детальной оценки интересуемых участков и для предоперационной разметки объектов, подлежащих удалению. При необходимости выполняли лечебные и диагностические пункции под ультразвуковым контролем.
IV этап – динамическое наблюдение. Выполняется с помощью УЗИ. Все пациенты после данного вида пластики должны находиться под динамическим ультразвуковым контролем, придерживаясь предложенных схем в зависимости от места и вида коррекции.
Первый осмотр после установки оболочечных силиконовых эндопротезов молочной железы важно проводить в раннем послеоперационном периоде, далее – желательно 1 раз в 2 года. После пластики безоболочечными имплантатами и удаления геля из мягких тканей первый осмотр необходимо проводить через месяц после операции, через полгода, далее – не реже 1 раза в год. При отсутствии отрицательной динамики на УЗИ МРТ не выполняли, что позволило уменьшить частоту проведения МРТ в 2,6 раза.
ВЫВОДЫ
1. Необходимость проведения динамического наблюдения за пациентами после контурной гелевой пластики тела с применением инструментальных методов исследования продиктована возрастающей частотой и тяжестью развивающихся осложнений в послеоперационном периоде.
2. Разработанная система оценок, протокол исследования мягких тканей и гелевых имплантатов (оболочечных и безоболочечных) после контурной гелевой пластики тела позволяют повысить чувствительность ультразвукового исследования в выявлении осложнений гелевой пластики до 96,0%.
3. Наиболее частыми осложнениями увеличивающей маммопластики оболочечными силиконовыми эндопротезами, требующими проведения лечебных мероприятий, являются капсулярная контрактура (13,1%), воспалительные изменения (8,2%) и разрывы имплантата (6,5%).
4. Оценка состояния перипротезной фиброзной капсулы необходима для раннего выявления капсулярного фиброза и капсулярной контрактуры. При неосложненном варианте увеличивающей маммопластики толщина фиброзной капсулы составляет 0,3±0,04 мм, при капсулярном фиброзе достигает 0,5±0,04 мм (p<0,05), капсулярной контрактуре - 0,9±0,045 мм (p<0,05). Локальный капсулярный фиброз развивается в зоне формирования серомы, гематомы и воспалительных изменений мягких тканей, окружающих эндопротез. Ранняя диагностика патологического капсулообразования позволяет своевременно проводить лечебно-профилактические мероприятия, направленные на изменение размеров перипротезной полости.
5. Чувствительность магнитно-резонансной томографии в диагностике разрывов оболочечных силиконовых эндопротезов после увеличивающей маммопластики составляет 100,0%, чувствительность ультразвукового исследования снижается у пациенток с капсулярной контрактурой после повторных хирургических вмешательств и составляет 88,3%, специфичность методов сопоставима – 88,2% и 86,7%, соответственно.
6. Преимуществом ультразвукового исследования перед магнитно-резонансной томографией является возможность детализации обнаруженных изменений, что позволяет выявить начальные проявления осложнений контурной пластики тела инъекционно введенными безоболочечными гелями в виде уплотнения, фрагментации и миграции геля еще на стадии латентных изменений независимо от места коррекции.
7. Дифференциальная диагностика заболеваний молочной железы и осложнений увеличивающей маммопластики проводится по совокупности ультразвуковых признаков в режиме серой шкалы, состоянию сосудистого рисунка и спектров кровотока в режиме ультразвуковой допплерографии. При остром воспалительном процессе мягких тканей, расположенных вокруг скоплений геля, скорость кровотока повышается в 1,5-2,0 раза, при хроническом воспалительном процессе достоверных отличий от нормальных показателей не зафиксировано. Точность диагностики гелеом молочной железы составляет 92,1% при чувствительности достигающей 98,0%.
8. Состояние мягких тканей и гелевых имплантатов (оболочечных и безоболочечных) после контурной пластики тела следует оценивать с помощью инструментальной диагностики по разработанному алгоритму: первоначальным скрининговым этапом является ультразвуковое исследование и при осложненных вариантах течения уточняющим методом служит магнитно-резонансная томография.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Первый осмотр после установки оболочечных силиконовых эндопротезов молочной железы важно проводить в течение первых двух недель, далее – желательно 1 раз в 2 года. После удаления инъекционно введенного безоболочечного геля первый осмотр желательно проводить через месяц после операции, через полгода, далее – не реже 1 раза в год для выявления оставшихся фрагментов геля. По показаниям скрининговое ультразвуковое исследование может проводиться так часто, как требует этого клиническая необходимость.
2. Для повышения эффективности ультразвукового исследования необходимо использовать высокочастотные датчики и современные технологии, улучшающие качество получаемого изображения.
3. После контурной инъекционной гелевой пластики тела всем пациентам необходимо проводить активный поиск очагов миграции геля по предложенным схемам, в зависимости от места коррекции.
4. Исследование мягких тканей вокруг скоплений геля необходимо выполнять с обязательным применением ультразвуковой допплерографии, что позволяет повысить диагностику острых воспалительных процессов на 48,0%.
5. Для предотвращения развития капсулярного фиброза и капсулярной контрактуры необходимо проводить комплекс мероприятий, направленных на уменьшение количества жидкости вокруг силиконового эндопротеза в раннем послеоперационном периоде (тщательная компрессия, противовоспалительная терапия, пункция серомы и гематомы, более продолжительный курс массажа для предотвращения развития патологического формирования фиброзной капсулы) под контролем ультразвукового исследования.
6. Дифференциальная диагностика фиброзно-кистозной болезни и миграции геля в ткань молочной железы проводится по определению локализации максимально расширенных протоков (при фиброзно-кистозной болезни – за соском, при прорыве геля – над местом прорыва), их форме и внутреннему содержимому (ветвистые анэхогенные при фиброзно-кистозной болезни, трубчатые, причудливые с неоднородным внутренним содержимым – при прорыве геля).
7. При необходимости проведения дифференциальной диагностики новообразований молочной железы с очагами миграции безоболочечного геля и гелеомами рекомендуется использовать разработанные серошкальные и допплерографические ультразвуковые критерии по характеристике локализации образований, их эхоструктуре, васкуляризации и спектральному анализу кровотока. При подозрении на злокачественное новообразование в собственной молочной железе следует выполнять стандартную рентгеновскую маммографию с последующей морфологической оценкой процесса.
