 Авторефераты по всем темам >>
Авторефераты по ветеринарии
Авторефераты по всем темам >>
Авторефераты по ветеринарии
Создание и результативность научно-обоснованной системы повышения эффективности вакцинопрофилактики инфекционных заболеваний у животных с выраженным иммунодефицитным состоянием
Автореферат докторской диссертации по ветеринарии
|
Страницы: | 1 | 2 | 3 | |
Шилова Евгения Николаевна
СОЗДАНИЕ И РЕЗУЛЬТАТИВНОСТЬ НАУЧНО-ОБОСНОВАННОЙ СИСТЕМЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ВАКЦИНОПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ У ЖИВОТНЫХ С ВЫРАЖЕННЫМ ИММУНОДЕФИЦИТНЫМ СОСТОЯНИЕМ
06.02.02 - ветеринарная микробиология, вирусология, эпизоотология,аа
микология с микотоксикологией и иммунология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора ветеринарных наук
Екатеринбург - 2011
Работа выполнена в отделе вирусных инфекций ГНУ Уральского научно-исследовательского ветеринарного института Российской академии сельскохозяйственных наук.
Научный консультант: |
академик Россельхозакадемии, |
доктор биологических наук, профессор |
|
Донник Ирина Михайловна |
|
Официальные оппоненты: |
Заслуженный деятель науки РФ, |
доктор ветеринарных наук, профессор |
|
Околелов Владимир Иванович |
|
доктор биологических наук, профессор |
|
Сидорова Клавдия Александровна |
|
доктор ветеринарных наук |
|
Ибишов Джалаир Фейруз-оглы |
|
Ведущая организация: |
ФГУ Федеральный центр токсикологической и радиационной безопасности животных, г. Казань |
Защита состоится л___ декабря 2011 года в л___ часов на заседании диссертационного совета Д 006.099.01 при Уральском научно-исследовательском ветеринарном институте РАСХН (корпус №2, ул. Главная, 21)
Адрес: ГНУ Уральский НИВИ Россельхозакадемии
620142 г. Екатеринбург, ул. Белинского, 112а
тел/факс (343) 257-64-82, 257-82-63
Адрес сайта института: http://
С диссертацией можно ознакомиться в библиотеке ГНУ Уральского научно-исследовательского ветеринарного института Россельхозакадемии
Автореферат разослан л __ ________ 2011 .
Ученый секретарь диссертационного совета,
кандидат ветеринарных наука Печура Е.В.
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Инфекционные болезни животных и птиц распространены во всем мире и наносят большой ущерб животноводству (Бакулов И.А. 2008; Джавадов Э.Д., 2008; Панин А.Н., 2008; Ибишов Д.Ф., 2008; Околелов В.И., 2009; Смирнов П.Н., 2009; Самуйленко А.Я. 2010; Ощепков В.Г., 2010; Рахманов А.М. и др., 2010; Смирнов А.М., 2010; Донник И.М., 2010; Wright P.F. et al., 1992; Relman D.A. et al., 2010; OIE, 2010 и др.). В системе мер их ликвидации широкое применение имеет вакцинопрофилактика, однако по ряду причин ее проведение не всегда может стабилизировать ситуацию. В сложившихся экономических условиях многие сельхозорганизации не имеют возможности проводить профилактические прививки (Гуленкин В.М. и др., 2001).
Среди остропротекающих инфекционных заболеваний животных наибольший материальный ущерб во многих странах мира причиняют острые респираторные болезни крупного рогатого скота (ОРВИ), ведущим патогенном в которых является возбудитель инфекционного ринотрахеита (Юров К.Л., 2001; Глотов А.Г. и др., 2009; Мищенко В.А., 2011; В Уральском регионе оздоровление племенных и товарных хозяйств от ОРВИ проводится с 1999 г., широкое внедрение оздоровительной программы позволило купировать эпизоотический подъем (Петрова О.Г., Татарчук А.Т., Хаматов М.Ф. и др., 2005-2007). Однако, вирусоносительство среди племенного стада продолжает служить причиной формирования респираторной и генитальной патологии (Юров К.П. и др., 2003; Нежданов А.Г. и др., 2011).
При управлении эпизоотическим процессом ОРВИ эффективная вакцинопрофилактика, как правило, предотвращает появление клинических признаков у крупного рогатого скота, но в условиях иммунодефицитов, как следствия воздействия разного рода факторов, необходимы новые комплексные подходы к организации противоэпизоотических мероприятий (Смирнов П.Н., 2009; Донник И.М., 2010).
В последнее время одной из наиболее значимых зоонозов, представляющих угрозу современному птицеводству,а является и высокопатогенный грипп А (pN1) (Смирнов А.М., 2006, 2010; Джавадов Э.Д., 2008; Lee Y.-J. et al., 2008; Grabkowsky B.J., Windhorst H.-W., 2010 и др.). В 2010 г. ситуация в мире по гриппу А птиц остается эндемической, неблагополучиеа отмечено в ряде азиатских и европейских стран, которые продолжают сообщать о возобновлении вспышек (OIE, 2010). Болезнь продолжает оказывать значительное влияние на здоровье птиц и наносит значительный экономический ущерб при ограничении производства птицеводческой продукции и торговле. При этом, наиболее эффективный способ контроля гриппа птиц - ранняя диагностика и иммунизация ( В Российской Федерации особая опасность в распространении гриппа связана с птицей, содержащейся на личных подворьях и крупных комплексах открытого типа для выращивания водоплавающей птицы (Смирнов А.М., 2010). Очевидной является также обоснованность проведения вакцинопрофилактики гриппа в зонах массовых скоплений диких перелетных водоплавающих птиц. Применение эффективной системы иммунизации данных популяционных групп позволит создать лиммунное кольцо вокруг птицефабрик и предупредить выделение возбудителя в случае его заноса с дикой птицей (Ирза В.Н., 2006). Поэтому поиск наиболее иммуногенной авакцины, разработка способов повышения эффективности вакцинации является одной из приоритетных задач науки.
Цель исследований: Разработать и оценить результативность научно-обоснованной системы комплексной профилактики инфекционных болезней на примере острых вирусных инфекций крупного рогатого скота и птиц.
Задачи исследований:
- Дать оценку эпизоотической ситуации в регионе по острым и хроническим инфекциям и инвазиям, выделить основные значимые нозологии и охарактеризовать существующую систему противоэпизоотических мероприятий в регионе.
- Изучить иммуногематологический и биохимический статус животных по ряду показателей. Определить экзо- и эндогенные афакторы, влияющие на формирование иммунных реакций при проведении специфической профилактики (наличие ксенобиотиков, микотоксинов, тяжелых металлов, паразитов, вакцинных и прочих антигенов, генетические особенности, продуктивность).
- Изучить клинические и серологические показатели эффективности специфической профилактики острых респираторных вирусных инфекций крупного рогатого скота при использовании инактивированных и живых вакцин.
- Изучить формирование иммунитета и методы его повышения при специфической профилактике острых инфекционных заболеваний на примере гриппа птиц А.
- Разработать научно-обоснованную систему комплексной профилактики инфекционных заболеванийа животных и птиц с учетом региональных особенностей и оценить ее результативность.
Научная новизна:
В условиях региона проведена комплексная оценка факторов, оказывающих влияние на эффективность вакцинации животных при разных нозологиях. Впервые в племенных и товарных предприятиях Уральского региона проведена оценка эффективности вакцинации против острых инфекций крупного рогатого скота на примере ОРВИ с учетом региональных особенностей. Изучена эффективность живых и инактивированных вакцин против ОРВИ крупного рогатого скота. Учтена роль технологических факторов в возникновении вирусных заболеваний. На основании полученных данных дополнен Регламент оздоровительных мероприятий приа ОРВИ крупного рогатого скота и разработана комплексная научно-обоснованная система профилактики инфекционных болезней животных в регионе.
Впервые на поголовье промышленной птицы была изучена иммуногенность разных вакцин против гриппа птиц А и предложены способы ее повышения.
Практическая значимость работы. Основные материалы исследования вошли в Регламент оздоровительных мероприятий при ОРВИ крупного рогатого скота в племенных и товарных хозяйствах Свердловской области и внедрены в 28-ми сельскохозяйственных организациях. Результаты работы учтены при составлении Комплексного плана мероприятий по предупреждению возникновения и распространения гриппа птиц на территории Свердловской области в 2008-2009 гг.. По результатам исследований разработано 11 рекомендаций, из которых 4 утверждены научно-техническим советом Министерства сельского хозяйства и продовольствия Свердловской области, 1 рекомендации утверждены Бюро отделения ветеринарной медицины Россельхозакадемии, 1 рекомендации иа Руководство имеют гриф МСХ РФ.
Проведенные исследования позволили сделать существенный вклад в эпизоотическое благополучие Свердловской области по острым инфекциям животных и птиц, сократить заболеваемость ОРВИ на 18-30%, успешно профилактировать грипп птиц при острой угрозе заноса инфекции в субъект.
Положения, выносимые на защиту:
- Эпизоотическая ситуация на Среднем Урале по основным острым и хроническим заболеваниям крупного рогатого скота и птиц является благополучной (ликвидированы туберкулез, бруцеллез, лейкоз), основные нозологии представлены факторными инфекциями (колибактериоз, сальмонеллез, пастереллез), природноочаговыми (лептоспироз, бешенство), из острых наиболее актуальны острые респираторные вирусные инфекции крупного рогатого скота и угроза заноса гриппа А птиц, чем обусловлена существующая система противоэпизоотических мероприятий.
- Иммуногематологический и биохимический статус крупного рогатого скота в Уральском регионе неоднороден, зависит от экологических факторов (в отдельных территориях), генетических особенностей популяции, уровня продуктивности. Выявлена иммунопатология у 90% животных.
- На формирование иммунных реакций у животных и птицы в Уральском регионе преимущественно оказывают влияние ксенобиотики, микотоксины, поступающие с кормами, а также доля кровности по голштинскому скоту и продуктивность.
- Эффективность специфической профилактики острых респираторных вирусных инфекций крупного рогатого скота в регионе неодинакова и преимущественно зависит от состояния иммунной системы, а также от вида вакцины.
- Формирование иммунитета при вакцинопрофилактике острых инфекций у птиц решающее значение имеют клинико-биохимический статус и иммуногенность вакцин.
- Разработанная и внедренная в производство региональная научно-обоснованная система комплексной профилактики инфекционных болезней животных и птиц показала значительную эффективность при оздоровлении от ОРВИ крупного рогатого скота и профилактике заноса гриппа птиц А в регионе.
ичное участие диссертанта в получении научных результатов, изложенных в работе. Автор принимала личное участие в проведении эпизоотологического исследования ситуации по острым инфекциям животных в сельхозорганизациях, проведении клинических, патоморфологических исследованиях, отборе проб, проведении лечебных и профилактических обработок животных, проведении пробоподготовки, вирусологических и серологических исследований. В работу вошли результаты исследований, проведенных совместно с научными сотрудниками отдела экологии и иммунопатологии Уральского НИВИ: зав. отделом докт.вет.наук, профессором И.А. Шкуратовой, канд. ветер. наук, доцентом М.В. Ряпосовой, канд. ветер. наук А.И. Белоусовым, канд. ветер. наук О.С. Бодровой, канд. ветер. наук А.С. Заслоновым, канд. биол. наук Е.Н. Беспамятных и др., за что автор приносит им большую благодарность.
Апробация работы. Основные положения диссертационной работы доложены и обсуждены на международных (Саранск, 2004 г.; Щелково, 2005г.; аТроицк, 2006 г.; Омск, 2009 г.; Самара, 2009 г.; Санкт-Петербург, 2011 г.; Екатеринбург, 2005, 2007, 2008, 2010 гг.), всероссийских (Челябинск, 2004 г.; г.Санкт-Петербург, 2007; Новочеркасск, 2009 г.) конференциях, на Ученых советах ГНУ Уральского НИВИ РАСХН (2008Ц2010 гг.),
Публикации. Всего по теме диссертации опубликовано 61 печатная работа, из них 15 в изданиях, рекомендованных ВАК РФ (журнал Ветеринария - 1, журнал Ветеринария Кубани - 6, журнал Аграрный вестник Урала - 8). Опубликовано 11 рекомендаций, из которых 4 утверждены научно-техническим советом Министерства сельского хозяйства и продовольствия Свердловской области и 1 с грифом УМО, а также 1 руководство с грифом МСХ РФ.
Объем и структура диссертации. Диссертационная работа изложена на 302 страницах компьютерного текста, состоит из введения, обзора литературы, описания материалов и методов исследований, результатов собственных исследований, обсуждения результатов исследований, выводов, практических предложений, списка литературы и приложения. Материалы диссертации иллюстрированы 46 таблицами и 74 рисунками. Список литературы включает 322 источника, в том числе 108 - иностранных авторов.
2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работа выполнена в отделе вирусных инфекций ГНУ Уральского научно-исследовательского ветеринарного института Российской академии сельскохозяйственных наук. Экспериментальные исследования проводили на базе племенных и товарных сельскохозяйственных организациях молочного направления Уральского региона (Свердловской, Тюменской, Курганской, Челябинской области), выбранных в качестве модельных.
Работа проведена в 2006-2011 гг. в соответствии с планом научно-исследовательских работ по теме: Разработка и внедрение эффективной системы оздоровительных мероприятий при смешанных острых респираторных болезнях крупного рогатого скота, обеспечивающей получение здорового молодняка, высокое качество биопродукции племпредприятий (№ государственной регистрации 01.2.00613099).
Лабораторная диагностика проведена на базе лабораторно-диагностического центра Уральского НИВИ, вирусологического отдела ОГУ Свердловская областная ветеринарная лаборатория, имеющих государственную аккредитацию на проведение исследований.
Ретроспективную оценку эпизоотической ситуации по инфекциям на территории Среднего Урала, изучение противоэпизоотической эффективности технологических, ветеринарно-санитарных и специальных мероприятий, внедряемой системы, осуществляли на основе материалов учета и отчетности ветеринарной службы (сведения по ф.1, 1а, 2, 4).
Вирусологические исследования патологического (трахея, доли легкого) и биоматериала (смывы с носовых оболочек) проводили согласно ГОСТ 25755-91 Методы лабораторной диагностики инфекционного ринотрахеита крупного рогатого скота. Наличие вируса в культуре клеток устанавливали по цитопатическому действию в первично трипсинизированных клеточных культурах (КСТ - клетки сердца теленка, ПЭК - почки эмбриона коровы) и перевиваемой линии почки телёнка МДВК.
Для диагностики вирусной диареи крупного рогатого скота полимеразной цепной реакцией применяли метод Real-Time на RotorGene 3000 (Corbett Reserch, Австралия). Применяли Тест-систему ВД для выявления возбудителя вирусной диареи крупного рогатого скота методом полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией в режиме реального времени (ООО ИнтерЛабСервис, г. Москва).
ПЦР-диагностику инфекционного ринотрахеита крупного рогатого скота, хламидиоза и микоплазмоза проводили методом гель-документации, амплификацию проводили на термоциклере Applied Biosystems 2720, визуализацию и учет - на трансиллюминаторе Biorade. Использовали тест-системы:а ХЛА-КОМ, МИК-КОМ, Тест-систему для диагностики инфекционного ринотрахеита крупного рогатого скота методом полимеразной цепной реакции (НПО Нарвак, г. Москва), согласно наставлению по применению.
Серологические исследования проводили согласно ГОСТ 25755-91 УМетоды лабораторной диагностики инфекционного ринотрахеита крупного рогатого скотаФ.
Специфический иммунитет к возбудителям инфекционного ринотрахеита оценивали исследованнием сыворотки крови иммуноферментным анализом (ИФА) с антигенами инфекционного ринотрахеита, реакции непрямой гемагглютинации (РНГА) с антигенами инфекционного ринотрахеита. Постановку реакции, учет и интерпретацию полученных данных проводили согласно инструкции каждого из наборов, рекомендованных фирмой-производителем, утвержденной в установленном порядке. Использовали Набор диагностикумов для серологическойа диагностики ринотрахеита крупного рогатого скота методом непрямой гемагглютинации (РНГА) (ООО Агровет, г. Москва), Набор диагностикумов парагриппа-3 крупного рогатого скота (РТГА) (ФГУП Курская биофабрика), Набор для выявления антител к вирусу инфекционного ринотрахеита крупного рогатого скота иммуноферментным методом ИРТ-СЕРОТЕСТ (АНО НИИ ДПБ, г. Москва). Иммуноферментный анализ проводили согласно инструкции к диагностическому набору, реакцию учитывали на ридере Tecan Sunrise, USA.
Титры антител к вирусам ИРТ, ПГ-3 КРС выражали в обратных величинах в виде log2 и lg.
Специфические антитела к возбудителям ОРВИ определяли в сыворотке молозива новотельных коров. Молозиво брали из каждой четверти вымени в равных объемах и объединяли для получения средней пробы. Получение сыворотки молозива проводили, обезжиривая пробы центрифугированием (10-20 мин при 3000-5000 об./мин), удаляли верхний слой, хранили в замороженном виде при температуре -20?С до исследования (В.А. Мищенко, В.М. Захаров и др., 2003). Определение содержания антител в сыворотке молозива проводили с использованием перечисленных диагностических наборов согласно инструкции к применению.
Гематологические исследования по общепринятым методикам включали: определение количества эритроцитов, лейкоцитов (Г.А. Симонян, Ф.Ф. Хисамутдинов, 1995). Массовую концентрацию гемоглобина в крови определяли гемоглобинцианидным методом по Л.М. Пименовой и Г.В. Дервизу (1974) с использованием набора химических реактивов. Лейкограмму выводили при подсчете процентного соотношения клеток в мазках крови, окрашенных по Романовскому-Гимзе. Определяли показатели клеточного и гуморального звена иммунитета: содержание Т-лимфоцитов (Е-РОЛ) в реакции спонтанного розеткообразования с эритроцитами барана (М.А. Бажин, 1989; Р.В. Петров, 1992), В-лимфоцитов (М-РОЛ) - методом спонтанного розеткообразования с эритроцитами мыши (Д.К. Новиков, В.И. Новикова, 1996), определяли соотношение Т и В-лимфоцитов (индекс Т/В). аФагоцитарную активность нейтрофилов определяли методом опсоно-фагоцитарной реакции (П.Н. Смирнов, 1989) с использованием культуры золотистого стафилококка (штамм 209).
Биохимические исследования проведены на полуавтоматическом биохимическом анализаторе Vitalon 400 с использованием стандартных наборов реактивов фирмы Vital Diagnostics Spb, а также на автоматическом биохимическом анализаторе ChemWell Combi (Awareness Technology, USA).
Гельминтологические исследования флотационным комбинированным методом Дарлинга с центрифугированием, использовали насыщенный раствор сахарозы. Наличие трематодозов и ларвальных цестодозов оценивали по данным отчетов лабораторий ВСЭ и мясоперерабатывающих предприятиях (ОГУ Свердловская областная ветеринарная станция по борьбе с болезнями животных).
Определение макро- и микроэлементов в кормах проводили на атомно-адсорбционном спектрофотометре АА-6800 FG. Для уменьшения потерь элементов использовали метод СВЧ-минерализации в фторопластовых автоклавах в системе MARS 5, CEM, USA. Определяли содержание меди, цинка, селена, железа.
Иммуноферментный анализ кормов и сырья на содержание микотоксинов проводили в соответствии ГОСТ Р 52471-2005 Иммуноферментный метод определения микотоксинов на приборе SunriseЦBesic Tecan, укомплектованным программным обеспечением BioChec, с использованием тест-систем Agra-Quant (США). Определяли содержание фумонизина, Т-2 токсина, деоксиниваленола (ДОН), зеараленона, охратоксина, афлотоксина.
Для микробиологических, молекулярно-биологических, биохимических, спектральных исследований применяли деионизированную воду, полученную с использованием системы очистки воды Milli-Q Gradient (Millipore, France).
Для вакцинации крупного рогатого скота разных возрастных групп против инфекционного ринотрахеита и парагриппа-3 в сельскохозяйственных предприятиях Уральского региона применяли следующие вакцины:
- Комбовак-Р, инактивированная комбинированная вакцина против ИРТ, ВД, ПГ-3, респираторно-синцитальной инфекции, рота-коронавирусной болезни телят, пастерелеза (НПО Нарвак, г. Москва, Россия),
- Бови-шилд Голд FP5 L5, вакцина из двух компонентов, содержащих живые аттенуированные возбудители инфекционного ринотрахеита крупного рогатого скота (IBR), вирусной диареи (BVD), парагриппа-3 (PI3), респираторно-синтициальной инфекции (BRSV), а также инактивированные лептоспиры серогрупп: L. Canicola, L. Grippotyphosa, L. Hardjo L. Icterohaemorrhagiae и L. Pomona с добавлением гентамицина (не более 30 мкг/мл) и мертиолята (не более 0,01 %) качестве консервантов (Pfizer, США).
- Бовилисо IBR Markerа - живая маркированная вакцина для специфической профилактики от инфекционного ринотрахеита КРС (Intervet, Нидерланды)
- Бовилис Bovipast - инактивированная вакцина против парагриппа-3 (ПГ-3), респираторно-синцитиальной инфекции (РС) и пастереллеза крупного рогатого скота (Intervet, Нидерланды).
Пробы сыворотки крови для серологического исследования отбирали через 14, 30 дней после введения вакцины, а также при оценке эффективности отдельных вакцин - через 45, 60, 90 дней.
Оценку эффективности вакцинации против гриппа экспериментальной (виварной) и промышленной птицы проводили на базе вивария ГНУ Уральский НИВИ, птицефабрики Камышловской (Свердловская обл.), Катайском гусеводческом комплексе (Курганская обл.).
Изучение иммуногематологических показателей у экспериментальной и виварной птицы включало определение содержания гемоглобина (по Л.М. Пименовой и Г.В. Дервизу, 1974) с использованием набора химических реактивов (И.П. Кондрахин, 2004), количество эритроцитов и лейкоцитов (И.А. Болотников, Ю.В. Соловьев, 1980). Для характеристики клеточного и гуморального иммунитета проводили количественное определение Т- и В-лимфоцитов в реакции розеткообразования по И.Ю. Ездаковой, О.М. Чуйко, Е.О. Чадиной (2008). Лизоцимную активность сыворотки крови птиц определяли фотоэлектроколометрическим методом по Дорофейчуку А.Г. с культурой М. lisodecticus и изменением температурного режима реакции сыворотки крови гусей с 37 до 39С.
Бактерицидную активностьа сыворотки крови определяли по методу Мишеляа Теффера в модификации О.В. Смирновой и Т.А. Кузьминой (1966) с суточной культурой E.coli и изменением температурного режима реакции сыворотки крови гусей с 37 до 39С.а Фагоцитарную активность нейтрофилов методом опсонофагоцитарной реакции (П.Н. Смирнов, 1989) с использованием культуры тест-микробаа St. aureus.
Напряженность поствакцинального иммунитета к возбудителю гриппа птиц Аа определяли в реакции торможения гемагглютинации (РТГА) с использованием стандартного диагностического набора. Применяли Набор антигенов и сывороток для диагностики гриппа птиц в реакции торможения гемагглютинации (РТГА) (OOO Щелковский завод фармацевтических и ветеринарных препаратов). Среднегеометрический титр антител выражали в обратных величинах в виде log2.
Для оценки эффективности вакцин против гриппа А птиц применяли следующие биопрепараты:
- Инактивированная эмульгированная вакцина против гриппа птиц из штамма Н5N1 (ОАО Покровский комбинат биопрепаратов, г. Покров);
- Экспериментальная инактивированная вакцина против высоко-патогенного гриппа птиц (ВПГП) подтипа Н5 (ГНУ ВНИВИП РАСХН, г. С. - Петербург);
- Инактивированная эмульгированная вакцина против гриппа птиц подтипа Н5 (ФГУП Ставропольская биофабрика, г. Ставрополь).
Экономический эффект проводимых лечебно-профилактических мероприятий рассчитывали согласно методическим рекомендациям по определению экономической эффективности ветеринарных мероприятий, утвержденным ГУВ МСХ и П РФ 21.02.1997 г.
Всего выполнено: 1380 серологических исследований у крупного рогатого скота в РНГА, 488 серологических исследований у крупного рогатого скота в РТГА, 320 серологических исследований у крупного рогатого скота в ИФА, 1574 серологических исследований у птиц в РТГА, 186 проб кормов исследовано на микотоксины иммуноферментным анализом, 128 проб исследовано методом ПЦР на инфекционные заболевания крупного рогатого скота, проведено 35 вирусологических исследований патологического и биоматериала от телят и коров, 9513 биохимических, 2262 иммуногематологических исследований у крупного рогатого скота, 3366 иммуногематологических и 342 биохимических исследований у птиц.
Достоверность результатов подтверждали путем статистической обработки и определения различий средних значений с помощью критерия Стьюдента. Результаты считали достоверными при Р<0,05. Для обработки полученных данных использовали программу Microsoft Excel, входящую в пакет программ Microsoft Office Pro.
Благодарности: приношу большую благодарность за всестороннюю научно-методическую помощь в выполнении работы докт. ветер. наук, профессору И.А. Шкуратовой, канд. ветер. наук А.Т. Татарчуку, начальнику управления ветеринарии МСХиП Свердловской области, канд. ветер. наук В.А. Красноперову, специалистам МСХиП Свердловской области и ОГУ ветеринарии, всем научным сотрудникам ГНУ УрНИВИ за помощь в организации и проведении исследований.
3. Результаты собственных исследований
3.1. Оценка эпизоотической ситуации по инфекционным заболеваниям в регионе
Мониторинг эпизоотической ситуации по основным острым и хроническим заболеваниям крупного рогатого скота и птиц показал благополучие по большинству инфекций. Свердловская область стационарно благополучна по основным инфекционным заболеваниям крупного рогатого скота: сибирская язва не регистрируется с 1978 г., эмфизематозный карбункул отмечен в виде единичных случаев (в 2010 г.). Отмечено эпизоотическое благополучие по ящуру, туберкулезу (с 2005 г.), бруцеллезу (с 1986 г.), лейкозу (с 2011 г.). Основные регистрируемые нозологии представлены природно-очаговыми и факторными инфекциями.
Из природно-очаговых инфекций наиболее часто регистрируются случаи бешенства животных. В 2006-2010 гг.а отмечали рост случаев: в 2006 г. было лабораторно подтверждено 29 случаев бешенства, в 2007 г. - 54 случая, в 2008 г. - 36, в 2009 - 20, в 2010 - 79 случаев. При этом, бешенство в 2010 г. у крупного рогатого скота регистрировали в 18% выявленных случаев.
В области отмечено наличие природных очагов лептоспироза в ряде сельскохозяйственных районов, обусловленных циркуляцией L.interrogans (серотипы Pomona, Tarrasovi, Icterohaemorrhagiae, Sejroe, Canicola и Hebdomadis). Ежегодно, по данным Областной ветеринарной лаборатории, выявляется более 20% положительно реагирующих в РМА животных, антитела к патогенным лептоспирам отмечаются более, чем у 40% абортирующих коров, однако из абортплодов и мочи возбудитель не выделяется.
В течение 2006-2009 г., не смотря на отсутствие эпизоотических очагов, Свердловская область являлась угрожаемой по гриппу птиц А, т.к. вспышки ГП отмечали в соседних Тюменской, Курганской, Челябинской областях. На период угрожающей эпизоотической ситуации был реализован разработанный совместно с Управлением ветеринарии Министерства сельского хозяйства и продовольствия Свердловской области Комплексный план мероприятий по предупреждению возникновения и распространения гриппа птиц на территории Свердловской области, утвержденный распоряжением Председателя Правительства Свердловской области, способствующий предупреждению заноса инфекции.а
При проведении мониторинга биоматериала от домашней и дикой птицы возбудитель гриппа pN1, а также антитела к полевому штамму не выделяли на всей территории субъекта.
С 01.01.2010 г. инструктивным письмом №25-25/130 от 28.01.2010 Департамента ветеринарии Минсельхоза России были сокращены зоны вакцинации против гриппа птиц А/Н5, в Уральском регионе угрожающими остались территории Курганской и Тюменской области, через которые пролегают пути сезонной миграции перелетных птиц.
Факторные инфекции в сельскохозяйственных организациях Свердловской области (колибактериоз, сальмонеллез, пастереллез) являются основной причиной отхода молодняка в виде падежа, санитарного убоя, технологического отхода. В отдельных районах общий отход к обороту стада в 1,5-1,9 раз превышает средние значения по области. При этом, доля отхода телят по причине падежа по Свердловской области в 2008-2010 гг. была на уровне 85-87%, вынужденного убоя по причине заболеваний 57-59%. Санитарный убой молодняка крупного рогатого скота составил 40-53% от общего убоя. По колибактериозу телят (штаммы E.coli F41, K88, K99, A20) ежегодно регистрируют неблагополучие в 30-ти фермах (при этом диагноз в подтверждали, в среднем, в 48% случаях). Сальмонеллез телят (Salm. dublin, Salm. enteritidis, Salm. typhymurium) ежегодно подтверждается, в среднем, в 24% случаев (до 20 ферм). Выделение возбудителей пастереллеза из патологического материала при подозрении на пастереллез отмечено, в среднем, в 8% случаев (Past.multocida).
Во всех модельных хозяйствах были выявлены нозологии молодняка крупного рогатого скота, обусловленные наличием условно-патогенной и патогенной бактериальной микрофлоры. В 2006-2010 гг. у телят, содержащихся в данных хозяйствах, отмечали все значимые бактериальные болезни молодняка (колибактериоз, сальмонеллез, пастереллез), в двух предприятиях неблагополучие по факторным инфекциям было представлено только одной нозологической единицей - сальмонеллезом.
Анализ распространения основных гельминтозов крупного рогатого скота показал, что наибольшее распространение в модельных хозяйствах имеют фасциолез (встречается в 58,3%) и цистицеркоз (отмечен в 41,7%). Также распространены стронгилятозы желудочно-кишечного тракта (отмечены в 33,3%), и диктиокаулезы (в 25%), которые, помимо поражения желудочно-кишечного тракта, участвуют в формировании респираторной патологии у молодняка крупного рогатого скота.
В плане реализации противоэпизоотических мероприятий во всех хозяйствах взрослые животные получают ежегодно до 11-ти иммунизаций (считая ревакцинации), молодняк - до 12 иммунизаций, из которых в отдельных фермах 4 введения вакцины проводят в первый месяц жизни. Непрерывная схема иммунизации животных на фоне воздействия разнообразных факторов внешней среды, в т.ч. экологических, оказывает влияние на полноценность иммунного ответа у животных. Поэтому в таких условиях эффективность вакцинации как профилактического мероприятия резко снижается, а временами она оказывается нецелесообразной.
3.2. Оценка воздействия факторов внешней среды, обуславливающих накопление поллютантов в организмеа и приводящих к развитию иммунодефицитных состояний у животных
В промышленных регионах часть сельскохозяйственных организаций расположены или имеют угодья для выращивания кормов в зоне интенсивного антропогенного загрязнения продуктами радиоактивных аварий и инцидентов (аварии в НПО Маяк, 1957, 1964 гг.), промышленными выбросами предприятий, в основном, металлургического профиля. Приоритетными загрязнителями при этом являются радиоактивные элементы (90Sr, 137Cs) и тяжелые металлы (Pb, Cd, Cu, Ni и др.). Наиболее высокое загрязнение радиоактивными элементами на Среднем Урале зарегистрировано ва районах с наиболее развитым животноводством и птицеводством.
Ранее проведенными исследованиями (И.М. Донник и соавт., 1996-2010) на данных территориях отмечено высокое содержание 90Sr в снеговых осадках - в Каменском районе 19-65 МБк/км2 (в среднем, 42,74МБк/км2), в Богдановическом - 34-41 МБк/км2 (в среднем, 37,76 МБк/км2). Также высокие значения отмечены в Белоярском районе - в среднем, 32,9 МБк/км2. Выпадение радионуклидов со снеговыми осадками коррелировало с накоплением их в тканях и органах животных (превышение допустимых уровней а90Sr в костях в 1,5-3 раза).
У животных из районов, испытывающих техногенный прессинг, уровень накопления меди в печени превышал МДУ (максимально допустимые уровни) в 6-28 раз, свинца в мышцах и печени - в 2-10 раз, цинка в печени - в 1,5-2 раза, кадмия - в 1,4-2 раза, никеля - в 9-12 раз.
В сельскохозяйственных организациях, расположенных в других районах (Ирбитский, Алапаевский, Сысертский) экологическую ситуацию можно охарактеризовать как благополучную, что связано с отсутствием на их территории предприятий металлургической промышленности и радиоактивного следа. В Красноуфимском районе, как в месте складирования и хранения монацитового концентрата, в отдельных зонах мы отмечали высокую концентрацию радона в припочвенном воздухе (И.М.Донник, Е.Н.Корсакова, 1999). Красноуфимский и Ачитский районы являются природными биогеохимическими провинциями по недостатку селена, в этих же районах отмечается недостаток меди и железа, а в отдельных местах - цинка.
Исследования, проведенные совместно с И.А.Шкуратовой, А.И. Белоусовым (2010) показали, что во всех кормах, отобранных в сельскохозяйственных организациях Уральского региона, был выявлен дефицит эссенциальных элементов.
В отдельных изучаемых хозяйствах дефицит кобальта в рационе дойного стада асоставил 1,3-3,8 раз, селена - в 1,4-2,3 раз. Избыток поступления железа с кормом отмечен на юго-западе регионе (в 1,8 раз), дефицит его поступления - на юго-востоке (до 3,3 раз). Недостаток поступления меди и цинка отмечен также в южных районах: в 1,9-3,5 и 2,7-3,2 раз соответственно. Как избыток, так и хроническая недостаточность этих биоэлементов могут приводить к развитию патологических состояний у животных.
Кроме того, неудовлетворительные погодные условия, затрудняющие качественную заготовку кормов, приводили к накоплению микотоксинов в кормах, превышающих МДУ в 66,7%, в 50% исследованных проб при этом были выделены микотоксины в количествах, превышающих допустимые уровни.
Наиболее неблагоприятная обстановка по контаминации микотоксинами кормов отмечена в предприятиях Белоярского, Сысертского, Сухоложского районов. В Белоярском районе при оценке суммарного поступления микотоксинов со всеми видами корма установлено, что, в среднем, уровень Т2-токсина был превышен в 26 раз, содержаниеа афлотоксина превышало МДУ в силосе - в 8,2 и зерносмеси - в 5,6 раз, охратоксина в сенаже - в 12 раз (рис.1). В Сысертском районе установлено повышенное содержание Т2-токсина и ДОН в силосе - в 7,2 и 3,1 раз соответственно, охратоксина в силосе и зерносмеси - в 6 и 21 раз соответственно.
В Сухоложском районе отмечали превышение МДУ по двум видам микотоксинов одновременно: ДОН - в 1,3 раза и охратоксин - в 5,78 раз.
Таким образом, определяющим фактором, действующим на животных в промышленных регионах, является массовое поступление в организма экотоксикантов с питьевой водой, кормами, что сопровождается их значительным накоплением в органах и тканях.
Вторым значимым фактором является поступление с кормом микотоксинов в количествах, превышающих МДУ.
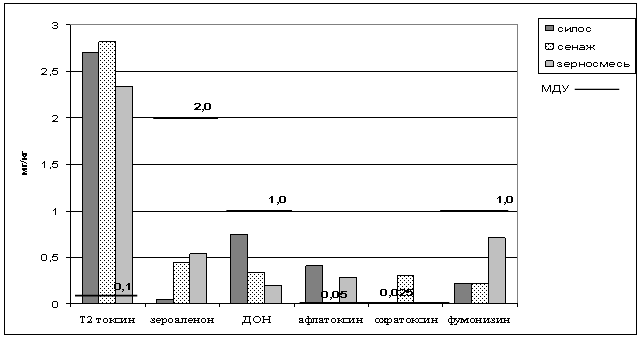
Рисунок 1 - Поступление микотоксинов с кормами на фермах Белоярского района
|
Страницы: | 1 | 2 | 3 | |
 Авторефераты по всем темам >>
Авторефераты по ветеринарии
Авторефераты по всем темам >>
Авторефераты по ветеринарии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА