Книга вторая Дж. Эдвард Морган-мл. Мэгид С. Михаил Перевод с английского
| Вид материала | Книга |
- Книга первая Дж. Эдвард Морган-мл. Мэгид С. Михаил Перевод с английского, 10010.77kb.
- А. Конан-Дойль новоеоткровени е перевод с английского Йога Рàманантáты, 2314.23kb.
- Copyright Сергей Александровский, перевод с английского Email: navegante[a]rambler, 619.61kb.
- "книга непрестанности осириса " 177, 7373.41kb.
- Н. М. Макарова Перевод с английского и редакция, 4147.65kb.
- Трудового Красного Знамени гупп детская книга, 2911.61kb.
- Трудового Красного Знамени гупп детская книга, 2911.77kb.
- Уайнхолд Б., Уайнхолд Дж. У 67 Освобождение от созависимости / Перевод с английского, 11462.2kb.
- Малиновской Софьи Борисовны Специальность: журналистика Специализация: художественный, 969.08kb.
- Духовные истины в психических явлениях перевод с английского 3-е издание Москва «Философская, 1557.75kb.
Минимальный объем мониторинга включает ЭКГ, АД и пульсоксиметрию. Для мониторинга дыхательных шумов используют прекордиальный стетоскоп. Очень важно следить за уровнем сознания пациента; наилучшим методом считается поддержание с ним непрерывного вербального контакта. Для выполнения кардиоверсии необходим де-фибриллятор, способный вырабатывать синхронизированный и несинхронизированный разряд постоянного тока мощностью до 400 Дж. Нужно также иметь оборудование для наружной ЭКС. Необходимо обеспечить надежный внутривенный доступ. Кроме того, в помещении для кардиоверсии должен иметься следующий минимум оборудования и медикаментов:
• Функционирующий дыхательный мешок с маской, позволяющий обеспечить ингаляцию 100 % кислорода (гл. 3).
• Источник кислорода (из системы централизованной разводки медицинских газов или полный кислородный баллон).
• Ротоглоточные и носоглоточные воздуховоды, ларингоскопы и эндотрахеальные трубки.
• Отсос, готовый к работе.
• Набор анестетиков, включающий не менее одного препарата с седативно-гипнотическим эффектом, а также сукцинилхолин.
• Тележка для экстренной помощи, содержащая все необходимые препараты и оборудование для СЛР (гл. 48).
^ Какая методика анестезии показана при кардиоверсии?
Премедикация необязательна. Требуется только очень короткая (1-2 мин) амнезия или поверхностная общая анестезия. Можно использовать барбитураты короткого действия (метогекситал), пропофол, этомидат или бензодиазепины (например, мидазолам, диазепам). После предварительной оксигенации 100 % кислородом в течение 3-5 мин дробными дозами каждые 2-3 мин вводят препарат седативно-гипнотического действия (например, метогекситал, 20 мг), в то время как с больным поддерживают вербальный контакт. Разряд наносят, когда больной теряет способность разговаривать, а иногда — в момент исчезновения роговичного рефлекса. Разряд обычно пробуждает больного. Иногда возникают преходящая обструкция дыхательных путей или апноэ, особенно после нанесения нескольких разрядов.
^ С какими осложнениями сопряжена кардиоверсия?
Осложнения включают преходящую депрессию миокарда, ятрогенные аритмии и артериальные эмболии. Возникновение аритмии чаще всего обусловлено неадекватной синхронизацией, но иногда даже правильно синхронизированная кардиоверсия приводит к фибрилляции желудочков. Большинство аритмий носят преходящий характер и исчезают без лечения. Иногда отмечается подъем сегмента ST, однако концентрация креа-тинфосфокиназы в сыворотке (МВ-фракция) обычно остается нормальной. Причиной замедленного пробуждения после кардиоверсии может стать эмболия.
^ Как вести больного после кардиоверсии ?
Хотя обычно сознание у таких больных восстанавливается очень быстро, их нужно вести так, как будто им проводили общую анестезию (гл. 49). В процессе восстановления больного необходимо следить за возможным развитием рецидива аритмии и симптомов эмболии мозговых артерий.
Избранная литература
Estafanous F. G., Barash P. G., Reves J. G. Cardiac Anesthesia: Principles and Clinical Practice. Lippincott, 1994.
Fabian J. A. Anesthesia for Organ Transplantation. Lippincott, 1992.
Hensley F. A., Martin D. E. A Practical Approach to Cardiac Anesthesia, 2nd ed. Little, Brown, 1995.
Kaplan J. A. Cardiac Anesthesia, 3rd ed. Saunders, 1993.
Anesthesia, Churchill
Kaplan J. A. Vascular Livingstone, 1991.
Lake C. L. Pediatric Cardiac Anesthesia, 2nd ed. Appleton & Lange, 1993.
Roizen M. F. Anesthesia for Vascular Surgery. Churchhill Livingstone, 1990.
Yeager M. P., Glass D. D. Anesthesiology and Vascular Surgery. Appleton & Lange, 1990.
22
Физиология дыхания и анестезия
Значительная часть современой анестезиологической практики по существу представляет собой прикладную физиологию дыхания. Так, действие наиболее распространенных анестетиков — ингаляционных — зависит от их поглощения и элиминации в легких. Основные побочные эффекты ингаляционных и неингаляционных анестетиков связаны с дыханием. Миорелаксация, необычное положение пациента на операционном столе и некоторые специальные пособия (например, однолегочная ИВЛ и искусственное кровообращение) — все это оказывает глубокое влияние на дыхание.
В настоящей главе обсуждаются основные положения физиологии дыхания, необходимые для понимания и выполнения различных анестезиологических методик; здесь также представлена в систематизированном виде информация о влиянии общей анестезии на дыхание. Механизм действия отдельных анестетиков на дыхание рассматривается в других разделах руководства.
^ Клеточное дыхание
Главная функция легких — обеспечение газообмена между венозной кровью и вдыхаемым воздухом. Необходимость газообмена обусловлена аэробным характером клеточного метаболизма, что требует непрерывного поступления в организм кислорода и выведения углекислого газа.
^ 1. АЭРОБНЫЙ МЕТАБОЛИЗМ
В норме практически во всех клетках человеческого организма энергетический обмен происходит аэробным путем, т. е. с использованием кислорода. Углеводы, жиры и белки превращаются в дикарбо-новые фрагменты (ацетил-КоА), которые включаются в цикл лимонной кислоты в митохондриях (гл. 34). В ходе превращения ацетил-КоА в CO2 образуется энергия, которая запасается в форме вос-
становленного никотинамидадениндинуклеотида (НАДН). В результате процесса, называемого окислительным фосфорилированием, эта энергия впоследствии преобразуется в аденозинтрифосфат (АТФ). Окислительное фосфорилирование потребляет более 90 % поступающего в организм кислорода и представляет собой серию переносов электронов, сопряженных с синтезом АТФ и происходящих с участием ферментов (цитохромов). На последнем этапе молекулярный кислород восстанавливается до воды.
Для глюкозы, основного источника энергии клетки, суммарное уравнение превращений таково:
C6H12O6 + 6O2 -» 6CO2+ 6H2O + Энергия.
Образовавшаяся энергия (1270 кДж) аккумулируется в третьей фосфатной связи при присоединении фосфата к аденозиндифосфату (АДФ):
^ Энергия + АДФ + ф -> АТФ.
При окислении одной молекулы глюкозы образуется 38 молекул АТФ. Энергия, аккумулированная в АТФ, используется для работы ионных насосов, мышечного сокращения, синтеза белка или клеточной секреции; в этих процессах вновь образуется АДФ:
^ АТФ -»АДФ + Ф + Энергия.
АТФ не может запасаться. On должен постоянно синтезироваться, что требует непрерывной доставки метаболических субстратов и кислорода к клеткам.
Отношение объемов образовавшегося CO2 (VCO2) и поглощенного O2 (VO2) называется дыхательным коэффициентом (RQ). Величина дыхательного коэффициента обычно указывает на тип использованного метаболического субстрата. Дыхательный коэффициент для углеводов, жиров и белков равен 1,0; 0,7 и 0,8 соответственно. VCO2 составляет около 200 мл/мин, тогда как VO2 —
250 мл/мин. Поскольку белки обычно не являются основным источником энергии, то дыхательный коэффициент, равный 0,8, по-видимому, отражает использование и жиров, и углеводов. Потребление кислорода можно косвенно оценить по формуле (гл. 7):
VO2= 10 х (массатела)374.
^ 2. АНАЭРОБНЫЙ МЕТАБОЛИЗМ
При анаэробном метаболизме, в отличие от аэробного метаболизма, образуется очень небольшое количество АТФ. В отсутствие кислорода АТФ может синтезироваться только при превращении пирувата в молочную кислоту. В ходе анаэробного метаболизма при окислении каждой молекулы глюкозы образуются две молекулы АТФ (в отличие от 38 молекул АТФ при аэробном распаде). Образовавшаяся энергия равна 67 кДж. Более того, развивающийся лактат-ацидоз резко ограничивает активность ферментов, участвующих в превращениях. Когда напряжение кислорода возвращается к норме, лак-тат вновь преобразуется в пируват, и аэробный метаболизм возобновляется.
^ 3. ВЛИЯНИЕ АНЕСТЕЗИИ НА КЛЕТОЧНЫЙ МЕТАБОЛИЗМ
Общая анестезия умемьшает VO2 и VCO2 приблизительно на 15 %. Помимо того, образование углекислого газа и поглощение кислорода дополнительно снижаются за счет гипотермии (гл. 21). В наибольшей степени уменьшается потребление кислорода в головном мозге и сердце.
Функциональная анатомия системы дыхания
^ 1. ГРУДНАЯ КЛЕТКА И ДЫХАТЕЛЬНАЯ МУСКУЛАТУРА
Грудная клетка содержит два легких, каждое из которых заключено в собственную плевру. Верхняя часть грудной полости невелика по размерам, в ней располагаются трахея, пищевод и к-ровеносные сосуды. Основание грудной полости образовано диафрагмой — главной дыхательной мышцей. При сокращении диафрагмы ее купол опускается на 1,5-7 см и содержимое грудной клетки (легкие) растягивается. Движения диафрагмы обычно обеспечивают 75 % изменения объема грудной полости. Вспомогательная дыхательная мускулатура также увеличивает объем грудной клетки и способствует растяжению легких, воздействуя на ребра. Первые де-
сять пар ребер соединяются сзади с позвонками и, направляясь вниз и изгибаясь кпереди, прикрепляются к грудине. Движения ребер вверх и наружу приводят к увеличению объема грудной клетки.
В норме диафрагма и, в меньшей степени, наружные межреберные мышцы отвечают за вдох; выдох происходит пассивно. При возрастании дыхательных усилий в акт дыхания вовлекаются также грудино-ключично-сосцевидные, лестничные и грудные мышцы. Грудино-ключично-сосцевидные мышцы помогают поднимать грудную клетку, тогда как лестничные мышцы предотвращают смещение верхних ребер внутрь во время вдоха. Грудные мышцы способствуют увеличению объема грудной клетки, когда руки упираются в неподвижную опору. Выдох в норме осуществляется пассивно в положении лежа на спине, но становится активным в положении стоя, а также при возрастании дыхательных усилий. Выдох облегчают некоторые мышцы живота (прямые, наружные и внутренние косые и поперечная) и внутренние межреберные мышцы. Они помогают движению ребер вниз.
Кроме обычно рассматриваемой дыхательной мускулатуры, для процесса дыхания важны также некоторые мышцы глотки, обеспечивающие проходимость верхних дыхательных путей (гл. 5). Тоническая pi рефлекторная активность подборо-дочно-язычной мышцы при вдохе позволяет удерживать язык на определенном расстоянии от задней стенки глотки. Тоническая активность мышцы, поднимающей нёбную занавеску, мышцы, напрягающей нёбную занавеску, нёбно-гло-точной и нёбно-язычной мышц предотвращает за-падение мягкого нёба, особенно в положении лежа на спине.
^ 2. ТРАХЕОБРОНХИАЛЬНОЕ ДЕРЕВО
Трахеобронхиальное дерево обеспечивает проведение потока газа в альвеолы. Увлажнение и фильтрация вдыхаемого воздуха осуществляется в верхних дыхательных путях (в носу, во рту и в глотке). Дихотомическое деление (каждый бронх разветвляется на два меньших бронха), начинающееся с трахеи и заканчивающееся в альвеолярных мешочках, включает 23 порядка, или генерации (рис. 22-1). При каждом делении количество дыхательных путей приблизительно удваивается. Каждый альвеолярный мешочек содержит в среднем 17 альвеол. Общее количество альвеол составляет около 300 млн, у взрослого человека они формируют огромную площадь газообмена — 50-100 м2.
При каждом делении элементов трахеоброн-хиального дерева характер эпителия их слизистой оболочки и подлежащих структур постепенно меняется. Эпителий переходит от реснитчатого столбчатого к кубическому и затем к плоскому альвеолярному. Газообмен может осуществляться только через плоский эпителий, который появляется в дыхательных бронхиолах (бронхи 17-19-го порядка), Стенки дыхательных путей постепенно теряют хрящевую основу (в бронхиолах) и гладкую мускулатуру. Утрата хрящевой основы приводит к тому, что с уменьшением диаметра проходимость дыхательных путей становится зависимой от радиального растяжения, обусловленного эластическими структурами окружающих тканей. Вследствие этого диаметр мелких дыхательных путей определяется общим объемом легких.
Реснички столбчатого и кубического эпителия синхронно движутся таким образом, что слизь, вырабатываемая железами дыхательных путей,
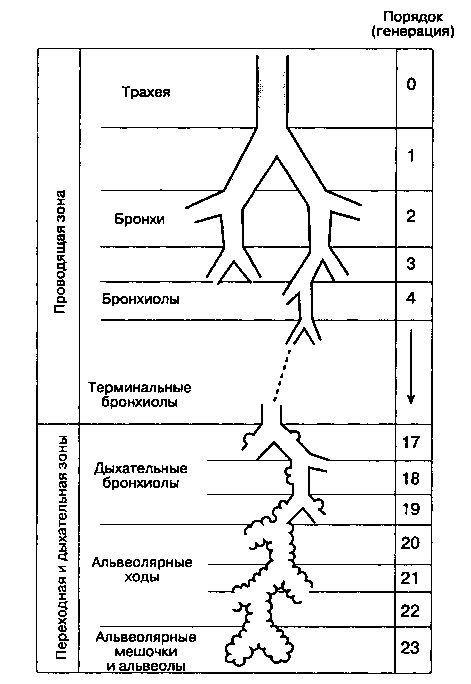
Рис. 22-1. Дихотомическое ветвление дыхательных путей. (С разрешения. Из: Weibel E. R. Morphometry of the Human Lung. Springer-Verlag, 1963.)
а также бактерии и частицы, подлежащие удалению, продвигаются вверх по направлению к полости рта.
Альвеолы
Размер альвеол определяется силой тяжести и объемом легких. Средний диаметр альвеолы составляет 0,2 мм. При вертикальном положении тела наиболее крупные альвеолы располагаются в верхушках легких, самые маленькие — у основания. При вдохе разница в объеме альвеол уменьшается.
Каждая альвеола находится в тесном контакте с сетью легочных капилляров. Стенки альвеолы устроены асимметрично (рис. 22-2). В респираторной (тонкой) части стенки альвеолы капиллярный эндотелий и альвеолярный эпителий разделены только их клеточными и базальной мембранами. В нереспираторной (толстой) части стенки альвеолы капиллярный эндотелий отделен от альвеолярного эпителия легочным интерстициаль-ным пространством. Легочное интерстициальное пространство содержит эластин, коллаген и, возможно, нервные волокна. Газообмен происходит в тонкой части альвеолокапиллярной мембраны толщиной < 0,4 мкм. Толстая сторона (1-2 мкм) обеспечивает альвеоле опору.
Дыхательный эпителий содержит по меньшей мере два типа клеток. Пневмоциты I типа — это плоские клетки, образующие между собой так называемые плотные (1 hm) контакты. Плотные контакты предотвращают попадание крупных онкоти-чески активных молекул (например, альбумина) внутрь альвеол. Не столь многочисленные пневмо-циты II типа — это клетки округлой формы, имеющие большое количество цитоплазматических включений (пластинчатые тельца). Пластинчатые тельца содержат сурфактант — вещество, играющее чрезвычайно важную роль в механике дыхания. В отличие от пневмоцитов I типа, пневмоциты II типа способны делиться (при необходимости) с образованием пневмоцитов I типа. Пневмоциты II типа устойчивы к токсическому действию кислорода.
В нижних дыхательных путях имеются также альвеолярные макрофаги, тучные клетки, лимфоциты и клетки APUD-системы, у курящих людей — нейтрофилы.
^ 3. КРОВООБРАЩЕНИЕ И ЛИМФОТОК В ЛЕГКИХ
В легкие кровь поступает из легочных (малый круг кровообращения) и бронхиальных артерий (большой круг кровообращения). Бронхиальные арте-
рии отходят от грудной аорты и кровоснабжают трахеобронхиальное дерево до уровня дыхательных бронхиол. Дистальнее метаболизм легочной ткани обеспечивается одновременно альвеолярным газом и кровью из сосудов малого (легочного) круга кровообращения.
Легочное кровообращение начинается от легочной артерии, в которую поступает из правого желудочка деоксигенированная кровь. Легочная артерия делится на правую и левую ветви, соответственно каждому легкому. Деоксигенированная кровь проходит через легочные капилляры, поглощая кислород pi отдавая углекислый газ. Насыщенная кислородом кровь затем возвращается в левое предсердие по четырем главным легочным венам (по две от каждого легкого). Хотя через большой и малый круги кровообращения в единицу времени протекает один и тот же объем крови, из-за более низкого легочного сосудистого сопротивления давление в легочной артерии в 6 раз ниже системного артериального давления. Стенки легочных артерий и вен тоньше и имеют менее
выраженный гладкомышечный слой, чем сосуды большого круга.
Бронхиальное и легочное русла сообщаются между собой. Прямые артериовенозные шунты, идущие в обход легочных капилляров, обычно не имеют функционального значения, но их роль становится ощутимой при некоторых патологических состояниях (гл. 26 и 35). Вклад бронхиального кровотока в венозную примесь у здоровых людей обсуждается ниже.
^ Легочные капилляры
Легочные капилляры проходят в стенках альвеол. Средний диаметр капилляра (10 мкм) практически соответствует диаметру эритроцита. Каждый сегмент капиллярной сети снабжает не одну альвеолу, поэтому кровь омывает несколько альвеол, прежде чем достигнет легочной вены. Из-за относительно низкого давления в малом круге крово-ток через отдельный сегмент зависит от силы тяжести и от размера альвеол. Крупные альвеолы
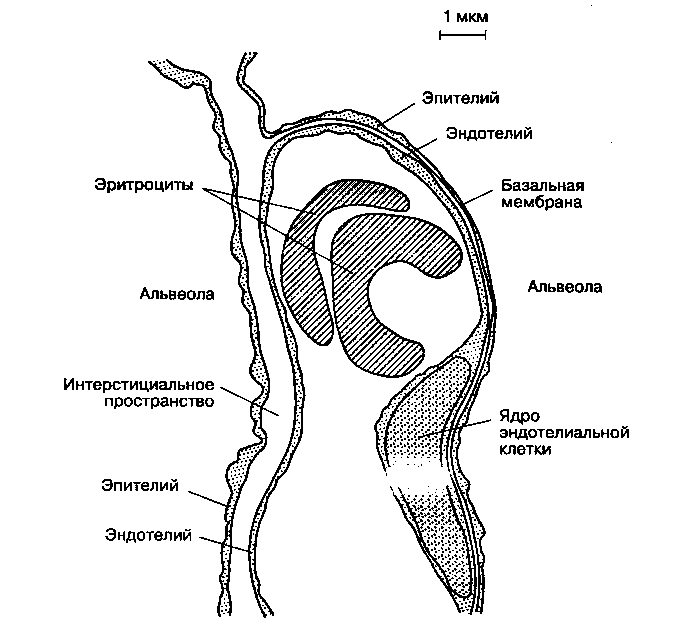
Рис. 22-2. Легочное интерстициальное пространство с капилляром, проходящим между двумя альвеолами. Капилляр выпячивается в просвет расположенной справа альвеолы через ее тонкую (газообменную) стенку. Интерстициальное пространство сливается с толстой стенкой левой альвеолы. (С разрешения. Из: Nunn J. F. Applied Respiratory Physiology, 3rd ed. Butterworths, 1987.)
имеют меньшее суммарное сечение прилегающих капилляров и, соответственно, большее сопротивление току крови. В вертикальном положении тела кровоток в капиллярах верхушек легких меньше, чем кровоток в капиллярах базальных отделов.
Клетки эндотелия легочных капилляров прилегают друг к другу сравнительно неплотно. Межклеточные промежутки в 5 мкм пропускают крупные молекулы, такие как альбумин. В результате легочное интерстициальное пространство содержит много альбумина. Циркулирующие макрофаги и нейтрофилы относительно легко проходят между клетками эндотелия и более плотно прилегающими друг к другу клетками альвеолярного эпителия. В интерстициальном пространстве и внутри альвеол обычно присутствуют легочные макрофаги: они противодействуют развитию бактериальной инфекции и удаляют инородные частицы.
^ Лимфатические сосуды легких
Лимфатические протоки легких начинаются в интерстициальном пространстве крупных легочных перегородок. Из-за неплотности межклеточных соединений эндотелия лимфа имеет высокое содержание белка; скорость тока лимфы в норме превышает 20 мл/мин. Крупные лимфатические сосуды идут вверх, сопровождая дыхательные пути и образуя трахеобронхиальную цепочку лимфатических узлов. Лимфатические дренажные протоки из обоих легких сообщаются между собой на пути вдоль трахеи. Лимфа из левого легкого оттекает главным образом в грудной проток, из правого легкого — в правый лимфатический проток.
4. ИННЕРВАЦИЯ
Диафрагма иннервируется диафрагмальными нервами, берущими начало в нервных корешках сегментов C3-C5. Односторонний блок или паралич диафрагмалъного нерва лишь не значительно уменьшает показатели нормальной легочной вентиляции (приблизительно на 25 %). Хотя двусторонний паралич диафрагмальных нервов приводит к более серьезным нарушениям, в некоторых случаях вспомогательные дыхательные мышцы могут обеспечивать адекватную вентиляцию. Межреберные мышцы иннервируются из грудных спинномозговых нервов. Повреждение шейного отдела спинного мозга выше уровня C5 вызывает полную утрату самостоятельного дыхания в связи с тем, что оказываются выключенными как диафрагмальные, так и межреберные мышцы.
Блуждающие нервы обеспечивают чувствительную иннервацию трахеобронхиального дерева. Существует и симпатическая, и парасимпатическая иннервация гладкой мускулатуры бронхов и бронхиальных желез. Активация блуждающего нерва приводит к бронхоконстрикции и усиливает бронхиальную секрецию через м-холинорецеп-торы. Активация симпатических (T1-T4) волокон через (32-адренорецепторы вызывает бронходила-тацию и ослабление секреции. Стимуляция Q1-ад-ренорецепторов уменьшает секрецию желез, но чревата бронхоконстрикцей. Кроме того, существует неадренергическая, нехолинергическая система бронходилатации; ее медиатором предположительно является вазоактивный интестиналь-ный пептид. Иннервация гортани рассмотрена в гл. 5.
В сосудах легких имеются и а-, и (3-адреноре-цепторы, но симпатическая система в норме не оказывает значительного влияния на легочный сосудистый тонус. Стимуляция Qi-адренорецепто-ров вызывает вазоконстрикцию, |32-адреноре-цепторов — вазодилатацию. Вазодилатация, обусловленная парасимпатической активностью, реализуется через оксид азота (NO).
^ Основные механизмы дыхания
Постоянно происходящий обмен между альвеолярным газом и свежим воздухом из верхних дыхательных путей обеспечивает оксигенацию венозной крови и удаление из нее углекислого газа. Этот обмен осуществляется благодаря небольшим по величине циклически меняющимся градиентам давления в дыхательных путях. При самостоятельном дыхании градиенты давления возникают вслед за изменением внутригрудного давления; во время ИВЛ их наличие обеспечивает перемежающееся положительное давление в верхних дыхательных путях.
^ Самостоятельное дыхание
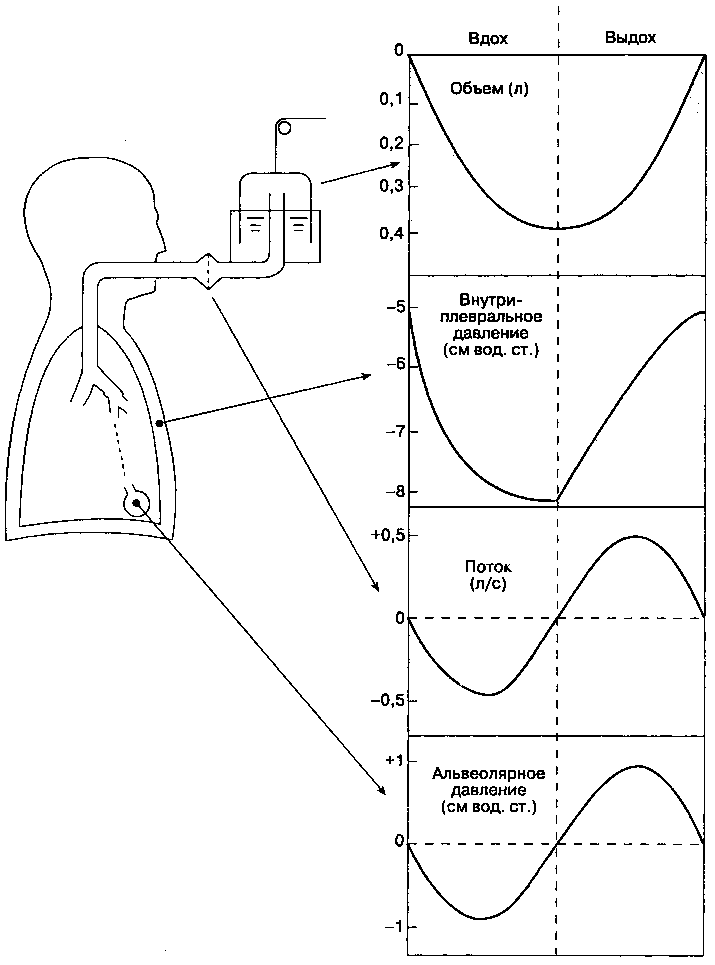
Изменения давления во время самостоятельного дыхания показаны на рис. 22-3. Если альвеолы находятся в расправленном (неспавшемся) состоянии, то давление внутри них всегда выше, чем окружающее (внутригрудное) давление. В конце вдоха и в конце выдоха альвеолярное давление (РА) в норме равно атмосферному (принимается за ноль в рассматриваемой ситуации). В физиологии дыхания внутриплевральное давление (РВц) принимают за эквивалент внутригрудного давления. Хотя, может быть, не совсем корректно говорить о давлении в потенциальном пространстве
(т. е. в плевральной полости), этот подход позволяет определить транспульмональное давление. Транспульмональное давление (РТц) определяется следующим образом:
P = P — P
'транспульмональное 'альвеолярное ' внутриплевральное-
В конце выдоха внутриплевральное давление в норме составляет -5 см вод. ст., соответственно транспульмональное давление равно +5 см вод. ст.
Сокращение диафрагмы и межреберных мышц во время вдоха вызывает увеличение объема грудной клетки и уменьшение внутриплеврального давления до -7,5 см вод. ст. В результате альвеолярное давление снижается (от О до -1— -2 см вод. ст.), и возникает градиент давления между альвеолами и верхними дыхательными путями; газ поступает из верхних дыхательных путей в альвеолы. В конце вдоха (когда движение газа прекращается) альвео-