Диагностика и терапия послеродовых эндометритов у коров, вызванных haemophilus somnus 06. 02. 06 ветеринарное акушерство и биотехника репродукции животных 06.
| Вид материала | Автореферат |
- Сравнительная оценка полихимиотерапевтического метода лечения неоплазий молочных желёз, 489.14kb.
- Диагностика и органосохраняющая терапия при пиометре у сук 16. 00. 07- ветеринарное, 436.56kb.
- Особенности этиопатогенеза, диагностики, терапии и профилактики мастита коров в сухостойный, 544.85kb.
- Воспроизводительная функция у высокопродуктивных коров при нарушении обмена веществ, 814.36kb.
- Применение электромагнитного излучения крайне высокой частоты и препарата гентодиамаст, 358.4kb.
- Программа-минимум кандидатского экзамена по специальности 16. 00. 07 Ветеринарное акушерство, 125.04kb.
- Программа курса «Акушерство, гинекология и биотехника размножения животных», 86.79kb.
- Влияние иммуномодулятора «миелопид» илазерного облучения молочной железы свиноматок, 348.3kb.
- Влияние стрессовых ситуаций на организм спортивных лошадей и разработка методов, 404.72kb.
- Программа вступительного экзамена в аспирантуру по специальной дисциплине 06. 02., 152.65kb.
На правах рукописи
Грибов Константин Петрович
ДИАГНОСТИКА И ТЕРАПИЯ ПОСЛЕРОДОВЫХ ЭНДОМЕТРИТОВ У КОРОВ, ВЫЗВАННЫХ
HAEMOPHILUS SOMNUS
06.02.06 – ветеринарное акушерство и биотехника репродукции животных
06.02.02 – ветеринарная микробиология, вирусология, эпизоотология, микология с микотоксикологией и иммунология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
г. Новочеркасск - 2011
Работа выполнена в Государственном научном учреждении
Северо-Кавказский зональный научно-исследовательский ветеринарный
институт Российской академии сельскохозяйственных наук
| Научный руководитель: | доктор биологических наук ^ Карташова Евгения Владимировна доктор медицинских наук, доцент Карташёв Владимир Васильевич |
| Официальные оппоненты: | доктор ветеринарных наук, профессор ^ Тимченко Людмила Дмитриевна (Ставропольский госуниверситет) доктор биологических наук, профессор Лапина Татьяна Ивановна (СКЗНИВИ Россельхозакадемии) |
| Ведущая организация: | ФГОУ ВПО «Самарская государственная сельскохозяйственная академия» |
Защита состоится «11» октября 2011 года в 1400 часов на заседании диссертационного совета Д 006.106.01 при Государственном научном учреждении Северо-Кавказский зональный научно-исследовательский ветеринарный институт Российской академии сельскохозяйственных наук.
346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0
С диссертацией можно ознакомиться в библиотеке ГНУ Северо-Кавказский зональный научно-исследовательский ветеринарный институт Россельхозакадемии - 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0.
Автореферат разослан «____» сентября 2011 г.
Ученый секретарь
диссертационного совета,
д.б.н., профессор А.М. Ермаков
^ 1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Диагностика и терапия послеродовых эндометритов у крупного рогатого скота остается нерешенным вопросом вот уже в течение многих лет. Различные подходы в диагностике и терапии связаны со многими факторами: различные породы крупного рогатого скота и уровни производительности, факторы риска развития эндометрита, а также микробные этиологические факторы. Наиболее часто послеродовый эндометрит развивается в первые 10-14 дней после рождения коров. Может протекать с различной тяжестью клинического течения – от субклинического до токсического с летальным исходом. Экономические потери от данного заболевания связаны со снижением удоев, затрат на лечение, уничтожением молока контаминированного лечебными препаратами, затрат на работу специалистов, и возможной гибели животного (Garcia M.E., 2003; Butler M., 2008; Антипов В.А. 1997; Гавриш В.Г., 2000; Макаров В.В.; 2000; Дегтярёв Д.В., 2002; Нежданов А.Г., 2003; Карташов С.Н., 2005; Рецкий М.И., 2005).
Послеродовыми эндометритами переболевает от 12 до 60% отелившихся коров. Ежегодно на молочных комплексах страны по причине эндометритов преждевременно выбраковывают до 27-30% коров, не пригодных для дальнейшего воспроизводства (Kim I.H., 2003; Feldmann M., 2005; Акулов А.В., 1987; Нежданов А.Г., 1995; Донник И.М., 1997; Эрнст Л.К., 2002; Карташов С.Н., 2008; Джамалутдинов Ш.А., 2009).
Главным этиологическим фактором в возникновении и развитии эндометритов считают условно-патогенную и патогенную микрофлору, которая попадает в половые пути самок гематогенным и лимфогенным путями, а также из внешней среды до отела, во время отела и сразу же после его завершения. Именно поэтому развитие традиционной терапии эндометритов осуществляется преимущественно на основе антимикробных средств. Однако применение химиотерапевтических средств сопряжено с целым рядом негативных сторон, и в частности, с недостаточной лечебной эффективностью, снижением качества и количества животноводческой продукции, ингибирующим влиянием на факторы локальной и общей резистентности макроорганизма, отрицательным влиянием на морфофункциональное состояние эндометрия. Вместе с тем в литературе имеются данные, что до 30% послеродовых эндометритов у коров вызываются специфическими возбудителями, существенную долю которых составляют эндометриты, вызванные Haemophilus somnus (Gilbert R.O., 2005; Corstvet R.E., 2009; Студенцов А.П., 1975; Гавриш В.Г., 1997; Сюрин В.Н., 1998; Субботин В.М., 2000; Шахов А.Г., 2006)
В этой связи имеется объективная необходимость в усовершенствовании методов диагностики послеродовых эндометритов у коров, и разработки новых терапевтических подходов, учитывающих этиологию данного заболевания, что и послужило целью нашего исследования.
^ Цель и задачи исследования. Цель настоящих исследований - выяснить эпизоотологические и клинико-морфологические аспекты эндометритов у крупного рогатого скота, вызванных Haemophilus somnus, разработать экспресс методы диагностики данной патологии, обосновать схемы терапии.
Для достижения этой цели были поставлены следующие задачи:
- Изучить эпизоотологические аспекты и этиологию эндометритов у крупного рогатого скота в хозяйствах Ростовской области, выяснить долю эндометритов, вызванных Haemophilus somnus.
- Установить качественный состав микрофлоры матки у коров при нормальном течении послеродового периода и при остром эндометрите.
- Разработать диагностический набор на обнаружение Haemophilus somnus.
- Выяснить эпизоотологические особенности эндометритов у крупного рогатого скота, вызванных Haemophilus somnus.
- Изучить клинические, морфологические и биохимические изменения крови при эндометритах ,вызванных Haemophilus somnus.
- Разработать эффективные методы лечения коров, больных эндометритами, вызванными Haemophilus somnus.
^ Научная новизна. Впервые изучены эпизоотологические особенности эндометритов у крупного рогатого скота, вызванных Haemophilus somnus. Разработан диагностический набор для диагностики инфекций крупного рогатого скота, вызванных Haemophilus somnus. Установлены клинические аспекты, а также морфологические и биохимические изменения в картине крови при данной патологии. Выяснены формы клинического течения послеродовых эндометритов у коров вызванных H. somnus. Разработаны эффективные схемы лечения коров, больных послеродовым эндометритом, вызванным H. somnus с учетом тяжести течения заболевания
^ Практическая значимость. Изучены эпизоотологические особенности гемофилеза крупного рогатого скота в Ростовской области, установлена его инцидентность и сезонность. Разработан диагностический набор для диагностики инфекций крупного рогатого скота, вызванных H. somnus. Выявлены различные клинические формы послеродового эндометрита у коров, установлены несколько степеней тяжести данного заболевания, что позволяет дифференцированно подходить к терапии данного заболевания.
^ Апробация работы. Материалы диссертации доложены и обсуждены на Всероссийской научно практической конференции «Актуальные проблемы ветеринарного обеспечения Российского животноводства» ГНУ СКЗНИВИ, г. Новочеркасск 2010г., на Всероссийской научно практической конференции «Научное обеспечение инновационного развития отечественного животноводства» ГНУ СКЗНИВИ г. Новочеркасск 2011г., на III Международной научно–практической конференции «Инновационные процессы в АПК», посвященной 50-летию образования аграрного факультета РУДН Москва, 2011 г.
^ Реализация результатов исследований. Разработанные практические предложения реализуются в повседневной работе скотоводческих хозяйств Ростовской области, в учебном процессе - при чтении лекций и проведении лабораторно-практических занятий на кафедре внутренних незаразных болезней и патофизиологии ДонГАУ.
Публикации. Основные положения диссертации отражены в 8 научных работах, в том числе 1 в трудах Международных конференций и 3 в изданиях, рекомендованных ВАК Минобразования и науки РФ: «Ветеринария и кормление» и «Ветеринарная патология».
^ Структура и объем работы. Диссертация изложена на 127 страницах компьютерного исполнения, состоит из введения, обзора литературы, материалов и методов исследований, результатов собственных исследований, а также заключения, выводов, предложений для практики, списка литературы и приложения. В диссертации приведено 16 таблиц, она иллюстрирована 4 рисунками. Список литературы включает 196 источников, в том числе 113 иностранных.
^ Основные положения, выносимые на защиту:
Выделение H. Somnus методом ПЦР при послеродовых эндометритах является эффективным методом позволяющим ставить точный диагноз в кратчайшие сроки.
Клинико-гематологические показатели и морфофункциональные изменения у коров при послеродовых эндометритах позволяют оценить тяжесть течения заболевания без уточнения вида возбудителя.
Точное знание возбудителя заболевания позволяет проводить этиотропное лечение и улучшать курабельность заболевания.
^
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
2.1. Материалы, методы и объемы исследований
Работу выполняли с 2008 по 2010 гг. в лаборатории функциональной диагностики болезней сельскохозяйственных животных ГНУ СКЗНИВИ Россельхозакадемии. Тема диссертационной работы является составной частью комплексной темы научных исследований Государственного научного учреждения Северо-Кавказский зональный научно-исследовательский ветеринарный институт и имеет № гос. регистрации №15070.3666026906.06.8.001.2.
Часть исследований была проведена в Ростовской областной ветеринарной лаборатории. Для изучения эпизоотической ситуации по гемофилезу были проанализированы результаты лабораторных исследований ГУРО «Ростовская областная ветеринарная лаборатория».
Клинико-гинекологическому исследованию по общепринятой методике подвергнуто 1248 отелившихся коров, из них у 457 животных проведены гематологические, биохимические, микробиологические исследования. Для микробиологических исследований использовано 1250 проб маточных выделений коров больных острым послеродовым эндометритом. Степень распространения острого послеродового эндометрита гемофилезной этиологии учитывали в зависимости от сезона года. Для своевременного выявления коров с острыми эндометритами в послеродовом периоде мы применяли методику гинекологической диспансеризации, предложенную Н.И. Полянцевым (1989).
Кровь для исследований от коров брали при начале опыта, затем 1 раз в неделю.
Для определения тяжести и особенности течения гемофилезного острого послеродового эндометрита всем животным проводили морфологический и биохимический анализ крови. Кровь для биохимического и морфологического исследования брали из яремной вены.
Морфологический анализ крови включал: определение числа эритроцитов и лейкоцитов в сетке камеры Горяева, определение концентрации гемоглобина – фотоэлектроколориметрическим методом, гематокрита по методике, предложенной И. И. Архангельским и Л. П. Сошенко (1993), определение скорости оседания эритроцитов (СОЭ) - в аппарате Т.Н.Панченкова, выведение лейкограммы выполняли путем подсчета лейкоцитов в мазках, окрашенных по Романовскому-Гимза по общепринятой методике.
Биохимический анализ крови включал определение следующих показателей: общий белок определяли рефрактометрически, а белковые фракции – электрофорезом в геле агара (П.Грабар, П.Буртен, 1963). Альбумин - по реакции с бромкрезоловым зеленым, С-реактивного белка - методом реакции преципитации в капилляре, сиаловых кислот, фибриногена, лактатдегидрогеназы и глобулина.
Для микробиологических исследований маточные выделения получали методом ректального массажа матки и вагинального отбора в одноразовые пробирки. С целью определения состава микрофлоры матки осуществляли посев полученного материала на МПА, МПБ, кровяной агар, МПА с 1% глюкозы, и др. Идентификацию изолированных микроорганизмов проводили с учетом их морфологических, культуральных свойств по общепринятым методикам. Для определения вида бактерий использовали пластины биохимические, дифференцирующие энтеробактерии и стафилококки, углеводные среды Гиса. Патогенность микроорганизмов изучали путем внутрибрюшного заражения белых мышей одномиллиардной взвесью смыва суточной агаровой культуры в дозах 0,2-0,5 мл (200-500 млн. микробных клеток).
Таблица 1
Объем проведенных исследований, голов
| № п./п. | Вид проведенного исследования | всего проведено исследований | |
| 1 | исследовано животных клинически, голов | 1438 | |
| 2 | выявлено больных животных, голов: | гемофилез | 368 |
| 3 | проведено ректальных исследований | 225 | |
| 4 | проведено лабораторных исследований: | Гематологических | 368 |
| 5 | Иммуноферментных | 368 | |
| 6 | Биохимических | 881 | |
| 7 | ПЦР | 881 | |
| 8 | Микробиологических | 1380 | |
Определение чувствительности бактерий к антибиотикам проводили на среде АГВ путем наложения стандартных дисков с антибиотиками. Антибактериальные средства лекарственных препаратов изучали луночным методом диффузии в агар. Оценку чувствительности осуществляли по диаметру зоны задержки роста тест-культур.
Диагностику гемофилеза проводили в лаборатории ГНУ СКЗНИВИ РАСХН и ГУРО «Ростовская областная ветеринарная лаборатория», с помощью тест-систем для выявления ДНК микроорганизмов биологическом материале методом полимеразно-цепной реакции (ПЦР) с электрофоретической детекцией продуктов амплификации в агарозном геле. Cat.№ VET-1-R 0,5.
Статистическую обработку результатов исследований проводили по Н.А. Плохинскому (1970), Хитоси Кумэ (1990) с использованием компьютерной техники AMD ATHLON.
^
2.2. Результаты исследования эпизоотологической ситуации по болезням КРС в Ростовской области
По результатам наших исследований нозопрофиль инфекционной патологии КРС в Ростовской области к настоящему времени представлен 18 нозологическими единицами: инфекционный ринотрахеит, микоплазмоз, парагрипп-3, вирусная диарея – болезнь слизистых, респираторно-синцитиальная инфекция, сальмонеллез, колибактериоз, пастереллез, лептоспироз, ротовирусная инфекция (диарея неонотальных коров), гемофилез, диплококкоз, микоплазмоз, парвовирусная инфекция, аденовирусная инфекция, листериоз, стрептококкоз.
ИРТ КРС в 2008 г. регистрировалась в 5 - и, в 2009 г.- в 7- и, в 2010 г.- в 11 – и пунктах.
Гемофилез отмечался в 2008 г. в 5–и неблагополучных пунктах, заболело 172 гол животных. В 2009 - 2010 гг. число неблагополучных пунктов осталось неизменным, однако интенсивность данной нозологической единицы постепенно снижалась. Средний показатель заболеваемости гемофилезом в среднем за 3 года составил 2,23. Смертность и летальность составили 0,43 и 31,23.
^
2.3. Разработка диагностикума для детекции ДНК Haemophilus somnus в реакции ПЦР
Исследования на гемофилез проводили методом полимеразной цепной реакции (ПЦР) с детекцией в агарозном геле. В основе метода лежит амплификация специфического участка за счет многократного повторения циклов денатурации ДНК в исследуемой пробе, отжига специфических олигонуклеотидных затравок (праймеров) и синтеза цепей ДНК с помощью фермента Taq-полимеразы.
Выделение нуклеиновых кислот проводили с использованием коммерческого набора производства ЦНИИЭ Роспотребнадзора в соответствии с рекомендациями изготовителя. Метод выделения основан на специфической обратимой сорбции ДНК в присутствии хаотропных солей (гуанидинтиоцианат, гуанидинхлорид, NaI, и т.д.) на частицы силикагеля.
Нуклеотидные последовательности генов-мишеней для ПЦР были получены из баз данных NCBI GenBank. Анализ нуклеотидных полноразмерных геномов и участков различных генов бабезий, взятых из базы данных GenBank (NCBI) последовательностей, проводили с применением пакета прикладных программ «BioEdit 6.0».
В результате выравнивания нуклеотидных последовательностей 16S рРНК-гена 10 штаммов H. somnus было выявлено несколько протяженных районов 100%-ной идентичности нуклеотидной последовательности между всеми штаммами, которые и были избраны в качестве мишеней для отжига праймеров и проб. Дизайн праймеров, комплементарных данному участку осуществлялся таким образом, чтобы 3’-терминальные и/или субтерминальные нуклеотидные остатки были комплементарны родоспецифичным остаткам в последовательностях 16S-рРНК и содержали гуанин или цитозин.
Рассчитанные видоспецифичные праймеры для выявления кДНК имели высокую температуру отжига 68° С, это позволило объединить два этапа реакции (отжиг и элонгацию), в один. В результате удалось значительно снизить время постановки реакции, что не повлияло на её специфичность и чувствительность. Постановку ПЦР проводили в реакционной смеси стандартного состава с использованием 10 пкМ каждого праймера, 5 мкл раствора кДНК с добавлением 3 мM MgCl2. Амплификация проводилась на программируемом термостате «Терцик» (ЗАО «ДНК-технология», Москва) в следующем режиме: предварительная денатурация при 95ºС в течение 5 минут, затем 35 циклов, включающих этапы 1) денатурация при 95 ºС – 10 секунд, отжиг праймеров при 68 ºС – 10 секунд, 3) элонгация при 72 ºС – 10 секунд.
В качестве положительного контроля использовали ДНК выделенной бактериологическими методами культуры.
Детекция продуктов амплификации проводилась электрофорезом в 2% агарозном геле в растворе бромистого этидия.
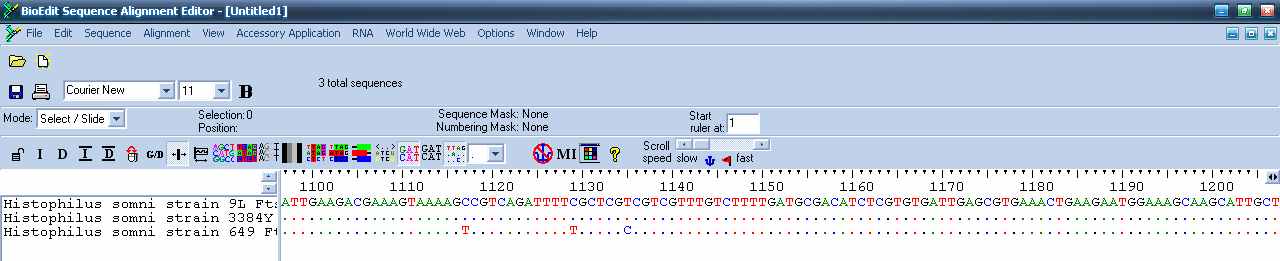
Рис. 1. Выравнивание нуклеотидных последовательностей FtsJ гена
нескольких штаммов ^ H. somnus
Диагностические характеристики разработанной тест-системы изучали в сравнении с классическим бактериологическим методом, подразумевающим выделение чистых культур бактерий из исследуемого материала с использованием элективных питательных сред и последующую морфологическую и биохимическую (либо серологическую) идентификацию выделенных культур. Всего было исследовано 117 клинических образцов (патологический материал, истечения и мазки из носовых ходов), среди которых 22 клинических образца представляли собой материал, полученный от новорожденных коров, находящихся в родильном отделении.
При изучении клинических образцов метод ПЦР проявил большую чувствительность по сравнению с классическим бактериологическим методом. Так, методом ПЦР H. somnus был выявлен в 31 образце (26,5%), в то время как с использованием бактериологического метода бактериальную обсемененность выявляли в 29 образцах (24,8%).
Возможно, это связано с назначением антибактериальной терапии клинически больным коровам. Поэтому в образцах, полученных от этих животных, присутствовали либо погибшие H. somnus, либо их некультивируемые формы, ДНК которых и определялась методом ПЦР в 1,71% случаев. В этой связи показатели чувствительности и специфичности ПЦР для детекции H. somnus по сравнению с бактериологическим методом составили 100% и 93,55% соответственно.
^
2.4. Распространение послеродовых патологий у крупного рогатого скота в хозяйствах Ростовской области
В структуре акушерско-гинекологических патологий на первом месте стоит острый послеродовый эндометрит (54,3 %) от всех случаев оказания акушерско-гинекологической помощи, за ним следуют такие заболевания, как задержание последа, процент которого очень высок, почти у всех коров с задержкой последа в дальнейшем развивался послеродовый эндометрит. Субинволюция матки отмечалась в 7%, персистенция желтого тела в 7% случаев, гипофункция яичников - в 1 % случаев (рис. 3).
Для послеродовых эндометритов характерна сезонность. Наибольшее количество отелов в изученных хозяйствах происходит в период с ноября по февраль, а послеродовыми эндометритами животные чаще заболевают с января по март месяц, в это время переболевает от 76 до 80% отелившихся животных.
Большое значение для развития эндометрита имеет возраст животного. Наиболее подвержены данной патологии коровы первотелки, среди них переболевает 64,3%, коровы в возрасте старше 5 лет, среди них переболевает 69,1% . По данным наших исследований заболеваемость отелившихся коров острым послеродовым эндометритом в исследованных хозяйствах в среднем составляет 54,3% коров. Кроме того, нами установлено, что заболеваемость коров послеродовым эндометритом гемофилезной этиологии составляет 43% от общего числа коров, заболевших острым послеродовым эндометритом. Наибольшее количество животных заболевает послеродовыми эндометритами в зимне-весенний период, что составляет 62,3 % от общего количества отелившихся коров, а в летне-осенний период-33,7%.
В процессе исследования было выявлено, что сезонное проявление эндометрита, вызванного Escherichia coli и Arcanobacter pyogenes отличается от эндометрита, вызванного H. somnus. Эндометрит, вызванный Escherichia coli и Arcanobacter pyogenes наиболее часто проявляется в зимне-весенний период, в который переболевает до 82,53% отелившихся коров, а пик заболеваемости эндометрита, вызванного Haemophilus somnus, приходится на май и июнь, заболеваемость доходит в этот период до 83,3 %.
^
2.5. Тяжесть клинического течения острого послеродового эндометрита вызванного Haemophilus somnus
Тяжесть течения заболевания определяется клиническими признаками заболевания. Мы в своей работе выделяли 3 степени тяжести клинического течение послеродового эндометрита, вызванного H. somnus.
Эндометрит с легким клиническим течением характеризовался увеличенной маткой и гнойными выделениями без каких-либо системных признаков заболевания. Животные с дополнительными признаками заболевания, такими как снижение удоев, атаксия, и лихорадка выше 39°C определены как имеющие эндометрит средней степени тяжести клинического течения. У животных с признаками токсемии, такими как отсутствие аппетита, скорость наполнения капилляров более 4,6 секунд, депрессия, тахикардия выше 95 ударов в минуту и одышка выше 24 дыхательных движений в минуту отмечали тяжелое клиническое течение эндометрита.
2.6. Основные возбудители послеродового эндометрита у коров в Ростовской области
Нами были проведены исследования по изолированию возбудителей послеродового эндометрита из течковых выделений коров и маточных выделений в послеродовый период от тех коров, которые заболели послеродовым эндометритом. При микробиологическом исследовании маточного содержимого от 458 коров 4 хозяйств, больных острым гнойно-катаральным послеродовым эндометритом, из течковой слизи от тех же коров выделено 18 видов микроорганизмов.
Таблица 2
| Возбудитель | процент выделений | |||
| из течковой слизи | из выделений матки | |||
| гол | % | гол | % | |
| Escherichia coli | 149 | 32,53% | 327 | 71,40% |
| Arcanobacter pyogenes | 94 | 20,52% | 254 | 55,46% |
| Staphylococcus spp. | 85 | 18,56% | 57 | 12,45% |
| Pasteurella spp. | 77 | 16,81% | 34 | 7,42% |
| Haemophilus somnus | 54 | 11,79% | 223 | 48,69% |
| Fusobacterium necrophorum | 11 | 2,40% | 143 | 31,22% |
| Bacteroides spp. | 14 | 3,06% | 79 | 17,25% |
| Manheimia hemolytica | 43 | 9,39% | 57 | 12,45% |
| Pseudomonas aeruginosa | 63 | 13,76% | 124 | 27,07% |
| Clostridium spp. | 8 | 1,75% | 32 | 6,99% |
| Streptococcus spp. | 43 | 9,39% | 77 | 16,81% |
| Chlamydophila spp. | 13 | 2,84% | 67 | 14,63% |
| Ureaplasma spp. | 9 | 1,97% | 54 | 11,79% |
| Salmonella spp. | 5 | 1,09% | 12 | 2,62% |
| Mycoplasma spp. | 43 | 9,39% | 89 | 19,43% |
| Neisseria spp. | 17 | 3,71% | 98 | 21,40% |
| BVD | 4 | 0,87% | 7 | 1,53% |
| ВНV-1 | 34 | 7,42% | 89 | 19,43% |
Чаще всего встречались следующие патогены в исследуемом материале: Escherichia coli, Arcanobacter pyogenes, Fusobacterium necrophorum, Bacteroides spp., Staphylococcus spp., Haemophilus somnus, Manheimia hemolytica, Pasteurella spp., Pseudomonas aeruginosa, Clostridium spp., Streptococcus spp., Chlamydophila spp., Ureaplasma spp., Salmonella spp., Mycoplasma spp., Neisseria spp., вирус вирусной диареи КРС (BVD), вирус инфекционного ринотрахеита КРС (ВНV-1) (табл. 2).
Из вышеизложенного следует, что микробный фон матки представлен разнообразными видами условно-патогенных микроорганизмов, которые являются одной из непосредственных причин острого воспаления матки животных, несмотря на то, что H. somnus редко выделяется из течковой слизи коров, при остром послеродовом эндометрите он выделялся у 223 коров из 458, что составило 48,7%,. У 97 коров, H. somnus выделялся как единственный инфекционных агент острого послеродового эндометрита, данные животные и участвовали в дальнейшей исследовании.
^
2.7. Результаты морфологических и биохимических исследований крови коров больных острым послеродовым эндометритом гемофилезной этиологии
Нами проведены морфологические исследования крови коров, больных острым послеродовым эндометритом гемофилезной этиологии при различной тяжести клинического течения заболевания (табл. 3).
Таблица 3
Гематологические показатели у коров, больных острым послеродовым эндометритом гемофилезной этиологии (n=40)
| Показатели | клинически здоровые | больные | ||
| тяжесть клинического течения | ||||
| легкая | средняя | тяжелая | ||
| эритроциты, ×1012/л | 8,21±0,14 | 5,33±0,27 | 4,5±0,14 | 2,7±0,21* |
| гемоглобин, г/л | 120±2,4 | 97±3,79 | 89,1±3,43 | 65±4,81* |
| гематокрит | 0,4±0,09 | 0,4±0,1 | 0,36±0,12 | 34,1,37±0,1* |
| СОЭ, мм/ч | 7,2±1,2 | 14±2 | 17,6±2 | 35,68±2,34* |
| лейкоциты, ×109/л | 8,8±0,18 | 8,8±0,22 | 13±1,21* | 19,2±0,89* |
| сиаловые к-ты, ммоль/л | 2,2±0,63 | 5,4±0,67* | 8,8±0,22* | 10,3±0,15* |
| фибриноген, г/л | 3,7±0,88 | 11,21±0,36* | 16±0,2* | 17,97±0,32* |
| С-реакт. белок, + | - | 3±0,13* | 3,8±0,1* | 4±0,16* |
| лактдегидрогеназа, Е/л | 156±2,8 | 412±10,2* | 535±8* | 675±13,6* |
| общий белок, г/л | 75,82±0,95 | 60,06±0,67* | 54,4±0,22* | 50,4±0,35* |
*Примечание:Р<0,001 относительно здоровых коров
Морфологические показатели крови характеризовались значительным снижением числа эритроцитов уже при легком клиническом течении эндометрита до 5,73±0,25×1012/л и снижением при средней тяжести и тяжелом клиническом течении эндометрита до 4,5±0,14×1012/л и 2,7±0,21×1012/л. Как видно, степень депрессии красного костного мозга при тяжелом течении эндометрита выраженнее, чем при легком и среднем клиническом течении острого послеродового эндометрита гемофилезной этиологии. По мере развития болезни число лейкоцитов увеличивалось за счет увеличения сегментоядерных нейтрофилов с дегенеративным сдвигом ядра. Необходимо отметить, что при остром послеродовом эндометрите гемофилезной этиологии не развивалась лейкопения, а по мере утяжеления течения заболевания развивался лейкоцитоз, вплоть до гиперлейкоцитоза при тяжелом течении заболевания и достигал 19,2±0,89×109/л. Лимфопения прогрессировала по мере распространения воспалительного процесса в легких и отображала тяжесть течения болезни.
При остром послеродовом эндометрите гемофилезной этиологии уровень маркеров воспаления оказался выше, чем у здоровых животных. Так, уровень сиаловых кислот при легком и среднем клиническом течении острого послеродового эндометрита гемофилезной этиологии соответственно составил 5,4±0,67 ммоль/л и 81,9±0,25 ммоль/л, что на 48% и 75% выше, чем у здоровых животных. Уровень фибриногена при тяжелом клиническом течении острого послеродового эндометрита гемофилезной этиологии составил 10,3±0,15 г/л, что на 80,3%, 50,4% и 25,5% выше, чем у здоровых животных и с легким и средним клиническим течением острого послеродового эндометрита гемофилезной этиологии соответственно.
^
2.8. Терапия коров, больных острым послеродовым эндометритом, вызванным Haemophilus somnus
Нами разработаны четыре схемы лечения коров, больных острым послеродовым эндометритом гемофилезной этиологии. Для этого были созданы три группы животных по 20 голов в каждой. Каждая группа делились на две подгруппы (по 10 голов): контрольную и опытную. В первую группу отбирались животные с легким клиническим течением острого послеродового эндометрита гемофилезной этиологии. Для лечения животных первой группы обоих подгрупп использовали две схемы лечения. Контрольную подгруппу лечили по схеме 1, а вторую группу по схеме 2.
Во вторую группу отбирались животные с клиническим течением послеродового эндометрита гемофилезной этиологии средней тяжести, при этом животных контрольной подгруппы второй группы лечили по схеме 2, а животных второй подгруппы второй группы лечили по схеме 3.
В третью группу отбирались животные с тяжелым клиническим течением послеродового эндометрита гемофилезной этиологии, при этом животных контрольной подгруппы третьей группы лечили по схеме 3, а животных второй подгруппы третьей группы лечили по схеме 4.
Схема 1: Метромакс внутриматочно, по одной таблетке 2-а раза в день в течение 3-х дней, при необходимости лечение продолжали введением одной таблетки до выздоровления; окситоцин в/м в дозе 40 МЕ два раза в день до выздоровления; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды.
Схема 2: Цефтиофур подкожно, 1 мл на 50 кг массы тела в течение 5 дней; окситоцин в/м в дозе 40 МЕ два раза в день до выздоровления; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды.
Схема 3: Цефтиофур подкожно, 1 мл на 50 кг массы тела в течение 5 дней; окситоцин в/м в дозе 40 МЕ каждые 4 часа в 5, 9, 13, 18 и 22 часа; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды.
Схема 4: Драксин, в/м 1 мл на 40 кг массы однократно подкожно. При лечении животных, масса которых превышает 300 кг, дозу разделяют таким образом, чтобы вводить в одну точку не более 7,5 мл; окситоцин в/м в дозе 40 МЕ каждые 4 часа в 5, 9, 13, 18 и 22 часа; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды.
Клинико-гематологические показатели в динамике течения болезни исследовали до лечения, при лечении (на 5-6-й день) и после лечения (на 15-18-й день).
При лечении коров, больных острым послеродовым эндометритом гемофилезной этиологии с легким клиническим течением по первой схеме удавалось добиться нормализации показателей красной и белой крови, а также снижения маркеров воспаления только на 10 день терапии, тогда как при применении 2-й схемы лечения удавалось добиться стабилизации состояния животного уже на третий день лечения.
При лечении животных со средней тяжестью эндометрита по второй схеме удавалось добиться нормализации показателей красной и белой крови, а также снижения маркеров воспаления только на 15 день терапии, а показатели красной крови не стабилизировались даже к 20-у дню лечения. Тогда как при применении третьей схемы лечения удавалось добиться стабилизации состояния животного уже на пятый день лечения, а к 10-му дню отмечалась нормализация даже показателей красной крови и лейкоцитов.
При лечении животных с тяжелым течением эндометрита по третьей схеме удавалось добиться нормализации показателей красной и белой крови, а также снижения маркеров воспаления только на 15 день терапии, тогда как при применении четвертой схемы, к 10-му дню отмечалась нормализация показателей красной крови и лейкоцитов.
4. ВЫВОДЫ
- 1. Гемофилез в Ростовской области получил широкое распространение, в 2008-2010 г.г. диагностировался в 4–х неблагополучных пунктах, заболело 172 голов животных. Заболеваемость гемофилезом за 3 года составила 2,23, смертность и летальность 0,43 и 31,23 соответственно.
- 2. При изучении клинических образцов метод ПЦР проявил большую чувствительность по сравнению с классическим бактериологическим методом, методом ПЦР H. somnus был выявлен в 31 образце (26,5%), в то время как с использованием бактериологического метода бактериальную обсемененность выявляли в 29 образцах (24,8%).
3. Заболеваемость отелившихся коров острым послеродовым эндометритом в исследованных хозяйствах в среднем составляет 54,3%. Заболеваемость коров послеродовым эндометритом гемофилезной этиологии составляет 43% от общего числа коров заболевших острым послеродовым эндометритом. Наибольшее количество животных заболевает послеродовыми эндометритами в зимне-весенний период, что составляет 62,3 % от общего количества отелившихся коров, а в летне-осенний период-33,7%. Пик заболеваемости эндометрита, вызванного Haemophilus somnus приходится на май и июнь, заболеваемость доходит в этот период до 83,3 %.
- 4. Целесообразно выделять три тяжести клинического течения эндометрита, вызванного ^ Haemophilus somnus. Эндометрит с легким клиническим течением характеризовался увеличенной маткой и гнойными выделениями без каких-либо системных признаков заболевания. Эндометрит средней тяжести сопровождается лихорадкой выше 39°C, анорексией, невыраженной астенией, снижением удоев. При тяжелом клиническом течении эндометрита отмечаются признаки токсемии, полная анорексия, выраженная астения, тахикардия и одышка.
- 5. H. somnus выделяется при остром послеродовом эндометрите у 223 коров из 458, что составило 48,7%. У 97 коров, H. somnus выделялся как единственный инфекционный агент острого послеродового эндометрита.
- 6. Морфологические показатели крови при эндометрите, вызванном ^ H. Somnus, характеризовались значительным снижением числа эритроцитов уже при легком клиническом течении эндометрита до 5,73±0,25×1012/л и снижением при тяжелом клиническом течении эндометрита до 2,7±0,21×1012/л. Отмечены более значительные отклонения в СОЭ у коров, больных острым послеродовым эндометритом гемофилезной этиологии, до 35,68±2,34 мм/ч при тяжелом, 17,6 мм/ч среднем, и 14,2 мм/ч при легком клиническом течении острого послеродового эндометрита гемофилезной этиологии соответственно.
- Отмечался гиперлейкоцитоз, уровень маркеров воспаления оказался выше, чем у здоровых животных. Уровень сиаловых кислот в зависимости от тяжести течения повышался на 48%, 75% и 97%; уровень фибриногена повышался на 25,5%, 50,4%, 80,3%; показатели лактатдегидрогеназы - на 33,1%, 43,4%, 64,7% выше, чем у здоровых животных. Отмечается снижение общего белка на 27,4% , 31,4% и 48,3%, это ниже, чем у здоровых животных.
- 7. Для лечения послеродового эндометрита наиболее эффективными оказались следующие схемы лечения: схема 2: цефтиофур подкожно, 1 мл на 50 кг массы тела в течение 5 дней; окситоцин в/м в дозе 40 МЕ два раза в день до выздоровления; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды, для лечения коров с легким клиническим течением эндометрита. Схема 3: Цефтиофур подкожно, 1 мл на 50 кг массы тела в течение 5 дней; окситоцин в/м в дозе 40 МЕ каждые 4 часа в 5, 9, 13, 18 и 22 часа; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды, для лечения коров с клиническим течением эндометрита средней тяжести. Схема 4: Драксин, в/м 1 мл на 40 кг массы однократно подкожно; окситоцин в/м в дозе 40 МЕ каждые 4 часа в 5, 9, 13, 18 и 22 часа; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды для лечения коров с тяжелым клиническим течением эндометрита.
5. ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
- Для диагностики острого послеродового эндометрита гемофилезной этиологии использовать разработанным нами набор для выявления ДНК H. somnus в реакции ПЦР.
- Для лечения послеродового эндометрита наиболее эффективными оказались следующие схемы лечения: схема 2: цефтиофур подкожно, 1 мл на 50 кг массы тела в течение 5 дней; окситоцин в/м в дозе 40 МЕ два раза в день до выздоровления; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды, для лечения коров с легким клиническим течением эндометрита. Схема 3: Цефтиофур подкожно, 1 мл на 50 кг массы тела в течение 5 дней; окситоцин в/м в дозе 40 МЕ каждые 4 часа в 5, 9, 13, 18 и 22 часа; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды, для лечения коров с клиническим течением эндометрита средней тяжести. Схеме 4: Драксин, в/м 1 мл на 40 кг массы однократно подкожно; окситоцин в/м в дозе 40 МЕ каждые 4 часа в 5, 9, 13, 18 и 22 часа; тривитамин в/м в дозе 10 мл 1 раз в 7 дней дважды для лечения коров с тяжелым клиническим течением эндометрита.
- Выздоровевшими коровами считать тех коров, у которых в крови снижаются маркеры воспаления: исчезает С-реактивный белок, уровень фибриногена снижется до 4 г/л, лактатдегидрогеназы до 235 Ед.
- Материалы исследований могут быть использованы при написании соответствующих разделов справочных и учебных пособий по диагностике и лечению мелких домашних животных.
^ 6. СПИСОК ОПУБЛИКОВАННЫХ РАБОТ:
- Карташов С.Н. Гормональные нарушения в этиологии хронических эндометритов у коров/ С.Н.Карташов, Е.В. Карташова, Р.В. Клименко, К.П. Грибов //Ветеринария и кормление. -№4, 2010. – с. 22-23.
- Грибов К.П. Нейтропеническая лихорадка при послеродовом эндометрите у коров/ К.П. Грибов // Актуальные проблемы ветеринарного обеспечения Российского животноводства: сборник научных трудов по материалам Всероссийской научно-практической конференции/ - г. Новочеркасск, 2010. - с. 154–157.
- Грибов К.П. Лейкоцитарный индекс интоксикации у коров с бактериальными эндометритами/ К.П. Грибов // Актуальные проблемы ветеринарного обеспечения Российского животноводства: сборник научных трудов по материалам Всероссийской научно-практической конференции/ - г. Новочеркасск, 2010. - с. 157–159.
- Грибов К.П. Распространение послеродовых эндометритов у коров, вызванных Haemophilus somnus/ К.П. Грибов, А.Г. Ключников, С.Н. Карташов // Ветеринарная патология, № 1(36), 2011. - с.16-19.
- Карташов С.Н. Особенности диагностики послеродовых эндометритов у коров, вызванных Haemophilus somnus/ С.Н. Карташов, А.Г. Ключников, К.П. Грибов.// Ветеринарная патология, № 1(36), 2011. - с.25-28.
- Ключников А.Г. Морфо-функциональные показатели у коров при эндометритах, вызванных Haemophilus somnus/ А.Г. Ключников, С.Н. Карташов, К.П. Грибов // Ветеринарная патология, № 1(36), 2011. - с.41-43.
- Грибов К.П. Изменения показателей крови при послеродовом эндометрите у коров гемофилезной этиологии/ К.П. Грибов.// Инновационные процессы в АПК: сборник статей III Международной научно-практической конференции преподавателей, молодых учёных, аспирантов и студентов факультета РУДН / Москва, 2011. - с. 316-318.
- Грибов К.П. Сложности диагностики эндометритов, вызванных Haemophilus somnus/ К.П. Грибов.// Научное обеспечение инновационного развития отечественного животноводства: материалы Всероссийской научно- практической конференции ГНУ СКЗНИВИ/ – г. Новочеркасск, 2011-с. 105-108.
- Грибов К.П. Некоторые гематологические изменения при эндометритах у коров, вызванных Haemophilus somnus/ К.П. Грибов.// Научное обеспечение инновационного развития отечественного животноводства: материалы Всероссийской научно-практической конференции ГНУ СКЗНИВИ/ – г. Новочеркасск, 2011- с. 110-112.
